LOCAMETZ valmisteyhdistelmä radioaktiivista lääkettä varten 25 mikrog
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Injektiopullo sisältää 25 mikrogrammaa gotsetotidia.
Radionuklidi ei kuulu valmisteyhdistelmään.
Apuaine, jonka vaikutus tunnetaan
Injektiopullo sisältää 28,97 mg natriumia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Valmisteyhdistelmä radioaktiivista lääkettä varten.
Kliiniset tiedot
Käyttöaiheet
Locametz on tarkoitettu vain diagnostiseen käyttöön.
Gallium‑68:lla radioaktiivisesti leimattu Locametz on tarkoitettu PSMA (prostataspesifinen membraaniantigeeni) -positiivisten muutosten havaitsemiseen positroniemissiotomografialla (PET‑kuvaus) eturauhassyöpää sairastavilla aikuisilla seuraavissa tilanteissa:
- ennen primaaria kuratiivista hoitoa tehtävä ensimmäinen levinneisyysmääritys potilailla, joilla on korkean riskin eturauhassyöpä.
- epäily eturauhassyövän uusiutumisesta primaarin kuratiivisen hoidon jälkeen potilailla, joiden seerumin PSA-pitoisuus (prostataspesifinen antigeeni) on suurentunut.
- PSMA-täsmähoitoa saamaan soveltuvien PSMA-positiivista etenevää etäpesäkkeistä kastraatioresistenttiä eturauhassyöpää sairastavien potilaiden tunnistaminen.
Ehto
Lääkevalmiste on tarkoitettu käytettäväksi vain sairaaloissa tai isotooppidiagnostiikkaan erikoistuneissa yksiköissä, jolloin sitä käsittelevät vain radiofarmaseuttisilla tuotteilla kuvantamiseen perehtyneet henkilöt.
Annostus ja antotapa
Tätä lääkevalmistetta saavat antaa vain koulutetut terveydenhuollon ammattilaiset, joilla on teknistä
osaamista isotooppilääketieteellisten diagnostisten aineiden käytöstä ja käsittelystä. Valmistetta saa
antaa vain erityisessä isotooppilääketieteellisessä yksikössä.
Annostus
Suositeltu annos gallium(68Ga)gotsetotidia on 1,8–2,2 MBq/kg. Vähimmäisannos on 111 MBq ja enimmäisannos 259 MBq.
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa 65 vuotta täyttäneillä potilailla (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Ei ole olemassa tietoja gallium(68Ga)gotsetotidin käytöstä keskivaikeaa tai vaikeaa/loppuvaiheen munuaisten vajaatoimintaa sairastavien potilaiden hoidossa. Annoksen muuttamista ei pidetä tarpeellisena potilailla, joilla on munuaisten vajaatoiminta (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää Locametz-valmistetta pediatrisille potilaille eturauhassyövän PSMA‑positiivisten muutosten tunnistamiseen.
Antotapa
Tämä lääkevalmiste annetaan laskimoon ja se on tarkoitettu moniannoskäyttöön. Se on saatettava käyttökuntoon ja leimattava radioaktiivisesti ennen antoa potilaalle.
Käyttökuntoon saattamisen ja radioaktiivisen leimaamisen jälkeen gallium(68Ga)gotsetotidiliuos annetaan hitaana injektiona laskimoon. Paikallista ekstravasaatiota on vältettävä, sillä se aiheuttaa tahatonta säteilyaltistusta potilaalle ja kuvantamisartefakteja. Koko annoksen saamisen varmistamiseksi on injektion jälkeen toteutettava huuhtelu antamalla steriiliä 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta laskimoon.
Ruiskussa oleva kokonaisradioaktiivisuus on tarkistettava annoskalibraattorilla juuri ennen valmisteen antoa potilaalle ja heti sen jälkeen. Annoskalibraattorin on oltava kalibroitu ja kansainvälisten standardien mukainen. Gallium(68Ga)gotsetotidiliuoksen laimentamiseen annettuja ohjeita on noudatettava (ks. kohta 12).
Potilaan valmistelu, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Ks. kohdasta 12 ohjeet valmisteen saattamisesta käyttökuntoon ja radioaktiivisesta leimaamisesta ennen lääkkeen antoa.
Kuvantaminen
Gallium(68Ga)gotsetotidilla toteutettavassa PET-kuvauksessa on kuvattava koko keho reiden puolivälistä kallonpohjaan asti. PET-kuvat on otettava 50–100 minuutin kuluessa gallium(68Ga)gotsetotidiliuoksen antamisesta laskimoon.
Jotta kuvien laatu olisi mahdollisimman hyvä, kuvantamisen aloitusaika ja kesto on säädettävä käytettävien välineiden, potilaan ja kasvaimen ominaisuuksien mukaan.
Tietokonetomografian tai magneettikuvauksen käyttöä vaimennuskorjaukseen suositellaan.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, kohdassa Apuaineet mainituille apuaineille tai radioaktiivisesti leimatun valmisteen mille tahansa aineelle.
Varoitukset ja käyttöön liittyvät varotoimet
Yksilöllinen hyöty-riskiarvio
Kunkin potilaan kohdalla säteilyaltistus on oltava perusteltavissa todennäköisellä hyödyllä. Annettavan aktiivisuuden on oltava aina niin vähäistä kuin kohtuullisesti on mahdollista tarvittavien diagnostisten tietojen saamiseksi.
Tällä hetkellä ei ole hoitotulostietoja ohjaamaan jatkohoitotoimia niille korkean riskin eturauhassyöpää sairastaville potilaille, joiden ensimmäiseen levinneisyysmääritykseen on käytetty PSMA‑PET/TT‑kuvantamista.
Kokemukset gallium(68Ga)gotsetotidi-PET-kuvantamisen käytöstä PSMA-täsmähoitoa saamaan soveltuvien potilaiden tunnistamiseen rajoittuvat vain niihin etenevää etäpesäkkeistä kastraatioresistenttiä eturauhassyöpää sairastaviin potilaisiin, joita on aiemmin hoidettu androgeenireseptorireitin estäjällä ja taksaanipohjaisella solunsalpaajalla ja vain lutetium(177Lu)vipivotiditetraksetaanihoitoa saamaan soveltuvien potilaiden tunnistamiseen. Hyöty-riskisuhdetta ei voi yleistää muun tyyppisiin PSMA-täsmähoitoihin eikä niihin etenevää etäpesäkkeistä kastraatioresistenttiä eturauhassyöpää sairastaviin potilaisiin, jotka ovat saaneet aiemmin jotain muuta kuin yllä mainittuja hoitoja.
Säteilyriski
Gallium(68Ga)gotsetotidi vaikuttaa osaltaan potilaan pitkän aikavälin kumulatiiviseen kokonaissäteilyaltistukseen, joka on yhteydessä suurentuneeseen syöpäriskiin. Valmisteen käsittelyn, käyttökuntoon saattamisen ja radioaktiivisen leimaamisen on oltava turvallista, jotta potilaita ja terveydenhuoltohenkilöstöä voidaan suojata tahattomalta säteilyaltistukselta (ks. kohdat Käyttö- ja käsittelyohjeet ja 12).
Gallium(68Ga)gotsetotidikuvien tulkinta
Gallium(68Ga)gotsetotidin avulla otetut PET-kuvat on arvioitava visuaalisesti. Epäily pahanlaatuisista leesioista perustuu gallium(68Ga)gotsetotidin oton vertaamiseen taustakudokseen.
Gallium(68Ga)gotsetotidi ei kerry vain eturauhassyövän muutoksiin, vaan voi kertyä myös normaaliin kudokseen (ks. kohta Farmakokinetiikka), muihin syöpämuutoksiin ja ei-pahanlaatuisiin muutoksiin, mikä voi aiheuttaa virheellisiä positiivisia löydöksiä. Munuaisissa, kyynelrauhasissa, maksassa, sylkirauhasissa ja virtsarakon seinämässä esiintyy kohtalaista tai runsasta fysiologista PSMA:n ottoa. Virheellisiä positiivisia löydöksiä voivat olla esimerkiksi munuaisen adenokarsinooma, maksasolusyöpä, rintasyöpä, keuhkosyöpä, hyvänlaatuiset luusairaudet (esim. Pagetin tauti), keuhkosarkoidoosi/-granulomatoosi, glioomat, meningioomat, paraganglioomat ja neurofibroomat. Gangliot voivat muistuttaa imusolmukkeita.
Seerumin PSA-pitoisuus, androgeenireseptoriin kohdistuvat hoidot, taudin levinneisyys ja pahanlaatuisten imusolmukkeiden koko voivat vaikuttaa gallium(68Ga)gotsetotidin diagnostiseen suorituskykyyn (ks. kohta Farmakodynamiikka).
Gallium(68Ga)gotsetotidin avulla otettuja PET-kuvia voi tulkita ainoastaan gallium(68Ga)gotsetotidi-PET-kuvien tulkintaan koulutettu arvioitsija. Gallium(68Ga)gotsetotidi-PET-kuvien löydösten tulkinnassa ja varmistamisessa on aina käytettävä myös muita diagnostisia menetelmiä (mukaan lukien histopatologiset menetelmät) ennen potilaan hoitosuunnitelman muuttamista.
Potilaan valmistelu
Potilaiden on oltava hyvin nesteytettyjä ennen gallium(68Ga)gotsetotidin antoa, ja heitä on ohjeistettava virtsaamaan juuri ennen kuvantamista ja tiheään sen jälkeisinä ensimmäisinä tunteina säteilyaltistuksen pienentämiseksi.
Erityisvaroitukset
Natriumpitoisuus
Tämä lääkevalmiste sisältää 28,97 mg natriumia per injektio, joka vastaa 1,5 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Hapan pH-arvo ja ekstravasaatio
Gallium(68Ga)gotsetotidin alhainen pH-arvo voi aiheuttaa injektiokohdan reaktioita annon jälkeen. Tahaton ekstravasaatio voi aiheuttaa paikallista ärsytystä liuoksen happaman pH:n vuoksi. Ekstravasaatiotapaukset on hoidettava paikallisten ohjeiden mukaisesti.
Yhteisvaikutukset
In vitro -yhteisvaikutustutkimusten perusteella gallium(68Ga)gotsetotidilla ei odoteta olevan kliinisesti merkittäviä yhteisvaikutuksia muiden lääkevalmisteiden kanssa (ks. kohta Farmakokinetiikka). Yhteisvaikutustutkimuksia ei ole tehty.
Raskaus ja imetys
Raskaus
Locametz ei ole tarkoitettu käytettäväksi naisille. Ei ole olemassa tietoja gallium(68Ga)gotsetotidin käytöstä naisille. Eläimillä ei ole tehty gallium(68Ga)gotsetotidia koskevia lisääntymistoksisuustutkimuksia. Kaikki radiofarmaseuttiset valmisteet, myös gallium(68Ga)gotsetotidi, saattavat kuitenkin vahingoittaa sikiötä.
Imetys
Locametz ei ole tarkoitettu käytettäväksi naisille. Ei ole olemassa tietoja gallium(68Ga)gotsetotidin vaikutuksista imetettävään vastasyntyneeseen/imeväiseen tai maidoneritykseen. Eläimillä ei ole tehty gallium(68Ga)gotsetotidia koskevia imetystutkimuksia.
Hedelmällisyys
Saatavilla ei ole tietoja gallium(68Ga)gotsetotidin vaikutuksesta ihmisen hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Gallium(68Ga)gotsetotidilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Ionisoivalle säteilylle altistuminen on yhteydessä syövän kehittymiseen ja voi aiheuttaa perinnöllisiä poikkeavuuksia. Koska efektiivinen annos on 0,0166 mSv/MBq ja suositeltu enimmäisannos 259 MBq (4,3 mSv), tällaisten haittavaikutusten esiintyminen on melko epätodennäköistä.
Gallium(68Ga)gotsetotidia saaneilla esiintyi lieviä tai keskivaikeita haittavaikutuksia, poikkeuksena asteen 3 uupumustapahtuma (0,1 %).
Yleisimmät haittavaikutukset ovat uupumus (1,2 %), pahoinvointi (0,8 %), ummetus (0,5 %) ja oksentelu (0,5 %).
Haittavaikutustaulukko
Gallium(68Ga)gotsetotidin turvallisuusprofiilia arvioitiin 1 003:lla etäpesäkkeistä kastraatioresistenttiä eturauhassyöpää sairastavalla potilaalla, joiden saamien annosten mediaani oli 1,9 MBq/kg (vaihteluväli 0,9–3,7 MBq/kg). Potilaat saivat lääkärin harkinnan mukaan parasta standardihoitoa (VISION-tutkimus).
Haittavaikutukset (taulukko 1) esitetään MedDRA-elinjärjestelmäluokittain. Kunkin elinjärjestelmäluokan haittavaikutukset esitetään yleisyysjärjestyksessä yleisimmästä alkaen. Kunkin yleisyysluokan haittavaikutukset esitetään vakavimmasta alkaen. Lisäksi kunkin haittavaikutuksen kohdalla mainittava yleisyysluokka perustuu seuraavaan jaotteluun (CIOMS III): hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000).
Taulukko 1 Gallium(68Ga)gotsetotidia saaneilla havaitut haittavaikutukset
Elinjärjestelmäluokka | Yleisyysluokka | Haittavaikutus |
Ruoansulatuselimistö | Melko harvinainen | Pahoinvointi |
Melko harvinainen | Ummetus | |
Melko harvinainen | Oksentelu | |
Melko harvinainen | Ripuli | |
Melko harvinainen | Suun kuivuus | |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Uupumus |
Melko harvinainen | Injektiokohdan reaktiot1 | |
Melko harvinainen | Vilunväristykset | |
1 Injektiokohdan reaktioita ovat injektiokohdan hematooma, injektiokohdan kuumotus, injektiokohdan punoitus. | ||
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta.
www-sivusto: http://www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Jos potilas saa gallium(68Ga)gotsetotidista yliannostuksen säteilyä, elimistöön absorboituvaa säteilyannosta on pyrittävä pienentämään mahdollisuuksien mukaan tehostamalla radionuklidin eliminaatiota elimistöstä nesteytyksen ja tiheästi toistuvan virtsarakon tyhjentämisen avulla. Annetun efektiivisen säteilyannoksen arvioinnista voi olla hyötyä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: diagnostiset radioaktiiviset lääkevalmisteet, muut radioaktiiviset lääkevalmisteet kasvainten diagnosointiin, ATC-koodi: V09IX14
Vaikutusmekanismi
Gallium(68Ga)gotsetotidi sitoutuu PSMA:ta ilmentäviin soluihin, mukaan lukien PSMA:ta yli-ilmentäviin pahanlaatuisiin eturauhassyöpäsoluihin. Gallium-68 on radionuklidi, jonka emissio mahdollistaa PET-kuvauksen. Gallium(68Ga)gotsetotidilla otetuissa PET-kuvissa havaitaan signaalivoimistumien perusteella kudoksissa oleva PSMA-proteiini.
Farmakodynaamiset vaikutukset
Diagnostisissa tutkimuksissa käytettyinä kemiallisina pitoisuuksina gallium(68Ga)gotsetotidilla ei ole farmakodynaamista aktiivisuutta.
Kliininen teho ja turvallisuus
Gallium(68Ga)gotsetotidin herkkyyttä ja tarkkuutta arvioitiin seuraavissa kahdessa prospektiivisessa tutkimuksessa:
Van Kalmthout et al. vuonna 2020 toteuttamassa tutkimuksessa tehtiin gallium(68Ga)gotsetotidi-PET/TT-kuvaus 103 aikuiselle miespotilaalle, joilla oli biopsialla todennettu keskisuuren tai korkean riskin eturauhassyöpä ja jotka soveltuivat hoidettavaksi laajalla lantion imusolmukkeiden dissektiolla. PET/TT-kuvat arvioi kaksi riippumatonta sokkoutettua arvioitsijaa. Histopatologisena viitestandardina 96:lle potilaalle 103:sta (93 %) käytettiin laajaa lantion imusolmukkeiden dissektiota. Taulukossa 2 esitetään yhteenveto gallium(68Ga)gotsetotidi-PET/TT-kuvauksen herkkyydestä, tarkkuudesta sekä positiivisesta ja negatiivisesta ennustearvosta (PPV, positive predictive value ja NPV, negative predictive value) potilaiden imusolmuke-etäpesäkkeiden havaitsemisessa.
Taulukko 2 Ensimmäisen levinneisyysmäärityksen tehotulokset potilailla, joilla oli biopsialla todennettu eturauhassyöpä
Tulokset potilailla N = 961 | |
Herkkyys (95 % lv) | 42 % (27; 58) |
Tarkkuus (95 % lv) | 91 % (79; 97) |
PPV | 77 % (54; 91) |
NPV | 68 % (56; 78) |
1 Arvioitavissa oleva populaatio | |
Kahden riippumattoman sokkoutetun arvioitsijan välinen yksimielisyysluku oli κ = 0,67. 67:stä analysoidusta imusolmuke-etäpesäkkeestä 26 oli havaittu gallium(68Ga)gotsetotidi-PET/TT-kuvauksessa, joten imusolmuke-etäpesäkkeiden kohdalla herkkyys oli 38,8 %. Havaittujen imusolmuke-etäpesäkkeiden metastaattisten esiintymien halkaisijoiden mediaani oli 7 mm (vaihteluväli: 0,3‑35). PET-kuvaksessa jäi havaitsematta 41 imusolmuke-etäpesäkettä, joiden metastaattisten esiintymien halkaisijoiden mediaani oli 3,0 mm (vaihteluväli: 0,5‑35,0).
Fendler et al. vuonna 2019 toteuttamassa tutkimuksessa tehtiin gallium(68Ga)gotsetotidi-PET/TT tai PET/magneettikuvaus 635 aikuiselle miespotilaalle, joilla oli histopatologisesti todennettu ja biokemiallisesti uusiutunut eturauhassyöpä ja anamneesissa prostatektomia (N = 262), sädehoito (N = 169) tai kummatkin (N = 204). Biokemiallisen uusiutumisen määritelmänä oli seerumin PSA-pitoisuus ≥ 0,2 ng/ml yli 6 viikon kuluttua prostatektomiasta tai seerumin PSA-pitoisuuden suureneminen vähintään 2 ng/ml yli nadiirin definitiivisen sädehoidon jälkeen. Potilaiden PSA-pitoisuuden mediaani oli 2,1 ng/ml yli nadiirin sädehoidon jälkeen (vaihteluväli: 0,1–1 154 ng/ml). Yhdistetty viitestandardi, johon kuuluivat histopatologiset löydökset, seerumin PSA-pitoisuuden sarjamittaukset ja kuvantamislöydökset (TT, magneettikuvaus ja/tai luustokartoitus), oli saatavilla 223 potilaalle 635:stä (35,1 %), ja pelkkä histopatologinen viitestandardi oli saatavilla 93 potilaalle (14,6 %). PET/TT-kuvat tulkitsi kolme riippumatonta arvioitsijaa, jotka oli sokkoutettu kliinisen tiedon suhteen (lukuun ottamatta primaarihoidon tyyppiä ja viimeisintä seerumin PSA-pitoisuutta).
PSMA-positiivisia muutoksia havaittiin 475 potilaalla 635:stä (75 %) gallium(68Ga)gotsetotidia saaneesta, ja havaittujen muutosten määrä suureni merkitsevästi PSA-pitoisuuden suurenemisen myötä. Gallium(68Ga)gotsetotidi-PET-kuvauksella havaittujen positiivisten muutosten määrä suureni PSA-pitoisuuden suurenemisen myötä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Gallium(68Ga)gotsetotidi-PET/TT-kuvauksen herkkyys ja positiivinen ennustearvo on esitetty yhteenvetona taulukossa 3. Arvioitsijoiden välinen Fleissin κ vaihteli gallium(68Ga)gotsetotidi-PET/TT-kuvauksessa arvosta 0,65 (95 % lv: 0,61–0,70) arvoon 0,78 (95 % lv: 0,73–0,82) kaikkien arvioitujen alueiden osalta (eturauhasen kuoppa, lantion imusolmukkeet, lantion ulkopuolinen pehmytkudos ja luusto).
Taulukko 3 Tehotulokset potilailla, joilla oli histopatologisesti todennettu ja biokemiallisesti uusiutunut eturauhassyöpä
Yhdistetty viitestandardi N = 2231 | Histopatologinen viitestandardi N = 931 | |
Herkkyys potilasta kohden (95 % lv) | Ei saatavilla | 92 % (84–96) |
Herkkyys aluetta kohden (95 % lv) | Ei saatavilla | 90 % (82–95) |
Positiivinen ennustearvo potilasta kohden (95 % lv) | 92 % (88–95) | 84 % (75–90) |
Positiivinen ennustearvo aluetta kohden (95 % lv) | 92 % (88–95) | 84 % (76–91) |
1 Arvioitavissa oleva populaatio | ||
Satunnaistetussa, avoimessa, vaiheen III VISION-monikeskustutkimuksessa verrattiin Pluvicto-hoidon ja parhaan standardihoidon yhdistelmän tehoa ja ainoana hoitona annetun parhaan standardihoidon tehoa. Gallium(68Ga)gotsetotidi-PET/TT-kuvausta käytettiin tutkimukseen soveltuvien etenevää PSMA-positiivista etäpesäkkeistä kastraatioresistenttiä eturauhassyöpää sairastavien aikuispotilaiden tunnistamiseksi. Tutkimukseen valittiin eturauhassyöpäkasvainten PSMA-ilmentymisen perusteella 1 003 miespotilasta, jotka olivat aiemmin saaneet ainakin yhtä androgeenireseptorireitin estäjähoitoa ja yhden tai kaksi hoitojaksoa taksaanipohjaisella solunsalpaajalla. Potilaille tehtiin gallium(68Ga)gotsetotidi-PET/TT-kuvaus, jonka perusteella kasvainten PSMA-ilmentymistä arvioitiin keskitetyn lukukriteerin määritelmien mukaisesti. Kokonaiselossaolon ja radiografisesti määritellyn etenemisvapaan elossaolon tulokset olivat paremmat PSMA-täsmähoitoa saaneessa ryhmässä.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Locametz-valmisteen käytöstä eturauhassyövän PSMA-muutosten visualisoinnissa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Jakautuminen
Gallium(68Ga)gotsetotidi käyttäytyy veressä bieksponentiaalisesti, ja sen biologinen puoliintumisaika on nopean komponentin osalta 6,5 minuuttia ja terminaalinen puoliintumisaika hitaamman komponentin osalta 4,4 tuntia. In vitro -tietojen perusteella gotsetotidi jakautuu pääasiassa plasmaan; veren ja plasman suhde on keskimäärin 0,71. Gotsetotidi sitoutuu plasman proteiineihin ihmisellä 33-prosenttisesti.
Kertyminen elimiin
Suurimmat absorboituvat gallium(68Ga)gotsetotidin säteilyannokset esiintyivät munuaisissa, kyynelrauhasissa, sylkirauhasissa, virtsarakon seinämässä ja maksassa.
Arvioidut absorboituvat säteilyannokset näissä elimissä olivat annetulla 259 MBq:n aktiivisuudella 62,1 mGy (munuaiset), 28,5 mGy (kyynelrauhaset), 23,1 mGy (sylkirauhaset), 14,8 mGy (virtsarakon seinämä) ja 13,7 mGy (maksa).
Biotransformaatio
In vitro -tietojen perusteella gallium(68Ga)gotsetotidi ei juurikaan metaboloidu maksassa tai munuaisissa.
Eliminaatio
Gallium(68Ga)gotsetotidi eliminoituu pääasiassa munuaisteitse. Noin 14 % annetusta gallium(68Ga)gotsetotidiannoksesta erittyy virtsaan 2 tunnin kuluttua injektiosta.
Puoliintumisaika
Kun huomioidaan gallium(68Ga)gotsetotidin biologinen ja terminaalinen 4,4 tunnin puoliintumisaika ja gallium-68:n fysikaalinen 68 minuutin puoliintumisaika, gallium(68Ga)gotsetotidin efektiivinen puoliintumisaika on 54 minuuttia.
Lääkeyhteisvaikutusten mahdollisuus in vitro
CYP450-entsyymit
Gotsetotidi ei ole CYP450-entsyymien substraatti, estäjä eikä indusori. Gallium(68Ga)gotsetotidilla ei odoteta olevan yhteisvaikutuksia CYP450:n substraattien, estäjien tai indusorien kanssa.
Kuljettajaproteiinit
Gotsetotidi ei ole BCRP:n, P‑gp:n, MATE1:n, MATE2‑K:n, OAT1:n, OAT3:n tai OCT2:n substraatti. Gotsetotidi ei ole BCRP:n, BSEP:n, P‑gp:n, MATE1:n, MATE2‑K:n, OAT1:n, OAT3:n, OATP1B1:n, OATP1B3:n, OCT1:n tai OCT2:n estäjä. Gallium(68Ga)gotsetotidilla ei odoteta olevan yhteisvaikutuksia näiden kuljettajaproteiinien substraattien kanssa.
Erityisryhmät
Iäkkäät
Kliinisessä VISION-tutkimuksessa 752 potilasta 1 003:sta (75 %) oli vähintään 65-vuotiaita. Turvallisuudessa ja tehossa ei kokonaisuutena ajatellen havaittu eroja iäkkäiden ja nuorempien potilaiden välillä.
Munuaisten/maksan vajaatoiminta
Munuaisten tai maksan vajaatoiminta ei odoteta vaikuttavan kliinisesti merkittävissä määrin gallium(68Ga)gotsetotidin farmakokinetiikkaan ja biojakaumaan.
Prekliiniset tiedot turvallisuudesta
Gotsetotidia on arvioitu farmakologista turvallisuutta ja kerta-altistuksen aiheuttamaa toksisuutta koskevissa tutkimuksissa. Farmakologista turvallisuutta ja kerta-altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Karsinogeenisuus ja mutageenisuus
Gallium(68Ga)gotsetotidia koskevia mutageenisuustutkimuksia ja karsinogeenisuustutkimuksia ei ole tehty.
Farmaseuttiset tiedot
Apuaineet
Gentisiinihappo
Natriumasetaattitrihydraatti
Natriumkloridi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet ja 12.
Kestoaika
Avaamaton injektiopullo: 1 vuosi.
Käyttökuntoon saattamisen ja radioaktiivisen leimaamisen jälkeen käytönaikainen kemiallinen ja fysikaalinen stabiilius on osoitettu olevan 6 tuntia 30 °C:ssa. Säilytä pystyasennossa.
Mikrobiologiselta kannalta lääkevalmiste tulee käyttää heti, ellei mikrobiologisen kontaminaation riskiä voida poissulkea avaamisessa, käyttökuntoon saattamisessa, radioaktiivisessa leimaamisessa ja laimentamisessa käytetyin menetelmin.
Jos lääkevalmistetta ei käytetä heti, käytön aikaiset säilytysajat ja olosuhteet ovat käyttäjän vastuulla.
Säilytys
Ennen käyttökuntoon saattamista: säilytä alle 25 °C.
Käyttökuntoon saatetun ja radioaktiivisesti leimatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Radiofarmaseuttiset valmisteet on säilytettävä radioaktiivisia aineita koskevien kansallisten määräysten mukaisesti.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
LOCAMETZ valmisteyhdistelmä radioaktiivista lääkettä varten
25 mikrog (L:ei) 1 kpl (-)
PF-selosteen tieto
Locametz on valmisteyhdistelmä radioaktiivista lääkettä varten eli gallium(68Ga)gotsetotidi-injektionestettä varten (ks. kohdat Vaikuttavat aineet ja niiden määrät ja 3), ja se on tarkoitettu moniannoskäyttöön. Locametz sisältää yhden, tyypin 1 pluslasista valmistetun 10 ml:n injektiopullon, joka on suljettu kumitulpalla ja sinetöity repäisykorkilla.
Valmisteen kuvaus:
Yksi injektiopullo valkoista kylmäkuivattua jauhetta (injektiokuiva-aine, liuosta varten).
Käyttö- ja käsittelyohjeet
Yleinen varoitus
Vain valtuutetut henkilöt saavat vastaanottaa, käyttää ja antaa radiofarmaseuttisia valmisteita, ja käsittelyn on tapahduttava tähän tarkoitukseen varatuissa kliinisissä tiloissa. Valmisteiden vastaanotossa, säilytyksessä, käytössä, kuljetuksessa ja hävittämisessä on noudatettava toimivaltaisen viranomaisorganisaation antamia määräyksiä ja/tai asianmukaisia lupia.
Radiofarmaseuttisten valmisteiden valmistuksessa on huomioitava sekä säteilyturvallisuus että farmaseuttiset laatuvaatimukset. Asianmukaisia aseptisia varotoimia on noudatettava.
Injektiopullon sisältöä saa käyttää vain gallium(68Ga)gotsetotidi-injektionesteen valmistamiseen, eikä sitä saa antaa potilaalle sellaisenaan ilman valmistelutoimenpiteitä (ks. kohdat Annostus ja antotapa ja 12).
Varotoimet ennen lääkevalmisteen käsittelyä tai antoa
Locametz ei ole radioaktiivinen ennen käyttökuntoon saattamista. Käyttökuntoon saattamisen ja radioaktiivisen leimaamisen jälkeen on huolehdittava gallium(68Ga)gotsetotidi-injektionesteen tehokkaasta säteilysuojauksesta (ks. kohta 3).
Käyttökuntoon saattamisen ja radioaktiivisen leimaamisen jälkeen Locametz sisältää steriiliä gallium(68Ga)gotsetotidi-injektionestettä, jonka aktiivisuus on enintään 1 369 MBq. Gallium(68Ga)gotsetotidi-injektioneste sisältää myös kloorivetyhappoa, joka on peräisin gallium-68-kloridiliuoksesta.
Gallium(68Ga)gotsetotidi-injektioneste on steriili, kirkas, väritön, laskimoon annettava liuos, jossa ei ole liukenematonta ainetta. Sen pH on 3,2–6,5.
Asianmukaisia aseptisia varotoimia on noudatettava, kun gallium(68Ga)gotsetotidi-injektionestettä vedetään ruiskuun ja annetaan potilaalle.
Valmistetta annettaessa on minimoitava lääkevalmisteen kontaminaatioriski ja antajaan kohdistuva säteilyriski. Tehokkaan säteilysuojauksen käyttö on pakollista.
Jos injektiopullon eheys vaarantuu missä tahansa vaiheessa lääkevalmisteen valmistelua, valmistetta ei saa käyttää.
Ks. kohdasta 12 ohjeet lääkevalmisteen saattamisesta käyttökuntoon ja radioaktiivisesta leimaamisesta ennen lääkkeen antoa.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
LOCAMETZ valmisteyhdistelmä radioaktiivista lääkettä varten
25 mikrog 1 kpl
- Ei korvausta.
ATC-koodi
V09IX14
Valmisteyhteenvedon muuttamispäivämäärä
31.03.2025
Dosimetria
Gallium-68 tuotetaan germanium-68/gallium-68 (68Ge/68Ga) -generaattorilla, ja se hajoaa stabiiliksi sinkki-68:ksi puoliintumisajan ollessa 68 min. Gallium-68 hajoaa seuraavasti:
- 89 % positroniemissiosäteilyllä, jonka keskimääräinen energia on 836 keV, ja tämän jälkeen fotoniannihilaatiosäteilyn kautta, jonka energia on 511 keV (178 %),
- 10 % orbitaalisella elektronisieppauksella (röntgen- tai Augerin emissio), ja
- 3 % kolmenatoista gammasiirtymänä viideltä virittyneeltä tasolta.
Gallium(68Ga)gotsetotidin efektiivinen säteilyannos on 0,022 mSv/MBq, jolloin efektiivinen säteilyannos on annetulla enintään 259 MBq:n aktiivisuudella noin 5,70 mSv.
Sandgren et al. (2019) laski aikuispotilaiden (N = 6) elimiin ja kudoksiin absorboituneiden säteilyannosten mediaaniarvot ja havaitut vaihteluvälit laskimoon annetun gallium(68Ga)gotsetotidi-injektion jälkeen käyttäen IDAC-Dose 2.1 -ohjelmistoa ja ICRP/ICRU voxel phantom -menetelmää. Absorboituneiden gallium(68Ga)gotsetotidi-säteilyannosten mediaaniarvot esitetään taulukossa 4.
Taulukko 4 Arvioidut absorboituvien säteilyannosten mediaaniarvot käytettäessä gallium(68Ga)gotsetotidia
Absorboituva säteilyannos (mGy/MBq)1 N = 6 | ||
Elin | Mediaani (mGy/MBq) | Vaihteluväli (mGy/MBq) |
Lisämunuaiset | 0,048 | 0,0405–0,0548 |
Aivot | 0,008 | 0,0065–0,0079 |
Rinnat | 0,008 | 0,0077–0,0087 |
Endosti (luun pinta)* | 0,011 | 0,0095–0,0110 |
Silmien mykiöt* | 0,0051 | 0,0047–0,0054 |
Sappirakon seinämä | 0,027 | 0,0212–0,0343 |
Sydämen seinämä | 0,026 | 0,0236–0,0317 |
Munuaiset* | 0,240 | 0,2000–0,2800 |
Kyynelrauhaset* | 0,110 | 0,0430–0,2000 |
Paksusuolen vasen seinämä** | 0,014 | 0,0120–0,0140 |
Maksa* | 0,053 | 0,0380–0,0710 |
Keuhkot* | 0,016 | 0,0130–0,0170 |
Lihakset | 0,0083 | 0,0073–0,0086 |
Ruokatorvi* | 0,014 | 0,0110–0,0150 |
Haima | 0,019 | 0,0173–0,0209 |
Paksusuolen rektosigmoidinen seinämä | 0,013 | 0,0108–0,0149 |
Punainen (aktiivinen) luuydin* | 0,015 | 0,0140–0,0150 |
Paksusuolen oikea seinämä** | 0,014 | 0,0120–0,0140 |
Sylkirauhaset* | 0,089 | 0,0740–0,1500 |
Iho* | 0,007 | 0,0059–0,0069 |
Ohutsuolen seinämä | 0,014 | 0,0129–0,0149 |
Perna* | 0,046 | 0,0300–0,1000 |
Mahalaukun seinämä* | 0,015 | 0,0150–0,0170 |
Kivekset* | 0,009 | 0,0074–0,0089 |
Kateenkorva | 0,0081 | 0,0072–0,0085 |
Kilpirauhanen* | 0,010 | 0,0090–0,0100 |
Virtsarakon seinämä* | 0,057 | 0,0280–0,0840 |
Efektiivinen annos (mSv/MBq)*2 | 0,022 | 0,0204–0,0242 |
* Sandgren et al. (2019) mukaisesti; kaikki muut elinkohtaiset arviot perustuvat alkuperäisten julkaisussa esitettyjen elinten aktiivisuuden aikaintegraalikertoimiin ** Sandgrenin julkaisussa nämä raportoidaan yhteisellä termillä “Paksusuoli” 1 laskettu käyttämällä IDAC-Dose 2.1 -ohjelmistoa 2 johdettu ICRP Publication 103 -julkaisun mukaisesti | ||
Radiofarmaseuttisten valmisteiden valmistusohjeet
Valmistustapa
Vaihe 1: Käyttökuntoon saattaminen ja radioaktiivinen leimaaminen
Locametz voidaan valmistella suoraan gallium(68Ga)gotsetotidi-injektionesteestä ja eluaatista, joka tuotetaan jommallakummalla seuraavista generaattoreista (ks. tarkemmat generaattorikohtaiset käyttöohjeet jäljempänä):
- Eckert & Ziegler GalliaPharm germanium‑68/gallium‑68 (68Ge/68Ga) -generaattori
- IRE ELiT Galli Ad germanium‑68/gallium‑68 (68Ge/68Ga) -generaattori
Lisäksi on noudatettava germanium-68/gallium-68-generaattorin valmistajan käyttöohjeita.
Gallium(68Ga)gotsetotidi-injektioneste valmistetaan aseptisesti seuraavien ohjeiden mukaisesti:
- Repäise Locametz-injektiopullon korkki irti ja pyyhi kalvo asianmukaisella antiseptisella aineella. Anna kalvon kuivua.
- Lävistä Locametz-injektiopullon kalvo steriilillä neulalla, johon on liitetty 0,2 mikronin steriili ilmansuodatin ilmanpaineen ylläpitämiseksi injektiopullossa käyttökuntoon saattamisen aikana. Aseta Locametz-injektiopullo lyijysuojattuun säiliöön.
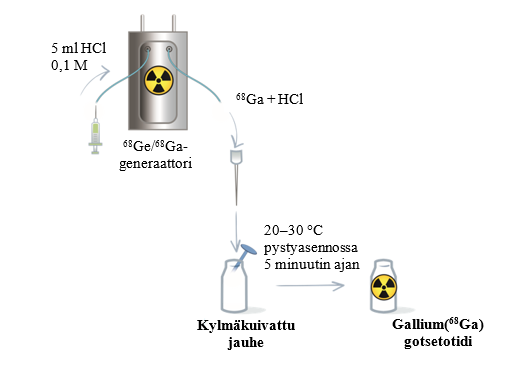
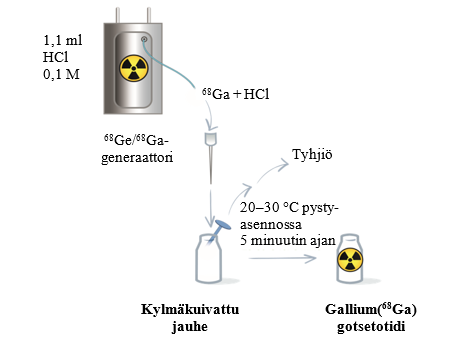
Noudata generaattorikohtaisia käyttökuntoon saattamista ja radioaktiivista leimaamista koskevia ohjeita (taulukko 5 sekä kuvat 1 ja 2). Siirry sitten vaiheeseen 2.
Taulukko 5 Käyttökuntoon saattaminen ja radioaktiivinen leimaaminen Eckert & Ziegler GalliaPharm- ja IRE ELiT Galli Ad -generaattoreilla
Jos käytössä Eckert & Ziegler GalliaPharm ‑generaattori | Jos käytössä IRE ELiT Galli Ad -generaattori |
| |
Suorita eluointi manuaalisesti tai pumpun avulla generaattorin käyttöohjeiden mukaisesti. | Yhdistä eluoinnin aloittamista varten Locametz-injektiopullo ilmausneulan (jossa 0,2 mikronin steriili ilmansuodatin) ja steriilin neulan (koko 21 G–23 G) avulla tyhjiöpulloon (minimitilavuus 25 ml) tai yhdistä injektiopullo pumppuun. |
Saata kylmäkuivattu jauhe käyttökuntoon 5 ml:lla eluaattia. | Saata kylmäkuivattu jauhe käyttökuntoon 1,1 ml:lla eluaattia. |
Eluoinnin päätyttyä irrota Locametz-injektiopullo generaattorista irrottamalla eluointineula ja ilmausneula (jossa 0,2 mikronin steriili ilmansuodatin) kumikalvosta. Käännä Locametz-injektiopullo kerran ylösalaisin ja aseta se pystyasentoon. | Eluoinnin päätyttyä vedä steriili neula pois tyhjiöpullosta tai irrota tyhjiöpumppu, jotta Locametz-injektiopulloon muodostuu ilmanpaine. Irrota injektiopullo sitten generaattorista irrottamalla kumikalvosta sekä eluointineula että ilmausneula (jossa 0,2 mikronin steriili ilmansuodatin). |
Kuva 1 Käyttökuntoon saattaminen ja radioaktiivinen leimaaminen Eckert & Ziegler GalliaPharm -generaattorilla
Kuva 2 Käyttökuntoon saattaminen ja radioaktiivinen leimaaminen IRE ELiT Galli Ad‑generaattorilla
Vaihe 2: Inkubointi
- Inkuboi Locametz-injektiopulloa pystyasennossa huoneenlämmössä (20–30 °C) vähintään 5 minuutin ajan ravistamatta tai sekoittamatta sitä.
- Kun 5 minuuttia on kulunut, määritä gallium(68Ga)gotsetotidi-injektionestettä sisältävän injektiopullon kokonaisradioaktiivisuus annoskalibraattorilla ja kirjaa tulos ylös.
- Suorita laadunvalvontatoimet suositelluin menetelmin tarvittavan vaatimustason varmistamiseksi (ks. vaihe 3).
- Säilytä gallium(68Ga)gotsetotidi-injektionestettä sisältävä Locametz-injektiopullo käyttöönottoon saakka pystyasennossa lyijysuojatussa säiliössä alle 30 °C:ssa.
- Kun olet lisännyt Locametz-injektiopulloon gallium-68-kloridia, käytä gallium(68Ga)gotsetotidi-injektioneste 6 tunnin kuluessa.
Vaihe 3: Vaatimukset ja laadunvalvonta
Suorita taulukon 6 mukaiset laadunvalvontatoimet lyijysuojatun lasin takana säteilysuojauksen takaamiseksi.
Taulukko 6 Gallium(68Ga)gotsetotidi-injektionestettä koskevat vaatimukset
Testi | Hyväksymiskriteerit | Menetelmä |
Ulkonäkö | Kirkas, väritön, ei liukenematonta ainetta | Silmämääräinen tarkastus |
pH | 3,2–6,5 | pH-testiliuskat |
Leimauksen teho | Kompleksoitumaton gallium-68-laji ≤ 3% | Ohutlevykromatografia (instant thin layer chromatography, ITLC, ks. jäljempänä) |
Määritä gallium(68Ga)gotsetotidi-injektionesteen leimausteho suorittamalla ITLC.
Suorita ITLC käyttämällä ITLC SG -liuskoja ja ammoniumasetaattia (1M) ja metanolia (1:1 V/V) liikkuvana faasina.
ITLC-menetelmä
a. Anna ITLC SG -liuskan kehittyä 6 cm:n etäisyyden verran näytteen applikointikohdasta (eli 7 cm:n etäisyydelle ITLC-liuskan alaosasta).
b. Skannaa ITLC SG -liuska radiometrisellä ITLC-skannerilla.
c. Laske leimauksen teho integroimalla kromatogrammin huiput. Älä käytä käyttökuntoon saatettua ja radioaktiivisesti leimattua valmistetta, jos kompleksoitumattoman gallium-68-lajin pitoisuus (%) on yli 3 %.
Retentiotekijää (Rf) koskevat vaatimukset ovat:
- kompleksoitumaton gallium-68-laji: Rf = 0–0,2.
- gallium(68Ga)gotsetotidi: Rf = 0,8–1.
Vaihe 4: Anto
a. Noudata aseptista tekniikkaa ja säteilysuojausta, kun vedät ruiskuun ja annat gallium(68Ga)gotsetotidi-injektionestettä (ks. kohdat Annostus ja antotapa ja Käyttö- ja käsittelyohjeet).
b. Tarkasta valmis gallium(68Ga)gotsetotidi-injektioneste silmämääräisesti ennen käyttöä lyijysuojatun lasin takana säteilysuojauksen takaamiseksi. Käytä liuosta vain, jos se on kirkas, väritön eikä sisällä liukenematonta ainetta (ks. kohdat Annostus ja antotapa ja Käyttö- ja käsittelyohjeet).
c. Käyttökuntoon saattamisen ja radioaktiivisen leimaamisen jälkeen gallium(68Ga)gotsetotidi-injektionestettä voidaan laimentaa injektionesteisiin käytettävällä vedellä tai 9 mg/ml (0,9 %) NaCl-infuusionesteellä, kunnes lopullinen tilavuus on 10 ml. IRE ELiT Galli Ad -generaattoria käytettäessä osmolaliteetin pienentämiseksi on injektioneste laimennettava vähintään 4 ml:n minimitilavuuteen.
d. Käytä kerta‑annosruiskua, johon on liitetty steriili neula (koko 21 G – 23 G) ja ruiskun suojus, ja vedä valmis gallium(68Ga)gotsetotidi-injektioneste aseptisesti ruiskuun ennen antoa (ks. kohdat Annostus ja antotapa ja Käyttö- ja käsittelyohjeet).
e. Ruiskussa oleva kokonaisradioaktiivisuus on tarkistettava annoskalibraattorilla juuri ennen gallium(68Ga)gotsetotidin antoa potilaalle ja heti sen jälkeen. Annoskalibraattorin on oltava kalibroitu ja kansainvälisten standardien mukainen (ks. kohta Annostus ja antotapa).
Lisätietoa tästä lääkevalmisteesta on Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu.
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
