SOMAKIT TOC valmisteyhdistelmä radioaktiivista lääkettä varten 40 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi kuiva-ainetta sisältävä injektiopullo sisältää 40 mikrogrammaa edotreotidia.
Radionuklidi ei ole mukana valmisteyhdistelmässä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Valmisteyhdistelmä radioaktiivista lääkettä varten.
Kliiniset tiedot
Käyttöaiheet
Tämä lääkevalmiste on tarkoitettu vain diagnostiseen käyttöön.
Gallium (68Ga)-kloridiliuoksen kanssa toteutetun radioleimauksen jälkeen saatu gallium (68Ga)-edotreotidiliuos on tarkoitettu somatostatiinireseptorien yli-ilmentymisen positroniemissiotomografiakuvantamiseen (PET-kuvantamiseen) aikuispotilailla, joilla on todettuja tai epäiltyjä hyvin erilaistuneita gastroenteropankreaattisia neuroendokriinikasvaimia (GEP-NET-kasvaimia), primaarikasvainten ja niiden etäpesäkkeiden paikallistamiseksi.
Ehto
Lääkevalmiste on tarkoitettu käytettäväksi vain sairaaloissa tai isotooppidiagnostiikkaan erikoistuneissa yksiköissä, jolloin sitä käsittelevät vain radiofarmaseuttisilla tuotteilla kuvantamiseen perehtyneet henkilöt.
Annostus ja antotapa
Tätä lääkevalmistetta saavat antaa vain koulutetut terveydenhuollon ammattilaiset, joilla on teknistä osaamista isotooppilääketieteellisten diagnostisten aineiden käytöstä ja käsittelystä. Valmistetta saa antaa vain erityisessä isotooppilääketieteellisessä yksikössä.
Annostus
Suositeltava aktiivisuus 70 kg painavalla aikuisella on 100–200 MBq, joka annetaan suoralla hitaalla laskimoinjektiolla.
Aktiivisuus muokataan potilaan ominaisuuksien, käytetyn PET-kameran tyypin ja kuvantamismoodin mukaiseksi.
Iäkkäät
Iäkkäille potilaille ei tarvita erillistä annosohjetta.
Munuaisten tai maksan vajaatoiminta
Gallium (68Ga)-edotreotidin tehoa ja turvallisuutta ei ole tutkittu munuaisten tai maksan vajaatoiminnan yhteydessä.
Pediatriset potilaat
Gallium (68Ga)-edotreotidin turvallisuutta ja tehoa ei ole varmistettu pediatrisissa populaatioissa, joissa efektiivinen annos voi olla erilainen kuin aikuisilla. SomaKit TOC-valmisteen käytöstä pediatrisille potilaille ei ole olemassa suositusta.
Antotapa
SomaKit TOC on tarkoitettu laskimonsisäiseen käyttöön ja vain kertakäyttöön.
Tämä lääkevalmiste on radioleimattava ennen potilaalle antoa.
Gallium (68Ga)-edotreotidin aktiivisuus on mitattava aktiivisuusmittarilla juuri ennen injektiota.
Gallium (68Ga)-edotreotidi on annettava laskimonsisäisesti paikallisen ekstravasaation välttämiseksi, joka aiheuttaa tahattoman potilaaseen kohdistuvan säteilytyksen, sekä kuvantamisartefaktien välttämiseksi.
Ks. kohdista Käyttö- ja käsittelyohjeet ja 12 ohjeet lääkevalmisteen valmistamisesta ennen lääkkeen antoa.
Ks. kohdasta Varoitukset ja käyttöön liittyvät varotoimet tiedot potilaan valmistelusta.
Kuvantaminen
Radioleimattu SomaKit TOC soveltuu PET-kuvantamiseen. Kuvantamisen on sisällettävä koko kehon kuvantaminen kallosta reiden puolivälin alueelle. Suositeltu kuvantamisen ajoitus on 40–90 minuuttia injektion jälkeen. Kuvantamisen alkamisaika ja kesto on muokattava käytetyn laitteiston, potilaan ja kasvaimen ominaisuuksien mukaiseksi, jotta saadaan mahdollisimman hyvä kuvanlaatu.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, kohdassa Apuaineet mainituille apuaineille tai mille tahansa leimatun radiofarmaseuttisen valmisteen aineosille.
Varoitukset ja käyttöön liittyvät varotoimet
Yliherkkyysreaktioiden tai anafylaktisten reaktioiden mahdollisuus
Jos yliherkkyysreaktioita tai anafylaktisia reaktioita ilmenee, lääkevalmisteen anto on heti keskeytettävä ja tarvittaessa on aloitettava laskimonsisäinen hoito. Jotta välittömät toimenpiteet ovat mahdollisia hätätilanteissa, tarvittavien lääkevalmisteiden ja välineiden kuten endotrakeaaliputken on oltava välittömästi käytettävissä.
Yksilölliset hyöty/riski-perustelut
Jokaisen potilaan kohdalla säteilyaltistuksen pitää olla perusteltavissa todennäköisesti saatavalla hyödyllä. Annetun aktiivisuuden on oltava jokaisessa tapauksessa niin vähäistä kuin on kohtuuden rajoissa mahdollista tarvittavien diagnostisten tietojen hankkimiseksi.
Munuaisten/maksan vajaatoiminta
Hyöty-riskisuhteen huolellinen harkinta on tarpeen näiden potilaiden kohdalla kohonneen säteilyaltistuksen mahdollisuuden takia.
Pediatriset potilaat
Tietoa käytöstä pediatrisille potilaille löytyy kohdasta Annostus ja antotapa.
Potilaan valmistelu
Potilas on nesteytettävä hyvin ennen tutkimuksen alkua ja häntä on pyydettävä virtsaamaan niin usein kuin mahdollista tutkimuksen jälkeisten ensimmäisten tuntien aikana säteilyn vähentämiseksi.
Gallium (68Ga)-edotreotidikuvien tulkintavirheet
Gallium (68Ga)-edotreotidin avulla otetut PET-kuvat kuvastavat somatostatiinireseptorien ilmentymistä kudoksissa.
Elimiä, joiden fysiologinen gallium (68Ga)-edotreotidin otto on voimakasta, ovat perna, munuaiset, maksa, aivolisäke, kilpirauhanen ja lisämunuaiset. Korkeaa fysiologista gallium (68Ga)-edotreotidin ottoa voidaan myös havaita haiman hakalisäkkeessä.
Gallium (68Ga)-edotreotidin oton lisääntyminen ei ole GEP-NET-kasvainspesifistä. Terveydenhuollon ammattilaisten on huomioitava, että lisäksi muunlaiset kuvantamistutkimukset tai histologiset ja/tai muut asianmukaiset tutkimukset voivat olla tarpeen diagnoosin varmistamiseksi.
Fysiologisen gallium (68Ga)-edotreotidin oton vuoksi splenoosi ja intrapankreaattinen lisäperna saatetaan todeta sattumalöydöksenä somatostatiinireseptoreihin kohdennetun diagnostiikan menetelmiä käytettäessä. Tällaisia tapauksia, jotka on virheellisesti diagnosoitu neuroendokriinisiksi kasvaimiksi johtaen tarpeettomiin hoitotoimenpiteisiin, on raportoitu. Pernan sairaus tai tila (esim. pernanpoisto, splenoosi ja intrapankreaattinen lisäperna) on huomioitava oleellisena tekijänä raportoitaessa somatostatiinireseptoreihin kohdennetun diagnostiikan tuloksia.
Positiiviset tulokset edellyttävät myös sen mahdollisuuden arviointia, että kyse voi olla toisen sairauden esiintymisestä, jonka piirteenä ovat korkeat paikalliset somatostatiinireseptorien määrät. Somatostatiinireseptorien tiheyden lisääntymistä voi ilmetä myös esimerkiksi seuraavissa patologisissa tiloissa: subakuutit tulehdukset (lymfosyyttikeskittymien alueet, mukaan lukien reaktiiviset imusolmukkeet esimerkiksi rokotuksen jälkeen), kilpirauhassairaudet (esim. kilpirauhasen autonomia ja Hashimoton tauti), aivolisäkkeen kasvaimet, keuhkojen neoplasmat (pienisoluinen karsinooma), meningioomat, rintojen karsinoomat, lymfoproliferatiivinen tauti (esim. Hodgkinin tauti ja non-Hodgkinin lymfoomat) ja hermostopienasta embryologisesti peräisin olevasta kudoksesta syntyvät kasvaimet (esim. paraganglioomat, medullaariset kilpirauhasen karsinoomat, neuroblastoomat, feokromosytoomat).
Cushingin oireyhtymän tapauksessa pitkäaikainen altistus endogeeniselle hyperkortisolismille saattaa heikentää somatostatiinireseptorien ilmentymistä ja vaikuttaa negatiivisesti gallium (68Ga)-edotreotidin avulla toteutettavan somatostatiinireseptorien kuvantamisen tuloksiin. Potilailla, joilla on GEP-NET-kasvain ja Cushingin oireyhtymä, hyperkortisolismin normalisointia on ehdotettava ennen PET-kuvantamista gallium (68Ga)-edotreotidin avulla.
Gallium (68Ga)-edotreotidikuvantamisen käytön rajoitukset
GEP-NET-kasvaimissa normaalia voimakkaampi gallium (68Ga)-edotreotidin otto on toistuva löydös. GEP-NET-leesioita, joissa ei esiinny riittävää somatostatiinireseptorien tiheyttä, ei kuitenkaan voida saada näkyviin gallium (68Ga)-edotreotidilla. Gallium (68Ga)-edotreotidin avulla tuotetut PET-kuvat on tulkittava silmämääräisesti. Semikvantitatiivista gallium (68Ga)-edotreotidin oton mittausta ei pidä käyttää kuvien kliiniseen tulkintaan.
Tiedot, jotka tukevat gallium (68Ga)-edotreotidin tehoa histologisesti varmistettujen etäpesäkkeisten NET-kasvainten pepitidireseptoriradionuklidihoidon (PRRT) hoitovasteen ennustamisessa ja seurannassa, ovat vähäisiä (ks. kohta Farmakodynamiikka).
Samanaikainen somatostatiinianalogien käyttö
On suositeltavampaa tehdä gallium (68Ga)-edotreotidikuvantaminen yksi tai useampi päivä ennen seuraavaa somatostatiinianalogin antoa. Ks. kohta Yhteisvaikutukset.
Toimenpiteen jälkeen
Läheistä kontaktia pikkulasten ja raskaana olevien naisten kanssa on rajoitettava ensimmäisten 12 tunnin aikana annon jälkeen.
Erityiset varoitukset
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Radiomerkityn gallium (68Ga)-edotreotidiliuoksen happamasta pH-arvosta johtuen vahingossa tapahtuva ekstravasaatio voi aiheuttaa paikallista ärsytystä. Ekstravasaation sattuessa injektio on keskeytettävä, injektiokohta on vaihdettava ja ekstravasaatioalue on huuhdeltava natriumkloridiliuoksella.
Ympäristöhaittoihin liittyvät varotoimet on esitetty kohdassa Käyttö- ja käsittelyohjeet.
Yhteisvaikutukset
Somatostatiini ja sen analogit kilpailevat todennäköisesti samoihin somatostatiinireseptoreihin sitoutumisesta. Sen vuoksi hoidettaessa potilaita somatostatiinianalogeilla on suositeltavampaa tehdä gallium (68Ga)-edotreotidikuvantaminen yksi tai useampi päivä ennen seuraavaa somatostatiinianalogien antoa.
Pitkäaikainen altistus endogeeniselle hyperkortisolismille saattaa heikentää somatostatiinireseptorien ilmentymistä ja vaikuttaa negatiivisesti gallium (68Ga)-edotreotidin avulla toteutettavan somatostatiinireseptorien kuvantamisen tuloksiin. Potilailla, joilla on Cushingin oireyhtymä, hyperkortisolismin normalisointia on harkittava ennen SomaKit-TOC-valmisteen avulla tehtävää PET-kuvausta.
On viitteitä siitä, että kortikosteroidit voivat indusoida tyypin 2 somatostatiinireseptorin (SSRT2) alassäätelyä. Toistuvien korkeiden glukokortikoidiannosten antaminen ennen gallium (68Ga)-edotreotidin antamista saattaa aiheuttaa somatostatiinireseptoripositiivisten NET-kasvainten visualisoinnin kannalta riittämätöntä SSTR2-reseptorin ilmentymistä.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Kun radiofarmaseuttista valmistetta annetaan tarkoituksellisesti naiselle, joka voi tulla raskaaksi, on tärkeää määrittää onko hän raskaana vai ei. Jos kuukautiset ovat jääneet tulematta, naisen on katsottava olevan raskaana, kunnes toisin todetaan. Jos naisen mahdollisesta raskaudesta on epäselvyyttä (jos kuukautiset ovat jääneet tulematta, jos kuukautiset ovat hyvin epäsäännölliset tms.), potilaalle on tarjottava vaihtoehtoisia tekniikoita (jos niitä on käytettävissä), joissa ei käytetä ionisoivaa säteilyä.
Raskaus
Tämän lääkevalmisteen käytöstä raskauden aikana ei ole saatavilla tietoja. Raskaana olevalle naiselle tehtävässä radionukliditoimenpiteessä myös sikiöön kohdistuu säteilyannos. Sen vuoksi vain välttämättömät tutkimukset on tehtävä raskauden aikana, kun todennäköinen hyöty ylittää selvästi äitiin ja sikiöön kohdistuvan riskin.
Imetys
Ennen kuin imettävälle äidille annetaan radiofarmaseuttista valmistetta, on harkittava voidaanko radionuklidin antoa siirtää siihen saakka, kunnes äiti on lopettanut imettämisen. Lisäksi on harkittava, mikä radiofarmaseuttinen lääkevalmiste on sopivin, ottaen huomioon aktiivisuuden erittyminen rintamaitoon. Jos antoa pidetään välttämättömänä, imetys on keskeytettävä 12 tunnin ajaksi ja lypsetty maito on hävitettävä.
Läheistä kontaktia pikkulasten kanssa on rajoitettava ensimmäisten 12 tunnin aikana injektion jälkeen.
Hedelmällisyys
Tutkimuksia ei ole tehty hedelmällisyyteen kohdistuvan vaikutuksen arvioimiseksi.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Gallium (68Ga)-edotreotidilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Ionisoivalle säteilylle altistuminen on yhteydessä syövän syntyyn ja aiheuttaa mahdollisesti perinnöllisiä vaurioita. Koska efektiivinen annos on noin 4.5 mSv kun maksimaalinen 200 MBq:n aktiivisuus annetaan, näiden haittavaikutusten odotetaan esiintyvän pienellä todennäköisyydellä.
Haittavaikutukset on jaettu esiintyvyysluokkiin MedDRA-käytännön mukaisesti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Yleisoireet ja antopaikassa todettavat haitat
Tuntematon: kipua injektiokohdassa
Valikoitujen haittavaikutusten kuvaus
On raportoitu tapauksia, joissa fysiologinen gallium (68Ga)-edotreotidin otto pernakudokseen on virheellisesti diagnosoitu neuroendokriiniseksi kasvaimeksi, mikä on johtanut tarpeettomiin hoitotoimenpiteisiin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Säteily-yliannostuksen sattuessa potilaaseen absorboitua säteilyannosta on vähennettävä mahdollisuuksien mukaan lisäämällä radionuklidin eliminaatiota kehosta nesteytystä lisäämällä ja virtsaamalla tiheästi. Voi olla hyödyllistä arvioida käytetty efektiivinen annos.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diagnostiset radioaktiiviset lääkevalmisteet; muut diagnostiset radioaktiiviset lääkevalmisteet kasvainten havaitsemiseen. ATC-koodi: V09IX09.
Vaikutusmekanismi
Gallium (68Ga)-edotreotidi sitoutuu somatostatiinireseptoreihin. Tämä radiofarmaseuttinen valmiste sitoutuu in vitro suurella affiniteetilla pääasiassa SSTR2-reseptoriin, mutta vähemmässä määrin myös SSTR5-reseptoriin.
Semikvantitatiivista korrelaatiota ei ole arvioitu gallium (68Ga)-edotreotidin kasvaimiin oton ja SSTR-reseptoritiheyden välillä in vivo histopatologisilla näytteillä GEP-NET-potilailla eikä normaaleissa elimissä. Gallium (68Ga)-edotreotidin sitoutuminen in vivo muihin rakenteisiin tai reseptoreihin kuin SSTR-reseptoreihin ei ole tiedossa.
Farmakodynaamiset vaikutukset
Diagnostisia tutkimuksia varten käytettävillä kemiallisilla pitoisuuksilla gallium (68Ga)-edotreotidilla ei vaikuta olevan mitään kliinisesti merkittävää farmakodynaamista vaikutusta.
Edotreotidi on somatostatiinianalogi. Somatostatiini on keskushermoston välittäjäaine, mutta myös hormoni, joka sitoutuu neuroendokriinista alkuperää oleviin soluihin ja estää kasvuhormonin, insuliinin, glukagonin ja gastriinin vapautumista. Ei ole olemassa tietoja siitä, aiheuttaako edotreotidin laskimonsisäinen anto muutoksia seerumin gastriini- ja glukagonipitoisuuksiin.
Kliininen teho ja turvallisuus
Primaaristen GEP-NET-kasvainten tunnistamisessa kun oleellisen biokemiallisen kasvainmarkkerin pitoisuus oli suurentunut tai kun NET-etäpesäke oli todettu gallium (68Ga)-edotreotidilla toteutetun PET-kuvantamisen potilasperusteinen sensitiivisyys oli 100 % (4/4) ja spesifisyys 89 % (8/9) prospektiivisessa Gabrielin ym. 2007 tutkimuksessa. Leesioiden havaitsemissuhde oli 75 % (3/4) prospektiivisessa Frillingin ym. 2010 tutkimuksessa potilaiden alaryhmässä, joilla primaarikasvaimen sijainti oli tuntematon. Schreiterin ym. 2014 retrospektiivisessä julkaisussa 20 potilaan yksilöidensisäisissä vertailuissa havaittiin, että gallium (68Ga)-edotreotidi mahdollisti primaarikasvaimen paikallistamisen 9/20 (45 %) potilaalla ja indium (111In)-pentetreotidi 2/20 (10 %) potilaalla.
Prospektiivinen yksilöidensisäinen vertailu osoitti, että gallium (68Ga)-edotreotidin avulla on mahdollista paikallistaa leesiot paremmin kuin indium (111In)-pentetreotidia käytettäessä. Leesioiden havaitsemissuhde oli 100 % (40/40) gallium (68Ga)-edotreotidia käytettäessä ja 85 % (34/40) indium (111In)-pentetreotidia käytettäessä Hofmannin ym. 2001 tutkimuksessa, johon otettiin mukaan potilaita, joilla oli histologisesti vahvistettu bronkiaalinen (n=2) tai keskisuolen (n=6) NET-kasvain. Buchmannin ym. 2007 tutkimuksessa, joka tehtiin 27 potilaalla, joista useimmilla oli GEP-NET-kasvain (59 %) tai NET-kasvain, jonka alkuperä oli tuntematon (30 %), gallium (68Ga)-edotreotidin avulla havaittiin 279 leesiota ja indium (111In)-pentetreotidia käytettäessä 157 leesiota. Van Binnebeekin ym. 2015 tutkimuksessa 53 potilaalla, joilla oli etäpesäkkeinen GEP-NET-kasvain [useimmilla GEP-NET-kasvain (n=39) tai NET-kasvain, jonka alkuperä oli tuntematon (n=6)], leesioperusteinen gallium (68Ga)-edotreotidin havaitsemissuhde oli 99,9 % (1098/1099) ja indium (111In)-pentetreotidilla 60 % (660/1099) seurantakuvausten perusteella. Leen ym. 2015 tutkimuksessa 13 GEP-NET-potilaalla yhteensä 35 positiivista leesiota havaittiin 10 potilaalla joko gallium (68Ga)-edotreotidin avulla toteutetussa PET/TT-kuvauksessa tai indium (111In)-pentetreotidin avulla toteutetussa SPECT/TT-kuvauksessa. Kolmella potilaalla ei ollut positiivisia leesioita kummallakaan kuvantamismenetelmällä tutkittaessa. Gallium (68Ga)-edotreotidin avulla havaittiin 35/35 (100 %) leesiota ja indium (111In)-pentetreotidilla 19/35 (54 %) leesiota SPECT/TT-kuvauksessa. Kowalskin ym. 2003 tutkimuksessa neljällä potilaalla, joilla oli GEP-NET-kasvain, gallium (68Ga)-edotreotidilla oli parempi potilasperusteinen havaitsemissuhde (100 %) kuin indium (111In)-pentetreotidilla (50 %).
Saatavilla olevat tiedot gallium (68Ga)-edotreotidin kliinisestä tehosta histologisesti vahvistetun etäpesäkkeisen NET-kasvaimen peptidireseptoriradionuklidihoidon (PRRT) hoitovasteen ennustamisessa ja seurannassa ovat vähäisiä. Viisi tutkimusta on lähetetty arvioitavaksi, joista yksi on prospektiivinen (Gabriel ym. 2009) ja neljä retrospektiivistä (Kroiss ym. 2013, Ezziddin ym. 2012, Kratochwil ym. 2015 ja Luboldt ym. 2010a). Gabrielin ym. 2009 tutkimuksessa peptidireseptoriradionuklidihoitoa edeltävää gallium (68Ga)-edotreotidia verrattiin TT- tai MRI-kuvaukseen Response Evaluation Criteria in Solid Tumors (RECIST) -hoitovastekriteereitä käyttäen. Gallium (68Ga)-edotreotidin avulla toteutetun PET-kuvauksen ja TT-kuvauksen tulokset olivat yhteneviä 32 potilaalla (70 %) ja epäyhteneviä 14 potilaalla (30 %). Potilaista yhdeksällä oli etenevä tauti ja viidellä remissio.
Kroissin ym. 2013 retrospektiivinen tutkimus 249 potilaalla, joilla oli NET-kasvain, osoitti, että peptidireseptoriradionuklidihoito ei vaikuta merkittävästi gallium (68Ga)-edotreotidin semikvantitatiiviseen elimiin ottoon PET-kuvauksessa, paitsi potilaiden NET-kasvaimen maksaetäpesäkkeiden kohdalla. Tutkimuksesta kuitenkin puuttui histologinen vahvistaminen. Kolme muuta retrospektiivistä tutkimusta ottivat mukaan pieniä näytteitä (vaihteluväli 20–28 potilasta, joilla oli GEP-NET-kasvain tai syöpä, jonka alkuperä oli tuntematon). Niissä havaittiin, että semikvantitatiivinen elimiin otto peptidireseptoriradionuklidihoitoa edeltävässä gallium (68Ga)-edotreotidin avulla toteutetussa PET-kuvauksessa korreloi kasvaimiin imeytyneiden annosten kanssa myöhemmän ensimmäisen hoitosyklin injisoidun aktiivisuuden mukaisesti, erotteli kolmen peptidireseptoriradionuklidihoidon syklin jälkeen ne leesiot, jotka oli luokiteltu vasteen saaneiksi ja vastetta vaille jääneiksi, ja auttoi erottelemaan maksaetäpesäkkeet normaalista maksakudoksesta.
Farmakokinetiikka
Jakautuminen
Laskimonsisäisen injektion jälkeen gallium (68Ga)-edotreotidi puhdistuu nopeasti verestä noudattaen bieksponentiaalista aktiivisuuden eliminaatiota, puoliintumisaikojen ollessa 2,0 ± 0,3 minuuttia ja 48 ± 7 minuuttia.
Elimiin otto
Gallium (68Ga)-edotreotidin fysiologinen otto on elimistä suurinta pernassa, sen jälkeen munuaisissa. Maksaan, aivolisäkkeeseen, kilpirauhaseen ja lisämunuaiseen otto on vähäisempää. Korkeaa fysiologista gallium (68Ga)-edotreotidin ottoa voidaan myös havaita haiman hakalisäkkeessä. Noin 50 minuuttia laskimonsisäisen annon jälkeen gallium (68Ga)-edotreotidin kertyminen tasoittuu kaikissa elimissä.
Elimiin oton on osoitettu olevan iästä riippumatonta normaaleissa aikuisten henkilöiden kudoksissa ja myös pääasiallisesti sukupuolesta riippumatonta (paitsi kilpirauhasessa ja haiman pään osalta).
Eliminaatio
Radioaktiivisia metaboliitteja ei havaittu seerumissa neljän tunnin sisällä laskimonsisäisen gallium (68Ga)-edotreotidi-injektion jälkeen.
Noin 16 % gallium (68Ga)-edotreotidin aktiivisuudesta poistuu kehosta virtsassa 2–4 tunnin sisällä. Peptidi erittyy munuaisten kautta muuttumattomana yhdisteenä.
Puoliintumisaika
Huomioiden sen, että eliminaationopeus on merkittävästi hitaampi kuin galliumin fysikaalinen puoliintumisaika (68 min), biologisella puoliintumisajalla ei juurikaan ole vaikutusta lääkevalmisteen efektiiviseen puoliintumisaikaan. Efektiivinen puoliintumisaika olisi siten oletettavasti jonkin verran lyhempi kuin 68 minuuttia.
Munuaisten tai maksan vajaatoiminta
Valmisteen farmakokinetiikkaa ei ole määritetty munuaisten eikä maksan vajaatoimintaa sairastavilla potilailla.
Prekliiniset tiedot turvallisuudesta
Ei-kliinisten tietojen perusteella gallium (68Ga)-edotreotidiin ei liity mitään erityistä vaaraa ihmiselle.
Paikallisessa siedettävyyden arvioinnissa esiintyi lieviä tai kohtalaisia tulehduksen merkkejä joidenkin eläinten perivaskulaarisella alueella. Tämä voi liittyä liuoksen happamaan pH-arvoon.
Tutkimuksia ei ole tehty hedelmällisyyttä, sikiön kehittymistä, mutageenisuutta eikä pitkäaikaista karsinogeenisuutta koskien.
Uuden apuaineen (1,10-fenantroliini) osalta SomaKit TOC-valmisteella tehdyssä toksisuustutkimuksessa, jossa oli mukana 1,10-fenantroliini 400 kertaa ihmisen annosta korkeammalla annoksella, ei havaittu merkkejä toksisuudesta.
Tutkimuskirjallisuudessa saatavilla olevat 1,10-fenantroliinin genotoksisuustutkimukset ovat osoittaneet negatiivisia tuloksia bakteerimutaatiokokeessa (Amesin testi). Hiiren lymfoomakokeessa näkyi merkkejä mahdollisesta genotoksisuudesta 750 kertaa korkeammilla pitoisuuksilla kuin mihin 1,10-fenantroliinin pitoisuus veressä nousee korkeimmillaan potilailla. Kuitenkin vaikka genotoksisten ja karsinogeenisten epäpuhtauksien rajat otettaisiin pahimman tilanteen vertailukohdaksi, 1,10‑fenantroliinin jäämiä SomaKit TOC-lääkemuodossa pidetään merkityksettöminä potilaille annettavalla annoksella: altistus 1,10-fenantroliinille (5 µg/annos) on 24 kertaa pienempi kuin hyväksyttävä päivittäinen genotoksisen epäpuhtauden saanti (120 µg/vrk alle 1 kuukauden altistuksella).
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine
1,10-fenantroliini
Gentisiinihappo
Mannitoli (E421)
Puskuriliuos
Muurahaishappo
Natriumhydroksidi (E524)
Injektionesteisiin käytettävä vesi
Radioleimauksen jälkeen saatu liuos sisältää myös apuaineena suolahappoa, joka on peräisin generaattorista saadusta eluaatista.
Yhteensopimattomuudet
Kuljetinmolekyylien radioleimaus gallium (68Ga)-kloridilla on hyvin herkkä hivenaineista peräisin olevien metallien epäpuhtauksille. Valmisteen kanssa on käytettävä vain ruiskua ja ruiskun neuloja, joilla voidaan minimoida hivenaineista peräisin olevien metallien epäpuhtauksien määrät (esimerkiksi ei-metallista tai silikonilla päällystettyä neulaa).
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa 12.
Kestoaika
Avaamaton myyntipakkaus
2 vuotta.
Radioleimauksen jälkeen
4 tuntia.
Älä säilytä yli 25°C:ssa radioleimauksen jälkeen.
Mikrobiologiselta kannalta lääkevalmiste tulee käyttää heti. Jos lääkevalmistetta ei käytetä heti, käyttöön liittyvät säilytysajat ja olosuhteet ennen käyttöä ovat käyttäjän vastuulla.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Lääkevalmisteen säilytys radioleimauksen jälkeen, ks. kohta Kestoaika.
Radiofarmaseuttisten valmisteiden säilytyksessä on noudatettava radioaktiivisia materiaaleja koskevia kansallisia määräyksiä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SOMAKIT TOC valmisteyhdistelmä radioaktiivista lääkettä varten
40 mikrog (L:ei) 1 kpl (40 mikrog + 1 ml) (-)
PF-selosteen tieto
Yhden pakkauksen sisältö:
- Yksi injektiopullo injektiokuiva-ainetta liuosta varten: 10 ml:n tyypin I lasinen injektiopullo, jossa on bromobutyylikumitulppa ja joka on suljettu repäisykorkilla. Yksi injektiopullo sisältää 40 mikrogrammaa edotreotidia.
- Yksi injektiopullo reaktiopuskuriliuosta: 10 ml:n syklisestä olefiinipolymeeristä valmistettu injektiopullo, jossa on teflonitulppa ja joka on suljettu repäisykorkilla. Yksi injektiopullo sisältää 1 ml reaktiopuskuriliuosta.
Valmisteen kuvaus:
Sisältö:
- Injektiokuiva-aine liuosta varten: injektiopullo sisältää valkoista tai melkein valkoista kylmäkuivattua jauhetta.
- Reaktiopuskuriliuos: injektiopullo sisältää kirkasta, väritöntä liuosta.
Radioleimaukseen gallium (68Ga)-kloridiliuoksen kanssa.
Käyttö- ja käsittelyohjeet
Yleiset varoitukset
Radiofarmaseuttisia valmisteita saavat ottaa vastaan, käyttää ja antaa vain siihen valtuutetut henkilöt siihen tarkoitetussa hoitoympäristössä. Niiden vastaanoton, säilytyksen, käytön, siirtämisen ja hävittämisen tulee tapahtua määräysten ja/tai toimivaltaisen viranomaisen myöntämien asianmukaisten lupien mukaisesti.
Radiofarmaseuttiset valmisteet on valmisteltava käyttövalmiiksi säteilyturvallisuuden ja farmaseuttisten laatuvaatimusten edellyttämällä tavalla. Asianmukaisia aseptisia varotoimia on noudatettava.
Injektiopullojen sisältö on tarkoitettu vain gallium (68Ga)-edotreotidi-injektioliuoksen valmistamiseen. Niitä ei saa antaa suoraan potilaalle ilman edeltäviä valmistelutoimenpiteitä.
Yksi 40 mikrogramman injektiopullo sisältää ylimääräistä lääkevalmistetta. On kuitenkin suositeltavaa, että injektiopullo valmistellaan ohjeiden mukaisesti ja käytetään vain yhden potilaan annokseen injisoitavan aktiivisuuden perusteella. Kaikki jäljelle jäänyt materiaali on hävitettävä radioleimauksen ja käytön jälkeen.
Ennen lääkevalmisteen käsittelyä tai antoa huomioon otettavat varotoimet
Ks. kohdasta 12 ohjeet lääkevalmisteen radioleimauksesta ennen antoa.
Jos injektiopullojen eheyteen tulee puutoksia milloin tahansa tämän lääkevalmisteen valmistuksen aikana, niitä ei pidä käyttää.
Antotoimenpiteet on toteutettava siten, että lääkevalmisteen kontaminaation ja käyttäjiin kohdistuvan säteilytyksen riski minimoidaan. Riittävien säteilysuojien käyttö on pakollista.
Valmisteyhdistelmän sisältö ei ole radioaktiivista ennen radioleimausta. Kuitenkin sen jälkeen kun gallium (68Ga)-kloridiliuos on lisätty, lopullinen valmiste on suojattava riittävillä säteilysuojilla.
Radiofarmaseuttisten valmisteiden antoon liittyy riski muille henkilöille ulkoisen säteilyn tai virtsan, oksennuksen, veren tms. läikkymisestä peräisin olevan kontaminaation takia. Tämän vuoksi on toteutettava kansallisten määräysten mukaiset säteilysuojauksen varotoimenpiteet.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
SOMAKIT TOC valmisteyhdistelmä radioaktiivista lääkettä varten
40 mikrog 1 kpl
- Ei korvausta.
ATC-koodi
V09IX09
Valmisteyhteenvedon muuttamispäivämäärä
04.04.2025
Dosimetria
Gallium-68 hajoaa 68 minuutin puoliintumisajalla vakaaksi sinkki-68:ksi, 89 % positroniemission kautta, jonka keskimääräinen energia on 836 keV, jonka jälkeen 511 keV:n fotonisina annihilaatiosäteilyinä (178 %), 10 % orbitaalisella elektronisieppauksella (röntgen- tai Auger-päästöt), ja 3 % 13 gammasiirtymänä viideltä virittyneeltä tasolta.
Sandstrom et al. (2013) toteuttivat gallium (68Ga)-edotreotidin dosimetrian laskemisen OLINDA/EXM 1.1-ohjelmistolla (taulukko 1).
Taulukko 1: Gallium (68Ga)-edotreotidin dosimetria
Absorboitu annos valituissa elimissä | mGy/MBq |
Elimet | Keskiarvo |
Lisämunuaiset | 0,077 |
Aivot | 0,010 |
Rinnat | 0,010 |
Sappirakon seinämä | 0,015 |
Alempi paksusuolen seinämä | 0,015 |
Ohutsuoli | 0,023 |
Mahan seinämä | 0,013 |
Ylempi paksusuolen seinämä | 0,020 |
Sydämen seinämä | 0,020 |
Munuaiset | 0,082 |
Maksa | 0,041 |
Keuhkot | 0,007 |
Lihas | 0,012 |
Munasarjat | 0,015 |
Haima | 0,015 |
Punainen luuydin | 0,016 |
Osteogeeniset solut | 0,021 |
Iho | 0,010 |
Perna | 0,108 |
Kivekset | 0,011 |
Kateenkorva | 0,011 |
Kilpirauhanen | 0,011 |
Virtsarakon seinämä | 0,119 |
Kohtu | 0,015 |
Koko keho | 0,014 |
Efektiivinen annos mSv/MBq | 0,021 |
200 MBq:n aktiivisuuden annosta 70 kg painavalle aikuiselle tuleva efektiivinen annos on noin 4,2 mSv.
200 MBq:n annetun aktiivisuuden osalta tyypillinen säteilyannos kriittisille elimille on noin 24 mGy (virtsarakon seinämä), 22 mGy (perna), 16 mGy (munuaiset) ja 15 mGy (lisämunuaiset).
Radiofarmaseuttisten valmisteiden valmistusohjeet
Säteilyturvallisuus – Lääkevalmisteen käsittely
Käytä vesitiiviitä hansikkaita, tehokkaita säteilysuojia ja asianmukaisia turvallisuustoimenpiteitä käsitellessäsi radioleimattua SomaKit TOC-valmistetta välttääksesi tarpeettoman potilaaseen, työntekijöihin, kliiniseen hoitohenkilöstöön ja muihin henkilöihin kohdistuvan säteilyaltistuksen.
Radiofarmaseuttisten valmisteiden käyttäjien on oltava sellaisia terveydenhuollon ammattilaisia tai käytön on tapahduttava sellaisten terveydenhuollon ammattilaisten valvonnassa, jotka ovat saaneet pätevyyden erityisen koulutuksen myötä, joilla on kokemusta radionuklidien turvallisesta käytöstä ja käsittelystä, ja joiden kokemus ja koulutus on hyväksytty asianmukaisen valtion viraston taholta, jolla on oikeus myöntää lupia radionuklidien käyttöön.
Gallium (68Ga)-edotreotidiliuos on valmistettava säteilysuojauksen ja farmaseuttisten laatustandardien mukaisesti, erityisesti aseptisen tekniikan osalta. Jos injektiopullojen eheyteen tulee puutoksia milloin tahansa tämän lääkevalmisteen valmistuksen aikana, lääkevalmistetta ei pidä käyttää.
1 ml:n vähäisen kuolleen tilavuuden muoviruiskua on käytettävä riittävän, valmistuksen aikana lisättävän reaktiopuskuriliuoksen tilavuuden mittaamiseksi. Lasiruiskua ei saa käyttää.
Liuos on vedettävä antoa varten tulpan kautta kerta-annosruiskulla, jossa on soveltuva suoja ja hävitettävä steriili neula, tai hyväksyttyä automatisoitua antojärjestelmää käyttäen.
Valmistusmenetelmä
SomaKit TOC toimitetaan valmisteyhdistelmänä, joka sisältää kaksi injektiopulloa. Se on tarkoitettu radioleimattavaksi gallium (68Ga)-kloridiliuoksella, joka on Ph.Eur. monograph 2464 Gallium (68Ga) chloride solution for radiolabelling -asiakirjan mukainen, steriili, ja jonka soveltuvuus SomaKit TOC-valmisteyhdistelmän kanssa on testattu. Vain generaattoreita, joilla on myyntilupa lääkevalmisteina EU:ssa, on käytettävä. Katso lisätietoja generaattorin valmisteyhteenvedosta.
Seuraavien myyntiluvan saaneiden generaattorien on osoitettu olevan yhteensopiva SomaKit TOC-valmisteyhdistelmän kanssa:
- GalliaPharm, 0,74 – 1,85 GBq, radionuklidigeneraattori (Eckert & Ziegler Radiopharma GmbH)
- Galli Ad, 0,74 – 1,85 GBq, radionuklidigeneraattori (IRE-Elit).
Gallium (68Ga)-edotreotidiliuos laskimonsisäistä injektiota varten on valmistettava aseptisten toimenpiteiden, paikallisten määräysten ja seuraavien ohjeiden mukaisesti:
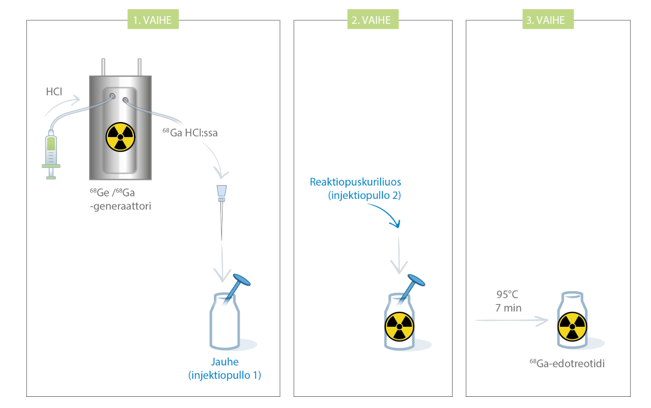
Rekonstituointi GalliaPharm-generaattoria käyttäen:
- Jos mahdollista, radioleimatun SomaKit TOC-valmisteen valmistamisen helpottamiseksi kuumennusalusta on syytä asettaa aivan generaattorin viereen.
- Aseta suojatun kuivahauteen, jonka kuoppien halkaisija on 25 mm, lämpötila 95 °C:seen. Varmista lämpömittarilla, että lämpötila saavuttaa asetetun pisteen ja vakautuu ennen rekonstituoinnin aloittamista.
- Irrota repäisykorkki kuiva-aineen injektiopullosta (injektiopullo 1) ja pyyhi pullon suuaukon yläosa asianmukaisella antiseptisella aineella pinnan desinfektoimiseksi. Anna tulpan kuivua sen jälkeen.
- Läpäise injektiopullo 1:n (injektiokuiva-aine liuosta varten) välikalvo 0,2 µm:n steriilillä poistoaukkosuodattimella ilmanpaineen ylläpitämiseksi injektiopullossa radioleimausprosessin aikana. Metallikontaminaation välttämiseksi 0,2 µm:n steriilin poistoaukkosuodattimen neula ei saa osua eluaattiin missään vaiheessa.
- Irrota repäisykorkki injektiopullosta 2 (reaktiopuskuriliuos) ja pyyhi pullon suuaukon yläosa asianmukaisella antiseptisella aineella pinnan desinfektoimiseksi. Anna tulpan kuivua sen jälkeen. Vedä 1 ml:n vähäisen kuolleen tilavuuden ruiskulla varovasti 0,5 ml reaktiopuskuriliuosta ja säilytä reaktiopuskuriliuos ruiskussa vaihetta ”i” varten.
- Yhdistä 68Ge/68Ga-generaattorin ulostulolinjan koiraspuolinen lukko (male luer) steriiliin neulaan (joka on metalliepäpuhtauksien vähentämiseksi päällystetty silikonilla tai muulla soveltuvalla materiaalilla).
- Yhdistä injektiopullo 1 generaattorin ulostulolinjaan painamalla eluaattineula kumisen kalvon läpi. Pidä eluaattineula 0,2 µm:n steriilin poistoaukkosuodattimen neulan alapuolella. Varmista, että missään vaiheessa neulat eivät pääse kosketuksiin toistensa kanssa, eivätkä painu eluaatin pinnan alle.
- Eluoi generaattori suoraan injektiopulloon 1 (neulan kautta) generaattorin valmistajan käyttöohjeiden mukaisesti, kuiva-aineen ja eluaatin sekoittamiseksi keskenään. Eluointi voidaan tehdä joko manuaalisesti tai pumpulla.
- Eluoinnin lopussa irrota generaattori injektiopullosta 1 vetämällä neula pois kumikalvosta ja lisää välittömästi reaktiopuskuriliuos, joka on annosteltu aiemmin 1 ml:n steriiliin ruiskuun. Vedä pois ruisku ja 0,2 µm:n steriili poistoaukkosuodatin ja siirrä injektiopullo 95 °C:n kuivahauteen aukkoon pihtejä käyttäen. Jätä injektiopullo 95 °C:seen vähintään 7 minuutiksi (älä ylitä 10 minuutin kuumennusaikaa) sekoittamatta ja ravistelematta.
- 7 minuutin jälkeen ota injektiopullo pois kuivahauteesta, aseta se asianmukaisesti merkittyyn lyijysuojaan ja anna sen jäähtyä huoneenlämmössä noin 10 minuuttia.
- Määritä injektiopullon radioaktiivisuus soveltuvalla radioaktiivisuuden kalibrointijärjestelmällä ja kirjaa tulos. Ilmoita aktiivisuuden arvo, kalibrointiaika, pakkauksessa olevan lyijysuojattuun säiliöön liitettävän suojan etiketin eränumero ja viimeinen käyttöpäivä.
- Tee laadunvarmistus suositeltujen menetelmien mukaisesti spesifikaatioiden noudattamisen tarkistamiseksi (ks. seuraava kohta, ”Laadunvarmistus”).
- Liuos on tarkastettava silmämääräisesti ennen käyttöä. Vain kirkasta liuosta, jossa ei ole näkyviä hiukkasia, saa käyttää. Silmämääräinen tarkastus on tehtävä ruudun alla, jossa on suoja säteilysuojelua varten.
- Säilytä gallium (68Ga)-edotreotidiliuoksen sisältävä injektiopullo alle 25 °C:ssa käyttöön saakka. Lääkevalmiste on otettava injektiopullosta aseptisesti antohetkellä ja säteilysuojelustandardeja on noudatettava. Potilaan annos on mitattava soveltuvalla radioaktiivisuuden kalibrointijärjestelmällä juuri ennen potilaalle antoa. Lääkevalmisteen antotiedot on myös kirjattava.
Kaaviokuva radioleimaustoimenpiteestä on esitetty kuvassa 1.
Kuva 1: Radioleimaustoimenpide GalliaPharm-generaattoria käytettäessä
Rekonstituointi Galli Ad -generaattoria käyttäen:
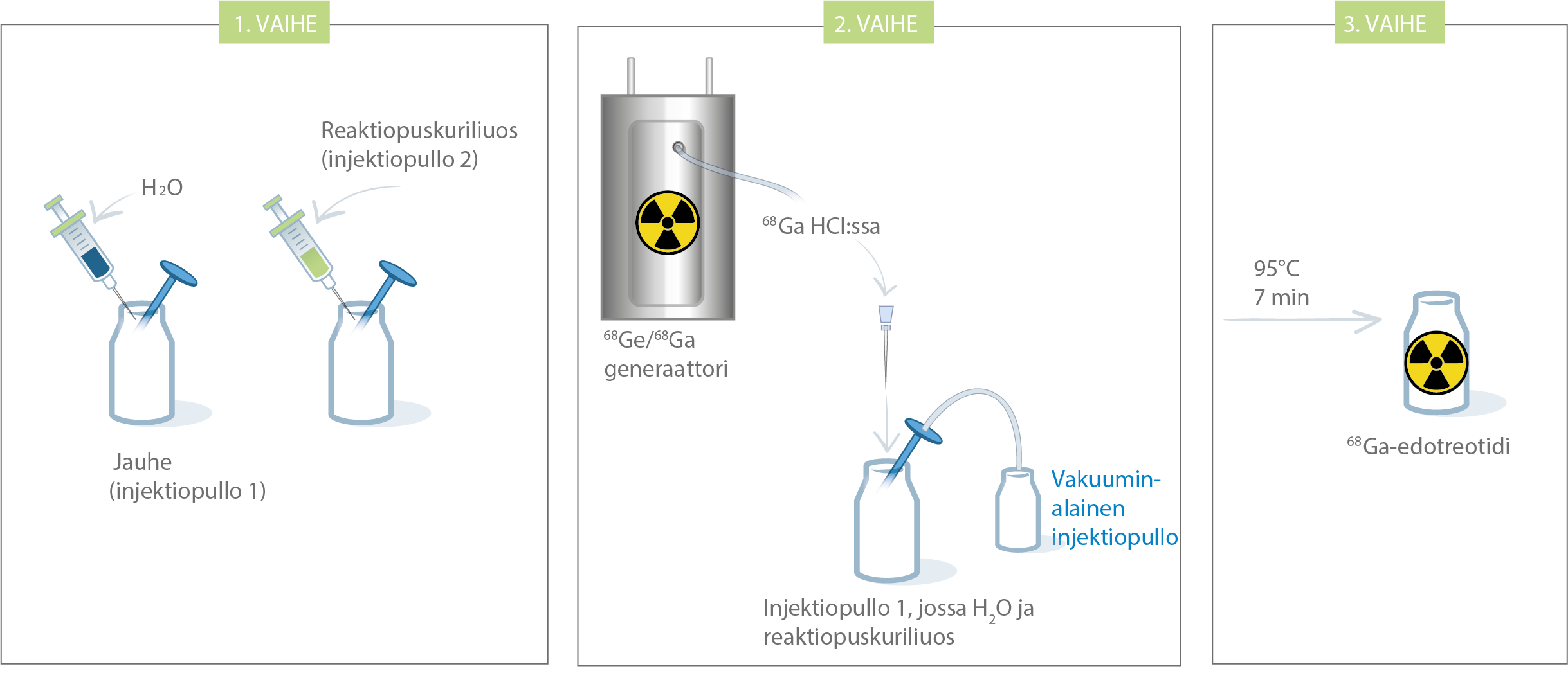
- Jos mahdollista, radioleimatun SomaKit TOC-valmisteen valmistamisen helpottamiseksi kuumennusalusta on syytä asettaa aivan generaattorin viereen.
- Aseta suojatun kuivahauteen, jonka kuoppien halkaisija on 25 mm, lämpötila 95 °C:seen. Varmista lämpömittarilla, että lämpötila saavuttaa asetetun pisteen ja vakautuu ennen rekonstituoinnin aloittamista.
- Irrota repäisykorkki kuiva-aineen injektiopullosta (injektiopullo 1) ja pyyhi pullon suuaukon yläosa asianmukaisella antiseptisella aineella pinnan desinfektoimiseksi. Anna tulpan kuivua sen jälkeen.
- Läpäise injektiopullo 1:n (injektiokuiva-aine liuosta varten) välikalvo 0,2 µm:n steriilillä poistoaukkosuodattimella ilmanpaineen ylläpitämiseksi injektiopullossa radioleimausprosessin aikana. Metallikontaminaation välttämiseksi 0,2 µm:n steriilin poistoaukkosuodattimen neula ei saa osua eluaattiin missään vaiheessa.
- Irrota repäisykorkki injektiopullosta 2 (reaktiopuskuriliuos) ja pyyhi pullon suuaukon yläosa asianmukaisella antiseptisella aineella pinnan desinfektoimiseksi. Anna tulpan kuivua sen jälkeen. Vedä 1 ml:n vähäisen kuolleen tilavuuden ruiskulla varovasti 100 µl reaktiopuskuriliuosta, ja säilytä reaktiopuskuriliuos ruiskussa vaihetta ”g” varten.
- Vedä 5 ml:n steriiliin ruiskuun, johon on kiinnitetty steriili neula (joka on metalliepäpuhtauksien vähentämiseksi päällystetty silikonilla tai muulla sopivalla materiaalilla), varovasti 4 ml injektionesteisiin käytettävää vettä ja rekonstituoi injektiopullossa 1 oleva jauhe.
- Lisää aiemmin 1 ml:n steriiliin ruiskuun annosteltu reaktiopuskuriliuos.
- Yhdistä 68Ge/68Ga-generaattorin ulostulolinjan koiraspuolinen lukko (male luer) steriiliin neulaan (joka on metalliepäpuhtauksien vähentämiseksi päällystetty silikonilla tai muulla soveltuvalla materiaalilla).
- Yhdistä injektiopullo 1 generaattorin ulostulolinjaan painamalla eluaattineula kumisen kalvon läpi. Pidä eluaattineula 0,2 µm:n steriilin poistoaukkosuodattimen neulan alapuolella. Varmista, että missään vaiheessa neulat eivät pääse kosketuksiin toistensa kanssa, eivätkä painu eluaatin pinnan alle. Käännä nappia 90°(astetta) lastausasentoon, odota 10 sekuntia, ja palauta nappi takaisin alkuasentoon generaattorin käyttöohjeita noudattaen.
- Liitä injektiopullo 1 0,2 µm:n poistoaukkosuodattimen kautta vakuumipulloon tai pumppuun eluoinnin aloittamiseksi. Eluoi generaattori suoraan injektiopulloon 1 (neulan kautta).
- Eluoinnin lopussa irrota ensin neula vakuumipullosta ympäristön paineen muodostamiseksi injektiopullossa 1. Irrota tämän jälkeen injektiopullo 1 generaattorista poistamalla neula kumitulpasta. Poista 0,2 µm:n steriili poistoaukkosuodatin ja siirrä injektiopullo 95 °C:n kuivahauteen aukkoon pihtejä käyttäen. Jätä injektiopullo 95 °C:seen vähintään 7 minuutiksi (älä ylitä 10 minuutin kuumennusaikaa) sekoittamatta ja ravistelematta.
- 7 minuutin jälkeen ota injektiopullo pois kuivahauteesta, aseta se asianmukaisesti merkittyyn lyijysuojaan ja anna sen jäähtyä huoneenlämmössä noin 10 minuuttia.
- Määritä injektiopullon radioaktiivisuus soveltuvalla radioaktiivisuuden kalibrointijärjestelmällä ja kirjaa tulos. Ilmoita aktiivisuuden arvo, kalibrointiaika, pakkauksessa olevan lyijysuojattuun säiliöön liitettävän suojan etiketin eränumero ja viimeinen käyttöpäivä.
- Tee laadunvarmistus suositeltujen menetelmien mukaisesti spesifikaatioiden noudattamisen tarkistamiseksi (ks. seuraava kohta, ”Laadunvarmistus”).
- Liuos on tarkastettava silmämääräisesti ennen käyttöä. Vain kirkasta liuosta, jossa ei ole näkyviä hiukkasia, saa käyttää. Silmämääräinen tarkastus on tehtävä ruudun alla, jossa on suoja säteilysuojelua varten.
- Säilytä gallium (68Ga)-edotreotidiliuoksen sisältävä injektiopullo alle 25 °C:ssa käyttöön saakka. Lääkevalmiste on otettava injektiopullosta aseptisesti antohetkellä ja säteilysuojelustandardeja on noudatettava. Potilaan annos on mitattava soveltuvalla radioaktiivisuuden kalibrointijärjestelmällä juuri ennen potilaalle antoa. Lääkevalmisteen antotiedot on myös kirjattava.
Kaaviokuva radioleimaustoimenpiteestä on esitetty kuvassa 2.
Kuva 2: Radioleimaustoimenpide Galli Ad -generaattoria käytettäessä
Gallium (68Ga)-edotreotidiliuos on vakaa maksimissaan 4 tuntia valmistamisen jälkeen. Sen vuoksi radioleimattu liuos voidaan käyttää 4 tunnin sisällä valmistamisen jälkeen annon edellyttämän aktiivisuuden mukaisesti.
Radioaktiivinen jäte on hävitettävä asiaankuuluvien kansallisten määräysten mukaisesti.
Oikealla reaktiopuskuriliuoksen tilavuudella ja generaattorieluaatilla toteutetun radioleimauksen jälkeen muu liuottaminen millä tahansa liuottimella on kiellettyä.
Laadunvarmistus
Taulukko 2: Gallium (68Ga)-edotreotidin spesifikaatiot
Testi | Sopivuuskriteerit | Menetelmä |
Ulkonäkö | Kirkas liuos, jossa ei ole näkyviä hiukkasia | Silmämääräinen tarkastus |
pH | 3,2 – 3,8 | pH-indikaattoriliuskat |
Leimaustehokkuus kolloidinen gallium-68-laji | ≤ 3 % | Ohutkerroksinen kromatografia (ITLC1, katso tiedot jäljempänä) |
Leimaustehokkuus % Vapaa gallium-68 | ≤ 2 % | Ohutkerroksinen kromatografia (ITLC2, katso tiedot jäljempänä) |
Laadunvarmistus on tehtävä ruudun alla, jossa on suoja säteilysuojelua varten.
Suositeltava menetelmä gallium (68Ga)-edotreotidin leimaustehokkuuden määrittämiseen:
ITLC1:
Materiaali
- Lasikuituinen ITLC-paperi (esim. Agilent ITLC SGI001), joka on esileikattu 1 cm x 12 cm liuskoiksi
- Liikkuva faasi: 77 g/l ammoniumasetaattiliuos vesi/metanoli 50:50 V/V -seoksessa
- Kehitystankki
- Radiometrinen ITLC-skanneri
Näytteen analyysi
- TLC-kehitystankki valmistellaan kaatamalla liikkuva faasi 3–4 mm:n syvyyteen. Peitä tankki ja anna tasapainottua.
- Lisää pisara gallium (68Ga)-edotreotidiliuosta kynälinjaan 1 cm ITLC-liuskan pohjasta lukien.
- Aseta ITLC-liuska kehitystankkiin ja anna sen kehittyä 9 cm:n etäisyyden verran asettamiskohdasta.
- Skannaa ITLC-liuska radiometrisellä ITLC-skannerilla.
-
Retentiofaktorilla (Rf) on seuraavat spesifikaatiot:
Ei-kompleksoitunut gallium (68Ga) = 0–0,1
gallium (68Ga)-edotreotidi = 0,8–1
Leimaustehokkuus lasketaan integroimalla huippupitoisuus Rf:lla = 0–0,1; jonka pitää olla ≤ 3 %.
ITLC2:
Materiaali
- Lasikuituinen ITLC-paperi (esim. Agilent ITLC SGI001), joka on esileikattu 1 cm x 12 cm liuskoiksi
- Liikkuva faasi: natriumsitraatti 0,1 M (pH-arvo 5) vedessä
- Kehitystankki
- Radiometrinen ITLC-skanneri
Näytteen analyysi
- TLC-kehitystankki valmistellaan kaatamalla liikkuva faasi 3–4 syvyyteen. Peitä tankki ja anna tasapainottua.
- Lisää pisara gallium (68Ga)-edotreotidiliuosta kynälinjaan 1 cm ITLC-liuskan pohjasta lukien.
- Aseta ITLC-liuska kehitystankkiin ja anna sen kehittyä 9 cm:n etäisyyden verran asettamiskohdasta.
-
Skannaa ITLC-liuska radiometrisellä ITLC-skannerilla.
Retentiofaktorilla (Rf) on seuraavat spesifikaatiot: gallium (68Ga)-edotreotidi = 0,1–0,2
Vapaa gallium-68 = 0,9–0,1
Leimaustehokkuus lasketaan integroimalla huippupitoisuus Rf:lla = 0,9–1,0; jonka pitää olla ≤ 2 %.
Lisätietoa tästä lääkevalmisteesta on Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu.
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
