VYDURA tabletti, kylmäkuivattu 75 mg
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi kylmäkuivattu tabletti sisältää rimegepanttisulfaattia määrän, joka vastaa 75 mg:aa rimegepanttia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kylmäkuivattu.
Kliiniset tiedot
Käyttöaiheet
VYDURA on tarkoitettu
- aikuisten aurallisen tai aurattoman migreenin akuuttiin hoitoon
- episodisen migreenin ennaltaehkäisevään hoitoon aikuisille, joilla on vähintään 4 migreenikohtausta kuukaudessa.
Annostus ja antotapa
Annostus
Migreenin akuutti hoito
Suositeltu annos on 75 mg rimegepanttia kerran päivässä tarpeen mukaan.
Migreenin ennaltaehkäisy
Suositeltu annos on 75 mg rimegepanttia joka toinen päivä.
Enimmäisannos vuorokautta kohden on 75 mg rimegepanttia.
VYDURA-valmisteen voi ottaa ruoan kanssa tai ilman ruokaa.
Samanaikaiset lääkevalmisteet
Jos rimegepanttiannos otetaan samanaikaisesti kohtalaisen CYP3A4:n estäjän tai voimakkaan P‑glykoproteiinin (P-gp) estäjän kanssa, on odotettava vähintään 48 tuntia ennen seuraavan rimegepanttiannoksen ottamista (ks. kohta Yhteisvaikutukset).
Erityisryhmät
Iäkkäät (vähintään 65‑vuotiaat) potilaat
Rimegepantin käytöstä vähintään 65‑vuotiaille potilaille on vain vähän kokemusta. Annosta ei tarvitse muuttaa, koska ikä ei vaikuta rimegepantin farmakokinetiikkaan (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa lievää, keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastaville potilaille. Vaikea munuaisten vajaatoiminta suurensi vapaan lääkeaineen AUC-arvoa yli 2‑kertaisesti, mutta kokonais-AUC suureni alle 50 % (ks. kohta Farmakokinetiikka). Usein toistuvassa käytössä potilaille, joilla on vaikea munuaisten vajaatoiminta, on noudatettava varovaisuutta. Rimegepanttia ei ole tutkittu potilailla, joilla on loppuvaiheen munuaissairaus tai jotka saavat dialyysihoitoa. Rimegepantin käyttöä on vältettävä potilaille, joilla on loppuvaiheen munuaissairaus (kreatiniinipuhdistuma < 15 ml/min).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa lievää (Child-Pugh A) tai keskivaikeaa (Child-Pugh B) maksan vajaatoimintaa sairastaville potilaille. Rimegepantin pitoisuus plasmassa (vapaan lääkeaineen AUC) oli huomattavasti suurempi vaikeaa maksan vajaatoimintaa (Child-Pugh C) sairastavilla tutkittavilla (ks. kohta Farmakokinetiikka). Rimegepantin käyttöä on vältettävä potilaille, joilla on vaikea maksan vajaatoiminta.
Pediatriset potilaat
VYDURA-valmisteen turvallisuutta pediatristen (< 18 vuoden ikäisten) potilaiden hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
VYDURA on tarkoitettu suun kautta otettavaksi.
Kylmäkuivattu tabletti asetetaan kielen päälle tai alle. Tabletti hajoaa suussa, eikä sitä tarvitse ottaa nesteen kanssa.
Potilaita on neuvottava avaamaan läpipainopakkaus kuivin käsin ja lukemaan pakkausselosteessa olevat täydelliset ohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Yliherkkyysreaktioita, mukaan lukien hengenahdistusta ja ihottumaa, on esiintynyt alle 1 %:lla potilaista, jotka ovat saaneet rimegepanttihoitoa kliinisissä tutkimuksissa (ks. kohta Haittavaikutukset). Yliherkkyysreaktiot, myös vakavat yliherkkyysreaktiot, voivat ilmaantua päivien kuluttua annoksen ottamisesta. Yliherkkyysreaktion tapauksessa rimegepantin käyttö on lopetettava ja potilaalle on annettava asianmukaista hoitoa.
VYDURA-valmistetta ei suositella:
- potilaille, joilla on vaikea maksan vajatoiminta (ks. kohta Annostus ja antotapa)
- potilaille, joilla on loppuvaiheen munuaissairaus (kreatiniinipuhdistuma < 15 ml/min) (ks. kohta Annostus ja antotapa)
- samanaikaiseen käyttöön voimakkaiden CYP3A4:n estäjien kanssa (ks. kohta Yhteisvaikutukset)
- samanaikaiseen käyttöön voimakkaiden tai kohtalaisten CYP3A4:n indusoijien kanssa (ks. kohta Yhteisvaikutukset).
Lääkepäänsärky
Minkä tahansa päänsäryn hoitoon tarkoitetun lääkevalmisteen liiallinen käyttö saattaa pahentaa päänsärkyjä. Tällaisen tilanteen ilmetessä tai sitä epäiltäessä potilaan pitää kääntyä lääkärin puoleen ja hoito on lopetettava. Lääkepäänsärkyä on syytä epäillä, jos potilaalla on usein toistuvaa tai päivittäistä päänsärkyä akuuttiin päänsärkyyn tarkoitettujen lääkevalmisteiden säännöllisestä käytöstä huolimatta (tai sen takia).
Yhteisvaikutukset
Rimegepantti on CYP3A4:n sekä effluksikuljettajaproteiinien P‑gp (P‑glykoproteiini) ja BCRP (rintasyöpäresistenssiproteiini) substraatti (ks. kohta Farmakokinetiikka).
CYP3A4:n estäjät
CYP3A4:n estäjät suurentavat rimegepantin pitoisuutta plasmassa. Rimegepantin käyttöä samanaikaisesti voimakkaiden CYP3A4:n estäjien kanssa (esim. klaritromysiini, itrakonatsoli, ritonaviiri) ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Rimegepantin anto samanaikaisesti itrakonatsolin kanssa lisäsi rimegepanttialtistusta huomattavasti (AUC suureni 4‑kertaisesti ja Cmax 1,5‑kertaisesti).
Rimegepantin käyttö samanaikaisesti CYP3A4:ää kohtalaisesti estävien lääkevalmisteiden kanssa (esim. diltiatseemi, erytromysiini, flukonatsoli) saattaa lisätä rimegepanttialtistusta. Rimegepantin anto samanaikaisesti flukonatsolin kanssa lisäsi rimegepanttialtistusta (AUC suureni 1,8‑kertaisesti) ilman merkittävää vaikutusta Cmax-arvoon. Jos rimegepanttiannos otetaan samanaikaisesti kohtalaisen CYP3A4:n estäjän (kuten flukonatsolin) kanssa, on odotettava vähintään 48 tuntia ennen seuraavan rimegepanttiannoksen ottamista (ks. kohta Annostus ja antotapa).
CYP3A4:n indusoijat
CYP3A4:n indusoijat pienentävät rimegepantin pitoisuutta plasmassa. VYDURA-valmisteen käyttöä samanaikaisesti voimakkaiden CYP3A4:n indusoijien kanssa (esim. fenobarbitaali, rifampisiini, mäkikuisma [Hypericum perforatum]) tai kohtalaisten CYP3A4:n indusoijien kanssa (esim. bosentaani, efavirentsi, modafiniili) ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). CYP3A4:ää indusoiva vaikutus saattaa kestää jopa 2 viikkoa voimakkaan tai kohtalaisen CYP3A4:n indusoijan käytön lopettamisen jälkeen. Rimegepantin anto samanaikaisesti rifampisiinin kanssa vähensi rimegepanttialtistusta huomattavasti (AUC pieneni 80 % ja Cmax 64 %), mikä saattaa heikentää lääkeaineen tehoa.
Vain P‑gp:n ja BCRP:n estäjät
Effluksikuljettajaproteiinien P-gp ja BCRP estäjät saattavat suurentaa rimegepantin pitoisuutta plasmassa. Jos VYDURA otetaan samanaikaisesti voimakkaan P-gp:n estäjän (kuten siklosporiinin, verapamiilin tai kinidiinin) kanssa, on odotettava vähintään 48 tuntia ennen seuraavan VYDURA-annoksen ottamista (ks. kohta Annostus ja antotapa). Rimegepantin anto samanaikaisesti siklosporiinin kanssa (voimakas P-gp:n ja BCRP:n estäjä) tai kinidiinin kanssa (selektiivinen P-gp:n estäjä) lisäsi rimegepanttialtistusta huomattavasti (AUC ja Cmax suurenivat yli 50 % mutta alle 2-kertaisesti).
Raskaus ja imetys
Raskaus
On vain vähän tietoja rimegepantin käytöstä raskaana oleville naisille. Eläinkokeissa rimegepantti ei ollut letaali alkioille, eikä teratogeenisuutta havaittu kliinisesti edustavilla altistuksilla. Alkioiden ja sikiöiden kehitykseen kohdistuvia haittavaikutuksia (sikiöiden painon alentumista ja luustomuutosten lisääntymistä rotilla) havaittiin ainoastaan emolle myrkyllisillä altistustasoilla (noin 200kertainen kliininen altistus), kun rimegepanttia annettiin tiineyden aikana (ks. kohta Prekliiniset tiedot turvallisuudesta). Varmuuden vuoksi VYDURA-valmisteen käyttöä on suositeltavaa välttää raskauden aikana.
Imetys
Yksikeskustutkimuksessa, jossa 12:lle imettävälle naiselle annettiin 75 mg:n kerta-annos rimegepanttia, rimegepanttia havaittiin minimaalisina pitoisuuksina rintamaidossa. Suhteellinen osuus äidin annoksesta, jonka arvioidaan kulkeutuvan imeväiseen, on alle 1 %. Ei ole olemassa tietoja rimegepantin vaikutuksesta maidontuotantoon. Rintaruokinnan hyödyt imeväisen kehitykselle ja terveydelle, äidin VYDURA-valmisteen kliininen tarve sekä rimegepantin tai äidin sairauden aiheuttamat mahdolliset rintaruokittavaan imeväiseen kohdistuvat haittavaikutukset on huomioitava kokonaisuudessaan.
Hedelmällisyys
Eläinkokeissa ei havaittu kliinisesti oleellisia vaikutuksia naaraiden ja urosten hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
VYDURA-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisin haittavaikutus migreenin akuutissa hoidossa (1,2 %) ja ennaltaehkäisyssä (1,4 %) oli pahoinvointi. Suurin osa haittavaikutuksista oli vaikeusasteeltaan lieviä tai kohtalaisia. Yliherkkyyttä, mukaan lukien hengenahdistusta ja vaikeaa ihottumaa, esiintyi alle 1 %:lla hoitoa saaneista potilaista.
Haittavaikutusten taulukkomuotoinen luettelo
Haittavaikutukset on lueteltu taulukossa 1 MedDRA-elinjärjestelmäluokittain ja seuraavan yleisyysluokituksen (CIOMS III) mukaisesti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000).
Taulukko 1 Luettelo haittavaikutuksista
| Elinjärjestelmäluokka | Haittavaikutus | Yleisyys |
| Akuutti hoito | ||
| Immuunijärjestelmä | Yliherkkyys, mukaan lukien hengenahdistus ja vaikea ihottuma | Melko harvinainen |
| Ruoansulatuselimistö | Pahoinvointi | Yleinen |
| Ennaltaehkäisy | ||
| Ruoansulatuselimistö | Pahoinvointi | Yleinen |
Pitkäaikainen turvallisuus
Rimegepantin pitkäaikaista turvallisuutta arvioitiin kahdessa 1 vuoden pituisessa, avoimessa jatkotutkimuksessa, joissa yhteensä 1 662 potilasta sai rimegepanttia vähintään 6 kuukauden ajan ja 740 potilasta 12 kuukauden ajan akuuttina tai ennaltaehkäisevänä hoitona.
Valikoitujen haittavaikutusten kuvaus
Yliherkkyysreaktiot
Yliherkkyyttä, mukaan lukien hengenahdistusta ja vaikeaa ihottumaa, esiintyi alle 1 %:lla potilaista, jotka saivat hoitoa kliinisissä tutkimuksissa. Yliherkkyysreaktiot voivat ilmaantua päivien kuluttua annoksen ottamisesta, ja viivästynyttä vakavaa yliherkkyyttä on esiintynyt.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Rimegepantin yliannostuksesta on vain vähän kliinistä kokemusta. Yliannostusoireita ei ole raportoitu. Rimegepantin yliannostusta on hoidettava tukemalla ja tarkkailemalla elintoimintoja ja seuraamalla potilaan kliinistä tilaa. Rimegepantin yliannostuksen hoitoon ei ole saatavilla erityistä vastalääkettä. Suuren seerumin proteiineihin sitoutumisensa vuoksi on epätodennäköistä, että rimegepantti poistuu merkittävissä määrin dialyysissa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Analgeetit, kalsitoniinigeeniin liittyvän peptidin (CGRP) antagonistit, ATC-koodi: N02CD06
Vaikutusmekanismi
Rimegepantti sitoutuu selektiivisesti suurella affiniteetilla ihmisen kalsitoniinigeeniin liittyvän peptidin (CGRP) reseptoriin ja estää sen toimintaa.
Suhdetta rimegepantin farmakodynamiikan ja sen kliinisen vaikutuksen taustalla olevien mekanismien välillä ei tunneta.
Kliininen teho: akuutti hoito
VYDURA-valmisteen tehoa aurallisen ja aurattoman migreenin akuutissa hoidossa arvioitiin kolmessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa (tutkimukset 1–3). Potilaita neuvottiin hoitamaan keskivaikeaa tai vaikeaa migreenipäänsärkyä. Apulääkityksen (NSAID-lääkkeiden, parasetamolin ja/tai pahoinvointilääkkeen) käyttö sallittiin 2 tuntia alkuperäisen hoidon jälkeen. Muun tyyppisiä apulääkkeitä, kuten triptaaneja, ei sallittu alkuperäisen hoidon jälkeisten 48 tunnin aikana. Noin 14 % potilaista käytti lähtötilanteessa migreeniä ennaltaehkäiseviä lääkevalmisteita. Kukaan tutkimuksen 1 potilaista ei käyttänyt samanaikaisesti ennaltaehkäiseviä CGRP-reittiin vaikuttavia lääkevalmisteita.
Ensisijaiset tehoanalyysit tehtiin potilailla, jotka hoitivat keskivaikeaa tai vaikeaa migreenipäänsärkyä. Kivuttomuus määriteltiin keskivaikean tai vaikean päänsäryn täydelliseksi helpottumiseksi, ja kaikkein häiritsevintä oiretta (MBS-oiretta) koskeva oireettomuus (MBS-oireettomuus) määriteltiin potilaan itse ilmoittaman MBS-oireen (valonarkuuden, ääniarkuuden tai pahoinvoinnin) puuttumiseksi. Yleisin MBS-oire niillä potilailla, jotka valitsivat MBS-oireen, oli valonarkuus (54 %), toiseksi yleisin pahoinvointi (28 %) ja kolmanneksi yleisin ääniarkuus (15 %).
Niiden potilaiden prosenttiosuus tutkimuksessa 1, jotka olivat saavuttaneet migreenikivuttomuuden ja MBS-oireettomuuden 2 tunnin jälkeen kerta-annoksen ottamisesta, oli tilastollisesti merkitsevästi suurempi VYDURA-valmistetta saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin (taulukko 2). Lisäksi VYDURA-valmisteella todettiin tilastollisesti merkitsevä vaikutus lumelääkkeeseen verrattuna myös seuraavien muiden tehopäätetapahtumien osalta: kivun lievittyminen 2 tunnin kohdalla, kivuttomuuden jatkuminen 2 tunnin jälkeen 48 tuntiin asti, apulääkityksen käyttö 24 tunnin sisällä ja normaali toimintakyky 2 tuntia annoksen ottamisen jälkeen. Yhden kohtauksen hoitoa koskevissa, kaksoissokkoutetuissa, lumekontrolloiduissa pivotaalitutkimuksissa 2 ja 3 migreenipotilaat saivat 75 mg:n kerta-annoksen rimegepanttia biologisesti samanarvoisena lääkemuotona.
Taulukko 2:Migreeniä koskevan tehon päätetapahtumat akuuttia hoitoa koskevissa tutkimuksissa
Tutkimus 1 | Tutkimus 2 | Tutkimus 3 | ||||
VYDURA 75 mg | Lumelääke | Rimegepantti 75 mg | Lumelääke | Rimegepantti 75 mg | Lumelääke | |
Kivuttomuus 2 tunnin kohdalla | ||||||
n/N* | 142/669 | 74/682 | 105/537 | 64/535 | 104/543 | 77/541 |
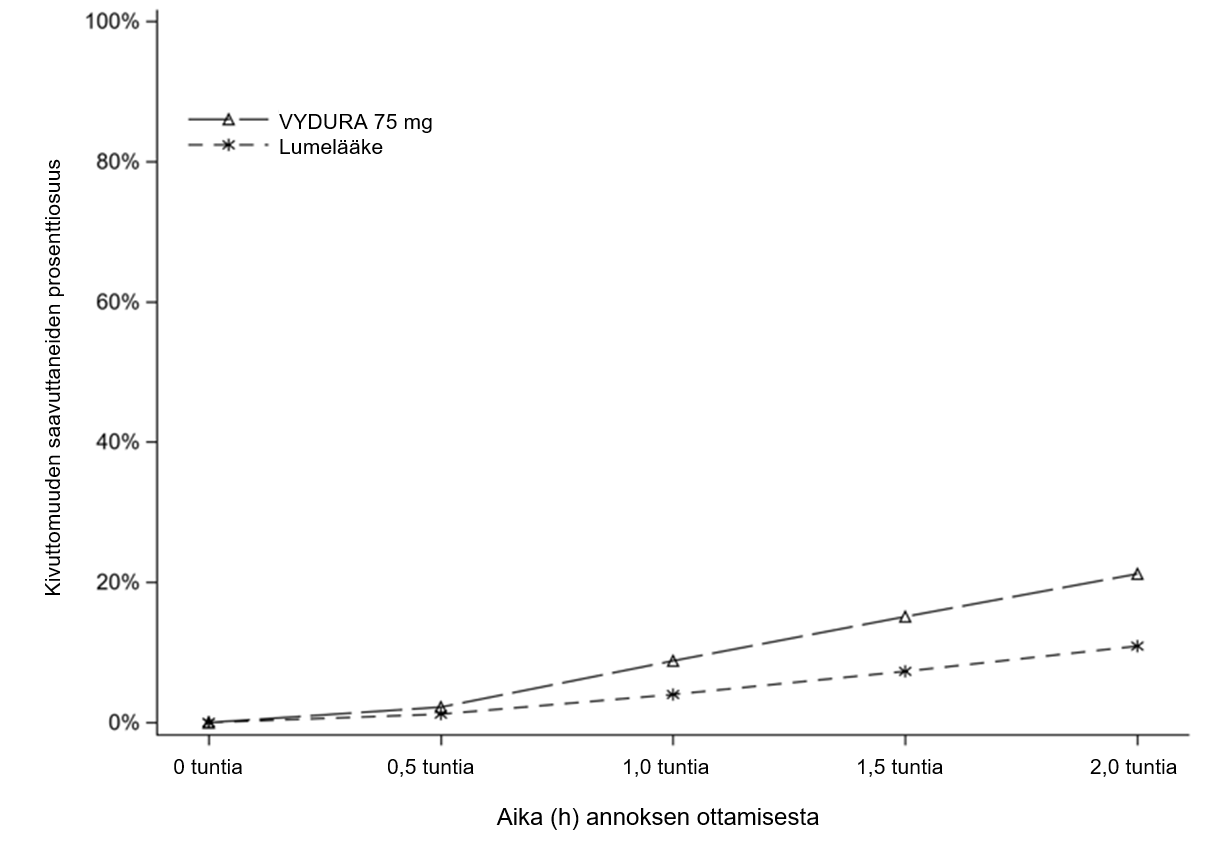
Vasteen saavuttaneiden osuus (%) | 21,2 | 10,9 | 19,6 | 12,0 | 19,2 | 14,2 |
Ero lumelääkkeeseen (%) | 10,3 | 7,6 | 4,9 | |||
p-arvo | < 0,0001 a | 0,0006a | 0,0298 a | |||
MBS-oireettomuus 2 tunnin kohdalla | ||||||
n/N* | 235/669 | 183/682 | 202/537 | 135/535 | 199/543 | 150/541 |
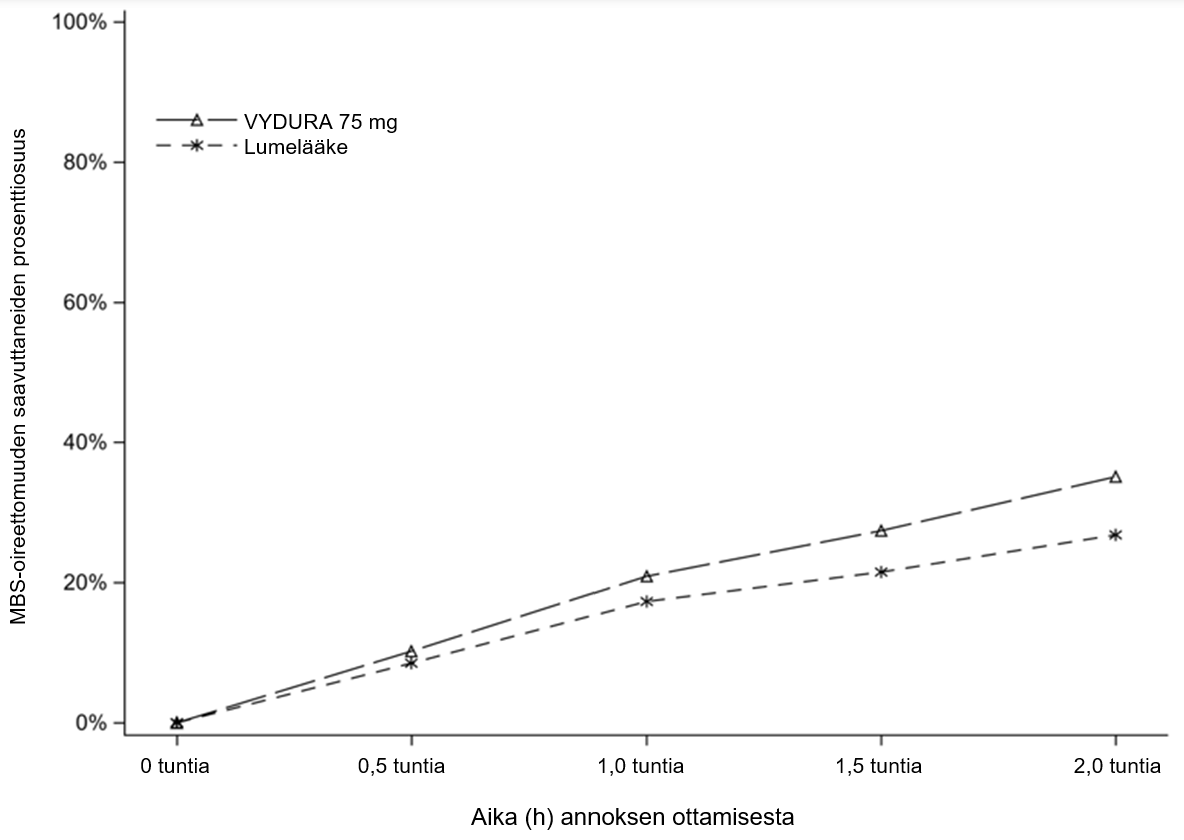
Vasteen saavuttaneiden osuus (%) | 35,1 | 26,8 | 37,6 | 25,2 | 36,6 | 27,7 |
Ero lumelääkkeeseen (%) | 8,3 | 12,4 | 8,9 | |||
p-arvo | 0,0009 a | < 0,0001 a | 0,0016 a | |||
Kivun lievittyminen 2 tunnin kohdalla | ||||||
n/N* | 397/669 | 295/682 | 312/537 | 229/535 | 304/543 | 247/541 |
Vasteen saavuttaneiden osuus (%) | 59,3 | 43,3 | 58,1 | 42,8 | 56,0 | 45,7 |
Ero lumelääkkeeseen (%) | 16,1 | 15,3 | 10,3 | |||
p-arvo | < 0,0001a | < 0,0001a | 0,0006a | |||
Kivuttomuuden jatkuminen 2 tunnin jälkeen 48 tuntiin asti | ||||||
n/N* | 90/669 | 37/682 | 53/537 | 32/535 | 63/543 | 39/541 |
Vasteen saavuttaneiden osuus (%) | 13,5 | 5,4 | 9,9 | 6,0 | 11,6 | 7,2 |
Ero lumelääkkeeseen (%) | 8,0 | 3,9 | 4,4 | |||
p-arvo | < 0,0001a | 0,0181b | 0,0130b | |||
*n/N = vasteen saavuttaneiden lukumäärä / potilaiden lukumäärä kyseisessä hoitoryhmässä
a Merkitsevä p-arvo hierarkkisessa testauksessa
b Nimellinen p‑arvo hierarkkisessa testauksessa
MBS = kaikkein häiritsevin oire
Kuvassa 1 on esitetty niiden potilaiden prosenttiosuudet, jotka saavuttivat migreenikivuttomuuden 2 tunnin kuluessa hoidosta tutkimuksessa 1.
Kuva 1:Kivuttomuuden 2 tunnin kuluessa saavuttaneiden potilaiden prosenttiosuudet tutkimuksessa 1
Kuvassa 2 on esitetty niiden potilaiden prosenttiosuudet, jotka saavuttivat MBS-oireettomuuden 2 tunnin kuluessa tutkimuksessa 1.
Kuva 2:MBS-oireettomuuden 2 tunnin kuluessa saavuttaneiden potilaiden prosenttiosuudet tutkimuksessa 1
Valonarkuuden ja ääniarkuuden ilmaantuvuus 2 tunnin kohdalla oli pienempi VYDURA 75 mg ‑valmisteen ottamisen jälkeen verrattuna lumelääkkeeseen kaikissa kolmessa tutkimuksessa.
Kliininen teho: ennaltaehkäisy
Rimegepantin tehoa migreenin ennaltaehkäisevässä hoidossa arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa (tutkimus 4).
Tutkimukseen 4 osallistui miehiä ja naisia, jotka olivat sairastaneet migreeniä (aurallista tai auratonta) vähintään 1 vuoden ajan. Seulontakäyntiä edeltävien 12 viikon aikana potilailla oli ollut 4–18 keskivaikeaa tai vaikeaa migreenikohtausta 4 viikon ajanjaksoa kohden. Satunnaistamista edeltävän 28 päivän pituisen havainnointijakson aikana potilaiden päänsärkypäivien keskilukumäärä oli 10,9 josta migreenipäiviä oli keskimäärin 10,2. Tutkimuksen potilaat satunnaistettiin saamaan rimegepanttia 75 mg:n annoksella (N = 373) tai lumelääkettä (N = 374) enintään 12 viikon ajan. Potilaita neuvottiin ottamaan satunnaistettua hoitoa yksi annos joka toinen päivä 12 viikon pituisen hoitojakson ajan. Potilaiden annettiin tarvittaessa käyttää muita lääkkeitä migreenin akuuttiin hoitoon (esim. triptaaneja, NSAID-lääkkeitä, parasetamolia ja pahoinvointilääkkeitä). Noin 22 % potilaista käytti lähtötilanteessa migreeniä ennaltaehkäiseviä lääkevalmisteita. Hoitojakson jälkeen potilaille annettiin mahdollisuus jatkaa avoimessa jatkotutkimuksessa 12 kuukauden ajan.
Tutkimuksen 4 ensisijainen tehon päätetapahtuma oli kuukausittaisten migreenipäivien keskilukumäärän muutos lähtötilanteesta kaksoissokkoutetun hoitojakson viikoilla 9–12. Toissijaisiin päätetapahtumiin kuului muun muassa kuukausittaisten keskivaikeiden tai vaikeiden migreenipäivien keskilukumäärän vähentyminen ≥ 50 %:lla lähtötilanteesta.
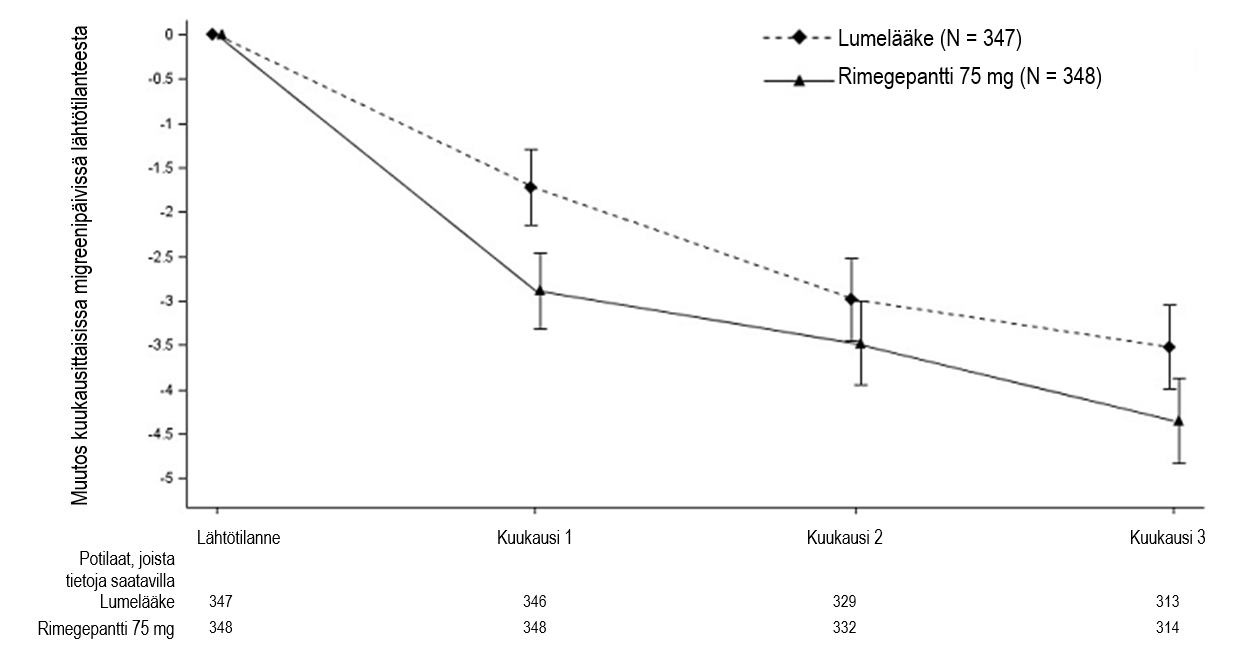
Joka toinen päivä otettujen 75 mg:n rimegepanttiannosten osoitettiin johtavan tilastollisesti merkitsevästi parempiin tuloksiin tärkeimmissä tehon päätetapahtumissa lumelääkkeeseen verrattuna, kuten taulukon 3 yhteenvedossa sekä kuvassa 3 on esitetty.
Taulukko 3:Tärkeimmät tehon päätetapahtumat tutkimuksessa 4
Rimegepantti75 mg joka toinen pv | Lumelääkejoka toinen pv | |
Kuukausittaiset migreenipäivät viikoilla 9 – 12 | N = 348 | N = 347 |
Muutos lähtötilanteesta | −4,3 | −3,5 |
Muutos lumelääkkeeseen verrattuna | −0,8 | |
p-arvo | 0,010a | |
Kuukausittaisten keskivaikeiden tai vaikeiden migreenipäivien vähentyminen ≥ 50 %:lla viikoilla 9 – 12 | N = 348 | N = 347 |
Vasteen saavuttaneiden osuus (%) | 49,1 | 41,5 |
Ero lumelääkkeeseen (%) | 7,6 | |
p-arvo | 0,044a | |
a Merkitsevä p‑arvo hierarkkisessa testauksessa | ||
Kuva 3:Kuukausittaisten migreenipäivien lukumäärän muutos lähtötilanteesta tutkimuksessa 4
Pitkäaikainen teho
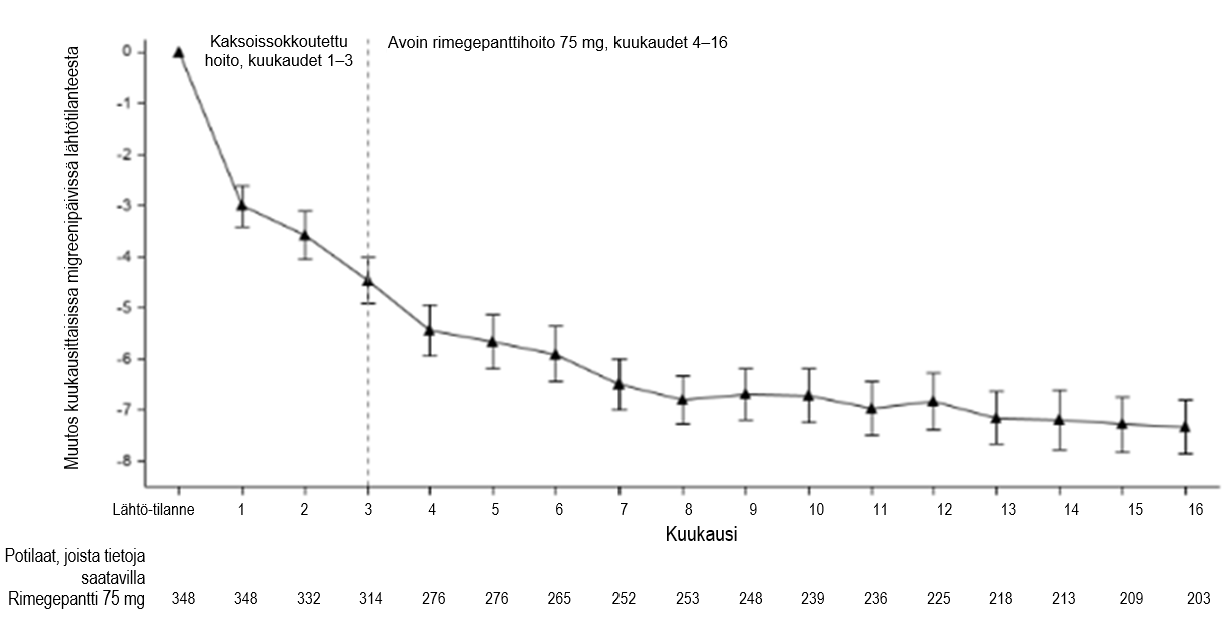
Tutkimukseen 4 osallistuneille potilaille annettiin mahdollisuus jatkaa avoimessa jatkotutkimuksessa 12 kuukauden ajan. Teho säilyi avoimessa jatkotutkimuksessa enintään 1 vuoden ajan. Jatkotutkimuksen potilaat ottivat 75 mg rimegepanttia joka toinen päivä sekä tarvittaessa välipäivinä (kuva 4). Rimegepanttihoitoon satunnaistetuista potilaista 203 oli mukana koko 16 kuukauden kokonaishoitojakson ajan. Näiden potilaiden kuukausittaiset migreenipäivät vähenivät 16 kuukauden hoitojakson aikana keskimäärin 6,2 päivällä lähtötilanteesta.
Kuva 4:Havainnointijakson jälkeinen muutos kuukausittaisten migreenipäivien keskilukumäärässä ajan mittaan kaksoissokkoutetun hoidon (kuukaudet 1 – 3) ja avoimen rimegepanttihoidon (kuukaudet 4 – 16) aikana
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset VYDURA-valmisteen käytöstä migreenin ennaltaehkäisevässä hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset VYDURA-valmisteen käytöstä migreenin akuutissa hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Suun kautta annettu rimegepantti saavuttaa suurimman pitoisuutensa 1,5 tunnissa. Suun kautta annetun 300 mg:n supraterapeuttisen rimegepanttiannoksen absoluuttinen hyötyosuus on noin 64 %.
Ruoan vaikutus
Kun rimegepanttia annettiin runsas- tai vähärasvaisen aterian kanssa, Tmax pidentyi 1–1,5 tunnilla. Runsasrasvainen ateria pienensi Cmax-arvoa 41 – 53 %:lla ja AUC-arvoa 32 – 38 %:lla. Vähärasvainen ateria pienensi Cmax-arvoa 36 %:lla ja AUC-arvoa 28 %:lla. Turvallisuuta ja tehoa arvioivissa kliinisissä tutkimuksissa rimegepanttia annettiin ilman ruokaan liittyvää ohjeistusta.
Jakautuminen
Rimegepantin vakaan tilan jakautumistilavuus on 120 litraa. Rimegepantin plasman proteiineihin sitoutuminen on noin 96‑prosenttista.
Biotransformaatio
Rimegepantti metaboloituu pääasiassa CYP3A4:n välityksellä ja vähäisemmässä määrin CYP2C9:n välityksellä. Rimegepantti on pääasiallinen muoto (noin 77 %), eikä merkittäviä metaboliitteja (> 10 %) havaittu plasmassa.
In vitro -tutkimusten perusteella rimegepantti ei ole CYP1A2:n, CYP2B6:n, 2C8, CYP2C9:n, CYP2C19:n, CYP2D6:n tai UGT1A1:n estäjä kliinisesti oleellisilla pitoisuuksilla. Rimegepantti on kuitenkin heikko CYP3A4:n estäjä, jonka estovaikutus on aikariippuvainen. Rimegepantti ei ole CYP1A2:n, CYP2B6:n tai CYP3A4:n estäjä kliinisesti oleellisilla pitoisuuksilla.
Eliminaatio
Rimegepantin eliminaation puoliintumisaika on noin 11 tuntia terveillä tutkittavilla. Terveille miestutkittaville annetun [14C]-rimegepantin kokonaisradioaktiivisuudesta 78 % poistui ulosteen mukana ja 24 % virtsan mukana. Muuttumaton rimegepantti on suurin yksittäinen komponentti ulosteessa (42 %) ja virtsassa (51 %).
Kuljettajaproteiinit
Rimegepantti on effluksikuljettajaproteiinien P‑gp ja BCRP substraatti in vitro. P‑gp- ja BCRP-effluksikuljettajaproteiinien estäjät saattavat suurentaa rimegepantin pitoisuutta plasmassa (ks. kohta Yhteisvaikutukset).
Rimegepantti ei ole OATP1B1:n tai OATP1B3:n substraatti. Hitaan munuaispuhdistumansa vuoksi rimegepanttia ei arvioitu OAT1:n, OAT3:n, OCT2:n, MATE1:n tai MATE2‑K:n substraattina.
Rimegepantti ei ole P‑gp:n, BCRP:n, OAT1:n tai MATE2‑K:n estäjä kliinisesti oleellisilla pitoisuuksilla. Se on heikko OATP1B1:n ja OAT3:n estäjä.
Rimegepantti on OATP1B3:n, OCT2:n ja MATE1:n estäjä. Rimegepantin anto samanaikaisesti MATE1-kuljettajaproteiinin substraatti metformiinin kanssa ei kliinisesti merkittävällä tavalla muuttanut metformiinin farmakokinetiikkaa tai glukoosin hyödyntämistä. Rimegepantin ja OATP1B3:n tai OCT2:n välisiä yhteisvaikutuksia ei odoteta syntyvän kliinisesti oleellisilla pitoisuuksilla.
Lineaarisuus/ei-lineaarisuus
Suun kautta annettujen kerta-annosten jälkeinen rimegepanttialtistus lisääntyy enemmän kuin suhteessa annokseen, mikä vaikuttaa liittyvän annosriippuvaiseen hyötyosuuden suurenemiseen.
Ikä, sukupuoli, paino, rotu, etninen tausta
Rimegepantin farmakokinetiikassa ei havaittu kliinisesti merkittäviä eroja iän, sukupuolen, rodun / etnisen taustan, painon, migreenityypin tai CYP2C9-genotyypin perusteella.
Munuaisten vajaatoiminta
Erillisessä kliinisessä tutkimuksessa, jossa rimegepantin farmakokinetiikkaa verrattiin lievää (arvioitu kreatiniinipuhdistuma 60 – 89 ml/min), keskivaikeaa (kreatiniinipuhdistuma 30 – 59 ml/min) ja vaikeaa (kreatiniinipuhdistuma 15 – 29 ml/min) munuaisten vajaatoimintaa sairastavien ja munuaistoiminnaltaan normaalien tutkittavien (terveistä tutkittavista koostuvan yhdistetyn verrokkiryhmän) välillä, rimegepantin kokonaisaltistuksen havaittiin lisääntyvän alle 50 %:lla 75 mg:n kerta-annoksen jälkeen. Vapaan rimegepantin AUC oli 2,57 kertaa suurempi vaikeaa munuaisten vajaatoimintaa sairastavilla tutkittavilla. VYDURA-valmistetta ei ole tutkittu potilailla, joilla on loppuvaiheen munuaissairaus (kreatiniinipuhdistuma < 15 ml/min).
Maksan vajaatoiminta
Erillisessä kliinisessä tutkimuksessa, jossa rimegepantin farmakokinetiikkaa verrattiin lievää, keskivaikeaa ja vaikeaa maksan vajaatoimintaa sairastavien ja maksan toiminnaltaan normaalien tutkittavien (terveiden kaltaistettujen verrokkien) välillä, rimegepanttialtistus (vapaan lääkeaineen AUC) 75 mg:n kerta-annoksen jälkeen oli 3,89 kertaa suurempi vaikeaa maksan vajaatoimintaa sairastavilla potilailla (Child-Pugh-luokka C). Rimegepanttialtistus lievää ja keskivaikeaa maksan vajaatoimintaa sairastavilla tutkittavilla (Child-Pugh-luokat A ja B) ei eronnut kliinisesti merkittävällä tavalla tutkittavista, joiden maksan toiminta oli normaali.
Prekliiniset tiedot turvallisuudesta
Rimegepantin farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, valotoksisuutta, lisääntymis- ja kehitystoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Suuriin rimegepanttiannoksiin liittyviä haittavaikutuksia toistuvaa altistusta koskevissa tutkimuksissa olivat maksan rasvoittuminen hiirillä ja rotilla, intravaskulaarinen hemolyysi rotilla ja apinoilla ja oksentelu apinoilla. Näitä haittavaikutuksia on todettu vain silloin, kun on käytetty altistusta, joka ylittää suurimman ihmisille käytettävän annostuksen niin huomattavasti, että asialla on kliinisen käytön kannalta vain vähäinen merkitys (maksan rasvoittumisen tapauksessa ≥ 12‑kertaista [hiiret] ja ≥ 49‑kertaista [rotat], intravaskulaarisen hemolyysin tapauksessa ≥ 95‑kertaista [rotat] ja ≥ 9‑kertaista [apinat] ja oksentelun tapauksessa ≥ 37‑kertaista [apinat]).
Vaikutusta hedelmällisyyteen arvioivassa tutkimuksessa rotilla rimegepanttiin liittyviä haittavaikutuksia (hedelmällisyyden heikentymistä ja ennen implantaatiota kuolleiden alkioiden määrän lisääntymistä) havaittiin ainoastaan suurella, 150 mg/kg/vrk:n annoksella, joka oli myrkyllinen emolle ja jonka aikaansaama altistus vastasi ≥ 95‑kertaista suurinta ihmisille käytettävää annostusta. Rimegepantin anto suun kautta organogeneesin aikana aiheutti sikiövaikutuksia rotilla, mutta ei kaniineilla. Rotilla havaittiin sikiöiden painon alentumista ja sikiömuutosten yleistymistä ainoastaan suurimmalla, 300 mg/kg/vrk:n annoksella, joka oli myrkyllinen emolle ja jonka aikaansaama altistus vastasi noin 200‑kertaista suurinta ihmisille käytettävää annostusta. Lisäksi rimegepantti ei vaikuttanut pre- ja postnataaliseen kehitykseen rotilla enintään 60 mg/kg/vrk:n annoksilla (≥ 24‑kertainen suurin ihmisille käytettävä annostus), eikä kasvuun, kehitykseen tai lisääntymiskykyyn nuorilla rotilla enintään 45 mg/kg/vrk:n annoksilla (≥ 14‑kertainen suurin ihmisille käytettävä annostus).
Farmaseuttiset tiedot
Apuaineet
liivate
mannitoli (E421)
minttuaromi
sukraloosi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta
Säilytys
Säilytä alle 30 °C.
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VYDURA tabletti, kylmäkuivattu
75 mg (L:ei) 2 x 1 fol (56,80 €), 8 x 1 fol (207,04 €), 16 x 1 fol (398,04 €)
PF-selosteen tieto
Polyvinyylikloridista (PVC), orientoidusta polyamidista (OPA) ja alumiinifoliosta valmistetut yksittäispakatut läpipainopakkaukset, jotka on suljettu pois repäistävällä alumiinifoliolla.
Pakkauskoot:
2 x 1 yksittäispakattua kylmäkuivattua tablettia.
8 x 1 yksittäispakattua kylmäkuivattua tablettia.
16 x 1 yksittäispakattua kylmäkuivattua tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kylmäkuivattu tabletti on valkoinen tai luonnonvalkoinen, pyöreä, 14 mm halkaisijaltaan, ja siihen on kaiverrettu symboli

Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia hävittämisen suhteen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
VYDURA tabletti, kylmäkuivattu
75 mg 2 x 1 fol, 8 x 1 fol, 16 x 1 fol
- Rajoitettu peruskorvaus reseptimerkinnällä (40 %). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Akuutti migreeni, triptaanit eivät sovellu (E023).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Atogepantti, eptinetsumabi, erenumabi, fremanetsumabi, galkanetsumabi ja rimegepantti (migreenin estohoito): Aikuisten migreenin estohoito erityisin edellytyksin (3007).
ATC-koodi
N02CD06
Valmisteyhteenvedon muuttamispäivämäärä
11.04.2025
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
