VYDURA frystorkad tablett 75 mg
Observera
▼Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning. Se avsnitt Biverkningar om hur man rapporterar biverkningar.
Kvalitativ och kvantitativ sammansättning
Varje frystorkad tablett innehåller rimegepantsulfat motsvarande 75 mg rimegepant.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Frystorkad tablett
Kliniska uppgifter
Terapeutiska indikationer
VYDURA är avsett för
- akut behandling av migrän hos vuxna, med eller utan aura
- profylaktisk behandling av episodisk migrän hos vuxna som har minst 4 migränanfall per månad.
Dosering och administreringssätt
Dosering
Akutbehandling av migrän
Rekommenderad dos är 75 mg rimegepant vid behov, en gång dagligen.
Migränprofylax
Rekommenderad dos är 75 mg rimegepant varannan dag.
Högsta dos per dag är 75 mg rimegepant.
VYDURA kan tas med eller utan mat.
Samtidiga läkemedel
Ytterligare en dos av rimegepant inom 48 timmar ska undvikas när läkemedlet ges samtidigt med måttliga CYP3A4-hämmare eller med starka P-gp-hämmare (se avsnitt Interaktioner).
Särskilda populationer
Äldre (från 65 års ålder)
Det finns begränsad erfarenhet av rimegepant hos patienter som är 65 år eller äldre. Ingen dosjustering behövs eftersom rimegepants farmakokinetik inte påverkas av ålder (se avsnitt Farmakokinetiska egenskaper).
Nedsatt njurfunktion
Ingen dosjustering behövs för patienter med lätt, måttlig eller grav njurfunktionsnedsättning. Grav njurfunktionsnedsättning ledde till en mer än fördubbling av AUC för obundet läkemedel men mindre än 50 % ökning av total AUC (se avsnitt Farmakokinetiska egenskaper). Försiktighet ska iakttas vid frekvent användning hos patienter med gravt nedsatt njurfunktion. Rimegepant har inte studerats hos patienter med terminal njursvikt eller hos patienter som står på dialys. Behandling med rimegepant ska undvikas till patienter med terminal njursvikt (CrCl< 15 ml/min).
Nedsatt leverfunktion
Ingen dosjustering behövs för patienter med lätt (Child-Pugh A) eller måttligt (Child-Pugh B) nedsatt leverfunktion. Plasmakoncentrationerna (AUC för obundet läkemedel) av rimegepant var signifikant högre hos försökspersoner med gravt (Child-Pugh C) nedsatt leverfunktion (se avsnitt Farmakokinetiska egenskaper). Behandling med rimegepant ska undvikas hos patienter med gravt nedsatt leverfunktion.
Pediatrisk population
Säkerhet och effekt för VYDURA hos barn (< 18 års ålder) har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
VYDURA är avsett för oral användning.
Den frystorkade tabletten ska placeras på eller under tungan. Den löses upp i munnen och kan tas utan vätska.
Patienterna ska instrueras att ha torra händer när de öppnar blisterkartan samt att läsa bipacksedeln för fullständiga anvisningar.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Överkänslighetsreaktioner, inklusive dyspné och hudutslag, har förekommit hos mindre än 1 % av patienterna som behandlades med rimegepant i kliniska studier (se avsnitt Biverkningar). Överkänslighetsreaktioner, inklusive allvarlig överkänslighet, kan uppkomma flera dagar efter administreringen. Om patienten får en överkänslighetsreaktion ska rimegepant sättas ut och lämplig behandling sättas in.
VYDURA rekommenderas inte
- till patienter med gravt nedsatt leverfunktion (se avsnitt Dosering och administreringssätt)
- till patienter med terminal njursvikt (CrCl < 15 ml/min) (se avsnitt Dosering och administreringssätt)
- samtidigt med starka CYP3A4-hämmare (se avsnitt Interaktioner)
- samtidigt med starka eller måttliga CYP3A4-inducerare (se avsnitt Interaktioner).
Läkemedelsutlöst huvudvärk
Överanvändning av någon typ av läkemedel mot huvudvärk kan förvärra tillståndet. Om detta konstateras eller misstänks ska patienten söka medicinsk rådgivning och behandlingen avslutas. Läkemedelsutlöst huvudvärk ska misstänkas hos patienter med frekvent eller daglig huvudvärk trots (eller på grund av) regelbunden användning av läkemedel mot akut huvudvärk.
Interaktioner
Rimegepant är substrat för CYP3A4 och för effluxtransportörerna P-glykoprotein (P‑gp) och bröstcancerresistensprotein (BCRP) (se avsnitt Farmakokinetiska egenskaper).
CYP3A4-hämmare
CYP3A4-hämmare ökar plasmakoncentrationerna av rimegepant. Samtidig administrering av rimegepant och starka CYP3A4-hämmare (t.ex. klaritromycin, itrakonazol, ritonavir) rekommenderas inte (se avsnitt Varningar och försiktighet). Samtidig administrering av rimegepant och itrakonazol resulterade i en signifikant ökning av rimegepantexponeringen (4-faldig ökning av AUC och 1,5-faldig ökning av Cmax).
Samtidig administrering av rimegepant och läkemedel som är måttliga CYP3A4-hämmare (t.ex. diltiazem, erytromycin, flukonazol) kan öka exponeringen för rimegepant. Samtidig administrering av rimegepant och flukonazol resulterade i ökad exponering för rimegepant (1,8-faldig ökning av AUC) utan någon relevant effekt på Cmax. Ytterligare en dos av rimegepant inom 48 timmar ska undvikas när läkemedlet ges samtidigt med måttliga CYP3A4-hämmare (t.ex. flukonazol (se avsnitt Dosering och administreringssätt).
CYP3A4-inducerare
CYP3A4-inducerare minskar plasmakoncentrationerna av rimegepant. Samtidig administrering av VYDURA och starka CYP3A4-inducerare (t.ex. fenobarbital, rifampicin, johannesört [Hypericum perforatum]) eller måttliga CYP3A4-inducerare (t.ex. bosentan, efavirenz, modafinil) rekommenderas inte (se avsnitt Varningar och försiktighet). Effekten av CYP3A4-induktion kan vara i upp till 2 veckor efter utsättning av den starka eller måttliga CYP3A4-induceraren. Samtidig administrering av rimegepant och rifampicin resulterade i en signifikant minskning (AUC minskade med 80 % och Cmax med 64 %) av exponeringen för rimegepant, vilket kan leda till sämre effekt.
Hämmare av enbart P-gp och BCRP
Hämmare av effluxtransportörerna P‑gp och BCRP kan öka plasmakoncentrationerna av rimegepant. Ytterligare en dos av VYDURA inom 48 timmar ska undvikas när läkemedlet ges samtidigt med starka hämmare av P‑gp (t.ex. ciklosporin, verapamil, kinidin) (se avsnitt Dosering och administreringssätt). Samtidig administrering av rimegepant och ciklosporin (en potent P‑gp- och BCRP-hämmare) eller kinidin (en selektiv P‑gp-hämmare) resulterade i en signifikant ökning av rimegepantexponeringen av samma storleksordning (AUC och Cmax ökade med mer än 50 % men mindre än en fördubbling).
Fertilitet, graviditet och amning
Graviditet
Det finns begränsad mängd data från användningen av rimegepant i gravida kvinnor. Djurstudier visar att rimegepant inte är embryocidalt och ingen teratogen potential har observerats vid kliniskt relevanta exponeringar. Negativa effekter på den embryofetala utvecklingen (minskad fostervikt och fler skelettavvikelser hos råttor) sågs endast vid exponeringar som var associerade med toxicitet hos moderdjuret (cirka 200 gånger högre än den kliniska exponeringen) efter administrering av rimegepant under dräktigheten (se avsnitt Prekliniska säkerhetsuppgifter). Som en försiktighetsåtgärd bör man undvika användning av VYDURA under graviditet. Comment by Pfizer/EO: Update to Day +25 translation
Amning
I en singelcenterstudie med 12 ammande kvinnor som behandlades med en engångsdos på 75 mg rimegepant sågs minimala koncentrationer av rimegepant i bröstmjölken. Den relativa procentandelen av moderns dos som når spädbarnet uppskattas till mindre än 1 %. Det finns inga data om effekterna på mjölkproduktionen. Den utvecklings- och hälsomässiga nyttan av amning ska beaktas, med samtidig hänsyn tagen till moderns kliniska behov av VYDURA och eventuella biverkningar hos det ammade spädbarnet av rimegepant eller av moderns underliggande sjukdom.
Fertilitet
Djurstudier visade ingen kliniskt relevant effekt på hon- och handjurens fertilitet (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
VYDURA har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Den vanligaste biverkningen var illamående vid akutbehandling (1,2 %) och vid migränprofylax (1,4 %). De flesta reaktionerna var lindriga eller måttliga. Överkänslighet, inklusive dyspné och allvarligt hudutslag, förekom hos mindre än 1 % av de behandlade patienterna.
Biverkningstabell
Biverkningar redovisas i tabell 1 indelade enligt MedDRA:s organsystem. Frekvenskategorin för respektive läkemedelsbiverkning bygger på följande princip (CIOMS III): mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000) och mycket sällsynta (< 1/10 000).
Tabell 1 Förteckning över biverkningar
| Organsystem | Biverkning | Frekvens |
| Akutbehandling | ||
| Immunsystemet | Överkänslighet, inklusive dyspné och allvarligt hudutslag | Mindre vanliga |
| Magtarmkanalen | Illamående | Vanliga |
| Profylax | ||
| Magtarmkanalen | Illamående | Vanliga |
Långtidssäkerhet
Långtidssäkerheten för rimegepant har utvärderats i två 1-åriga öppna förlängningsstudier då 1 662 patienter fick rimegepant i minst 6 månader och 740 patienter fick rimegepant i 12 månader som akut eller profylaktisk behandling.
Beskrivning av valda biverkningar
Överkänslighetsreaktioner
Överkänslighet, inklusive dyspné och allvarligt hudutslag, förekom hos mindre än 1 % av patienterna som behandlades i de kliniska studierna. Överkänslighetsreaktioner kan uppkomma flera dagar efter administreringen och fördröjda allvarliga överkänslighetsreaktioner har förekommit.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Den kliniska erfarenheten av överdosering av rimegepant är begränsad. Inga överdoseringssymtom har rapporterats. Behandling av en överdos av rimegepant ska bestå av allmänna stödjande åtgärder inklusive övervakning av vitala tecken och observation av patientens kliniska status. Det finns ingen specifik antidot för behandling av en överdos rimegepant. På grund av den höga bindningsgraden till serumproteiner kan dialys sannolikt inte eliminera rimegepant i någon större omfattning.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: analgetika, kalcitoningenrelaterad peptid (CGRP)-antagonister, ATC-kod: N02CD06. Comment by Pfizer/EO: Update to Day +25 translation (space)
Verkningsmekanism
Rimegepant binds selektivt och med hög affinitet till receptorn för human kalcitoningenrelaterad peptid (CGRP) och motverkar CGRP-receptorns funktion.
Sambandet mellan den farmakodynamiska aktiviteten och den/de mekanism/er med vilken/vilka rimegepant utövar sina kliniska effekter är okänt.
Klinisk effekt: akutbehandling
Effekten av VYDURA som akutbehandling av migrän med eller utan aura hos vuxna har studerats i tre randomiserade, dubbelblinda placebokontrollerade studier (studie 1‑3). Patienterna instruerades att behandla migrän med måttlig till svår smärta. Anfallskuperande läkemedel (som NSAID, paracetamol och/eller antiemetikum) var tillåtna 2 timmar efter den första behandlingen. Andra former av anfallskuperande läkemedel, t.ex. triptaner, var inte tillåtna förrän 48 timmar efter den första behandlingen. Cirka 14 % av patienterna tog förebyggande läkemedel mot migrän vid baslinjen. Ingen av patienterna i studie 1 stod samtidigt på förebyggande läkemedel som verkar på signalvägen för kalcitoningenrelaterad peptid.
De primära effektanalyserna utfördes på patienter som behandlade migrän med måttlig till svår smärta. Smärtfrihet definierades som en minskning av måttlig eller svår huvudvärk till ingen huvudvärk, och frihet från de svåraste symtomen (mest besvärande symtom, MBS) definierades som frånvaro av MBS enligt patientens egen bedömning (såsom fotofobi, fonofobi eller illamående). Bland patienterna som valde ett MBS var det vanligaste symtomet fotofobi (54 %), följt av illamående (28 %) och fonofobi (15 %).
I studie 1 var andelen patienter som uppnådde smärtfrihet och frihet från MBS när det gått 2 timmar efter en engångsdos statistiskt signifikant högre bland de patienter som fick VYDURA än bland dem som fick placebo (tabell 2). Dessutom sågs statistiskt signifikanta effekter av VYDURA jämfört med placebo för de övriga effektmåtten: smärtlindring 2 timmar efter behandlingen, kvarstående smärtfrihet från 2 till 48 timmar efter behandlingen, användning av anfallskuperande läkemedel inom 24 timmar, samt normal funktionsförmåga 2 timmar efter behandling. Smärtlindring definierades som minskad migränsmärta från måttlig eller svår till lindrig eller ingen. De pivotala, dubbelblinda, placebokontrollerade studierna 2 och 3 av ett enstaka migränanfall utfördes på patienter med migrän som fick en bioekvivalent oral läkemedelsberedning med 75 mg rimegepant.
Tabell 2: Effektmått avseende migrän i studie av akutbehandling
Studie 1 | Studie 2 | Studie 3 | ||||
VYDURA 75 mg | Placebo | Rimegepant 75 mg | Placebo | Rimegepant 75 mg | Placebo | |
Smärtfri 2 timmar efter behandling | ||||||
n/N* | 142/669 | 74/682 | 105/537 | 64/535 | 104/543 | 77/541 |
% responders | 21,2 | 10,9 | 19,6 | 12,0 | 19,2 | 14,2 |
Skillnad jämfört med placebo (%) | 10,3 | 7,6 | 4,9 | |||
p-värde | < 0,0001a | 0,0006a | 0,0298 a | |||
Fri från MBS 2 timmar efter behandling | ||||||
n/N* | 235/669 | 183/682 | 202/537 | 135/535 | 199/543 | 150/541 |
% responders | 35,1 | 26,8 | 37,6 | 25,2 | 36,6 | 27,7 |
Skillnad jämfört med placebo (%) | 8,3 | 12,4 | 8,9 | |||
p-värde | 0,0009a | < 0,0001 a | 0,0016 a | |||
Smärtlindring 2 timmar efter behandling | ||||||
n/N* | 397/669 | 295/682 | 312/537 | 229/535 | 304/543 | 247/541 |
% responders | 59,3 | 43,3 | 58,1 | 42,8 | 56,0 | 45,7 |
Skillnad jämfört med placebo | 16,1 | 15,3 | 10,3 | |||
p-värde | < 0,0001a | < 0,0001a | 0,0006a | |||
Kvarstående smärtfrihet från 2 till 48 timmar | ||||||
n/N* | 90/669 | 37/682 | 53/537 | 32/535 | 63/543 | 39/541 |
% responders | 13,5 | 5,4 | 9,9 | 6,0 | 11,6 | 7,2 |
Skillnad jämfört med placebo (%) | 8,0 | 3,9 | 4,4 | |||
p-värde | < 0,0001a | 0,0181b | 0,0130b | |||
*n = antal responders/N=antal patienter i behandlingsgruppen
aSignifikant p-värde vid hierarkisk testning
bNominellt p-värde vid hierarkisk testning
MBS: mest besvärande symtom
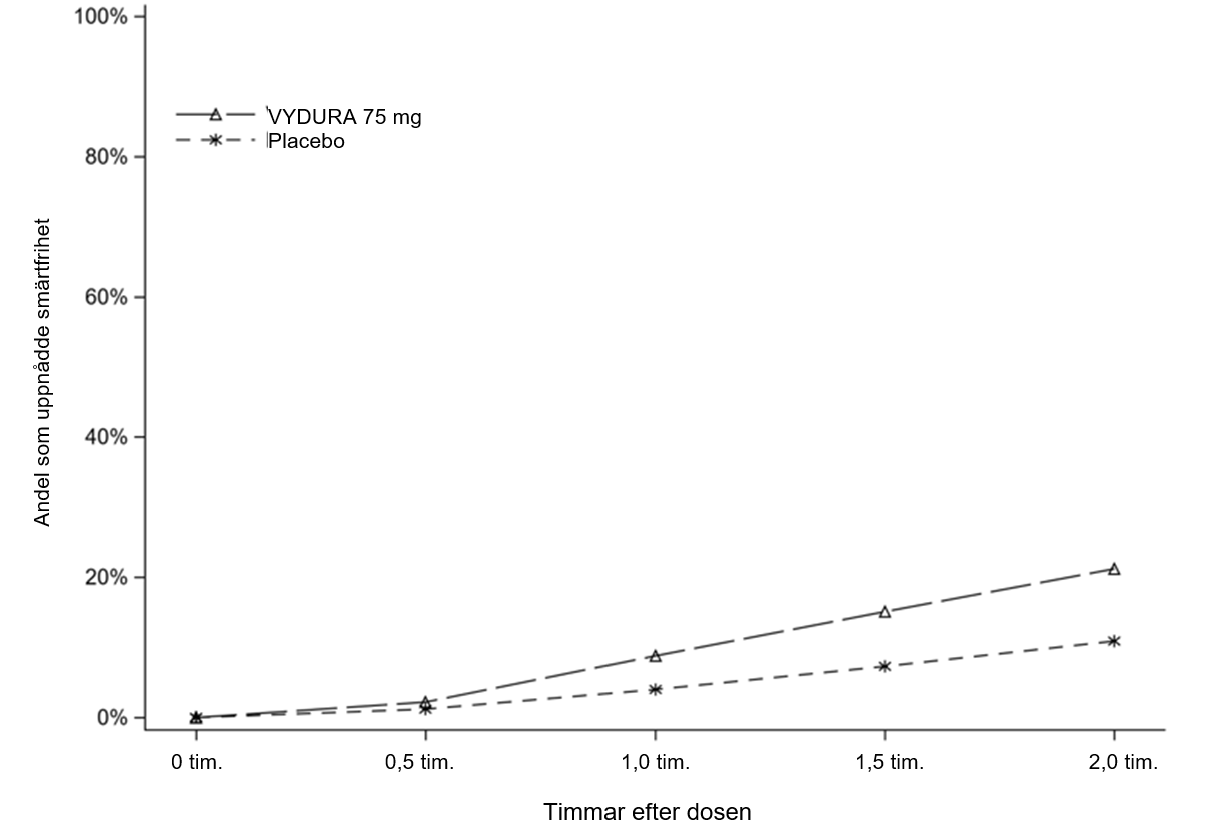
Figur 1 visar andelen patienter i studie 1 som var fria från migränsmärta inom 2 timmar efter behandlingen.
Figur 1: Andel patienter i studie 1 som uppnådde smärtfrihet inom 2 timmar
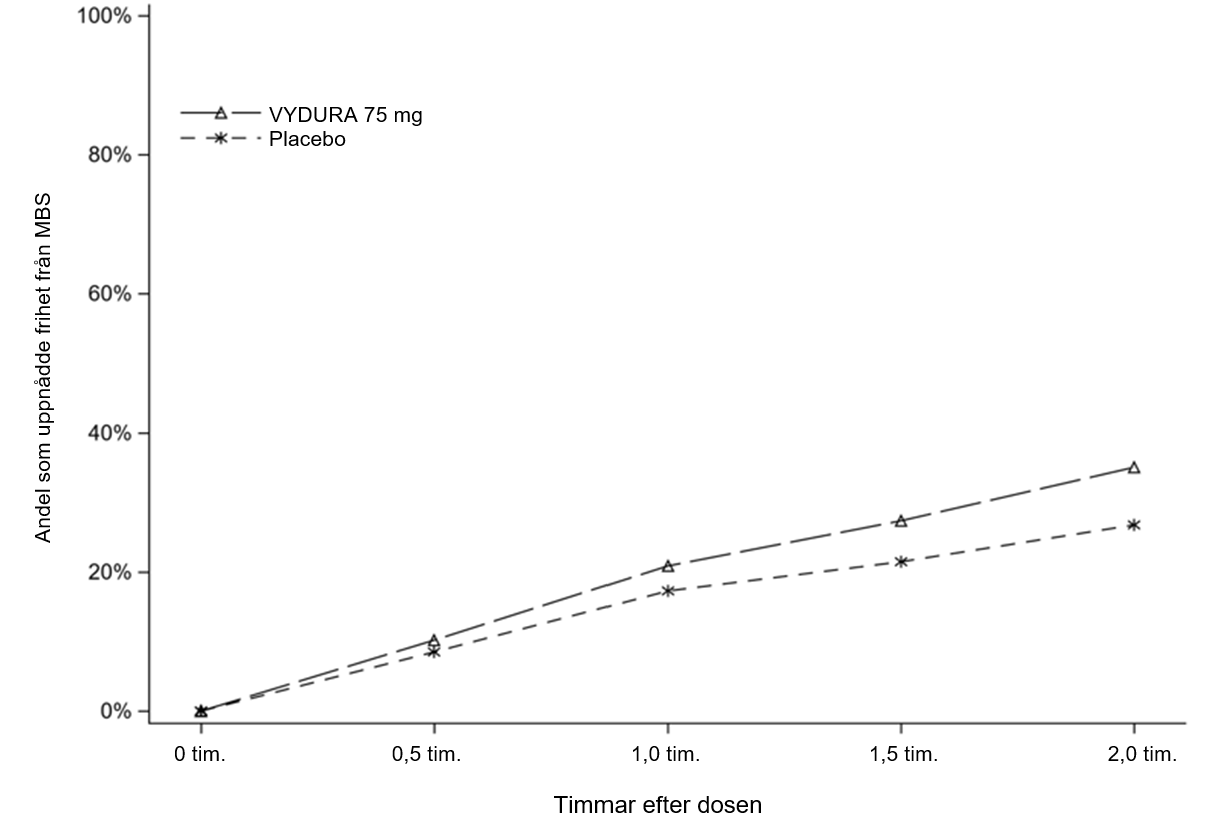
Figur 2 visar andelen patienter i studie 1 som var fria från MBS inom 2 timmar efter behandlingen.
Figur 2: Andel patienter i studie 1 som uppnådde frihet från MBS inom 2 timmar
Incidensen av fotofobi och fonofobi var lägre 2 timmar efter administrering av VYDURA 75 mg jämfört med placebo i alla tre studierna.
Klinisk effekt: profylax
Effekten av rimegepant som profylaktisk migränbehandling utvärderades i en randomiserad, dubbelblind placebokontrollerad studie (studie 4).
I studie 4 deltog vuxna män och kvinnor med minst 1 års anamnes på migrän (med eller utan aura). Patienterna hade haft 4 till 18 migränanfall med måttlig till svår smärta per 4-veckorsperiod under de 12 veckorna närmast före screeningbesöket. Patienterna hade i genomsnitt 10,9 huvudvärksdagar under den 28 dagar långa observationsperioden, varav i genomsnitt 10,2 var migrändagar, före randomiseringen till studien. I studien randomiserades patienterna till rimegepant 75 mg (N = 373) eller placebo (N = 374) i upp till 12 veckor. Patienterna instruerades att ta sin randomiserade behandling en gång varannan dag under 12-veckorsperioden. Annan akut behandling av migrän fick användas vid behov (t.ex. triptaner, NSAID, paracetamol, antiemetika). Cirka 22 % av patienterna tog förebyggande läkemedel mot migrän vid baslinjen. Patienterna kunde fortsätta i en öppen förlängningsstudie i ytterligare 12 månader.
Primärt effektmått i studie 4 var förändring från baslinjen av genomsnittligt antal migrändagar per månad (MMD) från vecka 9 t.o.m. 12 i den dubbelblinda behandlingsfasen. Sekundärt effektmått var uppnådd minskning från baslinjen på ≥ 50 % av antalet dagar per månad med måttlig eller svår migrän.
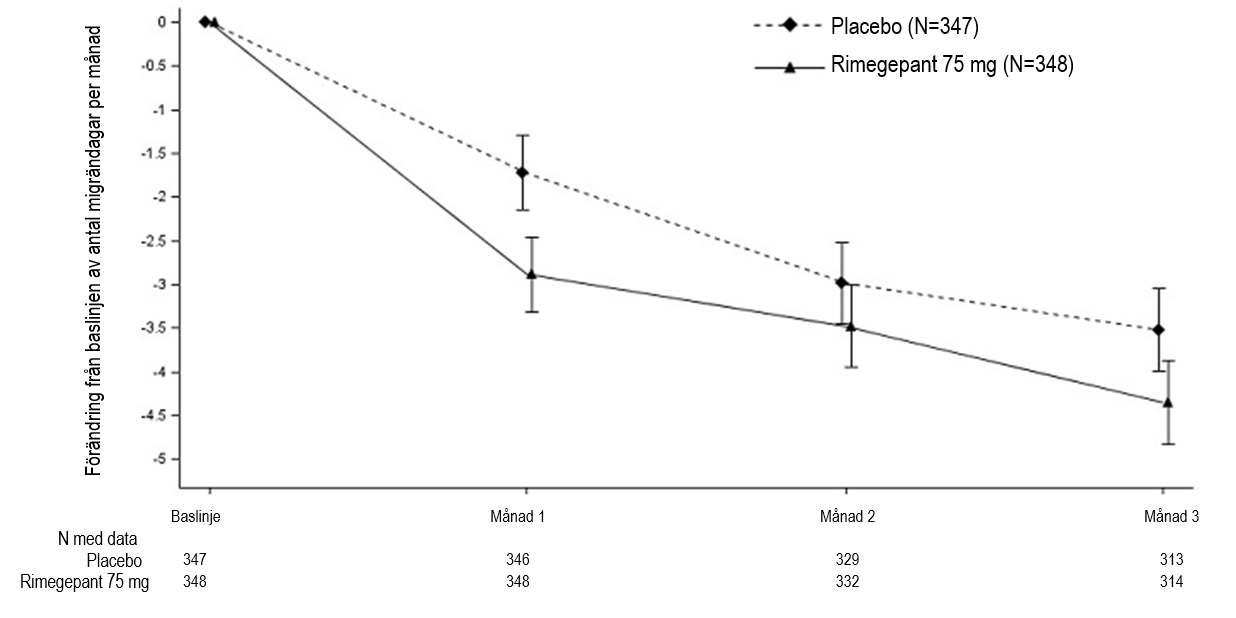
Rimegepant 75 mg taget en gång varannan dag gav en statistiskt signifikant förbättring av huvudeffektmåtten jämfört med placebo, se sammanfattning i tabell 3 och diagram i figur 3.
Tabell 3: Huvudeffektmått i studie 4
Rimegepant 75 mg 1 gång varannan dag | Placebo 1 gång varannan dag | |
Migrändagar per månad (MMD) vecka 9 t.o.m. 12 | N = 348 | N = 347 |
Förändring från baslinjen | –4,3 | –3,5 |
Förändring jämfört med placebo | –0,8 | |
p-värde | 0,010a | |
≥ 50 % minskning av måttliga eller svåra MMD vecka 9 t.o.m. 12 | N = 348 | N = 347 |
% responders | 49,1 | 41,5 |
Skillnad jämfört med placebo | 7,6 | |
p-värde | 0,044a | |
a Signifikant p-värde vid hierarkisk testning | ||
Figur 3: Förändring från baslinjen av antal migrändagar per månad i studie 4
Långtidseffekt
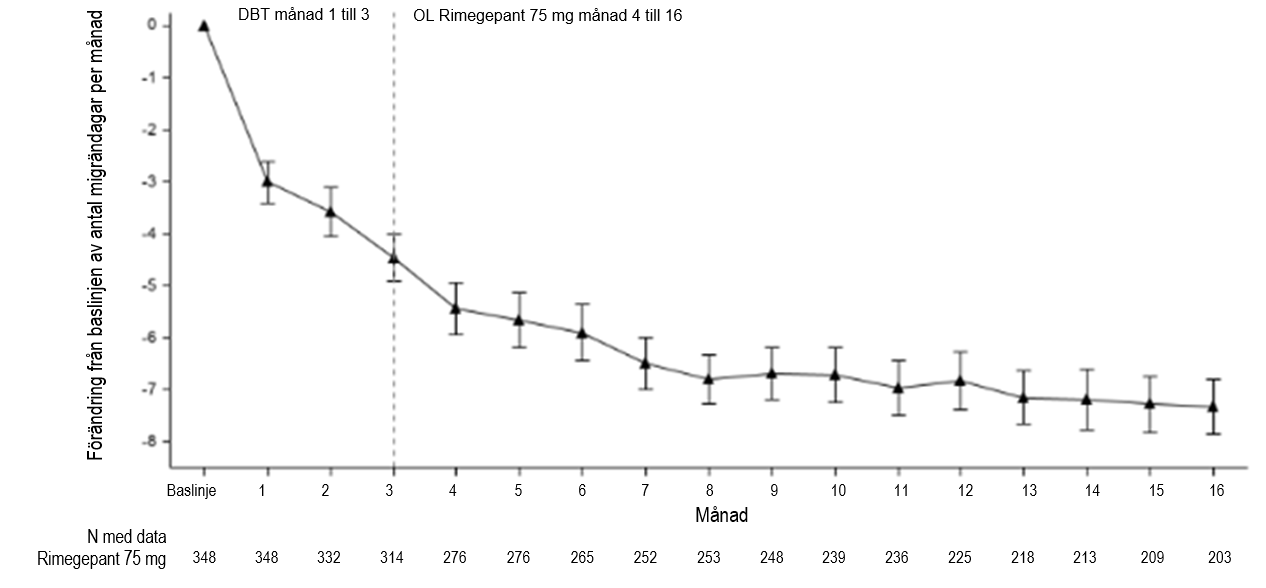
Patienterna i studie 4 kunde fortsätta i en öppen förlängningsstudie i ytterligare 12 månader. Effekten kvarstod i upp till 1 år i en öppen förlängningsstudie där patienter fick rimegepant 75 mg varannan dag plus vid behov på dagar utanför schemat (figur 4). 203 patienter som tilldelats rimegepant fullföljde hela den 16 månader långa behandlingen. Hos dessa patienter var den totala genomsnittliga minskningen av MMD från baslinjen under 16-månadersperioden 6,2 dagar.
Figur 4: Longitudinella data över förändringen av genomsnittligt antal MMD från observationsperioden och under den dubbelblinda behandlingsfasen (månad 1 till 3) samt under den öppna fasen med rimegepant (månad 4 till 16).
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för VYDURA för alla grupper av den pediatriska populationen för profylaktisk behandling av migränhuvudvärk (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Europeiska läkemedelsmyndigheten har senarelagt kravet att skicka in studieresultat för VYDURA för en eller flera grupper av den pediatriska populationen för akutbehandling av migrän (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Farmakokinetiska egenskaper
Absorption
Efter peroral administrering absorberas rimegepant och uppnår maximal koncentration efter 1,5 timmar. Efter en supraterapeutisk dos på 300 mg är absolut oral biotillgänglighet för rimegepant cirka 64 %.
Effekt av föda
Efter administrering av rimegepant samtidigt med intag av en fettrik eller fettsnål måltid fördröjdes Tmax med 1‑1,5 timmar. En fettrik måltid minskade Cmax med 41‑53 % och AUC med 32‑38 %. En fettsnål måltid minskade Cmax med 36 % och AUC med 28 % I de kliniska säkerhets- och effektstudierna gavs rimegepant utan hänsyn till födointag.
Distribution
Distributionsvolym vid steady state är 120 l. Plasmaproteinbindningsgraden för rimegepant är cirka 96 %.
Metabolism
Rimegepant metaboliseras främst via CYP3A4 och i mindre utsträckning via CYP2C9. Rimegepant är den primära formen (~77 %) och utan att några viktigare metaboliter (dvs. > 10 %) detekteras i plasma.
Baserat på in vitro-studier hämmar rimegepant inte CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6 eller UGT1A1 vid kliniskt relevanta koncentrationer. Rimegepant är dock en svag hämmare av CYP3A4 med en tidsberoende hämning. Rimegepant inducerar inte CYP1A2, CYP2B6 eller CYP3A4 vid kliniskt relevanta koncentrationer.
Eliminering
Halveringstiden i elimineringsfasen för rimegepant är cirka 11 timmar hos friska forskningspersoner. Efter peroral administrering av [14C]-rimegepant till friska manliga forskningspersoner återfanns 78 % av den totala radioaktiviteten i feces och 24 % i urinen. Oförändrat rimegepant är den enskilt viktigaste komponenten i feces (42 %) och urin (51 %).
Transportproteiner
In vitro är rimegepant substrat för effluxtransportörerna P‑gp och BCRP. Hämmare av P‑gp- och BCRP-effluxtransportörerna kan öka plasmakoncentrationerna av rimegepant (se avsnitt Interaktioner).
Rimegepant är inte substrat för OATP1B1 eller OATP1B3. Med tanke på dess låga njurclearance har rimegepant inte utvärderats som substrat för OAT1, OAT3, OCT2, MATE1 eller MATE2-K.
Rimegepant hämmar inte P-gp, BCRP, OAT1 eller MATE2-K vid kliniskt relevanta koncentrationer. Det är en svag hämmare av OATP1B1 och OAT3.
Rimegepant hämmar OATP1B3, OCT2 och MATE1. Samtidig administrering av rimegepant och metformin, ett substrat till MATE1-transportören, resulterade inte i någon kliniskt signifikant påverkan på varken metformins farmakokinetik eller på glukosanvändningen. Inga kliniska läkemedelsinteraktioner förväntas mellan rimegepant och OATP1B3 eller OCT2 vid kliniskt relevanta koncentrationer.
Linjäritet/icke-linjäritet
Rimegepant uppvisar en mer än dosproportionell ökning av exponeringen efter en oral engångsadministrering, vilket verkar ha samband med en dosberoende ökning av biotillgängligheten.
Ålder, kön, vikt, etnisk tillhörighet
Inga kliniskt signifikanta skillnader i rimegepants farmakokinetik baserat på ålder, kön, etnisk tillhörighet/etnicitet, kroppsvikt, migränstatus eller CYP2C9-genotyp observerades.
Nedsatt njurfunktion
I en dedikerad klinisk studie där man jämförde rimegepants farmakokinetik hos forskningspersoner med lätt (beräknad kreatininclearance [CrCl] 60‑89 ml/min), måttlig (CrCl 30‑59 ml/min) och kraftig (CrCl 15‑29 ml/min) njurfunktionsnedsättning med farmakokinetiken hos friska forskningspersoner (poolad kontrollgrupp), sågs en ökning av total rimegepantexponering på mindre än 50 % efter en engångsdos om 75 mg. AUC för obundet rimegepant var 2,57 gånger högre hos forskningspersoner med kraftigt nedsatt njurfunktion. VYDURA har inte studerats hos patienter med kronisk njursvikt (CrCl < 15 ml/min).
Nedsatt leverfunktion
I en dedikerad klinisk studie där man jämförde rimegepants farmakokinetik hos forskningspersoner med lätt, måttlig och kraftig leverfunktionsnedsättning med friska forskningspersoner (poolad kontrollgrupp), var rimegepantexponeringen (AUC för obundet läkemedel) efter en engångsdos om 75 mg 3,89 gånger högre hos forskningspersoner med kraftig nedsättning (Child-Pugh klass C). Hos forskningspersoner med lätt (Child-Pugh klass A) och måttlig (Child-Pugh klass B) leverfunktionsnedsättning sågs inga kliniskt betydelsefulla skillnader jämfört med hos forskningspersoner med normal leverfunktion.
Prekliniska säkerhetsuppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet, fototoxicitet, reproduktionseffekter och effekter på utveckling, eller karcinogen potential, visade inte några särskilda risker för människa
I studier av allmäntoxicitet var effekter relaterade till rimegepant i högre doser hepatisk lipidos hos mus och råtta, intravaskulär hemolys hos råtta och apa, samt emesis hos apa. Dessa fynd sågs endast vid exponeringar som bedömdes ligga tillräckligt långt över maximal exponering hos människa och vara av liten relevans för klinisk användning (≥ 12 gånger [mus] och ≥ 49 gånger [råtta] för hepatisk lipidos, ≥ 95 gånger [råtta] och ≥ 9 gånger [apa] för intravaskulär hemolys, samt ≥ 37 gånger för emesis [apa]).
I en fertilitetsstudie på råtta observerades rimegepantrelaterade effekter endast vid den höga dosen 150 mg/kg/dag (minskad fertilitet och ökade preimplantationsförluster), som ledde till toxicitet hos moderdjuret och systemiska exponeringar på ≥ 95 gånger den högsta exponeringen hos människa. Peroral administrering av rimegepant under organogenesen resulterade i fosterpåverkan hos råtta men inte hos kanin. Hos råtta sågs minskad fostervikt och fler avvikelser hos fostren endast vid den högsta dosen på 300 mg/kg/dag, som ledde till toxicitet hos moderdjuret vid exponeringar som var cirka ≥ 200 gånger den högsta exponeringen hos människa. Rimegepant hade inte heller några effekter på pre- och postnatal utveckling hos råtta i doser upp till 60 mg/kg/dag (≥ 24 gånger den högsta exponeringen hos människa) eller på tillväxt, utveckling och reproduktionsförmåga hos juvenila råttor vid doser upp till 45 mg/kg/dag (≥ 14 gånger den högsta exponeringen hos människa).
Farmaceutiska uppgifter
Förteckning över hjälpämnen
gelatin
mannitol (E421)
mintsmakämne
sukralos
Inkompatibiliteter
Ej relevant.
Hållbarhet
4 år
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C.
Förvaras i originalförpackningen. Fuktkänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
VYDURA tabletti, kylmäkuivattu
75 mg (L:ei) 2 x 1 fol (56,80 €), 8 x 1 fol (207,04 €), 16 x 1 fol (398,04 €)
PF-selosteen tieto
Endosblister av polyvinylklorid (PVC), orienterad polyamid (OPA) och aluminiumfolie, förseglade med avdragbart aluminiumfolie.
Förpackningsstorlekar:
Endos 2 x 1 frystorkade tabletter.
Endos 8 x 1 frystorkade tabletter.
Endos 16 x 1 frystorkade tabletter.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Den frystorkade tabletten är vit till benvit, rund med diameter 14 mm, präglad med symbolen
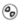
.
Särskilda anvisningar för destruktion och övrig hantering
Inga särskilda anvisningar för destruktion.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
VYDURA tabletti, kylmäkuivattu
75 mg 2 x 1 fol, 8 x 1 fol, 16 x 1 fol
- Rajoitettu peruskorvaus reseptimerkinnällä (40 %). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Akuutti migreeni, triptaanit eivät sovellu (E023).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Atogepantti, eptinetsumabi, erenumabi, fremanetsumabi, galkanetsumabi ja rimegepantti (migreenin estohoito): Aikuisten migreenin estohoito erityisin edellytyksin (3007).
Atc-kod
N02CD06
Datum för översyn av produktresumén
11.04.2025
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
