VUMERITY enterokapseli, kova 231 mg
Vaikuttavat aineet ja niiden määrät
Yksi kova enterokapseli sisältää 231 mg diroksimeelifumaraattia (diroximel fumarate).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kova enterokapseli
Kliiniset tiedot
Käyttöaiheet
Vumerity on tarkoitettu aikuispotilaiden aaltomaisen MS-taudin (relapsoiva-remittoiva multippeliskleroosi) hoitoon (ks. kohdasta Farmakodynamiikka tärkeitä tietoja populaatioista, joilla teho on osoitettu).
Ehto
Hoito tulee aloittaa MS-taudin hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoito tulee aloittaa MS-taudin hoitoon perehtyneen lääkärin valvonnassa.
Annostus
Aloitusannos on 231 mg kaksi kertaa vuorokaudessa. Annos suurennetaan seitsemän päivän hoidon jälkeen suositeltuun ylläpitoannokseen 462 mg kaksi kertaa vuorokaudessa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annoksen pienentäminen väliaikaisesti 231 mg:aan kaksi kertaa vuorokaudessa voi vähentää haittavaikutuksina esiintyvien punastumisen ja maha-suolikanavan oireiden esiintyvyyttä. Suositeltua annosta 462 mg kaksi kertaa vuorokaudessa tulisi jatkaa kuukauden kuluessa.
Jos potilas unohtaa ottaa annoksen, hänen ei pidä ottaa kaksinkertaista annosta. Potilas saa ottaa unohtuneen annoksen vain, jos annosten väliin jää neljä tuntia aikaa. Muussa tapauksessa potilaan tulee odottaa ja ottaa seuraava annos aikataulun mukaisesti.
Erityispotilasryhmät
Iäkkäät potilaat
Diroksimeelifumaraatin turvallisuusprofiili on kontrolloimattomista tutkimuksista saatujen tietojen perusteella ≥ 55-vuotiailla potilailla samankaltainen kuin < 55-vuotiailla potilailla. Diroksimeelifumaraattia sai kliinisissä tutkimuksissa vain pieni joukko 65‑vuotiaita tai sitä vanhempia potilaita eikä niissä ollut mukana riittävästi 65-vuotiaita tai sitä vanhempia potilaita, jotta olisi voitu selvittää, reagoivatko he valmisteeseen eri tavoin kuin nuoremmat potilaat (ks. kohta Farmakokinetiikka). Vaikuttavan aineen vaikutusmekanismin perusteella annoksen muuttamiseen iäkkäillä ei ole teoreettisia perusteita.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on munuaisten vajaatoimintaa (ks. kohta Farmakokinetiikka). Diroksimeelifumaraatin pitkäaikaista turvallisuutta ei ole tutkittu keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on maksan vajaatoimintaa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Diroksimeelifumaraattia ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla.
Pediatriset potilaat
Vumerity-valmisteen turvallisuutta ja tehoa 10 vuoden – alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole vielä varmistettu.
Ei ole asianmukaista käyttää Vumerity‑valmistetta alle 10 vuoden ikäisille lapsille aaltomaisen MS-taudin hoitoon.
Antotapa
Suun kautta.
Vumerity-kapselit tulee niellä kokonaisina ja ehjinä. Kapseleita ei pidä murskata tai pureskella, eikä kapselin sisältöä saa sirotella ruokaan, koska kapselin enteropäällyste estää suoliston ärsytystä.
Vumerity voidaan ottaa ruoan kanssa tai ilman ruokaa (ks. kohta Farmakokinetiikka). Ruoan kanssa ottaminen saattaa parantaa siedettävyyttä, jos potilaalla esiintyy punastumista tai maha-suolikanavan haittavaikutuksia (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille tai muille fumaarihapon estereille (ks. kohta Yhteisvaikutukset).
Epäilty tai vahvistettu progressiivinen multifokaalinen leukoenkefalopatia (PML).
Varoitukset ja käyttöön liittyvät varotoimet
Diroksimeelifumaraatti ja dimetyylifumaraatti metaboloituvat suun kautta otettuna monometyylifumaraatiksi (ks. kohta Farmakokinetiikka). Diroksimeelifumaraattiin liittyvät riskit ovat oletettavasti samankaltaisia kuin dimetyylifumaraatilla on raportoitu, vaikka kaikkia jäljempänä lueteltuja riskejä ei ole havaittu spesifisesti diroksimeelifumaraatin käytössä.
Verikokeet/laboratoriotutkimukset
Dimetyylifumaraattihoitoa kliinisissä tutkimuksissa saaneiden potilaiden munuaiskokeiden tuloksissa on havaittu muutoksia (ks. kohta Haittavaikutukset). Näiden muutosten kliinistä merkitystä ei tiedetä. Munuaisten (esim. kreatiniini, veren ureatyppi ja virtsatutkimus) toiminnan tutkimista suositellaan ennen Vumerity-hoidon aloittamista, 3 ja 6 kuukauden hoidon jälkeen, ja sen jälkeen 6–12 kuukauden välein sekä kliinisen tarpeen mukaan.
Dimetyylifumaraattihoidosta saattaa aiheutua maksavaurio, mukaan lukien maksaentsyymin pitoisuuden nousu (≥ 3 × normaalin yläraja (ULN)) ja kokonaisbilirubiinitasojen nousu (≥ 2 × ULN). Maksavaurio saattaa ilmetä välittömästi, viikkojen tai pidemmän ajan kuluttua. Haittavaikutusten on havaittu hävinneen, kun hoito on lopetettu. Seerumin aminotransferaasien (esim. alaniiniaminotransferaasi (ALAT), aspartaattiaminotransferaasi (ASAT)) ja kokonaisbilirubiinitasojen määrittämistä suositellaan ennen hoidon aloittamista ja hoidon aikana kliinisen tarpeen mukaan.
Diroksimeelifumaraattia saaneille potilaille voi kehittyä lymfopenia (ks. kohta Haittavaikutukset). Ennen hoidon aloittamista on määritettävä senhetkinen täydellinen verenkuva, lymfosyytit mukaan lukien. Jos lymfosyyttimäärä on normaalialueen rajan alapuolella, mahdolliset syyt on arvioitava huolellisesti ennen hoidon aloittamista. Vumerity-valmistetta ei ole tutkittu potilailla, joiden lymfosyyttimäärä on ennestään pieni, joten tämän potilasryhmän hoidossa on noudatettava varovaisuutta. Hoitoa ei pidä aloittaa potilaille, jolla on vaikea lymfopenia (lymfosyyttimäärä < 0,5 × 109/l).
Hoidon aloittamisen jälkeen täydellinen verenkuva, lymfosyytit mukaan lukien, on määritettävä 3 kuukauden välein.
Lymfopeenisten potilaiden tehostettua valvontaa suositellaan progressiivisen multifokaalisen leukoenkefalopatian (PML) lisääntyneen riskin vuoksi seuraavalla tavalla:
- Jos potilaalla on pitkittynyt vaikea lymfopenia (lymfosyyttimäärä on < 0,5 × 109/l) yli 6 kuukauden ajan, hoito pitää keskeyttää.
- Jos potilaan absoluuttisen lymfosyyttimäärän kohtalainen väheneminen ≥ 0,5 × 109/l – < 0,8 × 109/l pitkittyy yli kuuden kuukauden ajan, hoidon hyöty-riskisuhde on arvioitava uudelleen.
- Jos potilaan lymfosyyttimäärä on paikallisen laboratorion viitealueen mukaisten normaaliarvojen alarajan (LLN) alle, absoluuttisen lymfosyyttimäärän säännöllistä tarkkailua suositellaan. Lisätekijät, jotka saattavat entisestään lisätä yksilöllistä PML:n riskiä, on otettava huomioon (ks. PML-alakohta alla).
Lymfosyyttimääriä on seurattava kunnes ne ovat palautuneet (ks. kohta Farmakodynamiikka). Lymfosyyttimäärien palauduttua ja muiden hoitovaihtoehtojen puuttuessa on hoidon keskeyttämisen jälkeen käytettävä kliinistä harkintaa päätettäessä siitä, aloitetaanko Vumerity-hoito uudelleen vai ei.
Magneettikuvaus (MRI)
Ennen hoidon aloittamista lähtötilanteen magneettikuva (yleensä 3 kuukauden sisällä otettu) pitää olla käytettävissä vertailukuvana. Magneettikuvauksen uusimisen tarvetta on arvioitava kansallisten ja paikallisten hoitosuositusten mukaan. Magneettikuvausta voidaan pitää osana tehostettua valvontaa hoidettaessa potilaita, joilla on suurentunut PML-riski. Jos PML:ää epäillään, magneettikuvaus on tehtävä välittömästi osana diagnostiikkaa.
Progressiivinen multifokaalinen leukoenkefalopatia (PML)
Dimetyylifumaraatilla hoidetuilla potilailla on raportoitu PML:ää (ks. kohta Haittavaikutukset). PML on John-Cunningham-viruksen (JCV) aiheuttama opportunistinen infektio, joka voi johtaa kuolemaan tai vaikeaan toimintakyvyn heikkenemiseen.
PML-tapauksia on ilmennyt dimetyylifumaraatin ja muiden fumaraatteja sisältävien lääkevalmisteiden käytön yhteydessä, potilaan lymfopenian yhteydessä (lymfosyyttimäärä alle normaaliarvojen alarajan). Pitkittynyt kohtalainen tai vaikea lymfopenia näyttää lisäävän PML:n riskiä dimetyylifumaraattihoidon yhteydessä, mutta riskiä ei kuitenkaan voi poissulkea lievää lymfopeniaa sairastavilla potilailla.
Lisätekijöitä, jotka saattavat vaikuttaa lisääntyneeseen PML:n riskiin lymfopenian yhteydessä, ovat seuraavat:
- Vumerity-hoidon kesto. PML-tapaukset ovat ilmenneet noin 1–5 vuotta kestäneen dimetyylifumaraattihoidon jälkeen, vaikka tarkka suhde hoidon kestoon on tuntematon.
- voimakas immuunipuolustuksen kannalta tärkeiden CD4+- ja erityisesti CD8+-T-solumäärien väheneminen (ks. kohta Haittavaikutukset) ja
- aiempi immunosuppressiivinen tai immunomoduloiva hoito (ks. alla).
Lääkäreiden pitää tutkia potilaansa selvittääkseen, ovatko oireet merkki neurologisesta toimintahäiriöstä, ja jos ovat, ovatko ne MS-taudille tyypillisiä vai viittaavatko ne mahdollisesti PML:ään.
PML:ään viittaavan ensilöydöksen tai ‑oireen ilmaantuessa on lopetettava Vumerity-hoito ja tehtävä asianmukaiset diagnostiset tutkimukset, mukaan lukien JCV:n DNA-määritys aivo-selkäydinnesteestä kvantitatiivisella polymeraasiketjureaktiomenetelmällä (PCR). PML:n oireet voivat olla samankaltaisia MS-taudin pahenemisvaiheen oireiden kanssa. Tyypilliset PML:ään liittyvät oireet ovat moninaisia, ne etenevät vuorokausien tai viikkojen ajan, ja niihin kuuluu progressiivinen kehon toispuoleinen heikkous tai raajojen kömpelyys, näköhäiriöt sekä ajattelukyvyn, muistin ja orientaation muutokset, jotka johtavat sekavuuteen ja persoonallisuuden muutoksiin. Lääkärien pitää kiinnittää erityistä huomiota PML:ään viittaaviin oireisiin, joita potilas ei välttämättä huomaa. Potilasta on myös neuvottava kertomaan hoidosta kumppanilleen tai häntä hoitaville henkilöille, sillä he saattavat huomata oireita, joita potilas ei huomaa.
PML voi ilmetä ainoastaan, jos potilaalla on JCV-infektio. On otettava huomioon, että lymfopenian vaikutusta seerumista tehtävän JCV-vasta-ainemäärityksen tarkkuuteen ei ole tutkittu dimetyylifumaraattihoitoa tai Vumerity-hoitoa saaneilla potilailla. Myös se on huomioitava, että JCV-vasta-ainemäärityksen negatiivinen tulos (lymfosyyttimäärän ollessa normaali) ei sulje pois myöhemmän JCV-infektion mahdollisuutta.
Jos potilaalle kehittyy PML, Vumerity-hoito on lopetettava pysyvästi.
Hoitoa edeltävät immunosuppressio- tai immunomodulaatiohoidot
Diroksimeelifumaraatin tehoa ja turvallisuutta ei ole tutkittu silloin, kun potilaat ovat siirtyneet toisista taudin etenemiseen vaikuttavista hoidoista. On mahdollista, että aiempi immunosuppressiohoito vaikuttaa PML:n kehittymiseen.
PML-tapauksia on esiintynyt potilailla, joita on aiemmin hoidettu natalitsumabilla, jonka käytössä PML on varmistettu riski. Lääkäreiden on huomattava, että natalitsumabihoidon äskettäisen lopettamisen jälkeen ilmenneisiin PML-tapauksiin ei välttämättä liity lymfopeniaa.
Lisäksi suurin osa dimetyylifumaraatin käytön yhteydessä varmistetuista PML-tapauksista oli potilailla, jotka olivat aiemmin saaneet immunomoduloivaa hoitoa.
Kun potilas siirtyy toisesta taudin etenemiseen vaikuttavasta hoidosta Vumerity-valmisteen käyttöön, toisen hoidon puoliintumisaika ja vaikutusmekanismi on otettava huomioon, jotta vältetään additiivinen immuunivaikutus samalla kun pienennetään MS-taudin uudelleen aktivoitumisen riskiä. Täydellisen verenkuvan määrittämistä suositellaan ennen hoidon aloittamista ja säännöllisesti hoidon aikana (ks. edellä oleva kohta Verikokeet/laboratoriotutkimukset).
Vaikea munuaisten vajaatoiminta
Diroksimeelifumaraatin pitkäaikaista turvallisuutta ei ole tutkittu keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoidossa. Sen vuoksi näiden potilaiden hoitoa on syytä harkita tarkoin (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Vaikea maksan vajaatoiminta
Diroksimeelifumaraattia ei ole tutkittu vaikeaa maksan vajaatoimintaa sairastavien potilaiden hoidossa. Sen vuoksi näiden potilaiden hoitoa on syytä harkita tarkoin (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Vaikea aktiivinen ruoansulatuselimistön sairaus
Diroksimeelifumaraattia ei ole tutkittu vaikea-asteista aktiivista ruoansulatuselimistön sairautta sairastavien potilaiden hoidossa. Sen vuoksi näiden potilaiden hoitoa on syytä harkita tarkoin.
Punastuminen
Dimetyylifumaraattia koskevissa kliinisissä avaintutkimuksissa kolmella yhteensä 2 560:sta dimetyylifumaraattihoitoa saaneesta potilaasta esiintyi vakavia punastumisoireita, jotka olivat todennäköisesti yliherkkyys- tai anafylaktoidisia reaktioita. Nämä haittavaikutukset eivät olleet hengenvaarallisia, mutta ne johtivat sairaalahoitoon. Lääkkeen määrääjien ja potilaiden on oltava tarkkana tämän riskin suhteen vakavien punastumisoireiden esiintyessä Vumerity-valmisteen käytössä (ks. kohdat Annostus ja antotapa, Yhteisvaikutukset ja Haittavaikutukset).
Terveillä vapaaehtoisilla tehtyjen tutkimusten perusteella dimetyylifumaraatin käyttöön liittyvä punastuminen on todennäköisesti prostaglandiinivälitteistä. Lyhyestä hoitojaksosta enteropäällysteettömällä 75 mg:n asetyylisalisyylihappoannoksella saattaa olla hyötyä potilaille, jotka kokevat punastumisen sietämättömäksi (ks. kohta Yhteisvaikutukset). Punastumisen esiintyvyys ja voimakkuus vähenivät annostelujakson aikana kahdessa terveillä vapaaehtoisilla tehdyssä tutkimuksessa.
Anafylaktiset reaktiot
Dimetyylifumaraatin annon jälkeisiä anafylaksia-/anafylaktoidisia reaktiotapauksia on raportoitu markkinoille tulon jälkeen. Oireita voivat olla hengenahdistus, hypoksia, hypotensio, angioedeema, ihottuma tai urtikaria. Dimetyylifumaraatin aiheuttaman anafylaksian mekanismia ei tunneta. Nämä reaktiot ilmenevät yleensä ensimmäisen annoksen jälkeen, mutta niitä saattaa esiintyä myös milloin tahansa hoidon aikana, ja ne saattavat olla vakavia ja henkeä uhkaavia. Potilaita on neuvottava lopettamaan Vumerity-valmisteen ottaminen ja hakeutumaan välittömästi lääkärinhoitoon, jos heillä esiintyy anafylaksian oireita tai löydöksiä. Hoitoa ei pidä aloittaa uudelleen (ks. kohta Haittavaikutukset).
Infektiot
Infektioiden (60 % vs 58 %) ja vakavien infektioiden (2 % vs 2 %) esiintyvyys oli vaiheen 3 lumekontrolloiduissa tutkimuksissa samankaltaista dimetyylifumarattia tai lumelääkettä saaneilla potilailla.
Diroksimeelifumaraatilla on immuunivastetta muuntavia vaikutuksia (ks. kohta Farmakodynamiikka).
Vumerity-valmistetta saavia potilaita on neuvottava ilmoittamaan infektio-oireista lääkärille. Jos potilaalle kehittyy vakava infektio, hoidon keskeyttämistä on harkittava ja hyödyt ja riskit on arvioitava uudelleen ennen hoidon jatkamista. Potilaat, joilla on vakavia infektioita, eivät saa aloittaa hoitoa ennen kuin infektio/infektiot on hoidettu.
Vakavien infektioiden esiintyvyyden lisääntymistä ei havaittu dimetyylifumaraattihoitoa saaneilla potilailla, joiden lymfosyyttimäärä oli alle 0,8 x 109/l tai alle 0,5 x 109/l. Jos Vumerity-hoitoa jatketaan, kun potilaalla on kohtalainen tai vaikea, pitkittynyt lymfopenia, opportunistisen infektion, PML mukaan lukien, mahdollisuutta ei voida sulkea pois (ks. alakohta PML).
Vyöruusu (herpes zoster‑infektiot)
Diroksimeelifumaraatin ja dimetyylifumaraatin käytön yhteydessä on ilmennyt vyöruusutapauksia. Suurin osa dimetyylifumaraattiin liittyvistä tapauksista ei ollut vakavia, mutta myös vakavia tapauksia on raportoitu, mukaan lukien disseminoitunut vyöruusu, silmänseudun vyöruusu, korvan vyöruusu, neurologinen herpes zoster ‑infektio, herpes zoster ‑infektion aiheuttama meningoenkefaliitti ja herpes zoster ‑infektion aiheuttama meningomyeliitti. Näitä tapahtumia voi ilmetä missä tahansa vaiheessa hoidon aikana. Potilaita on seurattava vyöruusun oireiden ja löydösten havaitsemiseksi etenkin, jos potilaalla on raportoitu samanaikaisesti lymfosytopenia. Jos vyöruusu todetaan, potilaalle pitää antaa siihen asianmukaista hoitoa. Jos potilaalla on vakava infektio, on harkittava hoidon keskeyttämistä siihen saakka, kunnes infektio on hävinnyt (ks. kohta Haittavaikutukset).
Hoidon aloittaminen
Hoito tulee aloittaa asteittaisesti, jotta vältettäisiin punastumisoireet ja ruoansulatuskanavaan kohdistuvat haittavaikutukset (ks. kohta Annostus ja antotapa).
Fanconin oireyhtymä
Dimetyylifumaraattia sisältävän lääkevalmisteen ja muiden fumaarihapon estereiden samanaikaisen käytön yhteydessä on raportoitu Fanconin oireyhtymätapauksia. Fanconin oireyhtymän varhainen diagnoosi ja Vumerity-hoidon lopettaminen on tärkeää, jotta munuaisten vajaatoiminta ja osteomalasia voidaan estää, sillä oireyhtymä on yleensä korjaantuva. Tärkeimmät merkit ovat proteinuria, glukosuria (jossa verensokeriarvot ovat normaalit), aminoasiduria ja fosfaturia (mahdollisesti samanaikaisesti hypofosfatemian kanssa). Oireyhtymän edetessä saattaa ilmetä muita oireita, kuten polyuriaa, polydipsiaa ja proksimaalista lihasheikkoutta. Harvoissa tapauksissa saattaa ilmetä hypofosfateemista osteomalasiaa (jonka yhteydessä on paikantamatonta luukipua), kohonnut seerumin alkalisen fosfataasin pitoisuus ja rasitusmurtumia. On tärkeää huomata, että Fanconin oireyhtymä voi ilmetä, vaikka kreatiniinipitoisuus ei olisi kohonnut eikä glomerulusten suodatusnopeus olisi pieni. Jos epäselviä oireita ilmenee, Fanconin oireyhtymä pitää ottaa huomioon ja tehdä asianmukaiset tutkimukset.
Yhteisvaikutukset
Muiden (paikallisesti tai systeemisesti käytettävien) fumaarihapon estereiden samanaikaista käyttöä hoidon aikana on vältettävä.
Vumerity-valmistetta ei pidä antaa samaan aikaan dimetyylifumaraatin kanssa.
Kuljettajaproteiinien estymistä koskevissa tutkimuksissa in vitro ja/tai in vivo, CYP-entsyymien estymistä ja induktiota selvittäneissä tutkimuksissa in vitro tai diroksimeelifumaraatin ja sen tärkeimpien metaboliittien, aktiivisen metaboliitin, monometyylifumaraatin (MMF) ja inaktiivisen metaboliitin 2‑hydroksietyylisukkinimidin (HES) proteiiniin sitoutumista koskevissa tutkimuksissa ei tunnistettu mahdollisia yhteisvaikutusriskejä.
CYP-induktiotutkimukset in vitro eivät osoittaneet yhteisvaikutusta dimetyylifumaraatin ja suun kautta annettavien ehkäisyvalmisteiden välillä, mutta tutkimusta ei tehty diroksimeelifumaraatilla. In vivo ‑tutkimuksessa dimetyylifumaraatin samanaikainen anto suun kautta annettavan yhdistelmäehkäisyvalmisteen (norgestimaatti ja etinyyliestradioli) kanssa ei vaikuttanut oleellisesti suun kautta annettavalle ehkäisyvalmisteelle altistukseen. Yhteisvaikutustutkimuksia ei ole tehty muita progestogeenejä sisältävien suun kautta annettavien ehkäisyvalmisteiden kanssa, mutta diroksimeelifumaraatin ei odoteta vaikuttavan näille valmisteille altistukseen.
Diroksimeelifumaraatin käyttöä yhdessä syöpälääkkeiden tai immunosuppressiivisten hoitojen kanssa ei ole tutkittu, joten niitä samanaikaisesti käytettäessä on oltava varovainen. MS-potilailla tehdyissä kliinisissä tutkimuksissa pahenemisvaiheiden samanaikaiseen hoitoon lyhytaikaisella laskimoon annettavalla kortikosteroidikuurilla ei liittynyt kliinisesti oleellista infektioiden lisääntymistä.
Rokotteiden, jotka eivät sisällä eläviä taudinaiheuttajia, antoa kansallisen rokotusohjelman mukaisesti voidaan harkita Vumerity-hoidon aikana. Kliinisessä tutkimuksessa, johon osallistui yhteensä 71 relapsoivaa-remittoivaa MS-tautia (aaltomaista MS-tautia) sairastavaa potilasta, dimetyylifumaraattia 240 mg kahdesti vuorokaudessa vähintään 6 kuukauden ajan (n = 38) tai pegyloimatonta interferonia vähintään 3 kuukauden ajan (n = 33) saaneilla potilailla saavutettiin samankaltainen immuunivaste (määritettiin ≥ 2-kertaisena nousuna rokotusta edeltävästä titteristä rokotuksen jälkeiseen titteriin) tetanustoksoidille (muistiantigeeni) ja konjugoituneelle meningokokki C -polysakkaridirokotteelle (neoantigeeni). Immuunivaste konjugoimattoman 23-valenttisen pneumokokkipolysakkaridirokotteen eri serotyypeille (T-solusta riippumaton antigeeni) sen sijaan vaihteli kummassakin hoitoryhmässä. Positiivinen immuunivaste, joka määritettiin vasta-ainetitterin ≥ 4-kertaisena nousuna näille kolmelle rokotteelle, saavutettiin harvemmilla potilailla kummassakin hoitoryhmässä. Pieniä numeerisia eroja vasteessa tetanustoksoidille ja serotyypin 3 pneumokokkipolysakkaridille havaittiin pegyloimattoman interferonin hyväksi.
Kliinisiä tietoja ei ole saatavissa eläviä heikennettyjä taudinaiheuttajia sisältävien rokotteiden annon tehosta ja turvallisuudesta Vumerity-hoitoa saaville potilaille. Eläviin rokotteisiin saattaa liittyä suurempi kliinisen infektion riski eikä niitä saa antaa potilaille, ellei tämän riskin poikkeustapauksissa katsota olevan pienempi kuin potilaalle koituva riski, jos rokotusta ei anneta.
Terveille vapaaehtoisille tehtyjen tutkimusten perusteella dimetyylifumaraatin käyttöön liittyvä punastuminen on todennäköisesti prostaglandiinivälitteistä. Kahdessa terveille vapaaehtoisille tehdyssä dimetyylifumaraattia koskeneessa tutkimuksessa enteropäällysteettömän 325 mg:n (tai vastaavan) asetyylisalisyylihappoannoksen anto 30 minuuttia ennen dimetyylifumaraatin antoa 4 vuorokauden ja 4 viikon hoitojakson ajan ei muuttanut dimetyylifumaraatin farmakokineettistä profiilia. Asetyylisalisyylihappohoitoon liittyvät mahdolliset riskit on otettava huomioon ennen samanaikaista käyttöä Vumerity-valmisteen kanssa potilailla, joilla on aaltomainen MS-tauti. Asetyylisalisyylihapon pitkäaikaisesta (> 4 viikkoa) jatkuvasta käytöstä ei ole tehty tutkimuksia (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Vumerity-hoitoa saavien potilaiden samanaikainen hoito munuaistoksisilla lääkevalmisteilla (esim. aminoglykosideilla, diureeteilla, ei-steroidaalisilla tulehduskipulääkkeillä tai litiumilla) saattaa suurentaa munuaisiin kohdistuvien haittavaikutusten (esim. proteinurian, ks. kohta Haittavaikutukset) riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja diroksimeelifumaraatin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Vumerity-valmisteen käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä asianmukaista ehkäisyä (ks. kohta Yhteisvaikutukset). Vumerity-valmistetta saa käyttää raskauden aikana vain, jos se on selvästi välttämätöntä ja jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Imetys
Ei tiedetä, erittyvätkö diroksimeelifumaraatti tai sen metaboliitit ihmisen rintamaitoon. Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea. On päätettävä lopetetaanko rintaruokinta vai lopetetaanko Vumerity-hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Vumerity-valmisteen vaikutuksista ihmisten hedelmällisyyteen ei ole tietoja. Eläinkokeista saadut tiedot eivät osoittaneet diroksimeelifumaraatin heikentävän urosten tai naaraiden hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Vumerity-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Diroksimeelifumaraatti ja dimetyylifumaraatti metaboloituvat suun kautta annettuna nopeasti monometyylifumaraatiksi ennen pääsyä systeemiseen verenkiertoon, ja niiden haittavaikutukset metaboloitumisen jälkeen ovat oletettavasti samanlaisia.
Yleisimmin esiintyneet dimetyylifumaraatin haittavaikutukset olivat punastuminen (35 %) ja maha-suolikanavan oireet (ripuli 14 %, pahoinvointi 12 %, vatsakipu 10 %, ylävatsakipu 10 %). Dimetyylifumaraattihoidon keskeyttämiseen yleisimmin johtaneet haittavaikutukset olivat punastuminen (3 %) ja maha‑suolikanavan oireet (4 %)
Haittavaikutusten yhteenvetotaulukko
Taulukossa 1 esitetään haittavaikutukset, joita raportoitiin useammin dimetyylifumaraattihoitoa saaneilla potilailla kuin lumelääkettä saaneilla potilailla kahdessa vaiheen 3 lumekontrolloidussa kliinisessä avaintutkimuksessa ja valmisteen markkinoille tulon jälkeen.
Haittavaikutukset on esitetty MedDRA-elinjärjestelmäluokituksen suositeltujen termien mukaisesti. Haittavaikutusten esiintymistiheydet on luokiteltu seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1: Haittavaikutukset
| MedDRA-elinjärjestelmä | Haittavaikutus | Yleisyysluokka |
| Infektiot | Gastroenteriitti | Yleinen |
| Progressiivinen multifokaalinen leukoenkefalopatia (PML)1 | Tuntematon | |
| Vyöruusu1 | Tuntematon | |
| Veri ja imukudos | Lymfopenia1, 2 | Yleinen |
| Leukopenia | Yleinen | |
| Trombosytopenia | Melko harvinainen | |
| Immuunijärjestelmä | Yliherkkyys | Melko harvinainen |
| Anafylaksia | Tuntematon | |
| Hengenahdistus | Tuntematon | |
| Hypoksia | Tuntematon | |
| Hypotensio | Tuntematon | |
| Angioedeema | Tuntematon | |
| Hermosto | Poltteen tunne | Yleinen |
| Verisuonisto | Punastuminen1 | Hyvin yleinen |
| Kuumat aallot | Yleinen | |
| Hengityselimet, rintakehä ja välikarsina | Nuha | Tuntematon |
| Ruoansulatuselimistö | Ripuli | Hyvin yleinen |
| Pahoinvointi | Hyvin yleinen | |
| Ylävatsakipu | Hyvin yleinen | |
| Vatsakipu | Hyvin yleinen | |
| Oksentelu | Yleinen | |
| Dyspepsia | Yleinen | |
| Gastriitti | Yleinen | |
| Ruoansulatuskanavan oireet | Yleinen | |
| Maksa ja sappi | ASAT-arvon nousu1 | Yleinen |
| ALAT-arvon nousu1 | Yleinen | |
| Lääkkeen aiheuttama maksavaurio | Harvinainen | |
| Iho ja ihonalainen kudos | Kutina | Yleinen |
| Ihottuma | Yleinen | |
| Eryteema | Yleinen | |
| Alopesia | Yleinen | |
| Munuaiset ja virtsatiet | Proteinuria | Yleinen |
| Yleisoireet ja antopaikassa todettavat haitat | Kuumotus | Yleinen |
| Tutkimukset | Ketoaineita virtsassa | Hyvin yleinen |
| Albumiinia virtsassa | Yleinen | |
| Veren valkosolujen määrän väheneminen | Yleinen |
1 Katso lisätietoja kohdasta Valikoitujen haittavaikutusten kuvaus
2 Lymfopeniaa ilmoitettiin esiintymistiheydellä ”hyvin yleinen” diroksimeelifumaraatin avoimessa, kontrolloimattomassa vaiheen 3 tutkimuksessa
Valikoitujen haittavaikutusten kuvaus
Punastuminen
Lumekontrolloiduissa tutkimuksissa punastumisen (34 % vs. 5 %) ja kuumien aaltojen (7 % vs. 2 %) esiintyvyys oli suurempi dimetyylifumaraattihoitoa (240 mg kahdesti vuorokaudessa) saaneilla kuin lumehoitoa saaneilla potilailla. Punastumista kuvataan yleensä kasvojen tai kaulan punoituksena tai kuumina aaltoina, mutta se voi käsittää muitakin oireita (esim. lämmön tunne, punaisuus, kutina tai poltteen tunne). Punastumisoireet ilmaantuvat yleensä hoidon alkuvaiheessa (lähinnä ensimmäisen kuukauden aikana). Potilailla, joilla punastumista esiintyy, sitä saattaa esiintyä ajoittain koko dimetyylifumaraattihoidon ajan. Suurimmalla osalla potilaista punastumisoireet olivat voimakkuudeltaan lieviä tai kohtalaisia. Dimetyylifumaraattihoitoa saaneista potilaista kaikkiaan 3 % keskeytti hoidon punastumisen takia. Vakavia punastumisoireita, joille voi olla ominaista yleistynyt eryteema, ihottuma ja/tai kutina, havaittiin alle 1 %:lla dimetyylifumaraattihoitoa saaneista potilaista (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Diroksimeelifumaraatilla tehdyssä vaiheen 3 kaksoissokkoutetussa tutkimuksessa (ks. kohta Farmakodynamiikka) punastumista raportoitiin 32,8 %:lla ja kuumia aaltoja 1,6 %:lla diroksimeelifumaraattihoitoa saaneista potilaista, ja dimetyylifumaraattihoitoa saaneista potilaista 40,6 %:lla raportoitiin punastumista ja 0,8 %:lla kuumia aaltoja. Vakavia punastumiseen liittyviä tapahtumia ei ollut eikä yksikään potilas keskeyttänyt tutkimusta punastumisen vuoksi.
Ruoansulatuselimistö
Maha-suolikanavan oireiden esiintyvyys (esim. ripuli [14 % vs. 10 %], pahoinvointi [12 % vs. 9 %], ylävatsakipu [10 % vs. 6 %], vatsakipu [9 % vs. 4 %], oksentelu [8 % vs. 5 %] ja dyspepsia [5 % vs. 3 %]) oli suurempi dimetyylifumaraattihoitoa saaneilla potilailla verrattuna lumehoitoa saaneisiin. Maha‑suolikanavan oireet ilmaantuvat yleensä hoidon alkuvaiheessa (lähinnä ensimmäisen kuukauden aikana). Potilailla, joilla maha-suolikanavan oireita esiintyy, nämä saattavat jatkua ajoittain koko dimetyylifumaraattihoidon ajan. Suurimmalla osalla potilaista, joilla maha-suolikanavan oireita esiintyi, ne olivat voimakkuudeltaan lieviä tai keskivaikeita. Neljä prosenttia (4 %) dimetyylifumaraattihoitoa saaneista potilaista keskeytti hoidon maha-suolikanavan oireiden takia. Vakavia maha-suolikanavan oireita, kuten gastroenteriittiä ja gastriittia, havaittiin 1 %:lla dimetyylifumaraattihoitoa saaneista potilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Diroksimeelifumaraatilla ja dimetyylifumaraatilla tehdyssä kliinisessä tutkimuksessa raportoidut ruoansulatuselimistön haittavaikutukset esitetään kohdassa Farmakodynamiikka.
Maksan toiminta
Lumekontrolloiduista dimetyylifumaraattitutkimuksista saatujen tietojen perusteella suurimmalla osalla potilaista, joiden maksan transaminaasiarvot olivat suurentuneet, arvot olivat alle 3‑kertaiset viitearvojen ylärajaan (upper limit of normal, ULN) nähden. Dimetyylifumaraattihoitoa saaneilla potilailla havaittiin suurentuneita maksan transaminaasiarvoja lumehoitoa saaneisiin verrattuna ensisijaisesti ensimmäisten kuuden hoitokuukauden aikana. ALAT- ja ASAT-arvojen suurentumista vähintään 3‑kertaisiksi ULN:ään verrattuna havaittiin vastaavasti 5 % ja 2 %:lla lumehoitoa saaneista sekä 6 % ja 2 %:lla dimetyylifumaraattihoitoa saaneista potilaista. Hoidon keskeytti suurentuneiden maksan transaminaasiarvojen takia alle 1 % potilaista. Keskeyttämisiä tapahtui yhtä usein dimetyylifumaraattihoitoa saaneilla ja lumehoitoa saaneilla potilailla. Lääkkeen aiheuttamaan maksavaurioon viittaavaa transaminaasiarvojen suurenemista vähintään 3-kertaisiksi ULN:ään verrattuna ja samanaikaista kokonaisbilirubiinipitoisuuden suurenemista vähintään 2-kertaiseksi ULN:ään verrattuna ei havaittu lumelääkekontrolloiduissa tutkimuksissa, mutta näitä on raportoitu valmisteen markkinoille tulon jälkeisessä seurannassa dimetyylifumaraatin annon jälkeen ja ne hävisivät hoidon lopettamisen myötä.
Lymfopenia
Vaiheen 3 avoimessa kontrolloimattomassa diroksimeelifumaraattitutkimuksessa hoito keskeytettiin, jos potilaan lymfosyyttimääräksi varmistui alle 0,5 × 109/l ja tämä arvo säilyi ≥ 4 viikon ajan.
Lumekontrolloiduissa dimetyylifumaraattitutkimuksissa useimpien potilaiden (yli 98 %) lymfosyyttiarvot olivat normaalit ennen hoidon aloittamista. Keskimääräinen lymfosyyttimäärä pieneni ensimmäisen dimetyylifumaraattihoitovuoden aikana ja tasaantui sen jälkeen. Lymfosyyttimäärät pienenivät keskimäärin noin 30 % lähtötilanteen arvoista. Lymfosyyttimäärien keskiarvot ja mediaanit pysyivät normaaliarvojen rajoissa. Lymfosyyttimääriä alle 0,5 × 109/l havaittiin alle 1 %:lla lumehoitoa saaneista ja 6 %:lla dimetyylifumaraattihoitoa saaneista potilaista. Lymfosyyttimäärä oli alle 0,2 × 109/l yhdellä dimetyylifumaraattihoitoa saaneella potilaalla, mutta ei yhdelläkään lumehoitoa saaneista.
Kliinisissä tutkimuksissa (sekä kontrolloiduissa että kontrolloimattomissa) 41 %:lla dimetyylifumaraatilla hoidetuista potilaista oli lymfopenia (määritelty näissä tutkimuksissa arvoksi < 0,91 x 109/l). Lievää lymfopeniaa (määrät ≥ 0,8 × 109/l – < 0,91 × 109/l) havaittiin 28 %:lla potilaista; kohtalaista lymfopeniaa (määrät ≥ 0,5 × 109/l – < 0,8 × 109/l), joka jatkui vähintään kuuden kuukauden ajan, havaittiin 11 %:lla potilaista; vaikeaa lymfopeniaa (määrät < 0,5 × 109/l), joka jatkui vähintään kuuden kuukauden ajan, havaittiin 2 %:lla potilaista. Vaikean lymfopenian ryhmässä lymfosyyttimäärä pysyi suurimmalla osalla tasolla < 0,5 × 109/l hoidon jatkuessa.
Lisäksi kontrolloimattomassa, prospektiivisessa markkinoille tulon jälkeisessä tutkimuksessa dimetyylifumaraattihoidon viikon 48 kohdalla (n = 185) CD4+-T-solut olivat kohtalaisesti (määrä ≥ 0,2 × 109/l – < 0,4 × 109/l) tai vaikeasti (< 0,2 × 109/l) vähentyneet vastaavasti jopa 37 %:lla tai 6 %:lla potilaista, ja CD8+-T-solut olivat yleisemmin vähentyneet jopa 59 %:lla potilaista (määrä < 0,2 × 109/l) ja 25 %:lla potilaista (määrä < 0,1 × 109/l).
Kontrolloiduissa ja kontrolloimattomissa kliinisissä tutkimuksissa dimetyylifumaraattihoidon lopettaneilla potilailla, joiden lymfosyyttimäärä oli alle normaaliarvojen alarajan (lower limit of normal, LLN), seurattiin lymfosyyttimäärän palautumista normaaliarvojen alarajaan (ks. kohta Farmakodynamiikka).
Infektiot, mukaan lukien PML ja opportunistiset infektiot
Dimetyylifumaraatin käytön yhteydessä on raportoitu John Cunningham ‑viruksen (JCV) aiheuttamia infektioita, joista on aiheutunut progressiivista multifokaalista leukoenkefalopatiaa (PML) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). PML saattaa johtaa kuolemaan tai toimintakyvyn vaikeaan heikkenemiseen. Yhdessä kliinisistä tutkimuksista yhdelle dimetyylifumaraattia saaneelle potilaalle kehittyi PML pitkittyneen vaikean lymfopenian yhteydessä (lymfosyyttimäärä 3,5 vuoden ajan pääasiallisesti < 0,5 × 109/l), mikä johti kuolemaan. Markkinoille tulon jälkeen PML:ää on ilmennyt myös kohtalaisen ja lievän lymfopenian yhteydessä (> 0,5 × 109/l – < LLN, paikallisen laboratorion viitealueen mukaan).
Useissa PML-tapauksissa T-solualajoukkojen määrityksessä PML-diagnoosin aikaan CD8+-T-solumäärän havaittiin vähentyneen arvoon < 0,1 × 109/l, kun taas CD4+-T-solujen määrä vaihteli (< 0,05 – 0,5 × 109/l) ja korreloi enemmän lymfopenian kokonaisvaikeuden kanssa (< 0,5 x 109/l – < LLN). Tämän seurauksena CD4+/CD8+-suhde oli kasvanut näillä potilailla.
Pitkittynyt kohtalainen tai vaikea lymfopenia näyttää lisäävän PML:n riskiä dimetyylifumaraattihoidon ja samoin diroksimeelifumaraattihoidon yhteydessä, mutta PML:ää esiintyi myös dimetyylifumaraattihoitoa saaneilla potilailla, joilla oli lievä lymfopenia. Lisäksi suurin osa markkinoille tulon jälkeisistä PML-tapauksista esiintyi > 50-vuotiailla potilailla.
Dimetyylifumaraatin käytön yhteydessä on raportoitu vyöruusua (herpes zoster ‑infektioita). Käynnissä olevassa pitkäaikaisessa jatkotutkimuksessa, jossa dimetyylifumaraattihoitoa sai 1 736 MS-potilasta, noin 5 %:lla potilaista ilmeni vähintään yksi vyöruusutapahtuma. Tapahtumista suurin osa oli vaikeusasteeltaan lieviä tai kohtalaisia. Useimmilla potilaista lymfosyyttien määrä oli normaaliarvojen alarajan yläpuolella, myös niillä potilailla, joilla oli vakava vyöruusu. Suurimmalla osalla potilaista, joiden samanaikainen lymfosyyttimäärä oli alle normaaliarvojen alarajan, lymfopenia määriteltiin kohtalaiseksi tai vaikeaksi. Markkinoille tulon jälkeiset vyöruusutapaukset eivät useimmiten olleet vakavia ja hävisivät hoidon myötä. Markkinoille tulon jälkeen vyöruusun saaneiden potilaiden absoluuttisista lymfosyyttimääristä (ALC) on vähän tietoja saatavilla. Raportoiduissa tapauksissa suurimmalla osalla potilaista oli kohtalainen (≥ 0,5 × 109/l – < 0,8 × 109/l) tai vaikea (< 0,5 × 109/l – 0,2 × 109/l) lymfopenia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Laboratoriotulosten poikkeavuudet
Lumekontrolloiduissa dimetyylifumaraattitutkimuksissa virtsan ketoaineiden määrät (1+ tai sitä suurempi) olivat suurempia dimetyylifumaraattihoitoa saaneilla (45 %) kuin lumehoitoa saaneilla (10 %). Kliinisissä tutkimuksissa ei havaittu odottamattomia kliinisiä seurauksia.
Dimetyylifumaraattihoitoa saaneiden potilaiden 1,25-(OH)2-D-vitamiinipitoisuudet pienenivät suhteessa lumehoitoa saaneisiin (mediaanin prosentuaalinen lasku kahden vuoden kohdalla lähtötilanteeseen verrattuna 25 % vs. 15 %) ja lisäkilpirauhashormonipitoisuudet suurenivat dimetyylifumaraattihoitoa saaneilla suhteessa lumehoitoa saaneisiin (mediaanin prosentuaalinen kasvu kahden vuoden kohdalla lähtötilanteesta vastaavasti 29 % vs. 15 %). Kummankin parametrin keskimääräiset arvot pysyivät viitearvojen puitteissa.
Ohimenevää keskimääräisen eosinofiilimäärän suurenemista havaittiin ensimmäisen kahden dimetyylifumaraattihoitokuukauden aikana.
Pediatriset potilaat
Vumerity-valmisteen turvallisuutta pediatristen potilaiden hoidossa ei ole vielä varmistettu.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Raportoiduissa yliannostustapauksissa kuvatut oireet ovat olleet yhteneviä valmisteen tunnetun haittavaikutusprofiilin kanssa. Diroksimeelifumaraatin eliminaation tehostamiseen ei ole tunnettuja hoitokeinoja tai vastalääkettä. Yliannostustapauksissa suositellaan oireenmukaisen hoidon aloittamista kliinisen tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Immunosuppressantit, muut immunosuppressantit. ATC-koodi: L04AX09
Vaikutusmekanismi
Diroksimeelifumaraatin terapeuttisen vaikutuksen mekanismia MS-taudissa ei täysin tunneta. Diroksimeelifumaraatti vaikuttaa tärkeimmän aktiivisen metaboliitin, monometyylifumaraatin, kautta. Prekliiniset tutkimukset osoittavat, että monometyylifumaraatin farmakodynaamiset vaikutukset näyttävät välittyvän ainakin osittain transkriptiotekijä ”Nuclear factor (erythroid-derived 2)-like 2:n” (Nrf2) säätelemän signaalireitin kautta. Dimetyylifumaraatin on osoitettu aktivoivan Nrf2-riippuvaisten antioksidanttigeenien ilmentymistä.
Farmakodynaamiset vaikutukset
Vaikutukset immuunijärjestelmään
Dimetyylifumaraatilla osoitettiin kliinisissä tutkimuksissa olevan anti-inflammatorisia ja immuunivastetta muuntavia vaikutuksia. Dimetyylifumaraatti ja monometyylifumaraatti (diroksimeelifumaraatin ja dimetyylifumaraatin aktiivinen metaboliitti) vähentävät merkitsevästi tulehdusreaktiossa tapahtuvaa immuunisolujen aktivaatiota ja tämän jälkeistä proinflammatoristen sytokiinien vapautumista sekä vaikuttavat lymfosyytteihin proinflammatorisia sytokiiniprofiileja (TH1, TH17) vaimentaen ja siirtäen tasapainoa kohti anti‑inflammatorista (TH2) vastetta. Vaiheen 3 tutkimuksissa (DEFINE, CONFIRM ja ENDORSE) MS‑potilailla keskimääräinen lymfosyyttimäärä pieneni ensimmäisen dimetyylifumaraattihoitovuoden aikana keskimäärin noin 30 % lähtötilanteen arvosta ja tasaantui sen jälkeen. Näissä tutkimuksissa dimetyylifumaraattihoidon lopettaneilla potilailla, joiden lymfosyyttimäärä oli alle normaaliarvojen alarajan (LLN, 910 solua/mm3), seurattiin lymfosyyttimäärän palautumista normaaliarvojen alarajaan.
Kuvassa 1 on esitetty niiden potilaiden osuudet, joiden arvioitiin Kaplan-Meierin menetelmällä saavuttavan normaaliarvojen alarajan ilman pitkittynyttä vaikea-asteista lymfopeniaa. Palautumisen lähtötilanteeksi määriteltiin viimeinen hoidon aikana mitattu absoluuttinen lymfosyyttimäärä (ALC) ennen dimetyylifumaraattihoidon lopettamista. Taulukossa 2, taulukossa 3 ja taulukossa 4 on esitetty niiden potilaiden arvioidut osuudet, joiden arvot olivat palautuneet normaaliarvojen alarajaan (absoluuttinen lymfosyyttimäärä ≥ 0,9 × 109/l) viikolla 12 ja viikolla 24 ja joilla oli palautumisen lähtötilanteessa lievä, keskivaikea tai vaikea lymfopenia, sekä pisteittäiset 95 %:n luottamusvälit. Elossaolofunktion Kaplan-Meier-estimaattorin keskivirhe on laskettu Greenwoodin kaavalla.
Kuva 1: Kaplan-Meierin menetelmällä arvioidut niiden potilaiden osuudet, joiden absoluuttinen lymfosyyttimäärä (ALC) palautui palautumisen lähtötilanteesta (RBL) normaaliarvojen alarajaan (LLN) (≥ 910 solua/mm3)
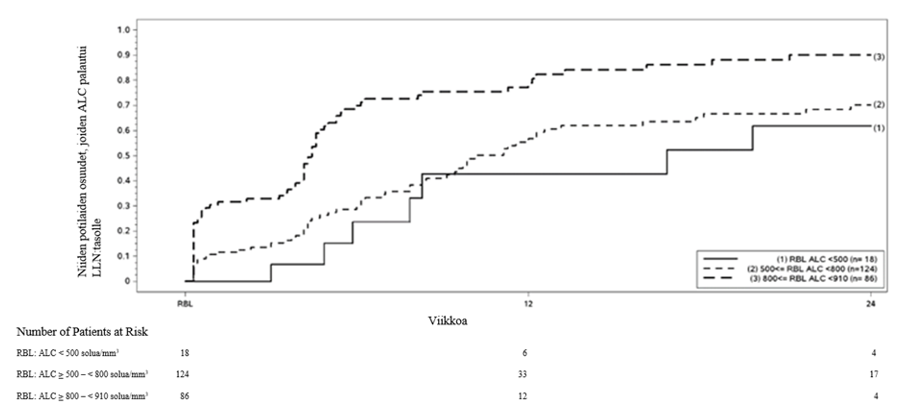
Taulukko 2.Kaplan-Meierin menetelmällä arvioitu niiden potilaiden osuus, joiden arvot palautuivat normaaliarvojen alarajaan; potilaat, joilla oli palautumisen lähtötilanteessa lievä lymfopenia, pois lukien potilaat, joilla oli pitkittynyt vaikea-asteinen lymfopenia
Riskinalaiset potilaat, joilla lievä lymfopenia, lkma | Lähtötilanne N = 86 | Viikko 12 N = 12 | Viikko 24 N = 4 |
Niiden potilaiden osuus, joiden arvot palautuivat normaaliarvojen alarajaan (95 %:n luottamusväli) | 0,81 (0,71, 0,89) | 0,90 (0,81, 0,96) |
a Potilaat, joiden absoluuttinen lymfosyyttimäärä < 910 ja ≥ 800 solua/mm3 palautumisen lähtötilanteessa, pois lukien potilaat, joilla oli pitkittynyt vaikea-asteinen lymfopenia.
Taulukko 3. Kaplan-Meierin menetelmällä arvioitu niiden potilaiden osuus, joiden arvot palautuivat normaaliarvojen alarajaan; potilaat, joilla oli palautumisen lähtötilanteessa keskivaikea lymfopenia, pois lukien potilaat, joilla oli pitkittynyt vaikea-asteinen lymfopenia
Riskinalaiset potilaat, joilla keskivaikea lymfopenia, lkma | Lähtötilanne N = 124 | Viikko 12 N = 33 | Viikko 24 N = 17 |
Niiden potilaiden osuus, joiden arvot palautuivat normaaliarvojen alarajaan (95 %:n luottamusväli) | 0,57 (0,46, 0,67) | 0,70 (0,60, 0,80) |
a Potilaat, joiden absoluuttinen lymfosyyttimäärä < 800 ja ≥ 500 solua/mm3 palautumisen lähtötilanteessa, pois lukien potilaat, joilla oli pitkittynyt vaikea-asteinen lymfopenia.
Taulukko 4.Kaplan-Meierin menetelmällä arvioitu niiden potilaiden osuus, joiden arvot palautuivat normaaliarvojen alarajaan; potilaat, joilla oli palautumisen lähtötilanteessa vaikea-asteinen lymfopenia, pois lukien potilaat, joilla oli pitkittynyt vaikea-asteinen lymfopenia
Riskinalaiset potilaat, joilla vaikea lymfopenia, lkma | Lähtötilanne N = 18 | Viikko 12 N = 6 | Viikko 24 N = 4 |
Niiden potilaiden osuus, joiden arvot palautuivat normaaliarvojen alarajaan (95 %:n luottamusväli) | 0,43 (0,20, 0,75) | 0,62 (0,35, 0,88) |
a Potilaat, joiden absoluuttinen lymfosyyttimäärä < 500 solua/mm3 palautumisen lähtötilanteessa, pois lukien potilaat, joilla oli pitkittynyt vaikea-asteinen lymfopenia.
Kliininen teho ja turvallisuus
Diroksimeelifumaraatti ja dimetyylifumaraatti metaboloituvat suun kautta annettuna nopeasti esteraasien välityksellä samaksi aktiiviseksi metaboliitiksi, monometyylifumaraatiksi, ennen pääsyä systeemiseen verenkiertoon. Diroksimeelifumaraatin ja dimetyylifumaraatin farmakokinetiikan on monometyylifumaraattialtistusta analysoimalla osoitettu olevan vertailukelpoinen (ks. kohta Farmakokinetiikka), joten tehon profiilit ovat oletettavasti samanlaiset.
Kliiniset dimetyylifumaraattitutkimukset
Aaltomaista (relapsoivaa–remittoivaa) MS-tautia (RRMS) sairastavilla potilailla tehtiin kaksi kahden vuoden kestoista, satunnaistettua, kaksoissokkoutettua, lumekontrolloitua tutkimusta (DEFINE [1 234 potilasta] ja CONFIRM [1 417 potilasta]). Näihin tutkimuksiin ei otettu mukaan MS-taudin progressiivisia muotoja sairastavia potilaita.
Teho (ks. seuraava taulukko) ja turvallisuus osoitettiin potilailla, joiden EDSS-pisteet (Expanded Disability Status Scale) olivat 0–5, joilla oli ilmennyt vähintään yksi pahenemisvaihe satunnaistamista edeltäneen vuoden aikana tai joilla kuuden viikon sisällä ennen satunnaistamista tehty aivojen magneettikuvaus osoitti vähintään yhden gadoliniumilla tehostuvan (Gd+) leesion. CONFIRM-tutkimus sisälsi arvioitsijan osalta sokkoutetun glatirameeriasetaattivertailuvalmisteryhmän (tutkimushoidon vastetta arvioiva tutkimuslääkäri/tutkija oli sokkoutettu).
DEFINE-tutkimuksessa potilasjoukkoa lähtötilanteessa kuvaavat mediaaniarvot olivat 39 vuoden ikä, sairauden kesto 7,0 vuotta ja EDSS-pistemäärä 2,0. Lisäksi 16 %:lla potilaista EDSS-pistemäärä oli yli 3,5, 28 %:lla oli ollut vähintään 2 pahenemisvaihetta edellisenä vuonna ja 42 % potilaista oli aikaisemmin saanut hoitoa jollakin hyväksytyistä MS‑taudin lääkehoidoista. MRI-ryhmässä 36 %:lla tutkimukseen mukaan otetuista potilaista oli lähtötilanteessa Gd+-leesioita (Gd+-leesioiden keskimääräinen lukumäärä 1,4).
CONFIRM-tutkimuksessa potilasjoukkoa lähtötilanteessa kuvaavat mediaaniarvot olivat 37 vuoden ikä, sairauden kesto 6,0 vuotta ja EDSS-pistemäärä 2,5. Lisäksi 17 %:lla potilaista EDSS-pistemäärä oli yli 3,5, 32 %:lla oli ollut vähintään 2 pahenemisvaihetta edellisenä vuonna ja 30 % potilaista oli aikaisemmin saanut hoitoa jollakin hyväksytyistä MS‑taudin lääkehoidoista. MRI-ryhmässä 45 %:lla tutkimukseen mukaan otetuista potilaista oli lähtötilanteessa Gd+-leesioita (Gd+-leesioiden keskimääräinen lukumäärä 2,4).
Dimetyylifumaraattihoitoa saaneiden potilaiden seuraavat päätetapahtumat pienenivät kliinisesti ja tilastollisesti merkitsevästi lumehoitoon verrattuna: DEFINE-tutkimuksen ensisijainen päätetapahtuma, pahenemisvaiheiden saaneiden potilaiden osuus kahden vuoden hoidon aikana; ja CONFIRM-tutkimuksen ensisijainen päätetapahtuma, pahenemisvaiheiden vuosittainen määrä (ARR) kahden vuoden hoidon aikana.
CONFIRM-tutkimuksessa pahenemisvaiheiden vuosittainen määrä oli glatirameeriasetaatilla 0,286 ja lumevalmisteella 0,401. Tämä vastaa 29 %:n (p = 0,013) vähenemistä.
DEFINE | CONFIRM | ||||
Lume | dimetyyli-fumaraatti 240 mg kahdesti vuorokaudessa | Lume | dimetyyli-fumaraatti 240 mg kahdesti vuorokaudessa | Glatira-meeri-asetaatti | |
Kliiniset päätetapahtumata | |||||
Potilaiden lukumäärä | 408 | 410 | 363 | 359 | 350 |
Vuosittainen pahenemisvaiheiden määrä (ARR) | 0,364 | 0,172*** | 0,401 | 0,224*** | 0,286* |
Esiintyvyyssuhde (95 %:n luottamusväli) | 0,47 (0,37, 0,61) | 0,56 (0,42, 0,74) | 0,71 (0,55, 0,93) | ||
Pahenemisvaiheen saaneiden osuus | 0,461 | 0,270*** | 0,410 | 0,291** | 0,321** |
Riskitiheyssuhde (HR) (95 %:n luottamusväli) | 0,51 (0,40, 0,66) | 0,66 (0,51, 0,86) | 0,71 (0,55, 0,92) | ||
Niiden potilaiden osuus, joilla toimintakyky heikkeni (varmistettu 12 viikon ajalta) | 0,271 | 0,164** | 0,169 | 0,128# | 0,156# |
Riskitiheyssuhde (HR) (95 %:n luottamusväli) | 0,62 (0,44, 0,87) | 0,79 (0,52, 1,19) | 0,93 (0,63, 1,37) | ||
Niiden potilaiden osuus, joilla toimintakyky heikkeni (varmistettu 24 viikon ajalta) | 0,169 | 0,128# | 0,125 | 0,078# | 0,108# |
Riskitiheyssuhde (HR) (95 %:n luottamusväli) | 0,77 (0,52, 1,14) | 0,62 (0,37, 1,03) | 0,87 (0,55, 1,38) | ||
MRI-päätetapahtumatb | |||||
Potilaiden lukumäärä | 165 | 152 | 144 | 147 | 161 |
Uusien tai äskettäin laajentuneiden T2-leesioiden keskimääräinen (mediaani) lukumäärä 2 vuoden aikana | 16,5 (7,0) | 3,2 (1,0)*** | 19,9 (11,0) | 5,7 (2,0)*** | 9,6 (3,0)*** |
Leesioiden keskisuhde (95 %:n luottamusväli) | 0,15 (0,10, 0,23) | 0,29 (0,21, 0,41) | 0,46 (0,33, 0,63) | ||
Gd-leesioiden keskimääräinen (mediaani) lukumäärä 2 vuoden kuluttua | 1,8 (0) | 0,1 (0)*** | 2,0 (0,0) | 0,5 (0,0)*** | 0,7 (0,0)** |
Kerroinsuhde (Odds Ratio) (95 %:n luottamusväli) | 0,10 (0,05, 0,22) | 0,26 (0,15, 0,46) | 0,39 (0,24, 0,65) | ||
Uusien T1-hypointensiivisten leesioiden keskimääräinen (mediaani) lukumäärä 2 vuoden aikana | 5,7 (2,0) | 2,0 (1,0)*** | 8,1 (4,0) | 3,8 (1,0)*** | 4,5 (2,0)** |
Leesioiden keskisuhde (95 %:n luottamusväli) | 0,28 (0,20, 0,39) | 0,43 (0,30, 0,61) | 0,59 (0,42, 0,82) | ||
aKaikki kliinisten päätetapahtumien analyysit olivat hoitoaikeen (intent-to-treat, ITT) mukaisia; bMRI-analyysissä käytettiin MRI-kohorttia
*p-arvo alle 0,05; **p-arvo alle 0,01; ***p-arvo alle 0,0001; #ei tilastollisesti merkitsevä
Avoimeen, kontrolloimattomaan 8 vuoden pituiseen jatkotutkimukseen (ENDORSE) rekrytoitiin pivotaalitutkimuksista (DEFINE ja CONFIRM) 1 736 aaltomaista (relapsoivaa–remittoivaa) MS-tautia (RRMS) sairastavaa soveltuvaa potilasta. Tutkimuksen ensisijainen tavoite oli arvioida dimetyylifumaraatin pitkän aikavälin turvallisuutta aaltomaista (relapsoivaa–remittoivaa) MS-tautia sairastavilla potilailla. Noin puolet 1 736 potilaasta (909, 52 %) sai hoitoa 6 vuotta tai pidempään. 501 potilasta sai kaikissa kolmessa tutkimuksessa jatkuvasti hoitona 240 mg dimetyylifumaraattia kahdesti vuorokaudessa, ja 249 potilasta, jotka saivat aikaisemmin DEFINE- ja CONFIRM-tutkimuksissa lumelääkettä, sai ENDORSE-tutkimuksessa hoitona 240 mg kahdesti vuorokaudessa. Potilaat, jotka saivat jatkuvaa hoitoa kahdesti päivässä, saivat hoitoa enintään 12 vuoden ajan.
ENDORSE-tutkimuksen aikana yli puolella potilaista, jotka saivat 240 mg dimetyylifumaraattia kahdesti vuorokaudessa, ei todettu pahenemisvaihetta. Potilailla, jotka saivat kaikissa kolmessa tutkimuksessa jatkuvaa hoitoa kahdesti vuorokaudessa, vakioitu vuosittainen pahenemisvaiheiden määrä oli DEFINE- ja CONFIRM-tutkimuksissa 0,187 (95 %:n luottamusväli: 0,156, 0,224) ja ENDORSE-tutkimuksessa 0,141 (95 %:n luottamusväli: 0,119, 0,167). Vakioitu vuosittainen pahenemisvaiheiden määrä väheni aiemmin lumelääkehoitoa saaneilla potilailla DEFINE- ja CONFIRM-tutkimusten arvosta 0,330 (95 %:n luottamusväli: 0,266, 0,408) ENDORSE-tutkimuksessa arvoon 0,149 (95 %:n luottamusväli: 0,116, 0,190).
ENDORSE-tutkimuksessa suurimmalla osalla potilaista (> 75 %) ei ollut vahvistettua toimintakyvyn heikkenemistä (mitattuna 6 kuukautta jatkuneena toimintakyvyn heikkenemisenä). Kolmen tutkimuksen yhdistetyt tulokset osoittivat, että dimetyylifumaraattihoitoa saaneilla potilailla toimintakyvyn heikkeneminen oli yhdenmukaista ja sen esiintyvyys vähäistä ja että ENDORSE-tutkimuksessa keskimääräiset EDSS-pistemäärät suurenivat hieman. Magneettikuvaukseen perustuvat arvioinnit (vuoteen 6 asti, mukaan lukien 752 potilasta, jotka olivat aiemmin DEFINE- ja CONFIRM-tutkimuksissa olleet mukana magneettikuvauskohortissa) osoittivat, että suurimmalla osalla potilaista (noin 90 %) ei ollut Gd-tehosteisia leesioita. Kuuden vuoden aikana vuosittainen uusien tai äskettäin laajentuneiden T2-leesioiden ja uusien T1-leesioiden vakioitu keskimääräinen lukumäärä pysyi pienenä.
Teho potilailla, joiden tauti on erittäin aktiivinen:
DEFINE- ja CONFIRM-tutkimuksissa hoitovaikutuksen pahenemisvaiheisiin havaittiin olevan yhdenmukainen niiden potilaiden alaryhmässä, joilla tauti oli erittäin aktiivinen, kun taas hoitovaikutusta toimintakyvyn jatkuvaan heikkenemiseen (varmistettu 3 kuukauden ajalta) ei ollut selvästi osoitettavissa. Erittäin aktiivinen tauti määriteltiin tutkimusasetelmassa seuraavasti:
- Potilaat, joilla oli vähintään 2 pahenemisvaihetta vuoden aikana ja vähintään yksi aivojen MRI‑kuvauksessa todettu Gd-tehosteinen leesio (n = 42 DEFINE-tutkimuksessa; n = 51 CONFIRM-tutkimuksessa) tai
- Potilaat, jotka eivät olleet saaneet vastetta asianmukaisesti toteutettuun interferonibeetahoitoon (vähintään yksi hoitovuosi), kun heillä oli ollut vähintään yksi hoidon aikainen pahenemisvaihe edeltävänä vuonna ja vähintään yhdeksän aivojen MRI-tutkimuksessa todettua T2‑hyperintensiivistä leesiota tai vähintään yksi Gd-tehosteinen leesio, tai potilaat, joilla pahenemisvaiheiden määrä ei ollut muuttunut tai se oli lisääntynyt viimeksi kuluneen vuoden aikana verrattuna sitä edeltäviin 2 vuoteen (n = 177 DEFINE-tutkimuksessa; n = 141 CONFIRM-tutkimuksessa).
Kliiniset Vumerity-tutkimukset
Maha-suolikanavaan liittyvää diroksimeelifumaraatin siedettävyyttä arvioitiin satunnaistetussa vaiheen 3 monikeskustutkimuksessa (EVOLVE-MS-2) 504 aikuispotilaalla, joilla oli aaltomainen (relapsoiva–remittoiva) MS-tauti. Tutkimus käsitti 5 viikon pituisen kaksoissokkoutetun hoitojakson, jossa oli kaksi hoitoryhmää. Potilailla oli yhden viikon titrausjakso, ja heidät satunnaistettiin (1:1) saamaan 462 mg diroksimeelifumaraattia kahdesti vuorokaudessa (n = 253) tai 240 mg dimetyylifumaraattia kahdesti vuorokaudessa (n = 251). Potilaita lähtötilanteessa kuvaavien arvojen mediaanit olivat 44 vuoden ikä, sairauden kesto 6,0 vuotta ja EDSS-pistemäärä 2,5. Tässä tutkimuksessa tutkittiin siedettävyyttä maha-suolikanavassa käyttäen Individual GI Symptom and Impact Scale (IGISIS) -asteikkoa, jossa arvioitiin viiden yksittäisen maha-suolikanavan oireen – pahoinvoinnin, oksentelun, ylävatsakivun, alavatsakivun ja ripulin – esiintyvyyttä, voimakkuutta, alkamisen ajankohtaa, kestoa ja toiminnallista vaikutusta.
Maha-suolikanavan haittavaikutusten kokonaisesiintyvyys oli diroksimeelifumaraattiryhmässä 34,8 % ja dimetyylifumaraattiryhmässä 49,0 %. Hoidon keskeyttäneitä oli yhteensä 1,6 % diroksimeelifumaraattiryhmässä ja 6 % dimetyylifumaraattiryhmässä, ja siedettävyyteen maha-suolikanavassa liittyvistä syistä johtuvia keskeytyksiä oli 0,8 % diroksimeelifumaraattiryhmässä ja 4,8 % dimetyylifumaraattiryhmässä. Hoidosta aiheutuneet maha-suolikanavan haittavaikutukset, joiden yleisyys oli ≥ 5 % diroksimeelifumaraatilla ja dimetyylifumaraatilla, olivat ripuli (15,4 % ja 22,3 %), pahoinvointi (14,6 % ja 20,7 %), ylävatsakipu (6,7 % ja 15,5 %), vatsakipu (6,3 % ja 9,6 %), alavatsakipu (5,9 % ja 6,8 %) ja oksentelu (3,6 % ja 8,8 %).
Pediatriset potilaat
Vumerity-valmisteen tehoa pediatristen potilaiden hoidossa ei ole varmistettu.
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Vumerity-valmisteen käytöstä MS-taudin hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Suun kautta annettu diroksimeelifumaraatti käy esteraasien välityksellä läpi nopean presysteemisen hydrolyysin ja muuntuu pääasiallisesti aktiiviseksi metaboliitiksi, monometyylifumaraatiksi, ja merkittäväksi inaktiiviseksi metaboliitiksi 2-hydroksietyylisukkinimidiksi (HES). Suun kautta tapahtuneen annon jälkeen diroksimeelifumaraattia ei ole plasmassa mitattavia määriä. Siksi kaikki diroksimeelifumaraattiin liittyvät farmakokineettiset analyysit tehtiin plasman monometyylifumaraattipitoisuuksista. Farmakokineettiset tiedot saatiin kymmenestä terveillä vapaaehtoisilla henkilöillä tehdystä kliinisestä tutkimuksesta, kahdesta MS-potilailla tehdystä tutkimuksesta ja populaatiofarmakokineettisistä analyyseistä. Farmakokineettinen arviointi on osoittanut, että monometyylifumaraattialtistus aikuisille suun kautta annetun 462 mg:n diroksimeelifumaraattiannoksen ja 240 mg:n dimetyylifumaraattiannoksen jälkeen on bioekvivalentti; diroksimeelifumaraatin yleinen teho- ja turvallisuusprofiili on näin ollen oletettavasti samankaltainen kuin dimetyylifumaraatilla.
Imeytyminen
Monometyylifumaraatin Tmax on 2,5–3 tuntia (mediaani). Plasman huippupitoisuuden (Cmax) ja kokonaisaltistuksen (AUC) arvot suurenivat tutkituilla annoksilla (49–980 mg) suhteessa annokseen. Kun diroksimeelifumaraattia annettiin EVOLVE-MS-1-tutkimuksessa MS-potilaille 462 mg kahdesti vuorokaudessa, monometyylifumaraatin keskimääräinen Cmax oli 2,11 mg/l. Aamuannoksen jälkeinen keskimääräinen AUClast oli 4,15 mg.h/l. Monometyylifumaraatin vakaan tilan keskimääräisen päivittäisen AUC-arvon (AUCss) MS-potilailla arvioitiin olevan 8,32 mg.h/l.
Diroksimeelifumaraatin antaminen samaan aikaan runsasrasvaisen, runsaskalorisen aterian kanssa ei vaikuttanut monometyylifumaraatin AUC-arvoon, mutta johti Cmax-arvon pienenemiseen noin 44 % paastotilaan verrattuna. Monometyylifumaraatin Cmax-arvo pieneni vähärasvaisten ja keskirasvaisten aterioiden yhteydessä noin 12 % (vähärasvainen ateria) ja 25 % (keskirasvainen ateria).
Ruoka ei vaikuttanut monometyylifumaraattialtistukseen kliinisesti merkittävästi. Näin ollen Vumerity voidaan ottaa ruoan kanssa tai ilman ruokaa (ks. kohta Annostus ja antotapa).
Jakautuminen
Diroksimeelifumaraatin annon jälkeen monometyylifumaraatin näennäinen jakautumistilavuus (Vd) terveillä tutkittavilla on 72–83 l. Monometyylifumaraatista sitoutuu ihmisen plasman proteiineihin alle 25 % eikä sitoutuminen ollut pitoisuudesta riippuvaista.
Biotransformaatio
Diroksimeelifumaraatti metaboloituu ihmisissä valtaosin kaikkialla ruoansulatuskanavassa, veressä ja kudoksissa olevien esteraasien välityksellä, ennen kuin se pääsee systeemiseen verenkiertoon. Diroksimeelifumaraatin esteraasimetabolia tuottaa pääasiassa sekä aktiivista metaboliittia monometyylifumaraattia että inaktiivista metaboliittia 2-hydroksietyylisukkinimidia (HES).
Monometyylifumaraatin metaboloituminen jatkuu edelleen esteraasien välityksellä, jota seuraa sitruunahappokierto, ilman sytokromi P450 (CYP) -järjestelmän osallistumista metaboliaan. Monometyylifumaraatista muodostuneet metaboliitit plasmassa ovat fumaarihappo, sitruunahappo ja glukoosi.
Eliminaatio
Monometyylifumaraatti eliminoituu pääasiassa uloshengitysilman hiilidioksidina ja virtsaan vain vähäisinä määrinä. Monometyylifumaraatin terminaalinen puoliintumisaika (t1/2) on noin 1 tunti, eikä monometyylifumaraattialtistuksesta plasmassa aiheutunut kertymistä annettaessa useita diroksimeelifumaraattiannoksia. Dimetyylifumaraattia koskevassa tutkimuksessa hiilidioksidin (CO2) uloshengityksen määritettiin olevan ensisijainen poistumisreitti, ja se kattaa noin 60 % annoksesta. Toissijaisia poistumisreittejä ovat munuaiset (15,5 % annoksesta) ja uloste (0,9 % annoksesta).
2-hydroksietyylisukkinimidi (HES) eliminoituu plasmasta siten, että t1/2 on 10,7–14,8 tuntia. 2‑hydroksietyylisukkinimidi (HES) eliminoituu pääasiassa virtsaan.
Lineaarisuus
Monometyylifumaraattialtistus suurenee suunnilleen suhteessa annokseen, kun annetaan yksi tai useampi tutkitun suuruinen annos (49–980 mg).
Farmakokinetiikka erityispotilasryhmillä
Paino on monometyylifumaraattialtistuksen tärkein kovariaatti, sillä Cmax- ja AUC-arvot suurenevat kevyemmillä tutkittavilla diroksimeelifumaraatin annon jälkeen. Vaikutusta kliinisissä tutkimuksissa käytettyihin turvallisuus- ja tehomittareihin ei havaittu. Näin ollen annosta ei tarvitse muuttaa painon perusteella.
Sukupuoli ja ikä eivät vaikuttaneet tilastollisesti merkitsevästi diroksimeelifumaraatin Cmax- ja AUC-arvoihin. Farmakokinetiikkaa ei ole tutkittu 65‑vuotiailla tai sitä vanhemmilla potilailla.
Pediatriset potilaat
Monometyylifumaraatin farmakokineettistä profiilia diroksimeelifumaraatin annon jälkeen ei ole tutkittu. Monometyylifumaraatin farmakokineettiset parametrit diroksimeelifumaraatin annon jälkeen korreloivat painon kanssa. Näin ollen on oletettavissa, että sama annos johtaa suurempaan altistukseen pediatrisilla potilailla, jotka painavat vähemmän kuin aikuiset. Dimetyylifumaraatin farmakokineettistä profiilia, kun valmistetta annettiin 240 mg kaksi kertaa vuorokaudessa, arvioitiin pienessä, avoimessa, kontrolloimattomassa tutkimuksessa aaltomaista (relapsoivaa-remittoivaa) MS-tautia (RRMS) sairastavilla 13–17-vuotiailla potilailla (n = 21). Dimetyylifumaraatin farmakokinetiikka näillä nuorilla potilailla oli samankaltainen aikuisilla potilailla aiemmin todetun kanssa.
Etninen tausta
Etnisellä taustalla ei ollut vaikutusta monometyylifumaraatin tai 2‑hydroksietyylisukkinimidin (HES) farmakokineettiseen profiiliin diroksimeelifumaraatin annon jälkeen.
Munuaisten vajaatoiminta
Tutkimuksessa, jossa tutkittiin munuaisten vajaatoiminnan vaikutusta diroksimeelifumaraatin farmakokineettiseen profiiliin, lievää (eGFR 60–89 ml/min/1,73 m2), keskivaikeaa (eGFR 30–59 ml/min/1,73 m2) tai vaikeaa munuaisten vajaatoimintaa (eGFR < 30 ml/min/1,73 m2) sairastavien potilaiden monometyylifumaraattialtistus ei muuttunut kliinisesti oleellisesti. 2‑hydroksietyylisukkinimidialtistus suureni kuitenkin munuaisten vajaatoiminnan yhteydessä 1,3- (lievä), 1,8- (keskivaikea) ja 2,7-kertaiseksi (vaikea munuaisten vajaatoiminta) (ks. kohta Haittavaikutukset). Diroksimeelifumaraatin pitkäaikaisesta käytöstä keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoitoon ei ole tietoja saatavissa (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoiminta
Koska diroksimeelifumaraatti ja monometyylifumaraatti metaboloituvat esteraasien välityksellä ilman sytokromi P450 (CYP) -järjestelmän osallistumista metaboliaan, farmakokinetiikkaa ei tutkittu maksan vajaatoimintaa sairastavilla potilailla (ks. kohta Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Prekliiniset tiedot turvallisuudesta
Toksikologia
Munuaistoksisuus ilmeni rotilla ja apinoilla munuaistiehyiden rappeutumisena / nekroosina ja regeneraationa, munuaistiehyiden hypertrofiana ja/tai interstitiaalisena fibroosina, munuaisten painon lisääntymisenä ja muutoksina kliinisissä patologiaparametreissa (virtsan määrä, ominaispaino ja munuaisvaurion biologiset merkkiaineet). Munuaisten haittavaikutuksia havaittiin kroonista toksikologiaa koskevissa tutkimuksissa monometyylifumaraattialtistuksella, joka vastasi diroksimeelifumaraatin suurimman ihmiselle suositellun annoksen (MRHD) AUC-arvoa.
Hiirten ja rottien maha-suolikanavan toksisuus koostui limakalvon hyperplasiasta ja hyperkeratoosista ei-rauhasmahassa (etumahassa) ja pohjukaissuolessa. Apinoilla huonoon siedettävyyteen maha-suolikanavassa liittyi tyypillisesti annosriippuvaista oksentelua, mahan ärtymistä, verenvuotoa ja tulehdusta sekä ripulia. Näitä löydöksiä ilmeni monometyylifumaraattialtistuksella, joka oli vähintään kaksinkertainen diroksimeelifumaraatin suurimman ihmiselle suositellun annoksen AUC-arvoon nähden.
Kolmella urosrotalla havaittiin 91 päivää kestäneessä toksisuustutkimuksessa sydäntulehdus ja sydämen nekroosi monometyylifumaraattialtistuksella, joka oli nelinkertainen diroksimeelifumaraatin suurimman ihmiselle suositellun annoksen AUC-arvoon nähden. Näitä sydänlöydöksiä havaittiin myös muissa toksisuustutkimuksissa rotilla, myös hoitamattomilla verrokeilla, mutta ei apinoilla. Näin ollen nämä sydäntulehdukset todennäköisesti edustavat rotilla yleisten taustaleesioiden pahenemista, jolla ei ole merkitystä ihmiselle.
Apinoilla havaittiin 91 päivää kestäneessä toksisuustutkimuksessa proksimaalisessa ja distaalisessa reisiluussa ja proksimaalisessa sääriluussa osittain palautuvaa kasvulevyn dysplasiaa monometyylifumaraattialtistuksella, joka oli 15-kertainen diroksimeelifumaraatin suurimman ihmiselle suositellun annoksen AUC-arvoon nähden. Luutoksisuus saattaa liittyä apinoiden esipuberteetti-ikään, koska luuston kehitys häiriintyi myös nuorilla rotilla (ks. jäljempänä), mutta pienemmät annokset eivät vaikuttaneet luustoon pitkäaikaisessa apinoilla tai kypsässä iässä olevilla aikuisilla rotilla tehdyssä tutkimuksessa. Luustolöydösten merkitys aikuispotilaille on hoitoannoksella vähäinen.
rasH2-hiirten villityypin poikueissa havaittiin kivestoksisuutta, johon sisältyi minimaalista ituepiteelin rappeutumista, isokokoisten esisiittiöiden lisääntynyttä ilmaantuvuutta, esisiittiöiden lievää vähenemistä tiehyiden epiteelissä ja kivesten painon vähenemistä. Nämä löydökset ilmenivät monometyylifumaraattialtistuksilla, jotka olivat 15-kertaisia diroksimeelifumaraatin suurimman ihmiselle suositellun annoksen AUC-arvoon nähden, mikä osoittaa, että hoitoannoksella merkitys ihmiselle on vähäinen.
Genotoksisuus
Diroksimeelifumaraatin in vitro- ja in vivo -tutkimuksissa ei todettu näyttöä kliinisesti oleellisesta genotoksisuudesta.
Karsinogeenisuus
Diroksimeelifumaraattia tutkittiin transgeenisessa biotestissä siirtogeenisillä rasH2-hiirillä ja 2 vuoden kestoisessa biotestissä rotilla. Diroksimeelifumaraatti ei ollut karsinogeeninen siirtogeenisillä hiirillä ja naarasrotilla, mutta se lisäsi urosrotilla kiveksen välisoluadenoomien ilmaantuvuutta annoksella 150 mg/kg/vrk (monometyylifumaraattialtistus oli noin kaksinkertainen suurimman ihmiselle suositellun annoksen AUC-arvoon nähden). Näiden löydösten merkitystä ihmisille aiheutuvan riskin kannalta ei tunneta.
Lisääntymis- ja kehitystoksisuus
Diroksimeelifumaraatti ei heikentänyt rotilla urosten tai naaraiden hedelmällisyyttä monometyylifumaraattialtistuksella, joka oli noin seitsenkertainen diroksimeelifumaraatin suurimman ihmiselle suositellun annoksen AUC-arvoon nähden.
Diroksimeelifumaraattia suun kautta organogeneesin aikana 40, 100 ja 400 mg/kg/vrk saaneilla rotilla havaittiin sikiöiden pienempiä painoja ja vaihtelua sikiön luuston luutumisessa emolle toksisilla diroksimeelifumaraattiannoksilla 400 mg/kg/vrk. Haittavaikutukseton altistustaso (NOAEL-taso) oli noin kaksinkertainen diroksimeelifumaraatin suurimmasta ihmiselle suositellusta annoksesta aiheutuvaan monometyylifumaraatin AUC-arvoon nähden.
Kaniineilla, joille annettiin 50, 150 ja 350 mg/kg/vrk diroksimeelifumaraattia suun kautta koko organogeneesin ajan, havaittiin annoksella ≥ 150 mg/kg/vrk luuston epämuodostumien lisääntymistä (nikaman keskiosan poikkeavuus, vaikea rintalastan virheasento sekä nikaman poikkeavuus ja siihen liittyvä kylkiluun poikkeavuus). Annoksella 350 mg/kg/vrk esiintyi myös enemmän vaihtelua luustossa, keskenmenoja, implantaation jälkeisiä keskenmenoja ja vastaavaa sikiön elinkelpoisuuden vähenemistä, mikä mahdollisesti liittyi emoon kohdistuvaan toksisuuteen. NOAEL-taso oli noin kaksinkertainen diroksimeelifumaraatin suurimmasta ihmiselle suositellusta annoksesta aiheutuvaan monometyylifumaraatin AUC-arvoon nähden. Luuston epämuodostumien merkitys ihmisen kannalta on toistaiseksi tuntematon.
Tutkimuksessa, joka koski kehitystä ennen syntymää ja syntymän jälkeen, tiineille rotille annettiin diroksimeelifumaraattia suun kautta annoksina 40, 100 tai 400 mg/kg/vrk tiineyden aikana synnytykseen saakka ja imetyksen aikana. Siinä havaittiin emon painon vähentyneen / painonkehityksen heikentyneen ja ruoankulutuksen vähentyneen, mihin liittyi poikasten syntymäpainon ja painon/painonkehityksen heikentyminen. NOAEL-taso oli noin kolminkertainen diroksimeelifumaraatin suurimmasta ihmiselle suositellusta annoksesta aiheutuvaan monometyylifumaraatin AUC-arvoon nähden.
Toksisuus nuorilla eläimillä
Nuorilla rotilla tehdyssä toksisuustutkimuksessa diroksimeelifumaraattia annettiin suun kautta 25. syntymän jälkeisestä päivästä 63. syntymän jälkeiseen päivään saakka, mikä vastaa ihmisillä aikaväliä noin 2–3-vuotiaasta murrosikään. Munuaisissa ja ei-rauhasmahassa havaitun kohde-elintoksisuuden lisäksi havaittiin luustoon kohdistuvia haittavaikutuksia, mukaan lukien reisiluun koon, massan ja tiheyden väheneminen ja muutokset luiden muodossa. Luihin liittyvien vaikutusten suhde vähentyneeseen painoon on mahdollinen, mutta suoran vaikutuksen osallisuutta ei voida poissulkea. NOAEL-taso oli noin 1,4-kertainen diroksimeelifumaraatin suurimmasta ihmiselle suositellusta annoksesta aiheutuvaan monometyylifumaraatin AUC-arvoon nähden. Luihin liittyvien löydösten merkitys aikuispotilaille on vähäinen. Merkitystä lapsipotilaille ei tunneta.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Metakryylihappo-etyyliakrylaattikopolymeeri (1:1) tyyppi A
Krospovidoni tyyppi A
Mikrokiteinen selluloosa
Vedetön kolloidinen piidioksidi
Trietyylisitraatti
Talkki
Magnesiumstearaatti
Kapselikuori
Hypromelloosi
Titaanidioksidi (E171)
Kaliumkloridi
Karrageeni
Kapselin painatus (musta muste)
Shellakka
Kaliumhydroksidi
Musta rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
32 kuukautta
Säilytys
Säilytä alle 25 °C.
Säilytä alkuperäisessä purkissa. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VUMERITY enterokapseli, kova
231 mg (L:ei) 120 kpl (974,62 €)
PF-selosteen tieto
HDPE-purkki, jossa on polypropeeninen turvasuljin ja silikageelikuivausaine.
Pakkauskoko:
Pakkaus sisältää 120 (1 purkki) tai 360 (3 purkkia) kovaa enterokapselia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen kapseli, koko 0 (noin 22 mm pitkä), jossa on mustalla musteella merkintä ”DRF 231 mg”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
VUMERITY enterokapseli, kova
231 mg 120 kpl
- Ylempi erityiskorvaus (100 %). Dimetyylifumaraatti, diroksimeelifumaraatti, glatirameeriasetaatti, interferoni beeta, ofatumumabi ja ponesimodi: Aaltoilevan tai aaltoilevaan läheisesti rinnastettavan MS-taudin hoito erityisin edellytyksin (157).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Dimetyylifumaraatti, diroksimeelifumaraatti, glatirameeriasetaatti, interferoni beeta, ofatumumabi ja ponesimodi: Aaltoilevan ja aaltoilevaan läheisesti rinnastettavan MS-taudin hoito erityisin edellytyksin (303).
ATC-koodi
L04AX09
Valmisteyhteenvedon muuttamispäivämäärä
05.09.2024
Yhteystiedot
Bertel Jungin aukio 5 C
02600 Espoo
0207 401 200
www.biogen.fi
www.MS-nyt.fi
