DEXAMETHASONE PHOSPHATE HAMELN injektioneste, liuos 4 mg/ml
Vaikuttavat aineet ja niiden määrät
1 ml liuosta sisältää 4,00 mg deksametasonifosfaattia (deksametasoninatriumfosfaattina).
2 ml liuosta sisältää 8,00 mg deksametasonifosfaattia (deksametasoninatriumfosfaattina).
Apuaineet, joiden vaikutus tunnetaan:
1 ml tätä lääkettä sisältää 20 mg propyleeniglykolia – katso kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet, Raskaus ja imetys ja Haittavaikutukset.
1 ml tätä lääkettä sisältää 0,42 mg natriumia – katso kohta Varoitukset ja käyttöön liittyvät varotoimet.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektio)
pH 7,5–8,7
Kliiniset tiedot
Käyttöaiheet
Systeeminen käyttö
Laskimoon tai lihakseen
Dexamethasone phosphate hameln -valmistetta suositellaan systeemiseen antoon injektiona laskimoon tai lihakseen, jos oraalinen hoito ei ole mahdollista tai toivottavaa seuraavien tilojen yhteydessä:
- Aivokasvaimen, neurokirurgisten toimenpiteiden, aivopaiseen tai bakteeriaivokalvotulehduksen aiheuttama aivojen turvotus
- Posttraumaattinen sokki ja posttraumaattisen äkillisen hengitysvaikeusoireyhtymän (ARDS) ehkäisy
- Koronavirustauti 2019 (COVID-19) Koronavirustaudin 2019 (COVID-19) hoito aikuisilla ja nuorilla potilailla (vähintään 12-vuotiailla ja vähintään 40 kg painavilla), jotka tarvitsevat täydentävää happihoitoa.
- Anafylaktinen sokki (hoidon alussa annetun adrenaliini-injektion jälkeen)
- Vaikea akuutti astmakohtaus
- Laaja-alaisten, akuuttien ja vaikeiden ihosairauksien, kuten erytrodermia, pemphigus vulgaris, akuutti ekseema, parenteraalinen aloitushoito
- Autoimmuunisairauksien, kuten systeeminen lupus erythematosus (erityisesti viskeraaliset muodot), parenteraalinen aloitushoito
- Vaikea, etenevä aktiivinen nivelreuma, esim. nopeasti tuhoavat muodot ja/tai nivelenulkoiset oireet
- Vaikeat tartuntataudit, joihin liittyy myrkytystiloja (esim. tuberkuloosi, lavantauti, bruselloosi) vain asianmukaisen infektion hoidon kanssa
- Pahanlaatuisten kasvainten palliatiivinen hoito
- Postoperatiivisen tai solunsalpaajahoidon aiheuttaman oksentelun ehkäisy ja hoito oksentelua hillitsevän hoidon yhteydessä
Ihon alle
- Pahanlaatuisten kasvainten palliatiivinen hoito sekä solunsalpaajahoidon aiheuttaman pahoinvoinnin ja oksentelun (CINV) ehkäisy ja hoito
Palliatiivisessa hoidossa Dexamethasone phosphate hameln -valmistetta voidaan antaa ihon alle potilaille, jotka saavat kortikosteroideja oireiden, kuten väsymyksen, ruokahaluttomuuden, hoitoon vastaamattoman pahoinvoinnin ja oksentelun, hoitoon tai liitännäisenä annettuna kivunhoitona sekä selkäytimen kompression tai kohonneen kallonsisäisen paineen oireenmukaiseen hoitoon (ks. kohta Annostus ja antotapa) vaihtoehtona annostelulle suun kautta, kun sitä ei voida käyttää tai se ei ole enää mahdollista.
Paikallinen käyttö
- Nivelensisäiset injektiot jatkuvaan tulehdukseen yhdessä tai useammassa nivelessä kroonisen tulehduksellisen nivelsairauden, aktivoituneen nivelrikon, humeroskapulaarisen periartriitin akuuttien muotojen yleisen hoidon jälkeen
- Infiltraatiohoito (kun se on ehdottomasti tarpeen) hoidettaessa ei-bakteeriperäistä jännetuppitulehdusta ja bursiittia, periartropatiaa ja insertionaalista tendinopatiaa
Annostus ja antotapa
Annostus
Annos on yksilöitävä taudin, taudin vaikeuden ja potilaan hoitovasteen mukaan. Yleensä tulisi käyttää suhteellisen suuria aloitusannoksia, ja akuuttien vaikeiden sairauksien hoitoon tarvitaan huomattavasti suurempia annoksia kuin kroonisissa sairauksissa.
Seuraavia annosteluohjelmia suositellaan:
Systeeminen käyttö
Laskimoon tai lihakseen
Aikuiset
- Aivojen turvotus
Aluksi 8–10 mg (enintään 80 mg) laskimoon (i.v.), sitten 16–24 mg (korkeintaan 48 mg) / päivä laskimoon (i.v.) 3–4 (6) yksittäisenä annoksena 4–8 päivän ajan. Dexamethasone phosphate hameln -valmisteen pitkäaikainen anto pienempinä annoksina voi olla tarpeen sädehoidon aikana ja osana leikkaukseen soveltumattomien aivokasvainten konservatiivista hoitoa.
Bakteeriaivokalvotulehduksen aiheuttama aivojen turvotus: 0,15 mg/kg 6 tunnin välein 4 päivän ajan.
- Posttraumaattinen sokki ja posttraumaattisen ARDS:n ehkäisy
Aluksi 40–100 mg laskimoon (i.v.) toistettuna 12 tunnin kuluttua. Vaihtoehtoisesti 16–40 mg 6 tunnin välein 2–3 päivän ajan.
- COVID-19:n hoito
6 mg laskimoon (i.v.) kerran päivässä enintään 10 päivän ajan. Hoidon kesto tulee päättää kliinisen vasteen ja potilaan yksilöllisten tarpeiden mukaan. Iäkkäät, munuaisten vajaatoimintaa sairastavat, maksan vajaatoimintaa sairastavat – annosta ei tarvitse muuttaa.
- Anafylaktinen sokki
40–100 mg laskimoon (i.v.) hoidon alussa laskimoon annetun adrenaliini-injektion jälkeen. Annos voidaan toistaa tarvittaessa.
- Vaikea akuutti astmakohtaus
8–20 mg laskimoon (i.v.) mahdollisimman aikaisessa vaiheessa. Injektio voidaan toistaa tarvittaessa 8 mg:n annoksella 4 tunnin välein. Lisäksi voidaan antaa laskimoon annettavaa aminofylliiniä.
- Akuutit ihosairaudet
8–40 mg:n annoksia päivittäin laskimoon (i.v.), yksittäisissä tapauksissa jopa 100 mg, jonka jälkeen hoitoa jatketaan suun kautta pienenevinä annoksina.
- Systeemisen reumaattisen taudin, kuten systeeminen lupus erythematosus, aktiiviset vaiheet.
Päivittäiset annokset 6–16 mg.
- Vaikea, etenevä aktiivinen nivelreuma
12–16 mg:n annoksia päivittäin nopeasti etenevän taudin hoitoon. Päivittäisiä 6–12 mg:n annoksia suositellaan nivelenulkoisten oireiden yhteydessä.
- Vaikea tartuntatauti, johon liittyy myrkytystiloja (esim. tuberkuloosi, lavantauti) vain infektion hoidon lisänä
4–20 mg:n annoksia päivittäin laskimoon (i.v.). Yksittäistapauksissa (esim. lavantauti) aluksi enintään 200 mg.
- Pahanlaatuisten kasvainten palliatiivinen hoito
Aluksi 8–16 mg/vrk, pidemmän hoidon yhteydessä 4–12 mg/vrk.
- Solunsalpaajahoidon aiheuttaman oksentelun ehkäisy ja hoito oksentelua hillitsevän hoidon yhteydessä
10–20 mg laskimoon (i.v.) kautta ennen solunsalpaajahoidon aloittamista, sen jälkeen tarvittaessa 2–3 kertaa päivässä 4–8 mg 1–3 päivän aikana (kohtalaisen paljon oksentelua aiheuttava hoito) tai jopa 6 päivän ajan (erittäin paljon oksentelua aiheuttava solunsalpaajahoito).
- Postoperatiivisen oksentelun ehkäisy ja hoito
Yksittäinen 8–20 mg:n annos laskimoon (i.v.) ennen leikkauksen aloittamista.
Ihon alle
- Pahanlaatuisten kasvainten palliatiivinen hoito, solunsalpaajahoidon aiheuttaman pahoinvoinnin ja oksentelun ehkäisy ja hoito (CINV)
Palliatiivisessa hoidossa Dexamethasone phosphate hameln -valmistetta voidaan antaa ihon alle injektiona tai jatkuvana ihonalaisena infuusiona (CSCI). Annokset vaihtelevat yleensä välillä 4,8 mg–19,3 mg 24 tunnin aikana, ottaen huomioon paikalliset kliiniset hoito-ohjeet, ja ne tulee titrata vasteen mukaan.
Pediatriset potilaat
- Bakteeriaivokalvotulehduksen aiheuttama aivojen turvotus
0,4 mg/kg lapsilla 12 tunnin välein 2 päivän ajan, aloitetaan ennen ensimmäistä antibioottien antamista.
- Posttraumaattinen sokki ja posttraumaattisen ARDS:n ehkäisy
Aluksi 40 mg laskimoon (i.v.) lapsilla, toistetaan 12 tunnin kuluttua.
- COVID-19:n hoito
12-vuotiaille ja sitä vanhemmille nuorille suositellaan annettavaksi 6 mg laskimoon (i.v.) kerran vuorokaudessa enintään 10 päivän ajan. Hoidon kesto tulee päättää kliinisen vasteen ja potilaan yksilöllisten tarpeiden mukaan.
- Anafylaktinen sokki
40 mg laskimoon (i.v.) lapsilla ensimmäisen laskimoon annetun adrenaliini-injektion jälkeen, annos voidaan toistaa tarvittaessa.
- Vaikea akuutti astmakohtaus
0,15–0,3 mg/kg laskimoon (i.v.) tai 1,2 mg/kg boluksena, minkä jälkeen 0,3 mg/kg 4–6 tunnin välein. Lisäksi voidaan antaa laskimoon annettavaa aminofylliiniä.
- Postoperatiivisen oksentelun ehkäisy ja hoito
0,15–0,5 mg/kg yli 2-vuotiailla lapsilla, maksimiannos 16 mg.
Dexamethasone phosphate hameln -valmistetta ei yleensä suositella käytettäväksi ennenaikaisten tai täysiaikaisten vastasyntyneiden hoidossa (ks. kohdat Vaikuttavat aineet ja niiden määrät ja Varoitukset ja käyttöön liittyvät varotoimet).
Dexamethasone phosphate hameln sisältää propyleeniglykolia (20 mg/ml), joten sitä tulee käyttää varoen imeväisten ja alle 5-vuotiaiden lasten hoidossa, varsinkin jos tarvitaan suuria annoksia tai harkitaan pitkäaikaista hoitoa (ks. kohdat Vaikuttavat aineet ja niiden määrät ja Varoitukset ja käyttöön liittyvät varotoimet).
Paikallinen käyttö
Paikalliseen infiltraatioon tai nivelensisäiseen antoon suositeltava tavallinen annos on 4–8 mg. Pienempään niveleen annettavaan injektioon tarvitaan yleensä pienempi 2 mg:n annos.
Käyttö maksan tai munuaisten vajaatoimintaa sairastavien potilaiden hoidossa
Tuotteen propyleeniglykolipitoisuuden vuoksi lääketieteellinen seuranta on tarpeen hoidettaessa potilaita, joilla on maksan tai munuaisten vajaatoiminta (ks. kohdat Vaikuttavat aineet ja niiden määrät ja Varoitukset ja käyttöön liittyvät varotoimet).
Jos potilaalla on kilpirauhasen vajaatoiminta tai maksakirroosi, suhteellisen pienet annokset voivat riittää tai annoksen pienentäminen voi olla tarpeen.
Antotapa
Käytön kesto riippuu käyttöaiheesta.
Dexamethasone phosphate hameln -valmistetta voidaan antaa sekoittamatta tai laimentamatta.
Laskimoon, lihakseen tai niveleen annettava injektio tai infiltraatio.
Dexamethasone phosphate hameln voidaan vaihtoehtoisesti lisätä ilman tehon menetystä 0,9-prosenttiseen natriumkloridiin, 5-prosenttiseen glukoosiin tai Ringerin liuokseen ja antaa infuusiona laskimoon:
- jatkuvasti tai jaksoittain tai tiputuksena aikuisille
- 15–20 minuutin aikana lapsille.
Palliatiivisessa hoidossa Dexamethasone phosphate hameln -valmistetta voidaan laimentaa 0,9-prosenttisella natriumkloridiliuoksella ja antaa jatkuvana ihonalaisena infuusiona (CSCI). Infuusioseokset on käytettävä 24 tunnin sisällä, ja on noudatettava tavanomaisia infuusioiden antamisessa käytettäviä aseptisia tekniikoita.
Nivelsisäinen injektio tulee antaa ehdottoman aseptisissa olosuhteissa. Yksi nivelensisäinen injektio yleensä riittää oireiden lievittämiseen. Jos lisäinjektio katsotaan tarpeelliseksi, se tulee antaa aikaisintaan 3–4 viikkoa ensimmäisen jälkeen. Injektioiden määrä niveltä kohti tulisi rajoittaa 3–4 injektioon. Erityisesti kunkin peräkkäisen injektion antamisen jälkeen lääkärin pitää tutkia kyseinen nivel.
Paikallinen infiltraatio tulisi suorittaa ehdottoman aseptisissa olosuhteissa voimakkaimman kivun tai jänteen kiinnittymiskohtien alueelle. Varovaisuutta tulee noudattaa sen suhteen, että injektiota ei anneta suoraan jänteeseen. Lyhyin väliajoin annettavia injektioita tulisi välttää.
Jos yksittäiseen hoitoon tarvitaan suuria annoksia, on harkittava sellaisten deksametasonilääkkeiden käyttöä, joiden vahvuudet/tilavuus ovat suurempia.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen laimentamiseen ennen lääkkeen antoa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Paikallinen nivelensisäinen injektio: infektio nivelessä tai hoidettavan nivelen välittömässä läheisyydessä, bakteerin aiheuttama niveltulehdus, epävakaat nivelet, verenvuotohäiriöt (spontaanit tai antikoagulanttien käytöstä aiheutuvat), periartikulaarinen kalkkiutuminen, avaskulaarinen luukuolio, jänteen repeämä, Charcot’n nivel.
- Paikallinen infiltraatio: antokohdan infektio, jota ei ole aiemmin hoidettu infektiolääkkeillä.
Varoitukset ja käyttöön liittyvät varotoimet
Yksittäisillä potilailla Dexamethasone phosphate hameln -valmisteen antamisen jälkeen on havaittu vaikeita anafylaktisia reaktioita, joihin liittyy verenkierron vajaatoiminta, sydämenpysähdys, rytmihäiriöitä, bronkospasmi ja/tai verenpaineen lasku tai nousu.
Immunosuppression vuoksi Dexamethasone phosphate hameln -hoito voi johtaa bakteeri-, virus-, lois- ja sieni-infektioiden ja opportunististen infektioiden riskin suurenemiseen. Olemassa olevan tai kehittyvän infektion oireet voivat peittyä, mikä vaikeuttaa diagnoosia. Latentit infektiot, kuten tuberkuloosi tai hepatiitti B, voivat aktivoitua uudelleen.
Jos Dexamethasone phosphate hameln -hoidon aikana ilmenee epätavallisen stressaavia tilanteita tai fyysistä stressiä (trauma, kirurginen toimenpide, synnytys jne.), annoksen väliaikainen suurentaminen voi olla tarpeen.
Systeemisten kortikosteroidien käyttöä ei tule lopettaa potilailla, joita hoidetaan jo systeemisillä (suun kautta otettavilla) kortikosteroideilla muista syistä (esim. potilaat, joilla on keuhkoahtaumatauti), mutta jotka eivät tarvitse lisähappea.
Erityiset varotoimet:
Hoitoa Dexamethasone phosphate hameln -valmisteella tulisi harkita vain, jos se on ehdottoman välttämätöntä, ja yhdessä kohdennetun infektiolääkkeen käytön kanssa seuraavien sairauksien yhteydessä:
- Akuutit virusinfektiot (hepatiitti B , herpes zoster, herpes simplex, vesirokko, herpeskeratiitti)
- HBsAg-positiivinen krooninen aktiivinen hepatiitti
- Noin 8 viikkoa ennen eläviä taudinaiheuttajia sisältävien rokotteiden antamista ja 2 viikkoa niiden antamisen jälkeen
- Systeemiset sieni-infektiot
- Loisinfektiot (esim. sukkulamatot)
- Jos potilaalla epäillään tai on vahvistettu strongyloidiaasi (lankamatotartunta), glukokortikoidit voivat johtaa loisten aktivaatioon ja laajamittaiseen lisääntymiseen
- Poliomyeliitti
- Lymfadeniitti calmetterokotuksen jälkeen
- Akuutit ja krooniset bakteeri-infektiot
- Jos potilaalla on aiemmin ollut tuberkuloosi, käytä vain tuberkulostaattisen suojauksen kanssa
Hoitoa Dexamethasone phosphate hameln -valmisteella tulisi harkita vain, jos se on ehdottoman välttämätöntä, ja yhdessä täsmällisen lisähoidon kanssa seuraavien sairauksien yhteydessä:
- Ruoansulatuskanavan haavaumat
- Osteoporoosi
- Vaikea sydämen vajaatoiminta
- Huonossa/riittämättömässä hoitotasapainossa oleva verenpaine
- Huonossa/puutteellisessa hoitotasapainossa oleva diabetes mellitus
- Psykiatrinen sairaus (mukaan lukien sairauden aiempi historia), mukaan lukien itsemurhataipumukset. Neurologista tai psykiatrista seurantaa suositellaan.
- Ahdaskulmaglaukooma ja avokulmaglaukooma. Silmälääkärin seurantaa ja samanaikaista glaukoomahoitoa suositellaan.
- Sarveiskalvon haavaumat ja sarveiskalvon vammat. Silmälääkärin seurantaa ja samanaikaista hoitoa suositellaan.
Näköhäiriöt
Kortikosteroidien systeemisen ja paikallisen käytön yhteydessä voi esiintyä näköhäiriöitä. Jos potilaalla on oireina esimerkiksi näön hämärtymistä tai muita näköhäiriöitä, tulisi harkita potilaan lähettämistä silmälääkäriin mahdollisten syiden arvioimiseksi. Näihin kuuluvat kaihi, glaukooma tai harvinaiset sairaudet, esim. sentraalinen seroosi korioretinopatia (CSC), joita on raportoitu systeemisten tai paikallisten kortikosteroidien käytön jälkeen.
Suolen perforaation riskin vuoksi Dexamethasone phosphate hameln -valmistetta voidaan käyttää vain, jos se on ehdottoman välttämätöntä, ja huolellinen seuranta on varmistettava, jos potilaalla on samanaikaisesti joku seuraavista tiloista:
- Vaikea haavainen paksusuolitulehdus, johon liittyy perforaation riski, mahdollisesti myös ilman vatsakalvon ärsytystä
- Divertikuliitti
- Enteroanastomoosit (heti leikkauksen jälkeen)
Feokromosytoomakriisi
Feokromosytoomakriisi voi johtaa kuolemaan, ja sitä on raportoitu systeemisten kortikosteroidien annon jälkeen. Kortikosteroideja saa antaa potilaille, joilla on todettu tai joilla epäillään olevan feokromosytooma, vain asianmukaisen riski-hyötyarvion jälkeen.
Vatsakalvon ärsytyksen merkit maha-suolikanavan perforaation jälkeen voivat puuttua potilailla, jotka saavat suuria glukokortikoidiannoksia.
Dexamethasone phosphate hameln -hoidon aikana diabeetikoilla tulee ottaa huomioon insuliinin tai suun kautta otettavien diabeteslääkkeiden lisääntynyt tarve.
Dexamethasone phosphate hameln hoidon aikana, erityisesti kun käytetään suuria annoksia ja potilailla on huonossa hoitotasapainossa oleva verenpainetauti, verenpaineen säännölliset mittaukset ovat tarpeen.
Potilaita, joilla on vaikea sydämen vajaatoiminta, on seurattava huolellisesti, koska tilan heikkenemisen vaara on olemassa.
Bradykardian riski on olemassa, jos käytetään suuria deksametasoniannoksia.
Vakavia anafylaktisia reaktioita voi myös esiintyä.
Jänteeseen liittyvien oireiden, jännetulehduksen ja jänteiden repeämien riski suurenee, kun fluorokinolonia ja glukokortikoideja annetaan samanaikaisesti.
Olemassa oleva myasthenia gravis voi pahentua Dexamethasone phosphate hameln- hoidon aikana.
Potilaalle voidaan periaatteessa antaa inaktivoituja (tapettuja) taudinaiheuttajia sisältäviä rokotteita. On kuitenkin otettava huomioon, että immuunivaste ja siten rokotuksen onnistuminen voivat heikentyä, jos käytetään suurempia kortikosteroidiannoksia.
Jos käytetään suuria kortikosteroidiannoksia, on varmistettava riittävä kaliumin saanti ja natriumin rajoittaminen ruokavaliossa voi olla tarpeen. Seerumin kaliumpitoisuutta on seurattava.
Yhteiskäytön CYP3A:n estäjien, mukaan lukien kobisistaattia sisältävät tuotteet, odotetaan suurentavan systeemisten haittavaikutusten riskiä. Yhdistelmää tulisi välttää, ellei hyöty ole suurempi kuin systeemisten kortikosteroidien haittavaikutusten suurentunut riski, jolloin potilaita tulee seurata systeemisten kortikosteroidien haittavaikutusten varalta.
Kun Dexamethasone phosphate hameln -valmisteen antoa on jatkettu yli 10 vuorokauden ajan, sen käytön äkillinen lopettaminen voi johtaa perussairauden pahenemiseen tai uusiutumiseen ja akuutin lisämunuaisen vajaatoiminnan / kortisonin vieroitusoireyhtymän ilmenemiseen. Siksi annosta on pienennettävä hitaasti, kun hoidon keskeyttäminen on odotettavissa.
Joidenkin virustautien, kuten vesirokon tai tuhkarokon, kulku voi olla erityisen vakava glukokortikoideilla hoidettavilla potilailla. Riski on erityisen suuri immunosuppressiopotilailla, joista ei tiedetä varmasti, ovatko he sairastaneet vesirokon tai tuhkarokon. Jos nämä potilaat joutuvat kosketuksiin tuhkarokkoa tai vesirokkoa sairastavien henkilöiden kanssa Dexamethasone phosphate hameln -hoidon aikana, ehkäisevä hoito on aloitettava tarvittaessa.
Valmisteen markkinoille tulon jälkeen tuumorilyysioireyhtymää (TLS) on raportoitu potilailla, joilla on hematologisia pahanlaatuisia kasvaimia pelkkää deksametasonia tai deksametasonia ja muita kemoterapia-aineita sisältävän hoidon jälkeen. Potilaita, joilla on suurin TLS:n riski, kuten potilaita, joilla solut lisääntyvät nopeasti, joilla on suuri kasvaintaakka ja jotka ovat erityisen herkkiä sytotoksisille aineille, tulee seurata tarkoin ja ryhtyä asianmukaisiin varotoimiin.
Laskimoon annettaessa injektio tulee antaa hitaasti 2–3 minuutin kuluessa. Jos injektio annetaan liian nopeasti, voi esiintyä lyhyitä ja pohjimmiltaan vaarattomia haittavaikutuksia eli epämiellyttävää pistelyä tai parestesioita, jotka kestävät enintään 3 minuuttia.
Dexamethasone phosphate hameln -valmiste on tarkoitettu vain lyhytaikaiseen käyttöön. Jos tätä lääkevalmistetta annetaan pitkään, on otettava huomioon / harkittava muita varoituksia ja varotoimia, jotka koskevat pitkäaikaiseen käyttöön tarkoitettuja glukokortikoideja sisältäviä lääkevalmisteita.
Valmisteen paikallisen käytön jälkeen mahdolliset systeemiset haittavaikutukset ja yhteisvaikutukset on otettava huomioon.
Glukokortikoidien nivelensisäinen anto suurentaa nivelinfektioiden riskiä. Glukokortikoidien pitkäaikainen ja toistuva käyttö kantavissa nivelissä voi johtaa kulumiseen liittyvien vaurioiden pahenemiseen, mikä johtuu nivelen mahdollisesta ylikuormituksesta kivun tai muiden oireiden vähenemisen jälkeen.
Lapset ja nuoret
Lasten kasvuvaiheessa Dexamethasone phosphate hameln -hoidon hyöty-haittatasapainoa on harkittava huolellisesti.
Ennenaikaiset vastasyntyneet
Saatavilla oleva näyttö viittaa pitkäaikaisiin hermoston kehitykseen liittyviin haittatapahtumiin, kun keskosten kroonista keuhkosairautta on hoidettu varhaisessa vaiheessa (< 96 tuntia) aloitusannoksilla 0,25 mg/kg kahdesti päivässä.
Hypertrofinen kardiomyopatia
Hypertrofisesta kardiomyopatiasta on tehty ilmoituksia ennenaikaisesti syntyneillä vauvoilla, joille on annettu systeemisesti kortikosteroideja, mukaan lukien deksametasonia. Suurimmassa osassa ilmoitettuja tapauksia haittavaikutus korjaantui, kun hoito lopetettiin. Systeemisesti deksametasonilla hoidettavien keskosten sydämen toimintaa ja rakennetta on arvioitava ja seurattava (kohta Haittavaikutukset).
Propyleeniglykolipitoisuus
Valmisteen propyleeniglykolipitoisuuden (20 mg/ml) vuoksi varovaisuutta on noudatettava, kun käytetään suuria Dexamethasone phosphate hameln -annoksia imeväisten ja alle 5-vuotiaiden lasten hoidossa ja/tai hoitoa jatketaan pitkään (ks. kohdat Vaikuttavat aineet ja niiden määrät ja Annostus ja antotapa). Seuraavilla pediatristen potilaiden ryhmillä on erityisesti propyleeniglykolitoksisuuden kehittymisen riski:
- Vastasyntyneet (alle 4 viikon ikäiset vauvat)
Dexamethasone phosphate hameln -valmistetta ei suositella käytettäväksi ennenaikaisten tai täysiaikaisten vastasyntyneiden hoidossa. Huolellisen yksilöllisen arvioinnin jälkeen tuotetta voidaan kuitenkin harkita vastasyntyneelle, jos terveydenhuollon ammattilaisen mielestä / lääkärin harkinnan mukaan tuotteen käytön edut ovat suuremmat kuin mahdolliset riskit.
Kun vastasyntyneiden hoidossa tarvitaan Dexamethasone phosphate hameln -annoksia, jotka ovat suurempia kuin 0,05 ml/kg/vrk, vastaava propyleeniglykoliannos voi ylittää turvallisuusrajan 1 mg/kg/vrk. Tämän turvallisuusrajan ylittäminen vastasyntyneillä voi aiheuttaa vakavia haittavaikutuksia, kun valmistetta annetaan samanaikaisesti minkä tahansa alkoholidehydrogenaasin substraatin, kuten etanolin, kanssa varsinkin jos heille annetaan muita propyleeniglykolia tai alkoholia sisältäviä lääkkeitä. Huolellinen lääketieteellinen seuranta toksisuuden merkkien varalta on tarpeen.
- Imeväiset (yli 4 viikon ikäiset lapset) ja alle 5-vuotiaat lapset
Kun tarvitaan Dexamethasone phosphate hameln -annoksia, jotka ovat suurempia kuin 2,5 ml/kg/vrk, vastaava propyleeniglykoliannos voi ylittääturvallisuusrajan 50 mg/kg/vrk. Propyleeniglykolin samanaikainen anto annoksella 50 mg/kg/vrk ja sitä suuremmilla annoksilla samanaikaisesti minkä tahansa alkoholidehydrogenaasin substraatin (kuten etanolin) kanssa voi aiheuttaa vakavia haittavaikutuksia imeväisille ja alle 5-vuotiaille lapsille, varsinkin jos heille annetaan muita propyleeniglykolia tai alkoholia sisältäviä lääkkeitä. Dexamethasone phosphate hameln -valmistetta tulee siksi käyttää varoen tässä potilasryhmässä.
Lasten kasvuvaiheessa Dexamethasone phosphate hameln -hoidon hyöty-haittatasapaino on harkittava huolellisesti.
Iäkkäät potilaat
Koska iäkkäillä potilailla on suurempi osteoporoosin riski, Dexamethasone phosphate hameln -hoidon hyöty-haittatasapaino on punnittava huolellisesti.
Maksan ja munuaisten vajaatoiminta
Tuotteen propyleeniglykolipitoisuuden takia lääketieteellistä seurantaa tulee toteuttaa usein, kun potilaalla on munuaisten vajaatoimintaa tai maksan vajaatoimintaa, koska on raportoitu erilaisia propeeniglykoliin liittyviä haittavaikutuksia, kuten munuaisten toimintahäiriö (akuutti tubulaarinen nekroosi), akuutti munuaisten vajaatoiminta ja maksan toimintahäiriö (ks. kohdat Vaikuttavat aineet ja niiden määrät ja Annostus ja antotapa). Päivittäinen altistuminen propyleeniglykolille ei näillä potilailla saisi ylittää määrää 50 mg/kg, mikä vastaa annosta 2,5 ml/kg/vrk Dexamethasone phosphate hameln -valmistetta.
Dexamethasone phosphate hameln -valmisteen käyttö voi johtaa positiivisiin tuloksiin dopingtesteissä.
Natrium
Tämä lääkevalmiste sisältää korkeintaan 1,9 mmol (43 mg) natriumia lääkkeen suurinta sallittua kerta-annosta kohden (350 mg henkilölle, jonka paino on 70 kg), mikä vastaa 2,15 %:a WHO:n suosittelemasta 2 g:n päivittäisestä aikuisen suurimmasta sallitusta natriumannoksesta.
Yhteisvaikutukset
Ruoansulatuskanavan haavaumien ja verenvuodon riski on suurentunut, kun valmistetta käytetään yhdessä steroideihin kuulumattomien tulehduskipulääkkeiden (NSAID), salisylaattien ja indometasiinin kanssa.
Glukokortikoidien puoliintumisaika voi pidentyä, kun niitä käytetään estrogeenien (esim. ovulaation estäjien) kanssa, ja siksi kortikoidien vaikutus voi voimistua.
CYP3A4:ää indusoivat lääkkeet, kuten fenytoiini, barbituraatit, karbamatsepiini, primidoni ja rifampisiini, voivat lisätä kortikosteroidien metabolista puhdistumaa, mikä johtaa veriarvojen pienenemiseen ja fysiologisen aktiivisuuden vähenemiseen, annosta voidaan joutua muuttamaan.
CYP3A4:n estäjät (mukaan lukien ketokonatsoli, itrakonatsoli ja kobisistaatti) voivat vähentää deksametasonin puhdistumaa, mikä voi johtaa vaikutuksen lisääntymiseen ja glukokortikoidilamaan/Cushingin oireyhtymään. Yhdistelmän käyttöä tulisi välttää, ellei hyöty ole suurempi kuin systeemisten kortikosteroidien haittavaikutusten lisääntynyt riski. Tässä tapauksessa potilaita tulee seurata systeemisten kortikosteroidivaikutusten varalta.
Efedriini voi lisätä glukokortikoidien metaboliaa ja siten vähentää niiden vaikutusta.
Samanaikainen angiotensiinikonvertaasin (ACE) estäjien käyttö saattaa suurentaa verenkuvan muutosten riskiä.
Kortikosteroidit voivat kiihdyttää digoksiinin (sydänglykosidit) toksisuutta elektrolyyttien epätasapainon (kaliumin puutos) vaikutuksesta.
Kun kortikosteroideja annetaan samanaikaisesti kaliumia heikentävien diureettien tai laksatiivien kanssa, potilaita tulee tarkkailla tarkoin siltä varalta, että heille kehittyy hypokalemia lisääntyneen kaliumin erityksen vuoksi.
Kumariiniantikoagulanttien tehoa voi muuttua samanaikaisen kortikosteroidihoidon aikana. Protrombiiniaika on tarkistettava usein potilailla, jotka saavat kortikosteroideja ja kumariiniantikoagulantteja samanaikaisesti, jotta vältetään spontaani verenvuoto. Antikoagulantin annoksen muuttaminen voi olla tarpeen samanaikaisen käytön aikana.
Kortikosteroidit estävät hypoglykeemisten aineiden (myös insuliinin) toivottuja vaikutuksia.
Jos glukokortikoideja käytetään samanaikaisesti atropiinin tai muiden antikolinergisten aineiden kanssa, silmänpaine voi nousta.
Pitkäaikaista lihasten rentoutumista voi ilmetä, kun glukokortikoidien kanssa samanaikaisesti käytetään ei-depolarisoivia lihasrelaksantteja.
Kortikosteroidit voivat vähentää pratsikvantelin pitoisuutta veressä.
Myopatioiden ja kardiomyopatioiden riski on lisääntynyt, kun deksametasonia käytetään samanaikaisesti klorokiinin, hydroksiklorokiinin ja meflokiinin kanssa.
Protireliinin käytön jälkeen kilpirauhasta stimuloivan hormonin (TSH) nousua voidaan vähentää.
Kun valmistetta käytetään samanaikaisesti muiden immunosuppressanttien kanssa, alttius infektioille on lisääntynyt ja latenttien infektioiden paheneminen tai ilmeneminen on mahdollista. Lisäksi käyttö yhdessä siklosporiinin kanssa lisää siklosporiinin pitoisuutta veressä ja suurentaa aivokohtausten riskiä.
Samanaikainen käyttö fluorokinolonien kanssa suurentaa jänteisiin liittyvien oireiden riskiä.
Ihoreaktiot allergiatesteissä voivat estyä.
Raskaus ja imetys
Raskaus
Deksametasoni läpäisee istukan.
Raskauden aikana, erityisesti ensimmäisen kolmanneksen aikana, deksametasonin käyttöä voidaan harkita vasta huolellisen hyötyjen ja haittojen arvioinnin jälkeen. Kortikosteroideja tulisi määrätä vain, kun äidille ja lapselle koituvat hyödyt ovat suuremmat kuin riskit.
Jos kortikosteroideja käytetään pitkiä aikoja tai toistuvasti raskauden aikana, ne voivat suurentaa kohdunsisäisen kasvun hidastumisen riskiä.
Tutkimuksissa on osoitettu, että vastasyntyneiden hypoglykemian riski on suurentunut, kun kortikosteroideja, myös deksametasonia, on annettu lyhytaikaisesti raskauden aikana naisille, joilla oli myöhäisen ennenaikaisen synnytyksen riski.
Kortikosteroidien anto raskaana oleville eläimille voi aiheuttaa sikiön kehityksen poikkeavuuksia, mukaan lukien suulakihalkio, kohdunsisäisen kasvun hidastuminen ja vaikutukset aivojen kasvuun ja kehitykseen. Ei ole näyttöä siitä, että kortikosteroidit lisäisivät synnynnäisiä poikkeavuuksia, kuten kitalaki- tai huulihalkioita ihmisellä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Jos glukokortikoideja annetaan raskauden lopussa, sikiöllä on lisämunuaiskuoren surkastumisen riski, mikä saattaa vaatia asteittain lopetettavaa korvaushoitoa vastasyntyneillä.
Dexamethasone phosphate hameln sisältää propyleeniglykolia. Vaikka propyleeniglykolin ei ole osoitettu aiheuttavan lisääntymis- tai kehitystoksisuutta eläimillä tai ihmisillä, sitä voi päästä sikiöön. Dexamethasone phosphate hameln -valmistetta on käytettävä varoen raskauden aikana. Steroidihoidon ja propyleeniglykolin antamisen mahdolliset hyödyt ja hoitoon liittyvät riskit on arvioitava huolellisesti yksilöllisesti.
Imetys
Deksametasoni erittyy rintamaitoon. Vauvoille ei ole koskaan raportoitu aiheutuneen haittaa.
Dexamethasone phosphate hameln -valmistetta tulee käyttää varoen imettävillä naisilla vain silloin, kun se on ehdottoman välttämätöntä. Hoidon mahdolliset hyödyt ja siihen liittyvät riskit on arvioitava huolellisesti yksilöllisesti.
Jos sairauden hoitoon tarvitaan suurempia annoksia, imetys on keskeytettävä.
Dexamethasone phosphate hameln -valmiste sisältää propyleeniglykolia, jota havaittiin myös rintamaidossa. Vaikka propyleeniglykolin ei ole osoitettu aiheuttavan lisääntymis- tai kehitystoksisuutta eläimillä ja ihmisillä, imettävien naisten on käytettävä Dexamethasone phosphate hameln -valmistetta varoen. Steroidihoidon ja propyleeniglykolin antamisen mahdolliset hyödyt ja hoitoon liittyvät riskit on arvioitava huolellisesti yksilöllisesti.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Dexamethasone phosphate hameln -valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn; sama koskee työtä vaarallisessa ympäristössä.
Haittavaikutukset
Haittavaikutusten riski on pieni lyhytaikaisen deksametasonihoidon aikana. Lyhytaikaisessa ja suuriannoksisessa parenteraalisessa hoidossa on kuitenkin otettava huomioon elektrolyyttimuutosten, turvotusten, mahdollisen verenpaineen nousun, sydämen vajaatoiminnan, sydämen rytmihäiriöiden tai kouristuskohtausten riski, ja myös infektion kliinisiin oireisiin on varauduttava. Lääkäreiden tulee ottaa huomioon glukoositoleranssin heikkeneminen sekä maha-suolikanavan haavaumien mahdollisuus; jotka liittyvät usein stressiin ja voivat olla suhteellisen oireettomia kortikosteroidihoidon aikana.
Ennakoitavien haittavaikutusten ilmaantuvuus, mukaan lukien hypotalamus-aivolisäke-lisämunuaisakselin suppressio, korreloi lääkkeen suhteellisen voimakkuuden, annoksen, antamisen ajankohdan ja hoidon keston kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutusten esiintymistiheys on lueteltu seuraavan käytännön mukaisesti:
Hyvin yleinen (≥1/10)
Yleinen (≥ 1/100, <1/10)
Melko harvinainen (≥ 1/1000, <1/100)
Harvinainen (≥1/10000, < 1/1000)
Hyvin harvinainen (<1/10000)
Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin)
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
| Infektiot | Tuntematon | Infektioiden peittyminen, virusinfektioiden, sieni-infektioiden, bakteeri-, lois- ja opportunististen infektioiden ilmeneminen, paheneminen tai uudelleen aktivoituminen, strongyloidiaasin aktivaatio(ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). |
| Veri ja imukudos | Tuntematon | Keskivaikea leukosytoosi, lympfosytopenia, eosinopenia, polysytemia. |
| Immuunijärjestelmä | Tuntematon | Yliherkkyysreaktiot (esim. lääkkeen aiheuttama eksanteema), vaikeat anafylaktiset reaktiot, kuten rytmihäiriöt, bronkospasmit, hypertensio tai hypotensio, verenkierron romahdus, sydämenpysähdys, immuunijärjestelmän heikkeneminen. |
| Umpieritys | Tuntematon | Cushingin oireyhtymä (tyypilliset oireet: kuukasvot, liikalihavuus vatsan alueella ja pletora), lisämunuaisen suppressio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). |
Aineenvaihdunta ja ravitsemus | Tuntematon | Natriumpitoisuus ja turvotus, lisääntynyt kaliumin menetys (varo rytmihäiriöitä), painonnousu, glukoositoleranssin heikkeneminen, diabetes mellitus, hyperkolesterolemia ja hypertriglyseridemia, ruokahalun lisääntyminen. |
| Psyykkiset häiriöt | Tuntematon | Masennukset, ärtymys, euforia, lisääntynyt tarmo, psykoosit, mania, hallusinaatiot, tunne-elämän horjuminen, ahdistuneisuuden tunteet, unihäiriöt, itsemurhataipumus. |
| Hermosto | Tuntematon | Aivojen valekasvain, latentin epilepsian ilmeneminen, kohtauksen todennäköisyyden lisääntyminen tiedossa olevan epilepsian yhteydessä. |
| Silmät | Tuntematon | Kaihi, johon liittyy erityisesti takakapselin alaista samentumaa, glaukooma, sarveiskalvon haavauman oireiden paheneminen, lisääntyneen virus-, sieni- ja bakteeri-infektion riski silmässä, sarveiskalvon bakteeritulehdusten paheneminen, riippuluomi, mydriaasi, kemoosi, hoidosta aiheutuva kovakalvon perforaatio, korioretinopatia. Harvinaisissa tapauksissa korjaantuva eksoftalmus. Näön hämärtyminen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet). |
| Sydän | Tuntematon | Hypertrofinen kardiomyopatia ennenaikaisesti syntyneillä vauvoilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). |
| Verisuonisto | Tuntematon | Hypertensio, arterioskleroosin ja tromboosin riskin suureneminen, vaskuliitti (myös vieroitusoireyhtymänä pitkäaikaisen hoidon jälkeen), lisääntynyt kapillaarien hauraus. |
| Ruoansulatuselimistö | Tuntematon | Maha-suolikanavan haavaumat, maha-suolikanavan verenvuodot, haimatulehdus, mahalaukun oireet. |
| Iho ja ihonalainen kudos | Tuntematon | Punaiset arpijuovat, atrofia, teleangiektasia, petekiat, mustelmat, runsaskarvaisuus, steroidiakne, ruusufinnin kaltainen ihotulehdus (suun ympärillä), muutokset ihon pigmentaatiossa. |
| Luusto, lihakset ja sidekudos | Tuntematon | Myopatia, lihasatrofia ja -heikkous, steroidimyopatia, osteoporoosi (annoksesta riippuvainen, mahdollinen myös lyhyen hoidon jälkeen), aseptinen luukuolio, jänteisiin liittyvät oireet, tendiniitti, jänteen repeämä, epiduraalinen lipomatoosi, kasvun estyminen lapsilla. |
| Sukupuolielimet ja rinnat | Tuntematon | Sukupuolihormonien erityksen häiriöt (aiheuttavat epäsäännöllisiä kuukautisia, kuukautisten puuttumista, amenorreaan, hirsutismia ja impotenssia). |
| Yleisoireet ja antopaikassa todettavat haitat | Tuntematon | Haavan paranemisen viivästyminen. |
Paikallinen käyttö:
Paikalliset ärsytykset ja intoleranssit ovat mahdollisia (lämmön tunne, suhteellisen jatkuva kipu). Ihon atrofian ja ihonalaisen kudoksen atrofian kehittymistä injektiokohdassa ei voida sulkea pois, jos kortikosteroideja ei pistetä varovasti nivelonteloon.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet:
Deksametasonin akuutteja myrkytyksiä ei ole koskaan raportoitu. Kroonisen yliannostuksen yhteydessä on odotettavissa haittavaikutusten voimistumista (ks. kohta Haittavaikutukset), erityisesti umpierityksessä, aineenvaihdunnassa ja elektrolyyttitasapainossa.
Vastalääkettä ei ole saatavilla. Hoitoa ei todennäköisesti ole tarkoitettu kroonisen myrkytyksen aiheuttamiin reaktioihin, ellei potilaalla ole tilaa, joka tekisi potilaasta epätavallisen alttiin kortikosteroidien haittavaikutuksille. Tällöin oireenmukainen hoito on aloitettava tarpeen mukaan.
Anafylaktisia ja yliherkkyysreaktioita voidaan hoitaa adrenaliinilla, ylipainetekohengityksellä ja aminofylliinillä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Glukokortikoidit, ATC-koodi: H02AB02
Farmakodynaamiset vaikutukset
Deksametasoni on monofluorattu glukokortikoidi, jolla on merkittäviä allergian oireita ehkäiseviä, tulehdusta ehkäiseviä ja kalvoa stabiloivia ominaisuuksia ja se vaikuttaa hiilihydraatti-, proteiini- ja rasva-aineenvaihduntaan.
Deksametasonilla on muiden perustason glukokortikoidien vaikutuksia, ja se kuuluu luokkansa aktiivisimpiin jäseniin.
Deksametasonilla on noin 7,5 kertaa suurempi glukokortikoidivaikutus kuin prednisolonilla ja prednisonilla, ja sen vaikutus on 30 kertaa voimakkaampi kuin hydrokortisonin; mineralokortikoidivaikutuksia ei ole.
Glukokortikoidien, kuten deksametasonin, biologinen vaikutus johtuu kortikosteroidiherkkien geenien transkription aktivaatiosta. Tulehdusta estävät, immunosuppressiiviset ja antiproliferatiiviset vaikutukset saadaan aikaan muiden mekanismien ohella tulehduksenvälittäjäaineiden muodostumisen, vapautumisen ja aktiivisuuden vähenemisellä sekä spesifisten toimintojen ja tulehdussolujen migraation estolla. Lisäksi kortikosteroidien avulla herkistyneiden T-lymfosyyttien ja makrofagien vaikutus kohdesoluihin voidaan ehkäistä.
Jos pitkäaikainen kortikosteroidilääkitys on välttämätöntä, on otettava huomioon, että se voi mahdollisesti saada aikaan ohimenevän lisämunuaisen vajaatoiminnan. Hypotalamus-aivolisäke-lisämunuaisakselin suppressiivisuus riippuu osittain yksittäisistä tekijöistä.
Kliininen teho ja turvallisuus – COVID-19
Kliininen teho
RECOVERY-tutkimus (Randomised Evaluation of COVid-19 thERapY)1 on tutkijalähtöinen, yksilöllisesti satunnaistettu, kontrolloitu, avoin, adaptiivinen alustatutkimus, jossa arvioidaan potentiaalisten hoitojen vaikutuksia COVID-19:n takia sairaalassa hoidettavilla potilailla.
Tutkimus tehtiin 176 sairaalaorganisaatiossa Isossa-Britanniassa.
Kaikkiaan 6425 potilasta satunnaistettiin saamaan joko deksametasonia (2104 potilasta) tai tavallista hoitoa pelkästään (4321 potilasta). Potilaista 89 %:lla oli laboratoriossa vahvistettu SARS-CoV-2-infektio.
Satunnaistamisen yhteydessä 16 % potilaista sai invasiivistä hengityskonehoitoa tai ECMO-hoitoa (veren kehonulkoinen happeuttaminen), 60 % pelkästään happea (non-invasiivisen ventilaation kanssa tai ilman sitä) ja 24 % ei saanut kumpaakaan.
Potilaiden keski-ikä oli 66,1 +/- 15,7 vuotta. Potilaista 36 % potilaista oli naisia. Potilaista 24 %:lla potilaista oli aiemmin todettu diabetes, 27 %:lla sydänsairaus ja 21 %:lla krooninen keuhkosairaus.
1www.recoverytrial.net
Ensisijainen päätetapahtuma
Kuolleisuus päivän 28 kohdalla oli deksametasoniryhmässä merkitsevästi pienempi kuin tavallisen hoidon ryhmässä. Kuolemia raportoitiin 482 tapausta deksametasoniryhmän 2104 potilaasta (22,9 %) ja 1110 tapausta tavallisen hoidon ryhmän 4321 potilaasta (25,7 %) (määräsuhde 0,83; 95 %:n luottamusväli [LV], 0,75–0,93; P < 0,001).
Deksametasoniryhmässä kuolemien esiintyminen oli vähäisempää kuin tavallisen hoidon ryhmässä invasiivista hengityskonehoitoa saavilla potilailla (29,3 % vs. 41,4 %; määräsuhde, 0,64; 95 %:n luottamusväli, 0,51–0,81) ja potilailla, jotka saavat lisähappea ilman invasiivistä hengityskonehoitoa (23,3 % vs. 26,2 %; määräsuhde, 0,82; 95 %:n luottamusväli, 0,72–0,94).
Deksametasonilla ei ollut selkeää vaikutusta niiden potilaiden hoidossa, jotka eivät saaneet mitään hengitystukea satunnaistamisen yhteydessä (17,8 % vs. 14,0 %; määräsuhde, 1,19; 95 %:n luottamusväli, 0,91–1,55).
Toissijaiset päätetapahtumat
Deksametasoniryhmän potilaiden sairaalahoidon kesto oli lyhyempi kuin tavallisen hoidon ryhmän potilaiden (mediaani, 12 päivää vs. 13 päivää) ja suurempi todennäköisyys kotiutukseen elossa 28 päivän kuluessa (määräsuhde, 1,10; 95 %:n luottamusväli, 1,03–1,17).
Ensisijaisen päätetapahtuman mukaisesti suurin vaikutus kotiutukseen 28 päivän kuluessa havaittiin potilailla, jotka saivat invasiivistä hengityskonehoitoa satunnaistamisen yhteydessä (määräsuhde 1,48; 95 %:n luottamusväli 1,16, 1,90), ja seuraavaksi suurin vaikutus oli pelkästään happea saaneessa ryhmässä (määräsuhde 1,15; 95:n luottamusväli 1,06–1,24). Hyötyä ei havaittu olevan potilaille, jotka eivät saaneet happea (määräsuhde 0,96; 95 %:n luottamusväli 0,85–1,08).
| Tulokset | Deksametasoni (N = 2104) | Tavallinen hoito (N = 4321) potilaiden määrä/kokonais-määrä (%) | Määräsuhde tai riskisuhde (95 %:n luottamusväli)* |
| Ensisijainen tulos | |||
| Kuolleisuus päivän 28 kohdalla | 482/2104 (22,9) | 1110/4321 (25,7) | 0,83 (0,75–0,93) |
| Toissijaiset tulokset | |||
| Kotiutettu 28 päivän kuluessa | 1413/2104 (67,2) | 2745/4321 (63,5) | 1,10 (1,03–1,17) |
| Invasiivinen hengityskonehoito tai kuolema † | 456/1780 (25,6) | 994/3638 (27,3) | 0,92 (0,84–1,01) |
| Invasiivinen hengityskonehoito | 102/1780 (5,7) | 285/3638 (7,8) | 0,77 (0,62–0,95) |
| Kuolema | 387/1780 (21,7) | 827/3638 (22,7) | 0,93 (0,84–1,03) |
* Määräsuhteet on mukautettu iän mukaan 28 päivän kuolleisuuden ja sairaalahoidon tuloksiin nähden. Riskisuhteet on mukautettu iän mukaan invasiivisen hengityskonehoidon tai kuoleman ja sen osien suhteen.
† Tähän luokkaan eivät kuulu potilaat, jotka saivat invasiivistä hengityskonehoitoa satunnaistamisen yhteydessä.
Turvallisuus
Tutkimushoitoon liittyi neljä vakavaa haittatapahtumaa (SAE): kaksi hyperglykemiatapausta, yksi steroidien aiheuttama psykoositapaus ja yksi ruoansulatuskanavan yläosan verenvuoto. Kaikki tapahtumat olivat korjautuvia.
Alaryhmäanalyysit
Deksametasonin kohdentamisen vaikutukset 28 päivän kuolleisuuteen satunnaistamisen yhteydessä iän ja saadun hengitystuen mukaan 2
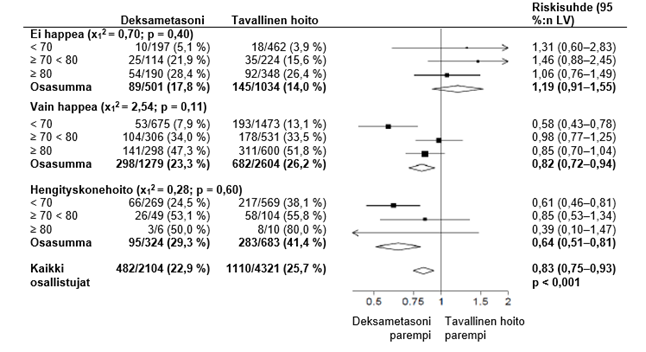
Deksametasonin kohdistamisen vaikutukset 28 päivän kuolleisuuteen satunnaistamisen yhteydessä saadun hengitystuen mukaan ja mikä tahansa aiempi krooninen sairaus.3
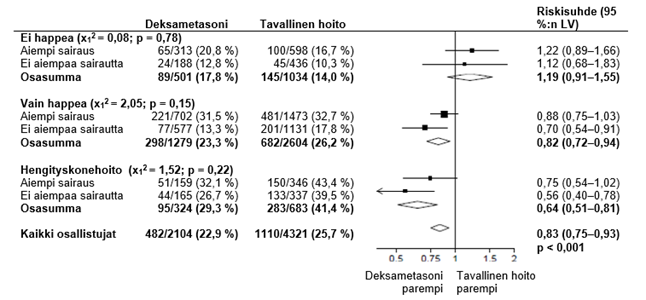
2, 3 (lähde: Horby P. ym., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1 ; doi: https://doi.org/10.1101/2020.06.22.20137273)
Farmakokinetiikka
Jakautuminen
Deksametasoni sitoutuu plasman proteiineihin vähemmän kuin useimmat muut kortikosteroidit, arviolta noin 77-prosenttisesti. Deksametasoni sitoutuu plasman proteiineihin annosriippuvaisesti. Hyvin suuria annoksia käytettäessä suurin osa deksametasonista kiertää vapaasti veressä. Hypoalbuminemian yhteydessä sitoutumattoman (aktiivisen) kortikoidin osuus kasvaa. Kun ihmisille annettiin laskimoon radioaktiivisesti merkittyä deksametasonia, deksametasonin maksimipitoisuuksia mitattiin aivo-selkäydinnesteestä; pitoisuus oli noin 1/6 vastaavasta pitoisuudesta plasmassa. Deksametasonin puoliintumisaika plasmassa on noin 190 minuuttia.
Deksametasonin biologinen puoliintumisaika on yli 36 tuntia, joten se on yksi erittäin pitkävaikutteisista glukokortikoideista. Pidentyneen vaikutuksen vuoksi jatkuvien päivittäisten annosten käyttö voi siten johtaa deksametasonin kertymiseen elimistöön ja yliannostukseen.
Eliminaatio
Deksametasonin eliminaation puoliintumisaika (seerumissa) aikuisilla on keskimäärin noin 250 minuuttia (+ 80 minuuttia).
Erittyminen tapahtuu pääosin munuaisten kautta vapaan deksametasonialkoholin muodossa. Jonkin verran aineenvaihduntaa tapahtuu, ja metaboliitit erittyvät pääasiassa glukuronaatteina tai sulfaatteina, samoin suurelta osin munuaisten kautta. Enintään 65 % annoksesta erittyy virtsaan 24 tunnissa. Munuaisten toiminnan häiriöt eivät vaikuta olennaisesti deksametasonin eliminaatioon. Toisaalta eliminaation puoliintumisaika pitenee vakavan maksasairauden yhteydessä.
Prekliiniset tiedot turvallisuudesta
Akuutti toksisuus:
Deksametasonin LD50 yhden suun kautta otetun annoksen jälkeen ensimmäisten 7 päivän aikana hiirillä on 16 g painokiloa kohden ja rotilla on yli 3 g painokiloa kohden. Yhden ihon alle annetun annoksen jälkeen LD50 hiirillä on yli 700 mg painokiloa kohden ja rotilla noin 120 mg painokiloa kohden ensimmäisten 7 päivän aikana. Kun arvoja seurattiin 21 päivän ajan, arvot laskevat, minkä tulkitaan olevan seurausta vakavista infektioista aiheutuneista sairauksista, jotka johtuvat hormonien aikaansaamasta immunosuppressiosta.
Krooninen toksisuus:
Kroonisesta toksisuudesta ihmisillä tai eläimillä ei ole tietoa. Kortikoidien aiheuttamia myrkytysoireita ei ole koskaan raportoitu. Suhteellisen pitkäaikaisessa hoidossa, jossa annokset ovat yli 1,5 mg/vrk, voidaan odottaa merkittäviä sivuvaikutuksia (ks. kohta Haittavaikutukset).
Mutageeniset ja karsinogeeniset vaikutukset:
Saatavilla olevat glukokortikoideja koskevat tutkimustuloksista ei ole näyttöä kliinisesti merkityksellisistä genotoksisista ominaisuuksista.
Lisääntymistoksisuus:
Kokeellisissa eläinkokeissa suulakihalkioita havaittiin rotilla, hiirillä, hamstereilla, kaneilla, koirilla ja kädellisillä, mutta ei hevosilla tai lampailla. Joissakin tapauksissa näihin poikkeavuuksiin liittyi keskushermoston ja sydämen vikoja. Kädellisissä havaittiin altistuksen jälkeen muutoksia aivojen alueella. Lisäksi kohdunsisäinen kasvu voi hidastua. Kaikkia näitä vaikutuksia havaittiin suurten annosten antamisen yhteydessä.
Ympäristöriskien arviointi (ERA):
Deksametasonin endokriinisen vaikutusmekanismin perusteella ei voida sulkea pois vesieliöille aiheutuvaa riskiä (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Propyleeniglykoli
Dinatriumedetaatti
Natriumhydroksidi (pH: n säätämiseen)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Deksametasoni on fyysisesti yhteensopimaton daunorubisiinin, doksorubisiinin, vankomysiinin, difenhydramiinin (loratsepaamin ja metoklopramidin kanssa) ja metaraminolibitartraatin kanssa, eikä sitä saa sekoittaa näitä lääkkeitä sisältäviin liuoksiin. Se on myös yhteensopimaton ruiskussa olevan doksapraamin ja glykopyrrolaatin kanssa sekä siprofloksasiinin, idarubisiinin ja midatsolaamin kanssa Y-kohdan injektioissa (seos 1:1).
Deksametasonin yhteensopivuustiedot, kun valmistetta annetaan jatkuvasti 24 tunnin ajan ihon alle annettavan injektion ruiskun ohjaimen kautta:
- Yhteensopiva metoklopramidin ja morfiinin kanssa
- Mahdollinen yhteensopimattomuus oktreotidin (somatostatiinianalogi) kanssa
- Saostuu seuraavien kanssa: syklitsiini, midatsolaami, haloperidoli, levomepromatsiini.
Kestoaika
Avaamattomat ampullit: 2 vuotta
Avatut ampullit: Tuote on käytettävä heti ensimmäisen avaamisen jälkeen.
Laimennettu liuos:
Laimennosten kemiallinen ja fysikaalinen käytönaikainen säilyvyys on osoitettu 24 tunnin ajan 25 °C:ssa. Mikrobiologiselta kannalta valmiste tulisi käyttää välittömästi. Jos sitä ei käytetä välittömästi, käytönaikaiset säilytysajat ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla, eivätkä ne normaalisti saa ylittää 24 tuntia 2–8 °C:ssa, ellei laimennus ole tapahtunut kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä alle 25 °C. Ei saa jäätyä.
Pidä ampulli ulkopakkauksessa. Herkkä valolle.
Säilytysolosuhteet lääkevalmisteen ensimmäisen avaamisen tai laimentamisen jälkeen, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DEXAMETHASONE PHOSPHATE HAMELN injektioneste, liuos
4 mg/ml (L:ei) 10 x 1 ml (14,63 €)
PF-selosteen tieto
Väritön neutraali lasi tyypin I OPC-ampullit (one-point-cut), nimellistilavuus 1 ml tai 2 ml.
Pakkaus sisältää 5 tai 10 ampullia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas ja väritön liuos, jossa ei ole näkyviä hiukkasia.
Käyttö- ja käsittelyohjeet
Kun Dexamethasone phosphate hameln -valmistetta annetaan infuusiona laskimoon, laimennusaineina suositellaan käytettäväksi glukoosia (5 %), natriumkloridia (0,9) % ja Ringerin liuosta. Deksametasonin tarkka pitoisuus infuusiosäiliötä kohden tulisi määrittää halutun annoksen, potilaan nesteen saannin ja tarvittavan tippumisnopeuden perusteella.
Palliatiivisessa hoidossa Dexamethasone phosphate hameln -valmistetta voidaan laimentaa natriumkloridilla ja antaa jatkuvana ihonalaisena infuusiona (CSCI).
Liuos on tarkastettava silmämääräisesti ennen käyttöä. Käytä vain kirkkaita liuoksia, joissa ei ole hiukkasia.
Vain kertakäyttöön.
Tämä lääkevalmiste voi aiheuttaa riskin ympäristölle. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
DEXAMETHASONE PHOSPHATE HAMELN injektioneste, liuos
4 mg/ml 10 x 1 ml
- Ei korvausta.
ATC-koodi
H02AB02
Valmisteyhteenvedon muuttamispäivämäärä
10.10.2024
Yhteystiedot
Inselstraße 1
31787 Hameln
Germany
www.hameln-pharma.com
quality@hameln-pharma.fi
