MYRELEZ injektioneste, liuos, esitäytetty ruisku 60 mg, 90 mg, 120 mg
Vaikuttavat aineet ja niiden määrät
Lanreotidiasetaatti vastaten 60 mg, 90 mg tai 120 mg lanreotidia
Jokaisessa esitäytetyssä ruiskussa on ylisaturoitunutta lanreotidiasetaattiliuosta vastaten 0,246 mg lanreotidiemästä/mg liuosta, mikä tuottaa injisoitavat annokset 60 mg, 90 mg tai 120 mg lanreotidia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos, esitäytetty ruisku.
Kliiniset tiedot
Käyttöaiheet
Myrelez on tarkoitettu:
- Akromegalian hoitoon potilaille, joilla veren kasvuhormoni (GH)- ja/tai insuliinin kaltaisen kasvutekijä-1:n (IGF-1) pitoisuudet pysyvät epänormaaleina leikkauksen ja/tai sädehoidon jälkeen, tai jotka muutoin tarvitsevat lääkehoitoa.
- Gastroenteropankreaattisten neuroendokriinisten kasvainten (GEP-NET), gradus 1 ja tietyt gradus 2 (Ki-67-indeksi enintään 10 %), hoitoon aikuisilla silloin, kun kasvain on saanut alkunsa keskisuolesta, haimasta tai tuntemattomasta paikasta ja lähtökohta takasuolesta on poissuljettu eikä kasvainta voida leikata ja se on levinnyt paikallisesti tai metastasoinut (katso kohta Farmakodynamiikka).
- Neuroendokriinisiin kasvaimiin (etenkin karsinoidikasvaimiin) liittyvien oireiden hoitoon.
Annostus ja antotapa
Annostus
Akromegalia
Suositeltu aloitusannos on 60–120 mg kerta-annoksena joka 28. päivä.
Annosta voidaan muuttaa potilaan vasteen (joka arvioidaan oirekuvan ja/tai biokemiallisen vaikutuksen perusteella) tai potilaan mahdollisen somatostatiinianalogien käyttöön liittyvän kokemuksen mukaan.
Esimerkiksi potilaille, joita aiemmin on hoidettu lanreotidin 30 mg:n annoksella joka 14. päivä, Myrelez-valmisteen aloitusannos on 60 mg joka 28. päivä. Potilaille, joita aiemmin on hoidettu lanreotidin 30 mg:n annoksella joka 10. päivä, Myrelez-valmisteen aloitusannos on 90 mg joka 28. päivä.
Aloitusannoksen jälkeen annos määritetään yksilöllisesti hoitovasteen mukaan (oireiden väheneminen ja/tai kasvuhormonin (GH) ja/tai IGF-1:n pitoisuuksien lasku).
Potilaille, joiden kliiniset oireet ja biokemialliset parametrit eivät korjaudu riittävästi, Myrelez-valmisteen annosta voidaan suurentaa enintään annokseen 120 mg joka 28. päivä.
Kun hoitovaste on saavutettu (GH-pitoisuus alle 1 ng/ml, normalisoitunut IGF-1:n pitoisuus ja/tai oireiden katoaminen), annosta voidaan pienentää.
Somatostatiinianalogilla hyvässä kontrollissa olevia potilaita voidaan hoitaa Myrelez 120 mg:lla joka 42.–56. päivä (6-8 viikon välein).
Pitkäaikainen oireiden sekä GH- ja IGF-1-pitoisuuksien seuranta pitää toteuttaa kaikkien potilaiden kohdalla.
Gastroenteropankreaattisten neuroendokriinisten kasvainten (GEP-NET), gradus 1 ja tietyt gradus 2 (Ki-67-indeksi enintään 10 %), hoito aikuisilla silloin, kun kasvain on saanut alkunsa keskisuolesta, haimasta tai tuntemattomasta paikasta ja lähtökohta takasuolesta on poissuljettu eikä kasvainta voida leikata ja se on levinnyt paikallisesti tai metastasoinut
Suositeltu annos on yksi Myrelez 120 mg injektio joka 28. päivä. Hoitoa jatketaan niin kauan kuin on tarpeen kasvaimen kasvun hallitsemiseksi.
Neuroendokriinisiin kasvaimiin liittyvien oireiden hoito
Suositeltu aloitusannos on 60–120 mg kerta-annoksena joka 28. päivä.
Annosta sovitetaan sen mukaan, kuinka oireet lievittyvät.
Munuaisten ja/tai maksan vajaatoiminta
Munuaisten tai maksan vajaatoimintaa sairastavilla ei tarvitse muuttaa annosta, koska lanreotidilla on suuri terapeuttinen leveys (katso kohta Farmakokinetiikka).
Iäkkäät potilaat
Iäkkäillä potilailla ei tarvitse muuttaa annosta, koska lanreotidilla on suuri terapeuttinen leveys (katso kohta Farmakokinetiikka).
Pediatriset potilaat
Myrelez-valmistetta ei suositella lapsille ja nuorille, koska turvallisuutta ja tehoa lasten ja nuorten hoidossa ei ole varmistettu.
Antotapa
Myrelez annetaan syvänä ihonalaisena injektiona pakaran ylä-ulkoneljännekseen tai ulkoreiden yläosaan.
Jos potilaan saama Myrelez-annos on vakio, potilas itse tai muu henkilö voi antaa valmisteen, jos valmisteen antoa varten on annettu asianmukainen koulutus. Jos potilas antaa injektion itse, injektio pitää antaa ulkoreiden yläosaan.
Terveydenhuollon ammattilainen tekee päätöksen siitä, voiko potilas itse tai valmisteen antoon koulutettu henkilö antaa valmisteen.
Riippumatta antopaikasta ihoa ei pidä puristaa poimulle ja neula tulee työntää nopeasti koko pituudeltaan kohtisuorasti ihoon.
Injektiopaikkaa pitää vaihdella oikean ja vasemman puolen kesken.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, somatostatiinille tai samansukuisille peptideille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Lanreotidi saattaa heikentää sappirakon motiliteettia ja aiheuttaa sappikivien muodostumista. Tämän vuoksi potilaita tulee seurata ajoittain. Valmisteen markkinoille tulon jälkeen lanreotidia saavilla potilailla on ilmoitettu sappikivien muodostumista ja siitä aiheutuvia komplikaatioita, kuten sappirakkotulehdusta, sappitietulehdusta ja haimatulehdusta, jotka ovat edellyttäneet sappirakon poistoa. Jos epäillään sappikivitautiin liittyviä komplikaatioita, lopetetaan lanreotidihoito ja potilasta hoidetaan asianmukaisesti.
Eläimillä ja ihmisellä suoritetut farmakologiset tutkimukset osoittavat, että lanreotidi estää somatostatiinin ja muiden somatostatiinianalogien tavoin insuliinin ja glukagonin erittymistä. Tästä johtuen lanreotidilla hoidetuilla potilailla saattaa esiintyä hypoglykemiaa tai hyperglykemiaa. Verensokeriarvoja tulee seurata lanreotidihoitoa aloitettaessa tai annostusta muutettaessa ja diabeteksen hoitoa tulee muuttaa vastaavasti.
Lievää kilpirauhasen toiminnan heikkenemistä on havaittu akromegaliapotilailla lanreotidihoidon aikana, mutta kliininen hypotyreoosi on harvinainen (< 1 %). Kilpirauhasen toimintakokeita suositellaan kliinisen tarpeen mukaan.
Lanreotidi voi alentaa sykettä potilailla, joilla ei ole sydänongelmia, mutta se ei välttämättä aiheuta bradykardiaa. Potilailla, joilla on todettu sydänsairaus ennen lanreotidihoitoa, voi esiintyä sinusbradykardiaa. Tarkkuutta on noudatettava, kun lanreotidilla aletaan hoitaa potilaita, joilla on bradykardia (katso kohta Yhteisvaikutukset).
Yhteisvaikutukset
Lanreotidin farmakologiset gastrointestinaaliset vaikutukset saattavat vähentää samanaikaisesti otettujen lääkkeiden, mm. siklosporiinin imeytymistä suolesta. Siklosporiinin ja lanreotidin samanaikainen käyttö voi vähentää siklosporiinin hyötyosuutta ja siksi voi olla tarpeen muuttaa siklosporiinin annosta terapeuttisen pitoisuuden ylläpitämiseksi.
Yhteisvaikutukset plasmaan runsaasti sitoutuneiden lääkkeiden kanssa ovat epätodennäköisiä, koska lanreotidi sitoutuu vain kohtalaisesti plasman proteiineihin.
Vähäisen julkaistun tiedon mukaan samanaikainen somatostatiinianalogien ja bromokriptiinin antaminen voi lisätä bromokriptiinin hyötyosuutta.
Samanaikainen bradykardiaa aiheuttavien lääkkeiden (esimerkiksi beetasalpaajat) antaminen voi aiheuttaa lanreotidin kanssa additiivisen sydämen sykettä alentavan vaikutuksen. Tämänkaltaisten samanaikaisesti käytettävien lääkkeiden annoksen muuttaminen voi olla tarpeen.
Vähäinen julkaistu tieto viittaa siihen, että somatostaniinianalogit voivat vähentää sytokromi P450- järjestelmän kautta metaboloituvien aineiden metabolista puhdistumaa, mikä saattaa johtua kasvuhormonin suppressiosta. Koska ei voida sulkea pois mahdollisuutta, että lanreotidilla on tämänlaista vaikutusta, muita pääosin CYP3A4:n kautta metaboloituvia ja kapean terapeuttisen leveyden omaavia lääkkeitä (esim. kinidiini, terfenadiini) pitää käyttää varoen.
Raskaus ja imetys
Raskaus
Lanreotidin käytöstä raskaana oleville naisille on vain vähän tietoja (alle 300 raskaudesta).
Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta, mutta teratogeenisia vaikutuksia ei ole havaittu (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta.
Varmuuden vuoksi Myrelez-valmisteen käyttöä on vältettävä raskauden aikana.
Imetys
Tämän lääkkeen kulkeutumista äidinmaitoon ei tunneta.
Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. Myrelez-valmistetta ei pidä käyttää imetyksen aikana.
Hedelmällisyys
Naarasrotilla havaittiin GH:n erityksen estymisestä johtuvaa fertiliteetin alenemista pitoisuuksilla, jotka olivat suurempia kuin ihmisillä hoitoannoksilla saavutettavat pitoisuudet.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Myrelez-valmisteella on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Tutkimuksia vaikutuksista ajokykyyn ja koneidenkäyttökykyyn ei ole tehty.
Myrelez-valmisteen käytön aikana on kuitenkin ilmoitettu huimausta (ks. kohta Haittavaikutukset). Jos potilaalla on oireita, hänen ei pidä ajaa autoa tai käyttää koneita.
Haittavaikutukset
Kliinisissä tutkimuksissa akromegaliaa ja GEP-NET-kasvaimia sairastavien, lanreotidilla hoidettujen potilaiden raportoimat haittavaikutukset on lueteltu elinjärjestelmittäin seuraavan luokittelun mukaisesti:
Hyvin yleinen (≥ 1/10); Yleinen (≥ 1/100,< 1/10); Melko harvinainen (≥ 1/1 000, < 1/100); Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Todennäköisimmät lanreotidihoidosta aiheutuvat haittavaikutukset ovat ruoansulatuselimistön häiriöt (useimmin raportoituja ovat ripuli ja vatsakipu, jotka tavallisesti ovat lieviä tai keskivaikeita ja ohimeneviä), sappikivitauti (usein oireeton) ja pistospaikan reaktiot (kipu, kyhmyt ja kovettumat).
Haittavaikutusprofiili on samankaltainen kaikissa käyttöaiheissa.
| Elinjärjestelmä | Hyvin yleinen (≥ 1/10) | Yleinen (≥ 1/100, < 1/10) | Melko harvinainen (≥ 1/1 000, < 1/100) | Markkinoille tulon jälkeiset tiedot turvallisuudesta (yleisyys tuntematon) |
| Infektiot | Injektiokohdan abskessi | |||
| Aineenvaihdunta ja ravitsemus | Hypoglykemia, ruokahalun väheneminen**, hypergykemia, diabetes mellitus | |||
| Psyykkiset häiriöt | Unettomuus* | |||
| Hermosto | Huimaus, päänsärky*, letargia** | |||
| Sydän | Sinus bradycardia* | |||
| Verisuonisto | Kuumat aallot* | |||
| Ruoansulatuselimistö | Ripuli, löysät ulosteet*, vatsakipu | Pahoinvointi, oksentelu, ummetus, ilmavaivat, vatsan pingotus, vatsavaivat*, dyspepsia, rasvaripuli** | Värjäytyneet ulosteet* | Haimatulehdus |
| Maksa ja sappi | Sappikivitauti | Sappiteiden laajeneminen* | Sappirakkotulehdus, sappitietulehdus | |
| Luusto, lihakset ja sidekudos | Luu-lihaskipu** lihassärky** | |||
| Iho ja ihonalainen kudos | Alopesia, niukkakarvaisuus* | |||
| Yleisoireet ja antopaikassa todettavat haitat | Astenia, väsymys, pistoskohdan reaktiot (kipu, kyhmy, kovettuma, kutina) | |||
| Tutkimukset | Kohonneet ALAT-arvot*, poikkeavat ASAT-arvot*, poikkeavat ALAT-arvot*, veren bilirubiinin lisääntyminen*, veren glukoosin lisääntyminen*, glykosyloituneen hemoglobiinin lisääntyminen*, painon lasku, haimaentsyymien väheneminen** | Kohonneet ASAT-arvot*, veren alkalisen fosfataasin lisääntyminen*, poikkeavat veren bilirubiiniarvot*, veren natriumin väheneminen* | ||
| Immuunijärjestelmä | Allergiset reaktiot (mukaan lukien angioedeema, anafylaksia, yliherkkyys) |
* perustuu akromegaliapotilaille tehtyihin tutkimuksiin
** perustuu GEP-NET-potilaille tehtyihin tutkimuksiin
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Mahdollisen yliannostuksen hoito on oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Aivolisäkkeen ja hypotalamuksen hormonit sekä analogit, somatostatiini ja sen analogit, ATC-koodi: H01C B03
Vaikutusmekanismi
Lanreotidi on oktapeptidi, joka on peräisin endogeenisesta somatostatiinista. Se on somatostatiinin tavoin useiden endokriinisten, neuroendokriinisten, eksokriinisten ja parakriinisten toimintojen inhibiittori. Lanreotidi sitoutuu hyvin ihmisen somatostatiinireseptoreihin (SSTR) 2 ja 5 ja heikommin ihmisen somatostatiinireseptoreihin 1, 3 ja 4. Vaikutuksen ihmisen somatostatiinireseptoreihin 2 ja 5 uskotaan olevan kasvuhormoni-inhibition ensisijainen mekanismi. Lanreotidi on tehokkaampi ja sen vaikutusaika on pitempi kuin luonnollisen somatostatiinin.
Somatostatiinin tavoin lanreotidi estää eksokriinista eritystä, mukaan lukien motiliinin eli mahan inhibitorisen peptidin ja haiman polypeptidin basaalieritystä, mutta sillä ei ole merkittävää vaikutusta paaston aikaiseen sekretiinin tai gastriinin eritykseen. Lisäksi se pienentää kromograniini A:n pitoisuutta plasmassa ja 5-HIAA:n (5-hydroksi-indoliasetaattihappo) pitoisuutta virtsassa GEP-NET-potilailla, joilla näiden kasvainmerkkiaineiden pitoisuudet ovat suurentuneet. Lanreotidi estää merkittävästi ruuan aiheuttamaa valtimoveren virtausta ylemmässä suoliliepeessä ja porttilaskimon verenvirtausta. Lanreotidi vähentää merkittävästi prostaglandiini E1:n stimuloimaa veden, natriumin, kaliumin ja kloridin eritystä tyhjäsuolesta (jejunum). Lanreotidi alentaa pitkäaikaishoidossa olevien akromegaliapotilaiden prolaktiinitasoja.
Avoimessa tutkimuksessa annettiin lanreotidia 120 mg joka 28. päivä 48 viikon ajan 90:lle aikaisemmin hoitamattomalle akromegaliapotilaalle, joilla oli aivolisäkkeen makroadenooma.
Kasvaimen tilavuus pieneni 63 %:lla potilaista ≥ 20 % (95 % CI: 52 %–73 %). Viikolla 48 kasvainten tilavuuden keskimääräinen prosentuaalinen pieneneminen oli 26,8 %. Kasvuhormonitasot olivat alle 2,5 μg/l 77,8 %:lla potilaista ja IGF-1 -tasot normalisoituivat 50 %:lla. Normalisoituneet IGF-1 -tasot yhdessä alle 2,5 μg/l kasvuhormonitasojen kanssa todettiin 43,5 %:lla potilaista. Useimmat potilaat ilmoittivat akromegalian oireiden, kuten väsymyksen, liikahikoilun, nivelkipujen ja pehmytkudoksen turvotuksen vähenemisestä. Kasvainten tilavuuden sekä varhainen että jatkuva pieneneminen kuten myös kasvuhormonin ja IGF-1:n pitoisuuksien aleneminen olivat nähtävissä viikosta 12 eteenpäin. Tutkimukseen ei otettu mukaan potilaita, joiden oletettiin tarvitsevan leikkauksen tai sädehoitoa aivolisäkkeeseen tutkimusjakson aikana.
Satunnaistetussa kaksoissokkoutetussa lumekontrolloidussa 96 viikkoa kestäneessä faasin III monikeskustutkimuksessa lanreotidia annettiin potilaille, joilla oli gastroenteropankreaattisia neuroendokriinisiä kasvaimia lanreotidin antiproliferatiivisen vaikutuksen arvioimiseksi.
Potilaat satunnaistettiin suhteessa 1:1 saamaan joko lanreotidia 120 mg joka 28. päivä (n = 101) tai lumetta (n = 103). Satunnaistamisessa ryhmät stratifioitiin sen mukaan, mitä hoitoa potilas sai tutkimukseen sisäänottohetkellä ja etenikö sairaus lähtötilanteessa RECIST 1.0 (Response Evaluation Criteria in Solid Tumours) -asteikolla mitattuna 3–6 kuukautta kestäneen aloitusvaiheen aikana.
Potilailla oli metastasoinut ja/tai paikallisesti edennyt syöpä, jota ei voitu hoitaa leikkauksella, ja histologisesti varmistettuja hyvin tai kohtalaisesti erilaistuneita primaarikasvaimia haimassa (44,6 %), keskisuolessa (35,8 %), takasuolessa (6,9 %) tai muussa/tuntemattomassa paikassa (12,7 %).
69 %:lla potilaista, joilla oli GEP-NET-kasvain, kasvaimen aste oli 1 (G1), jonka määritelmänä oli Ki-67-proliferaatioindeksi ≤ 2 % (50,5 % koko potilasjoukosta) tai mitoosi-indeksi < 2/10 HPF (18,5 % koko potilasjoukosta), ja 30 %:lla potilaista, joilla oli GEP-NET-kasvain, oli Ki-67-indeksiltään pienempi 2. asteen kasvain (G2) (jonka määritelmänä oli Ki-67-indeksi > 2 % – ≤ 10 %). Astetietoa ei ollut saatavana 1 %:sta potilaita. Tutkimuksesta suljettiin pois potilaat, joilla oli 2. asteen GEP-NET-kasvain, jonka proliferaatioindeksi oli suuri (Ki-67-indeksi > 10 % – ≤ 20 %), tai 3. asteen GEP neuroendokriininen karsinooma (Ki-67-indeksi > 20 %).
Yhteensä 52,5 %:lla potilaista maksatuumoritaakka oli ≤ 10 %, 14,5 %:lla taakka oli > 10 ja ≤ 25 % ja 33 %:lla se oli > 25 %.
Ensisijainen päätetapahtuma oli etenemättömyysaika, jota mitattiin joko aikana sairauden etenemiseen RECIST 1.0 -asteikolla tai kuolemaan tutkimushoidon ensimmäisen annon jälkeisen 96 viikon aikana. Etenemättömyysajan analyysissa käytettiin riippumattomia keskitetysti tehtyjä radiologisia arvioita sairauden etenemisestä.
Taulukko 1: Faasin III tutkimuksen tehoa koskevat tulokset
| Etenemättömyysajan mediaani (viikkoa) | Riskisuhde (95 % CI) | Etenemisen tai kuoleman riskin pienenemä | p-arvo | |
lanreotidi (n = 101 ) | Lume (n = 103 ) | |||
| > 96 viikkoa | 72,00 viikkoa (95 % CI : 48,57, 96,00) | 0,470 (0,304, 0,729) | 53 % | 0,0002 |
Kuva 1: Etenemättömyysaikaa kuvaavat Kaplan-Meierin käyrät
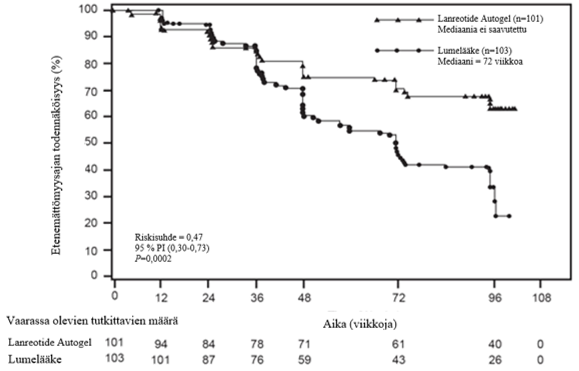
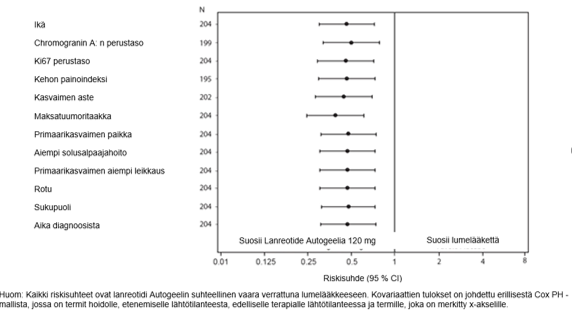
Lanreotidi pienensi sairauden etenemisen tai kuoleman riskiä riippumatta primaarikasvaimen paikasta, maksatuumoritaakasta, aiemmasta solusalpaajahoidosta, lähtötilanteen Ki-67-pitoisuudesta, kasvaimen asteesta tai muista ennalta määritetyistä tekijöistä kuvan 2 mukaisesti.
Lanreotidihoidon kliinisesti merkitsevä hyöty osoitettiin niiden potilaiden alaryhmissä, joilla oli haimassa, keskisuolessa (midgut) tai muussa/tuntemattomassa paikassa sijaitseva kasvain, sekä koko tutkimusväestössä. Potilaita, joilla kasvain sijaitsi takasuolessa, oli vähän (14/204), joten tuloksia oli vaikea tulkita tämän potilasryhmän osalta. Käytettävissä olevat tiedot eivät viittaa siihen, että lanreotidista olisi hyötyä näiden potilaiden hoidossa.
Kuva 2: Etenemättömyysajan kovariaatteja koskevan Coxin verrannollisen riskitiheysanalyysin tulokset
Jatkotutkimuksessa 45,6 % potilaista (47/103 potilasta) siirtyi lumeryhmästä avoimeen lanreotidiryhmään.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset landreotidia sisältävien valmisteiden käytöstä kaikkien pediatristen potilasryhmien hoidossa käyttöaiheissa akromegalia ja aivolisäkeperäinen jättikasvu (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa). Gastroenteropankreaattiset neuroendokriiniset kasvaimet (neuroblastoomaa, neuroganglioblastoomaa ja feokromosytoomaa lukuun ottamatta) kuuluvat Euroopan lääkeviraston luetteloon sairauksista, joiden osalta on myönnetty vapautus toimittaa tutkimustulokset pediatristen potilaiden hoidossa.
Farmakokinetiikka
Lanreotidin farmakokineettiset parametrit terveillä vapaaehtoisilla henkilöillä laskimonsisäisen annostelun jälkeen osoittivat ekstravaskulaarisen jakautumisen olevan rajoitettua, vakaan tilan jakautumistilavuus oli 16,1 l. Kokonaispuhdistuma oli 23,7 l/h, terminaalinen puoliintumisaika oli 1,14 tuntia ja keskimääräinen jäännösaika oli 0,68 tuntia.
Erittymistä mittaavissa tutkimuksissa alle 5 % lanreotidista erittyi virtsaan ja alle 0,5 % muuttumattomana ulosteeseen, mikä viittaa vähäiseen sapen kautta erittymiseen.
Terveille vapaaehtoisille henkilöille syvälle ihon alle annetut 60, 90 ja 120 mg:n lanreotidiannokset tuottivat keskimääräiset 4,25, 8,39 ja 6,79 ng/ml:n maksimaaliset seerumipitoisuudet. Nämä Cmax-arvot saavutettiin ensimmäisenä päivänä 8, 12 ja 7 tunnin annostelun jälkeen (mediaaniarvot). Huippupitoisuuden jälkeen lanreotidipitoisuudet alenevat hitaasti ensimmäisen asteen kinetiikkaa noudattaen, puoliintumisaikojen ollessa 23,3, 27,4 ja 30,1 päivää. Neljän viikon kuluttua injektion annosta lanreotidin seerumipitoisuuksien keskiarvot olivat 0,9, 1,11 ja 1,69 ng/ml. Absoluuttiset biologiset hyötyosuudet olivat 73,4, 69,0 ja 78,4 %.
Akromegaliapotilaille syvälle ihon alle annettujen lanreotidin 60, 90 ja 120 mg:n injektioiden jälkeen lanreotidin maksimipitoisuuksien keskiarvot seerumissa kohosivat 1,6, 3,5 ja 3,1 ng/ml:aan. Nämä Cmax-arvot saavutettiin ensimmäisenä päivänä, 6 ja 6 ja 24 tunnin kuluttua injektiosta. Huippupitoisuuden jälkeen seerumin lanreotidipitoisuudet alenevat hitaasti ensimmäisen asteen kinetiikkaa noudattaen ja neljän viikon kuluttua injektion annon jälkeen lanreotidin pitoisuuksien keskiarvot olivat 0,7, 1,0 ja 1,4 ng/ml.
Lanreotidin vakaan tilan pitoisuudet seerumissa saavutettiin keskimäärin neljän, 4:n viikon välein annetun, injektion jälkeen. Neljän viikon välein annettujen 60, 90 ja 120 mg:n injektioiden tuottamat vakaan tilan Cmax-pitoisuudet olivat 3,8, 5,7 ja 7,7 ng/ml ja Cmin-pitoisuudet olivat 1,8, 2,5 ja 3,8 ng/ml. Pitoisuuksien välinen vaihtelu oli kohtalaista, 81 %:sta 108 %:iin.
Akromegaliapotilaille annettujen syvien ihonalaisten lanreotidin 60, 90 ja 120 mg:n injektioiden kinetiikka oli lineaarista.
Lanreotidia 120 mg saaneen 290:n GEP-NET-potilaan tiedoista tehdyn populaatiofarmakokineettisen analyysin mukaan lääkeaine vapautui aluksi nopeasti ja yhden injektion jälkeen keskimääräinen Cmax 7,49 ± 7,58 ng/ml saavutettiin injektion jälkeisenä päivänä. Kun potilaille annettiin lanreotidi 120 mg -valmistetta joka 28. päivä, vakaan tilan pitoisuudet saavutettiin 5 injektion jälkeen, ja pitoisuudet pysyivät vakaina viimeiseen mittaukseen asti (pisimmillään 96 viikkoa ensimmäisestä injektiosta). Vakaassa tilassa Cmax-arvon keskiarvo 13,9 ± 7,44 ng/ml ja alimpien seerumista mitattujen pitoisuuksien keskiarvo oli 6,56 ± 1,99 ng/ml. Terminaalisen puoliintumisajan keskiarvo oli 49,8 ± 28,0 vuorokautta.
Munuaisten/maksan vajaatoiminta
Vaikeassa munuaisten vajaatoiminnassa seerumin lanreotidin kokonaispuhdistuma alenee noin puoleen ja puoliintumisaika vastaavasti pitenee sekä AUC-arvot suurenevat. Kohtalaisessa tai vaikeassa maksan vajaatoiminnassa puhdistuman huomattiin alenneen (30 %). Jakaantumistilavuus ja keskimääräinen viipymäaika kudoksissa lisääntyivät kaikissa maksan vajaatoiminnan asteissa.
Populaatiofarmakokineettisessä analyysissä, jossa oli165 lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavaa (lievää 106 ja keskivaikeaa 59) Myrelez-valmisteella hoidettua GEP-NET-potilasta, ei havaittu vaikutusta lanreotidin puhdistumaan. Vaikeaa munuaisten vajaatoimintaa sairastavia GEP-NET‑potilaita ei ole tutkittu.
Maksan vajaatoimintaa sairastavia (Child-Pugh -asteikon mukaan) GEP-NET-potilaita ei tutkittu.
Aloitusannosta ei tarvitse muuttaa munuaisten tai maksan vajaatoiminnassa, koska lanreotidin pitoisuuksien oletetaan olevan tässä ryhmässä niiden pitoisuuksien rajoissa, jotka ovat hyvin siedettyjä terveillä henkilöillä.
Iäkkäät potilaat
Iäkkäillä puoliintumisaika pitenee ja viipymäaika kudoksissa on pidempi kuin terveillä nuorilla henkilöillä. Iäkkäillä ei tarvitse muuttaa aloitusannosta, koska lanreotidin pitoisuuksien oletetaan olevan tässä ryhmässä niiden pitoisuuksien rajoissa, jotka ovat hyvin siedettyjä terveillä henkilöillä.
Iältään 65–85-vuotiaan 122:n GEP-NET-potilaan populaatiofarmakokineettisen analyysin perusteella ikä ei vaikuta lanreotidin puhdistumaan tai jakautumistilavuuteen.
Prekliiniset tiedot turvallisuudesta
Prekliinisissä tutkimuksissa havaittiin vaikutuksia vain altistustasoilla, joiden katsottiin olevan niin paljon ihmisen suurinta altistusta suurempia, että niillä ei ole vaikutusta kliiniseen käyttöön.
Rotilla ja hiirillä tehdyissä karsinogeenisuustutkimuksissa neoplastisia muutoksia ei todettu pitoisuuksilla, jotka olivat suurempia kuin ihmisillä saavutettavat terapeuttiset pitoisuudet. Injektiokohdissa todettiin lisääntynyttä ihonalaisten tuumoreiden esiintymistä, mikä luultavasti johtuu eläimille tiheästi (päivittäin) annetuista pistoksista. Tällä ei luultavasti ole kliinistä merkitystä, koska ihmisille injektio annetaan kerran kuukaudessa. In vitro ja in vivo suoritetuissa tavanomaisissa tutkimuksissa lanreotidi ei osoittanut genotoksisuutta.
Lanreotidi ei ollut teratogeeninen rotilla eikä kaneilla. Alkio-sikiötoksisuutta havaittiin rotilla (ennen alkion kiinnittymistä tapahtuneiden alkiokuolemien lisääntyminen) ja kaneilla (alkion kiinnittymisen jälkeen tapahtuneiden alkiokuolemien lisääntyminen). Lisääntymistutkimukset tiineillä rotilla, joille annettiin 30 mg/kg joka toinen viikko ihonalaisena injektiona (5 kertaa ihmisille annettua annosta suurempi annos kehon pinta-alavertailuihin perustuen), johtivat alkion/sikiön eloonjäämisen vähenemiseen. Tiineillä kaneilla tehdyt tutkimukset, joissa annettiin ihonalaisina injektioina 0,45 mg/kg/vrk (kaksinkertainen altistus ihmisen terapeuttiseen altistukseen verrattuna suositellulla 120 mg:n enimmäisannoksella perustuen suhteellisiin kehon pinta-alavertailuihin), osoittivat sikiöiden eloonjäämisen vähenemistä ja sikiöiden luuston/pehmytkudoksen poikkeavuuksien lisääntymistä.
Farmaseuttiset tiedot
Apuaineet
Injektionesteisiin käytettävä vesi
Väkevä etikkahappo (pH:n säätämistä varten).
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Valmiste tulee käyttää välittömästi laminoidun suojapussin avaamisen jälkeen.
Säilytys
Säilytä jääkaapissa (2 °C–8 °C) alkuperäispakkauksessa. Herkkä valolle.
Valmiste voidaan panna takaisin jääkaappiin (lämpötilapoikkeamia saa olla enintään kolme) jatkosäilytystä ja myöhempää käyttöä varten edellyttäen, että sitä on säilytetty avaamattomassa pussissa enintään 40 °C:n lämpötilassa yhteensä enintään 24 tuntia.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
MYRELEZ injektioneste, liuos, esitäytetty ruisku
60 mg (L:ei) 0,5 ml (turvaneula) (427,50 €)
90 mg (L:ei) 0,5 ml (turvaneula) (565,39 €)
120 mg (L:ei) 0,5 ml (turvaneula) (681,33 €)
PF-selosteen tieto
Myrelez toimitetaan esitäytetyssä ruiskussa (polypropeenia, termoplastisesta elastomeerikumista valmistettu mäntätulppa ja polypropyleenikorkki) muovisella alustalla, joka on pakattu suljettuun alumiinipussiin, ja erikseen pakattu kertakäyttöruiskun automaattinen turvajärjestelmä. Molemmat on pakattu pahvikoteloon.
Kotelo sisältää yhden 0,5 ml:n ruiskun ja yhden turvaneulan (1,2 mm x 20 mm) samassa pakkauksessa.
Monipakkaus, jossa on kolme koteloa, joista kukin sisältää yhden 0,5 ml:n ruiskun ja yhden turvaneulan (1,2 mm x 20 mm) samassa pakkauksessa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai haalean keltainen puolikiinteä formulaatio, jossa ei näy partikkeleita.
Käyttö- ja käsittelyohjeet
Esitäytetyssä ruiskussa oleva injektioneste on käyttövalmis.
Käytettävä välittömästi ja yhdellä kertaa avaamisen jälkeen. Ei saa käyttää, jos pussi on vaurioitunut tai avautunut.
On tärkeää, että liuos injektoidaan tarkasti pakkausselosteessa olevien ohjeiden mukaan.
Käytetty ruisku on hävitettävä terävien esineiden säiliöön.
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
MYRELEZ injektioneste, liuos, esitäytetty ruisku
60 mg 0,5 ml
90 mg 0,5 ml
120 mg 0,5 ml
- Ylempi erityiskorvaus (100 %). Pahanlaatuiset kasvaimet, joita ei ole edellä erikseen mainittu (130).
- Peruskorvaus (40 %).
ATC-koodi
H01CB03
Valmisteyhteenvedon muuttamispäivämäärä
25.07.2024
Yhteystiedot
Unit 17, Northwood House, Northwood Crescent, Northwood
D09 V504 Dublin 9
Ireland
+358 800 416231
www.advanzpharma.com
medicalinformation@advanzpharma.com
