Pakkausseloste
CANIZOL VET tabletti 200 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Canizol vet 200 mg tabletit koiralle
VAIKUTTAVAT JA MUUT AINEET
Yksi tabletti sisältää:
Vaikuttava aine:
Ketokonatsoli 200 mg
Ruskea, pilkullinen, pyöreä maustettu tabletti, jonka voi puolittaa ja jakaa neljään osaan.
KÄYTTÖAIHEET
Sieni-infektioiden hoito, kun aiheuttajana on:
- Microsporum canis
- Microsporum gypseum
- Trichophyton mentagrophytes
VASTA-AIHEET
Ei saa käyttää eläimille, joilla on maksan vajaatoiminta.
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
HAITTAVAIKUTUKSET
Koira:
Harvinainen (1–10 eläintä 10 000 hoidetusta eläimestä): | Hermostoperäiset oireeta (esim. haparointi, vapina) Apatiaa, ruokahaluttomuusa Maksamyrkyllisyysa Oksentelua, ripulia |
Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina): | Umpieritysjärjestelmän häiriö (antiandrogeeniset vaikutuksetb,c, antiglukokortikoidiset vaikutuksetb) |
a Saattaa esiintyä ohjeenmukaisilla annoksilla.
b Ohimenevää. Ketokonatsoli estää kolesterolin muuttumisen steroidihormoneiksi, kuten testosteroniksi ja kortisoliksi annos- ja aikariippuvaisesti.
c Siitokseen käytettävien uroskoirien osalta katso myös kohta Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle tai myyntiluvan haltijan paikalliselle edustajalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta:
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
www-sivusto: https://www.fimea.fi/elainlaakkeet/
KOHDE-ELÄINLAJI
Koira.

ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Suun kautta.
10 mg ketokonatsolia painokiloa kohti, eli 1 tabletti 20 painokiloa kohti päivittäin.
On suositeltavaa ottaa hoidossa olevasta eläimestä näyte kuukausittain ja lopettaa annostelu kahden negatiivisen viljelynäytteen jälkeen. Jollei sieninäytteiden tutkiminen ole mahdollista, on hoitoa jatkettava riittävän pitkään, jotta varmistetaan sienitartunnan paraneminen. Jos muutokset ovat edelleen havaittavissa 8 viikon hoidon jälkeen, on hoidosta vastaavan eläinlääkärin arvioitava lääkitys uudelleen.
Oikean annostuksen varmistamiseksi eläimen paino on määritettävä mahdollisimman tarkasti.
ANNOSTUSOHJEET
Annostellaan mieluimmin ruuan yhteydessä imeytymisen maksimoimiseksi.
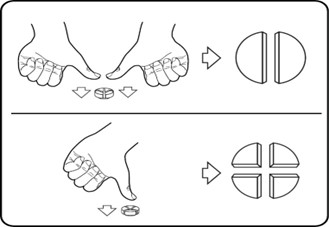
Tabletin voi jakaa puoliksi tai ¼ osiin tarkan annoksen varmistamiseksi. Aseta tabletti tasaiselle alustalle siten, että lovettu puoli on ylöspäin ja kupera puoli alustaa vasten.
Puolikkaat: paina peukaloiden kärjillä kevyesti kohtisuoralla paineella molempia tabletin puolikkaita ja murra tabletti kahtia.
Neljännekset: paina peukalon kärjellä kevyesti kohtisuoraan tabletin keskeltä murtaaksesi sen neljään osaan.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Ei erityisiä säilytysohjeita.
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu ulkopakkauksessa merkinnän Exp. jälkeen. Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
Jaettujen tablettien kestoaika: 3 vuorokautta.
ERITYISVAROITUKSET
Erityisvaroitukset:
Toistuva ketokonatsolin käyttö voi harvinaisissa tapauksissa aiheuttaa ristiresistenssiä muille atsoleille.
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Valmisteen käytön on perustuttava kohdepatogeeni(e)n tunnistamiseen ja herkkyysmääritykseen. Jos tämä ei ole mahdollista, hoidon on perustuttava epidemiologiseen tietoon kohdepatogeenien herkkyydestä tilatasolla tai paikallisella/alueellisella tasolla.
Valmistetta on käytettävä mikrobilääkkeitä koskevien viranomaismääräysten sekä kansallisten ja paikallisten määräysten mukaisesti.
Ketokonatsolihoito alentaa testosteronipitoisuutta ja nostaa progesteronipitoisuutta, ja se voi vaikuttaa uroskoirien lisääntymiskykyyn hoidon aikana ja joidenkin viikkojen ajan hoidon päätyttyä.
Ihon sieni-infektion hoito ei saa rajoittua pelkästään tartunnan saaneen eläimen tai eläinten hoitoon, vaan siihen on yhdistettävä ympäristön desinfektio, sillä itiöt voivat säilyä pitkään ympäristössä. Muut toimenpiteet, kuten säännöllinen imurointi ja turkinhoitoon käytettävien välineiden desinfektio sekä kaiken mahdollisesti saastuneen materiaalin, jota ei voida desinfioida, poistaminen vähentävät riskiä uuteen tartuntaan ja sen leviämiseen.
Systeemisen ja paikallisen hoidon yhdistäminen on suositeltavaa.
Pitkäaikaisessa hoidossa maksan toimintaa on huolellisesti tarkkailtava. Epäiltäessä maksan toiminnan vajausta kliinisiin oireisiin perustuen, on hoito lopetettava välittömästi. Koska tabletit ovat maustettuja, niitä on säilytettävä turvallisessa paikassa poissa eläinten ulottuvilta.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Valmisteen nielemistä vahingossa on vältettävä. Säilytä läpipainopakkaus ulkopakkauksessa estääksesi lapsien pääsyn käsiksi tabletteihin. Tabletin osat (puolikkaat ja neljännekset) säilytetään alkuperäisessä läpipainopakkauksessa ja käytetään seuraavan annostelun yhteydessä. Jos vahingossa nielet valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Henkilöiden, jotka ovat yliherkkiä ketokonatsolille, tulee välttää kosketusta eläinlääkkeen kanssa. Pese kädet lääkkeen annostelun jälkeen.
Muut varotoimet:
Käyttöaiheessa mainitut dermatofyytit (sienet) voivat tarttua ihmisiin. Huolehdi henkilökohtaisesta hygieniasta (pese kädet käsiteltyäsi eläintä ja vältä suoraa kontaktia eläimen kanssa). Jos havaitset ihomuutoksia, ota yhteyttä lääkäriin.
Tiineys ja laktaatio:
Laboratoriotutkimuksissa on löydetty näyttöä epämuodostumia aiheuttavista ja alkiotoksisista vaikutuksista.. Eläinlääkkeen turvallisuutta tiineillä ja imettävillä nartuilla ei ole selvitetty.
Käyttöä ei suositella tiineyden aikana.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Älä annostele yhdessä antasidien ja/tai H2-reseptoriantagonistien (simetidiini/ranitidiini) tai protonipumpun estäjien (esim. Omepratsoli) kanssa, sillä ketokonatsolin imeytyminen voi muuttua (vaatii imeytyäkseen happaman ympäristön).
Ketokonatsoli on sytokromi P450 3A4 (CYP3A4):n substraatti ja voimakas estäjä. Se voi heikentää sellaisten lääkeaineiden poistumista, jotka metaboloituvat CYP3A4 kautta ja siten vaikuttaa plasmakonsentraatioihin. Tämä saattaa johtaa esim. Siklosporiinin, makrosyklisten laktonien (ivermektiini, selamektiini, milbemysiini), midatsolaamin, sisapridin, kalsiumkanavan salpaajien, fentanyylin, digoksiinin, makrolidien, metyyliprednisolonin tai kumariinin antikoagulanttien plasmapitoisuuksien nousuun. Edellä mainittujen lääkkeiden plasmapitoisuuksien nousu saattaa pitkittää vaikutusten ja haittavaikutusten kestoa.
Toisaalta sytokromi P450:n indusoijat voivat tehostaa ketokonatsolin metaboliaa. Esim. Barbituraatit tai fenytoiini voivat tehostaa ketokonatsolin metaboliaa, mikä suurentaa biohajoavuutta ja näin ollen heikentää tehoa.
Ketokonatsoli saattaa vähentää teofylliinin seerumipitoisuuksia.
Ketokonatsoli estää kolesterolin muuntumisen kortisoliksi ja voi siten vaikuttaa trilostaanin/mitotaanin annokseen hyperadrenokortisismin takia hoidettavilla koirilla.
Ei tiedetä, kuinka oleellisia nämä yhteisvaikutukset ovat koirien ja kissojen kannalta, mutta niin kauan kuin tietoja ei ole saatavilla, eläinlääkkeen ja näiden lääkkeiden samanaikaista käyttöä on vältettävä.
Älä anna koirallesi mitään muita lääkkeitä keskustelematta ensin hoitavan eläinlääkärin kanssa.
Yliannostus:
Yliannostus voi aiheuttaa anoreksiaa (vakavaa ruokahaluttomuutta), oksentelua, pruritusta (kutinaa), alopesiaa (karvan lähtöä) ja eräiden maksaentsyymiarvojen nousua (ALAT ja AFOS).
Merkittävät yhteensopimattomuudet:
Ei oleellinen.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi tai apteekista.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
16.1.2025
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa (https://medicines.health.europa.eu/veterinary).
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija:
Dechra Regulatory B.V.
Handelsweg 25
5531 AE Bladel
Alankomaat
Erän vapauttamisesta vastaava valmistaja:
Lelypharma B.V.
Zuiveringweg 42
8243 PZ Lelystad
Alankomaat
Genera d.d.
Svetonedeljska cesta 2
Kalinovica
10436 Rakov Potok
Kroatia
Paikalliset edustajat ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
Dechra Veterinary Products Oy
Linnoitustie 4
02600 ESPOO
Suomi
Puh.: +358 (0)22510500
Lisätietoja tästä eläinlääkeestä saa myyntiluvan haltijan paikalliselta edustajalta.