Pakkausseloste
VABYSMO injektionsvätska, lösning i förfylld spruta 120 mg/ml
Tilläggsinformation
Vabysmo 120 mg/ml injektionsvätska, lösning i förfylld spruta
faricimab
Utökad övervakning
▼ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar du eventuellt får. Information om hur du rapporterar biverkningar finns i slutet av avsnitt Eventuella biverkningar.
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till din läkare.
- Om du får biverkningar, tala med din läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
Utöver bipacksedeln kommer din läkare att ge dig en patientbroschyr med viktig säkerhetsinformation för att hjälpa dig att förstå nyttan och riskerna med Vabysmo, samt information om den åtgärd som ska vidtas om du får vissa symtom.
I denna bipacksedel finns information om följande
- Vad Vabysmo är och vad det används för
- Vad du behöver veta innan du ges Vabysmo
- Hur du använder Vabysmo
- Eventuella biverkningar
- Hur Vabysmo ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Vabysmo är och vad det används för
Vabysmo innehåller den aktiva substansen faricimab, som tillhör en grupp av läkemedel som kallas antineovaskulära medel.
Vabysmo injiceras i ögat av en läkare för att behandla vuxna med ögonsjukdomarna:
- neovaskulär (våt) åldersrelaterad makuladegeneration (nAMD),
- synnedsättning orsakad av diabetiskt makulaödem (DME),
- synnedsättning på grund av makulaödem till följd av retinal venocklusion (RVO) (grenvensocklusion eller centralvensocklusion).
Dessa tillstånd påverkar makula (gula fläcken) som sitter i mitten av näthinnan (det ljuskänsliga området i bakre delen av ögat) och som ansvarar för den centrala synskärpan. nAMD orsakas av tillväxt av onormala blodkärl som läcker blod och vätska in i makula, och DME orsakas av läckande blodkärl som får makula att svullna. Vid centralvensocklusion blockeras det stora blodkärlet (venen) som transporterar bort blod från näthinnan. Vid grenvensocklusion är en av de mindre grenarna av den stora venen blockerad. På grund av det ökade trycket i dessa blodkärl läcker vätska ut i näthinnan, vilket orsakar svullnad av makula (makulaödem).
Hur verkar Vabysmo
Vabysmo känner specifikt igen proteinerna angiopoietin-2 och vaskulär endotelial tillväxtfaktor A och blockerar deras aktivitet. När dessa proteiner finns i högre nivåer än normalt kan de orsaka tillväxt av onormala blodkärl och/eller skada på normala blodkärl. Detta leder till läckage till makula som orsakar svullnad eller skada, vilket kan påverka synen negativt. Genom att binda till dessa proteiner kan Vabysmo blockera deras aktivitet och förhindra onormal tillväxt av blodkärl samt läckage och svullnad. Vabysmo kan förbättra sjukdomen och/eller bromsa försämring av sjukdomen och därigenom bevara eller till och med förbättra synen.
Vad du behöver veta innan produkten används
Du ska inte ges Vabysmo:
- om du är allergisk mot faricimab eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har en aktiv eller misstänkt infektion i eller runt ögat.
- om du har ont i ögat eller om ögat är rött (ögoninflammation).
Om något av detta stämmer in på dig, ska du tala om det för din läkare. Du ska då inte behandlas med Vabysmo.
Varningar och försiktighet
Tala med din läkare innan du får Vabysmo:
- om du har grön starr (glaukom, ett tillstånd som oftast orsakas av högt tryck i ögat).
- om du tidigare har sett ljusblixtar eller mörka prickar som flyter i synfältet eller om antalet och storleken på sådana prickar plötsligt har ökat.
- om du har genomgått en ögonoperation under de senaste 4 veckorna eller om en ögonoperation planeras inom de närmaste 4 veckorna.
- om du har eller någonsin har haft någon ögonsjukdom eller fått ögonbehandlingar.
Tala omedelbart med din läkare:
- om synen plötsligt försämras.
- om du märker tecken på en eventuell infektion eller inflammation i ögat såsom ökad rodnad i ögat, ögonsmärta, ökat obehag i ögat, dimsyn eller försämrad syn, ökat antal små prickar i synfältet, ökad känslighet för ljus.
Det är också viktigt för dig att veta att:
- säkerhet och effekt för Vabysmo givet samtidigt i båda ögonen inte har studerats och om det används på detta sätt kan det vara förenat med en ökad risk att drabbas av biverkningar.
- injektioner av Vabysmo kan tillfälligt öka trycket i ögat (intraokulärt tryck) hos vissa patienter inom 60 minuter från injektionen. Din läkare kommer att kontrollera detta efter varje injektion.
- läkaren kommer att undersöka om du har andra riskfaktorer som kan öka risken för ett hål i eller avlossning av ett av skikten i ögats bakre del (näthinneavlossning eller -ruptur, pigmentepitelavlossning eller -ruptur). I sådant fall ska Vabysmo ges med försiktighet.
När vissa läkemedel som fungerar på liknande sätt som Vabysmo ges finns det en känd risk för blodproppar som täpper till blodkärl (arteriella tromboemboliska händelser), vilket kan leda till hjärtinfarkt eller stroke. Eftersom små mängder av läkemedlet tas upp i blodet finns det en teoretisk risk för sådana händelser efter injektion av Vabysmo i ögat.
Det finns bara en begränsad erfarenhet vid behandling av:
- patienter med aktiva infektioner
- patienter med neovaskulär (våt) åldersrelaterad makuladegeneration nAMD och retinal venocklusion (RVO) som är 85 år eller äldre
- patienter med diabetiskt makulaödem DME orsakat av typ I diabetes
- diabetiker med högt medel-blodsockervärde (HbA1c över 10%)
- diabetiker med ögonsjukdom orsakad av så kallad diabetes proliferativ diabetes retinopati
- diabetiker med högt blodtryck, högre än 140/90 mmHg och blodkärlssjukdom
- patienter med DME som får injektioner kortare än var 8:e vecka under en längre tidsperiod
Det är enbart en begränsad erfarenhet av behandling av patienter som får injektioner kortare tid än var 8:e vecka under en längre tidsperiod och dessa patienter kan löpa en större risk att få biverkningar.
Det finns ingen erfarenhet vid behandling av:
- diabetiker eller RVO-patienter med okontrollerat högt blodtryck.
Om något av ovanstående gäller för dig, kommer din läkare att överväga denna brist på information när du behandlas med Vabysmo.
Barn och ungdomar
Användning av Vabysmo hos barn och ungdomar har inte studerats eftersom nAMD, DME och RVO främst förekommer hos vuxna.
Andra läkemedel och Vabysmo
Tala om för din läkare om du tar, nyligen har tagit eller kan komma att ta andra läkemedel.
Graviditet och amning
Vabysmo har inte studerats hos gravida kvinnor. Vabysmo ska inte användas under graviditet om inte den förväntade nyttan för patienten överväger den potentiella risken för fostret.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du behandlas med detta läkemedel.
Amning rekommenderas inte under behandling med Vabysmo eftersom det är okänt om Vabysmo går över i bröstmjölk.
Kvinnor som kan bli gravida måste använda en effektiv preventivmetod under behandling och i minst tre månader efter att behandlingen med Vabysmo har avslutats. Om du blir gravid eller tror att du är gravid under behandlingen ska du omedelbart tala om det för läkaren.
Körförmåga och användning av maskiner
Efter injektionen av Vabysmo kan tillfälliga synproblem uppstå (t.ex. dimsyn). Framför inte fordon eller använd maskiner så länge dessa varar.
Vabysmo innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Vabysmo innehåller polysorbat
Detta läkemedel innehåller 0,02 mg polysorbat i varje dos på 0,05 ml. Polysorbat kan orsaka allergiska reaktioner. Tala om för din läkare om du har några allergier.
Hur produkten används
Hur Vabysmo ges
Rekommenderad dos är 6 mg faricimab.
Våt neovaskulär åldersrelaterad makuladegeneration (våt AMD, nAMD)
- Under de första 3 månaderna kommer du att få en injektion i månaden.
- Därefter kan du få injektioner med som längst 4 månaders intervall. Din läkare kommer att bestämma hur ofta injektionerna ska ges beroende på ögats tillstånd.
Synnedsättning orsakad av diabetisk makulaödem (DME) och makulaödem till följd av retinal venocklusion (RVO) (grenvensocklusion eller centralvensocklusion)
- Du kommer att behandlas med en injektion varje månad i minst 3 månader.
- Därefter kan du få injektionerna mer sällan. Din läkare kommer att bestämma hur ofta injektionerna ska ges beroende på ögats tillstånd.
Administreringssätt
Vabysmo injiceras i ögat (intravitreal injektion) av en läkare som har erfarenhet av att ge injektioner i ögat.
Före injektionen kommer läkaren att noga rengöra ditt öga med desinfekterande ögontvätt för att förebygga infektioner. Läkaren ger dig ögondroppar (lokalbedövning) för att bedöva ögat och minska eller förhindra smärta vid injektionen.
Hur länge pågår behandlingen med Vabysmo
Detta är en långvarig behandling som kan pågå i månader eller år. Din läkare kommer att regelbundet kontrollera ditt tillstånd för att förvissa sig om att behandlingen fungerar. Beroende på hur du svarar på behandling med Vabysmo kan din läkare be dig att komma för behandling med kortare eller längre mellanrum.
Om du har missat en dos av Vabysmo
Om du har missat en dos ska du boka ny tid hos din läkare så snart som möjligt.
Om du slutar att använda Vabysmo
Tala med din läkare innan du slutar med behandlingen. Risken för synförlust kan öka och synen kan försämras om du slutar med behandlingen.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla som behandlas behöver inte få dem.
Biverkningarna av injektion med Vabysmo beror antingen på själva läkemedlet eller på injektionen och biverkningarna påverkar främst ögat.
Vissa biverkningar kan vara allvarliga
Kontakta omedelbart läkaren om du märker något av följande, som är tecken på allergiska reaktioner, inflammation eller infektioner:
- ögonsmärta, ökat obehag, ökad ögonrodnad, dimsyn eller försämrad syn, ökat antal små fläckar i synfältet, eller ökad känslighet för ljus – detta är tecken på en möjlig infektion, inflammation i ögat eller en allergisk reaktion.
- en plötslig försämring eller förändring av synen.
Andra eventuella biverkningar
Andra biverkningar som kan förekomma efter behandling med Vabysmo anges i listan nedan.
De flesta biverkningarna är lindriga till måttliga och försvinner i allmänhet inom en vecka efter varje injektion.
Kontakta läkare om någon av följande biverkningar blir svår.
Mycket vanliga (kan förekomma hos fler än 1 av 10 personer):
- Inga
Vanliga (kan förekomma hos upp till 1 av 10 personer):
- Grumlig lins i ögat (katarakt)
- Hål i ett av skikten i ögats bakre del (ruptur på näthinnans pigmentepitel - endast nAMD)
- Avlossning av den geléliknande substansen i ögat (glaskroppsavlossning)
- Ökat tryck inuti ögat (ökat intraokulärt tryck)
- Blödning från små blodkärl i ögats yttre skikt (konjunktivalblödning)
- Rörliga prickar eller mörka skuggor i synfältet (glaskroppsgrumlingar)
- Ögonsmärta
Mindre vanliga (kan förekomma hos upp till 1 av 100 personer):
- Allvarlig inflammation eller infektion inuti ögat (endoftalmit)
- Inflammation i den gelliknande substansen inuti ögat/rött öga (vitrit)
- Inflammation i regnbågshinnan och omgivande vävnad i ögat (irit, iridocyklit, uveit)
- Blödning i ögat (glaskroppsblödning)
- Obehag i ögat
- Ögonklåda
- Reva i näthinnan (det skikt i ögats bakre del som uppfattar ljus)
- Rött öga (okulär/konjunktival hyperemi)
- En känsla av att ha fått något i ögat
- Dimsyn
- Försämrad synskärpa (nedsatt syn)
- Smärta vid injektion av läkemedlet
- Näthinneavlossning
- Ökad tårbildning
- Repad hornhinna, skada på hornhinnan, ögats klara skikt som täcker regnbågshinnan (kornealabrasion)
- Ögonirritation
Sällsynta (kan förekomma hos upp till 1 av 1 000 personer):
- Tillfälligt försämrad synskärpa (övergående nedsatt synskärpa)
- Grumling av lins på grund av skada (traumatisk katarakt)
Har rapporterats (förekommer hos ett okänt antal användare):
- Inflammation i blodkärl i bakre delen av ögat (retinal vaskulit)
- Blockering av blodkärl i bakre delen av ögat (retinal ocklusiv vaskulit), vanligt vid samtidig inflammation
När vissa läkemedel som fungerar på liknande sätt som Vabysmo ges finns det en känd risk för blodproppar som täpper till blodkärl (arteriella tromboemboliska händelser), vilket kan leda till hjärtinfarkt eller stroke. Eftersom små mängder av läkemedlet tas upp i blodet finns det en teoretisk risk för sådana händelser efter injektion av Vabysmo i ögat.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Läkare, apotekspersonal eller sjuksköterska ansvarar för att förvara detta läkemedel och kassera använt läkemedel på rätt sätt. Följande information är avsedd för hälso- och sjukvårdspersonal.
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och etiketten efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp vid 2 °C – 8 °C.
Får ej frysas.
Förvara den förseglade innerförpackningen med den förfyllda sprutan i ytterkartongen. Ljuskänsligt.
Före användning kan den oöppnade förfyllda sprutan förvaras vid rumstemperatur, 20 °C till 25 °C i upp till 24 timmar.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är faricimab. En ml lösning, innehåller 120 mg faricimab. Varje förfylld spruta innehåller 21 mg faricimab i 0,175 ml lösning. Detta ger tillräcklig mängd för att tillföra en enkeldos à 0,05 ml lösning innehållande 6 mg faricimab.
- Övriga innehållsämnen är: L-histidin, ättiksyra 30 % (E 260), L-metionin, natriumklorid, sackaros, polysorbat 20 (E 432), vatten för injektionsvätskor (se avsnitt Vad du behöver veta innan produkten används ”Vabysmo innehåller natrium och polysorbat”).
Läkemedlets utseende och förpackningsstorlekar
Vabysmo 120 mg/ml injektionsvätska, lösning i förfylld spruta är en klar till opaliserande, färglös till brungul lösning.
Förpackningsstorlek med en steril injektionsfilternål med extra tunna väggar (30 G x ½ tum, 0,30 mm x 12,7 mm, 5 µm), tillsammans med en förfylld spruta, endast för engångsbruk.
Innehavare av godkännande för försäljning
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Tyskland
Tillverkare
Roche Pharma AG
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Tyskland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
België/Belgique/Belgien Luxembourg/Luxemburg N.V. Roche S.A. België/Belgique/Belgien Tél/Tel: +32 (0) 2 525 82 11 | Lietuva UAB “Roche Lietuva” Tel: +370 5 2546799 |
България Рош България ЕООД Тел: +359 2 474 5444 | |
Česká republika Roche s. r. o. Tel: +420 - 2 20382111 | Magyarország Roche (Magyarország) Kft. Tel: +36 - 1 279 4500 |
Danmark Roche Pharmaceuticals A/S Tlf: +45 - 36 39 99 99 | |
Deutschland Roche Pharma AG Tel: +49 (0) 7624 140 | Nederland Roche Nederland B.V. Tel: +31 (0) 348 438050 |
Eesti Roche Eesti OÜ Tel: + 372 - 6 177 380 | Norge Roche Norge AS Tlf: +47 - 22 78 90 00 |
Ελλάδα, Κύπρος Roche (Hellas) A.E. Ελλάδα Τηλ: +30 210 61 66 100 | Österreich Roche Austria GmbH Tel: +43 (0) 1 27739 |
España Roche Farma S.A. Tel: +34 - 91 324 81 00 | Polska Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88. |
France Roche Tél: +33 (0)1 47 61 40 00 | Portugal Roche Farmacêutica Química, Lda Tel: +351 - 21 425 70 00 |
Hrvatska Roche d.o.o. Tel: + 385 1 47 22 333 | România Roche România S.R.L. Tel: +40 21 206 47 01 |
Ireland/Malta Roche Products (Ireland) Ltd. Ireland/L-Irlanda Tel: +353 (0) 1 469 0700 | Slovenija Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00 |
Ísland Roche Pharmaceuticals A/S c/o Icepharma hf Sími: +354 540 8000 | Slovenská republika Roche Slovensko, s.r.o. Tel: +421 - 2 52638201 |
Italia Roche S.p.A. Tel: +39 - 039 2471 | Suomi/Finland Roche Oy Puh/Tel: +358 (0) 10 554 500 |
Sverige Roche AB Tel: +46 (0) 8 726 1200 | |
Latvija Roche Latvija SIA Tel: +371 - 6 7039831 |
Denna bipacksedel ändrades senast 05/2025
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu.
Direktiv för experterna inom hälsovården
Följande information är enbart riktad till vårdpersonal:
Instruktion för användning av förfylld spruta:
| Innan du börjar | |
| Läs hela instruktionen noga innan användning av Vabysmo. | |
| Förpackningen med Vabysmo innehåller: | |
| En steril förfylld spruta i en förseglad innerförpacknig. Den förfyllda sprutan är endast avsedd för engångsbruk. | |
| En steril, 30 G x tum, ETW (extra tunn vägg) injektionsfilternål med integrerat filter i mynningen. Injektionsfilternålen är endast avsedd för engångsbruk. | |
| Använd endast medföljande injektionsfilternål för administrering, då den är tillverkad för säker oftalmisk användning av detta läkemedel. | |
| Vabysmo ska förvaras I kylskåp vid 2°C – 8°C. | |
| Får ej frysas. | |
| Möjliggör så att den förfyllda sprutan når rumstemperatur, 20 °C till 25 ° innan läkemedlet administreras. | |
 | Innan användning, förvara den förseglade innerförpackningen i ytterförpackningen för att skydda mot ljus. Ljuskänsligt. Före användning kan den oöppnade förfyllda sprutan förvaras vid rumstemperatur, 20 °C till 25 °C i upp till 24 timmar. |
| Vabysmo ska inspekteras visuellt före administrering. | |
| Använd inte förpackningen om försegling har brutits. | |
| Använd inte om förpackningen, den förfyllda sprutan eller injektionsfilternålen har nått utgångsdatum, skadats eller har manipulerats. | |
| Använd inte om injektionsfilternålen saknas. | |
| Lossa inte fingergreppet om sprutan. | |
| Använd inte om sprutlocket har lossnat från Luer Lock. | |
| Använd inte om lösningen i den förfyllda sprutan innehåller synliga partiklar eller är missfärgad. Vabysmo är en klar till opaliserande, färglös till brungul lösning. | |
| Förpackningens innehåll | ||
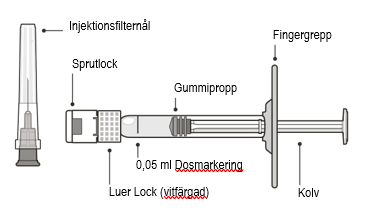
Figur A | ||
| Beskrivning av sprutan | ||
Figur B | ||
| Avlägsnandet av sprutan från innerförpackningen (steg 1) och alla efterföljande steg ska utföras med aseptisk teknik. | ||
| Öppna innerförpackningen och ta bort sprutlocket | ||
| 1 | Dra av locket från innerförpackningen och lyft ur sprutan aseptiskt. | |
| 2 | Håll sprutan i den vita ringen, bryt av sprutans lock (se figur C). | |
| Vrid inte av locket. | ||
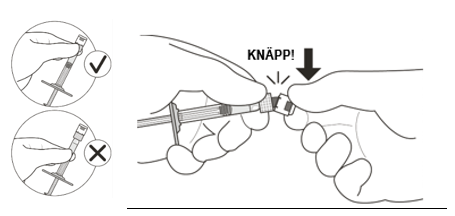 Figur C | ||
| Sätt på injektionsfilternålen | ||
| 3 | Ta aseptiskt ur filternålen från dess förpackning. | |
| 4 | Sätt på filternålen på sprutans Luer Lock med ett fast grepp och med aseptisk tekning (se figur D). | |
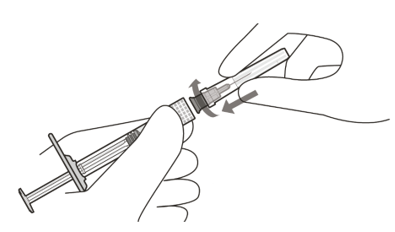 Figur D | Använd endast den medföljande injektionsfilternålen för administreringen | |
| 5 | Ta försiktigt av nålens skydd genom att dra det rakt ut. | |
| Avlägsna luftbubblor | ||
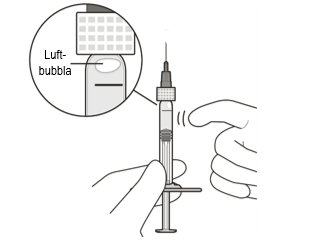
| 6 | Hållsprutan så att nålen pekar uppåt. Kontrollera om det finns luftbubblor I sprutan. | |
| 7 | Om det finns luftbubblor i sprutan, knacka försiktigt på sprutan med ditt finger tills bubblorna når toppen på sprutan (se figur E). | |
Figur E | ||
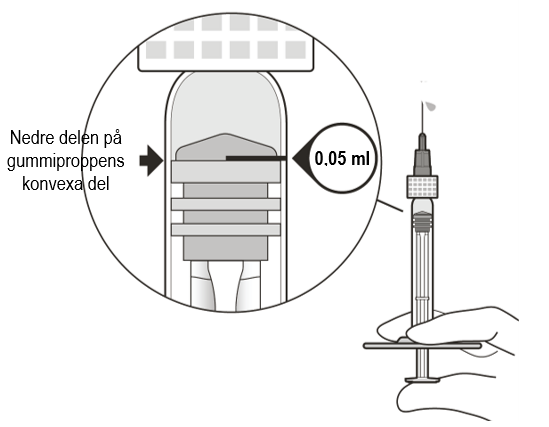
| Justera läkemedelsdosen och avlägsna luftbubblor | ||
| 8 | Håll sprutan i ögonhöjd och tryck långsamt på kolvstången tills den nedre kanten på gummiproppens konvexa del är i linje med dosmarkeringen 0,05 ml (se figur F). Luft och överflödig lösning sprutas då ut och dosen ställs in på 0,05 ml. | |
| Säkerställ att injektionen ges omedelbart efter att dosen har beretts. | ||
Figur F | ||
| Injektion | ||
| 9 | Injektionen ska ges under aseptiska förhållanden. Ge injektionen långsamt tills gummiproppen når botten på sprutan för att leverera en volym på 0,05 ml. Sätt inte tillbaka nålskyddet och ta inte av injektionsfilterkanylen från sprutan. Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar. | |