Pakkausseloste
VABYSMO injektioneste, liuos, esitäytetty ruisku 120 mg/ml
Vabysmo 120 mg/ml injektioneste, liuos, esitäytetty ruisku
farisimabi
Lisäseuranta
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista. Ks. kohdan Mahdolliset haittavaikutukset lopusta, miten haittavaikutuksista ilmoitetaan.
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Pakkausselosteen lisäksi saat lääkäriltä potilasoppaan, jossa on tärkeitä turvallisuutta koskevia tietoja. Niistä saat tietoa Vabysmo-valmisteeseen liittyvistä hyödyistä ja riskeistä sekä toimenpiteistä, joihin sinun on ryhdyttävä, jos sinulla ilmenee tiettyjä oireita.
Tässä pakkausselosteessa kerrotaan
1. Mitä Vabysmo on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat Vabysmo-valmistetta
3. Miten Vabysmo-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. Vabysmo-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Vabysmo on ja mihin sitä käytetään
Vabysmo sisältää vaikuttavana aineena farisimabia, joka kuuluu uudissuonittumista estävien lääkeaineiden ryhmään.
Lääkäri antaa Vabysmo-pistoksen silmään seuraavien silmäsairauksien hoitoon aikuisilla:
- kostea silmänpohjan ikärappeuma
- diabeettisesta makulaturvotuksesta aiheutuva näkökyvyn heikkeneminen
- verkkokalvon laskimotukoksesta (verkkokalvon haaralaskimotukos tai verkkokalvon keskuslaskimotukos) johtuvan makulaturvotuksen aiheuttaman näkökyvyn heikkeneminen.
Nämä sairaudet vaikuttavat verkkokalvon (silmän takaosan valoa aistiva kerros) keskiosaan eli makulaan, jossa on keskeinen tarkan näön keskus. Kostea silmänpohjan ikärappeuma aiheutuu poikkeavien verisuonten kasvusta. Niistä vuotaa makulaan verta ja nestettä. Diabeettinen makulaturvotus aiheutuu verisuonten vuotamisesta, mikä aiheuttaa makulan turpoamisen. Verkkokalvon keskuslaskimotukos on verta pois verkkokalvosta kuljettavan pääasiallisen verisuonen tukos, ja verkkokalvon haaralaskimotukos on puolestaan pääverisuonen yhden pienemmän haaran tukos. Näissä verisuonissa noussut paine aiheuttaa nesteen vuotamista verkkokalvoon, jolloin makula turpoaa (makulaturvotus).
Miten Vabysmo vaikuttaa
Vabysmo tunnistaa spesifisesti angiopoietiini‑2- ja verisuonen endoteelitekijä A ‑nimiset valkuaisaineet ja sitoutuu niihin. Kun näitä valkuaisaineita on normaalia enemmän, ne voivat aiheuttaa poikkeavien verisuonten kasvua ja/tai ne voivat vaurioittaa normaaleja verisuonia, jolloin ne vuotavat makulaan ja aiheuttavat sen turpoamisen tai vaurioitumisen, mikä puolestaan heikentää henkilön näkökykyä. Vabysmo voi näihin valkuaisaineisiin kiinnittymällä estää niiden toimintaa ja ehkäistä poikkeavien verisuonten kasvua, vuotamista ja siten turvotusta. Vabysmo voi lievittää näitä sairauksia ja/tai hidastaa niiden pahenemista ja siten ylläpitää tai jopa parantaa näkökykyä.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Sinulle ei saa antaa Vabysmo-valmistetta
- jos olet allerginen farisimabille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on aktiivinen tai epäilty infektio silmässä tai silmän ympärillä
- jos sinulla on kipua tai punoitusta silmässä (silmätulehdus).
Jos jokin edellä mainituista koskee sinua, kerro siitä lääkärille. Sinulle ei pidä antaa Vabysmo-valmistetta.
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen Vabysmo-valmisteen saamista
- jos sinulla on silmänpainetauti eli glaukooma (silmäsairaus, joka tavallisesti aiheutuu korkeasta silmänpaineesta)
- jos sinulla on aiemmin ollut näkökentässä valonvälähdyksiä tai lasiaiskellujia (tummia kelluvia pilkkuja) ja jos lasiaiskellujien koko tai määrä on äkillisesti suurentunut
- jos olet ollut silmäleikkauksessa edeltävien 4 viikon aikana tai jos sinulle suunnitellaan silmäleikkausta seuraavien neljän viikon aikana
- jos sinulla on joskus ollut jokin silmäsairaus tai olet saanut silmään hoitoa.
Kerro lääkärille heti
- jos menetät äkillisesti näkökykysi
- jos sinulle kehittyy mahdollisen silmäinfektion tai ‑tulehduksen oireita, kuten lisääntynyttä silmän punoitusta, silmäkipua, lisääntynyttä epämukavuuden tunnetta silmässä, näkökyvyn sumenemista tai heikkenemistä, pienten hiukkasten määrän lisääntymistä näkökentässä, lisääntyvää valonarkuutta.
Sinun on lisäksi tärkeää olla tietoinen, että
- kummankin silmän samalla kertaa tehtävän Vabysmo-hoidon turvallisuutta ja tehoa ei ole tutkittu ja tällainen käyttö voi lisätä haittavaikutusten riskiä
- Vabysmo-pistoksista voi aiheutua joillekin potilaille tilapäistä silmänpaineen kohoamista 60 minuutin kuluessa pistoksesta. Lääkäri seuraa tätä jokaisen pistoksen jälkeen.
- lääkäri tarkistaa, onko sinulla muita riskitekijöitä, jotka voivat lisätä silmän takaosan kerrosten repeämän tai irtauman (verkkokalvon irtauman tai repeämän tai verkkokalvon pigmenttiepiteelin repeämän tai irtauman) todennäköisyyttä, jolloin Vabysmo-pistoksen antamisessa pitää olla varovainen.
Joidenkin Vabysmo-valmisteen kanssa samankaltaisesti vaikuttavien lääkkeiden käyttöön tiedetään liittyvän verisuonet tukkivien veritulppien riski (valtimotromboemboliset tapahtumat); ne voivat johtaa sydäninfarktiin tai aivohalvaukseen. Silmään annettavan Vabysmo-pistoksen jälkeen pieniä määriä lääkettä pääsee vereen, joten tällaisten tapahtumien riski on teoriassa mahdollinen.
Hoidosta seuraavissa tilanteissa on vain rajallisesti kokemusta:
- potilaat, joilla on aktiivisia infektioita
- potilaat, joilla on kostea silmänpohjan ikärappeuma tai verkkokalvon laskimotukos ja jotka ovat iältään 85-vuotiaita tai sitä vanhempia
- potilaat, joilla on tyypin I diabeteksesta johtuva diabeettinen makulaturvotus
- diabetespotilaat, joiden keskimääräinen verensokeriarvo on korkea (HbA1c yli 10 %)
- diabetespotilaat, joilla on diabeteksesta aiheutuva silmäsairaus nimeltään proliferatiivinen diabeettinen retinopatia
- diabetespotilaat, joilla on korkea verenpaine (yli 140/90 mmHg) ja verisuonitauti
- potilaat, joilla on diabeettista makulaturvotusta ja jotka saavat injektioita pitkään alle 8 viikon välein.
Potilaista, jotka saavat injektioita pitkään alle 8 viikon välein, on vain rajallisesti kokemusta, ja näillä potilailla saattaa olla tavanomaista suurempi haittavaikutusten riski.
Hoidosta seuraavassa tilanteessa ei ole kokemusta:
- potilaat, joilla on diabetes tai verkkokalvon laskimotukos ja joiden korkea verenpaine on huonossa hoitotasapainossa.
Jos jokin edellä mainituista koskee sinua, lääkäri huomioi näiden tietojen puuttumisen hoitaessaan sinua Vabysmo-valmisteella.
Lapset ja nuoret
Vabysmo-valmisteen käyttöä ei ole tutkittu lapsilla eikä nuorilla, koska kosteaa silmänpohjan ikärappeumaa, diabeettista makulaturvotusta ja verkkokalvon laskimotukoksia esiintyy pääasiassa aikuisilla.
Muut lääkevalmisteet ja Vabysmo
Kerro lääkärille, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Vabysmo-valmistetta ei ole tutkittu raskaana olevilla naisilla. Vabysmo-valmistetta ei pidä käyttää raskauden aikana, paitsi jos mahdollinen hyöty potilaalle on sikiölle aiheutuvaa mahdollista riskiä suurempi.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä.
Imetystä ei suositella Vabysmo-hoidon aikana, sillä ei tiedetä, erittyykö Vabysmo ihmisillä äidinmaitoon.
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja vähintään kolmen kuukauden ajan Vabysmo-hoidon päättymisen jälkeen. Jos voit tulla raskaaksi tai epäilet olevasi raskaana hoidon aikana, kerro siitä heti lääkärille.
Ajaminen ja koneiden käyttö
Sinulla voi olla tilapäisiä näköhäiriöitä (esim. näön sumenemista) Vabysmo-pistoksen jälkeen. Älä aja moottoriajoneuvoa äläkä käytä koneita tällaisten vaikutusten aikana.
Vabysmo sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Vabysmo sisältää polysorbaattia
Tämä lääkevalmiste sisältää 0,02 mg polysorbaattia per 0,05 ml:n annos. Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla on allergioita, kerro asiasta lääkärille.
Miten valmistetta käytetään
Miten Vabysmo-valmistetta annetaan
Suositeltu annos on 6 mg farisimabia.
Kostea silmänpohjan ikärappeuma
- Saat kolmen ensimmäisen kuukauden ajan yhden pistoksen kuukaudessa.
- Sen jälkeen saatat saada pistoksia 4 kuukauden välein. Lääkäri päättää pistosten antovälin silmäsairautesi perusteella.
Diabeettisesta makulaturvotuksesta ja verkkokalvon laskimotukoksen (verkkokalvon haaralaskimotukos tai verkkokalvon keskuslaskimotukos) seurauksena kehittyneestä makulaturvotuksesta aiheutunut näkökyvyn heikkeneminen
- Saat yhden pistoksen joka kuukausi vähintään 3 kuukauden ajan.
- Sen jälkeen saat pistoksia harvemmin. Lääkäri päättää pistosten antovälin silmäsairautesi perusteella.
Antotapa
Silmään annettaviin pistoksiin perehtynyt lääkäri antaa Vabysmo-valmisteen pistoksena silmään (pistoksena lasiaiseen).
Lääkäri puhdistaa silmän ennen pistosta desinfioivalla silmähuuhteella infektion estämiseksi. Lääkäri puuduttaa silmän silmätipoilla (paikallispuudutteella) pistoksesta aiheutuvan kivun vähentämiseksi tai estämiseksi.
Miten kauan Vabysmo-hoito kestää
Kyse on pitkäaikaisesta hoidosta, joten se voi kestää kuukausia tai vuosia. Lääkäri seuraa vointiasi säännöllisin väliajoin tarkistaakseen, että hoito tehoaa. Lääkäri voi tihentää tai harventaa hoitoasi sen mukaan, millaisen vasteen saat Vabysmo-hoitoon.
Jos Vabysmo-annos jää saamatta
Jos annos jää saamatta, sovi lääkärin kanssa mahdollisimman pian uusi hoitoaika.
Jos lopetat Vabysmo-valmisteen käytön
Keskustele lääkärin kanssa ennen hoidon lopettamista. Hoidon lopettaminen voi lisätä riskiä, että menetät näkökykysi tai että näkökykysi heikkenee.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Vabysmo-pistosten haittavaikutukset liittyvät joko itse lääkkeeseen tai pistostoimenpiteeseen ja kohdistuvat pääasiassa silmään.
Jotkut haittavaikutukset voivat olla vakavia
Ota heti yhteyttä lääkäriin, jos sinulla on jokin seuraavista allergisten reaktioiden, tulehdusten tai infektioiden mahdollisista oireista:
- silmäkipua, lisääntynyttä epämukavuuden tunnetta, lisääntynyttä silmän punoitusta, sumentunut tai heikentynyt näkökyky, lisääntynyt pienten hiukkasten määrä näkökentässä tai lisääntynyttä valonarkuutta, sillä nämä ovat mahdollisen silmätulehduksen tai ‑infektion tai allergisen reaktion oireita
- äkillinen näkökyvyn heikkeneminen tai muutos.
Muut mahdolliset haittavaikutukset
Vabysmo-hoidon jälkeen ilmeneviä muita mahdollisia haittavaikutuksia luetellaan seuraavassa.
Haittavaikutukset ovat useimmiten lieviä tai keskivaikeita ja häviävät yleensä viikon kuluessa pistoksesta.
Jos jokin seuraavista haittavaikutuksista kehittyy vaikea-asteiseksi, ota yhteyttä lääkäriin.
Hyvin yleiset (voivat ilmetä useammalla kuin 1 henkilöllä kymmenestä):
- ei ole.
Yleiset (voivat ilmetä enintään 1 henkilöllä kymmenestä):
- samentunut silmän mykiö (kaihi).
- yhden silmän takaosan kerroksen repeämä (verkkokalvon pigmenttiepiteelin repeämä – vain kostea silmänpohjan ikärappeuma)
- silmän sisäosan hyytelömäisen aineen irtauma (lasiaisen irtauma)
- paineen nousu silmän sisällä (kohonnut silmänpaine)
- verenvuoto silmän ulomman kerroksen pienistä verisuonista (sidekalvon verenvuoto)
- liikkuvat pilkut tai tummat hahmot näkökentässä (lasiaiskellujat)
- silmäkipu.
Melko harvinaiset (voivat ilmetä enintään 1 henkilöllä sadasta):
- silmän sisäosan vakava tulehdus tai infektio (endoftalmiitti)
- silmän sisäosan hyytelömäisen aineen tulehdus / silmän punoitus (vitreiitti)
- silmän värikalvon ja sen liitännäiskudosten tulehdus (iriitti, iridosykliitti, uveiitti)
- silmänsisäinen verenvuoto (lasiaisverenvuoto)
- epämukavuuden tunne silmässä
- kutina (silmän kutina)
- verkkokalvon (silmän valoa aistivan takaosan) repeämä
- silmän punoitus (silmän/sidekalvon hyperemia)
- rikan tunne silmässä
- näön sumeneminen
- heikentynyt näöntarkkuus (vähentynyt näöntarkkuus)
- kipu toimenpiteen aikana (toimenpiteeseen liittyvä kipu)
- verkkokalvon irtauma
- lisääntynyt kyynelten tuotanto (lisääntynyt kyynelvuoto)
- sarveiskalvon naarmu, värikalvoa silmämunassa peittävän kirkkaan kerroksen vaurio (sarveiskalvon naarmu)
- silmä-ärsytys.
Harvinaiset (voivat ilmetä enintään 1 henkilöllä tuhannesta):
- tilapäisesti heikentynyt näöntarkkuus (tilapäisesti vähentynyt näöntarkkuus)
- vammasta aiheutuva mykiön samentuminen (traumaperäinen kaihi).
Tuntematon
- verkkokalvon vaskuliitti (silmän takaosan verisuonten tulehdus)
- verkkokalvon okklusiivinen vaskuliitti (verisuonten tukkeutuminen silmän takaosassa, tyypillisesti tulehduksen yhteydessä).
Joidenkin Vabysmo-valmisteen kanssa samankaltaisesti vaikuttavien lääkkeiden käyttöön tiedetään liittyvän verisuonet tukkivien veritulppien riski (valtimotromboemboliset tapahtumat); ne voivat johtaa sydäninfarktiin tai aivohalvaukseen. Silmään annettavan Vabysmo-pistoksen jälkeen pieniä määriä lääkettä pääsee vereen, joten tällaisten tapahtumien riski on teoriassa mahdollinen.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Lääkäri, apteekkihenkilökunta tai sairaanhoitaja vastaa tämän lääkkeen säilyttämisestä ja hävittää käyttämättä jäävän valmisteen asianmukaisesti. Seuraavat tiedot on tarkoitettu terveydenhuollon ammattilaisille.
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa ja etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2–8 °C).
Ei saa jäätyä.
Pidä avaamaton repäisypakkaus alkuperäisessä kartonkikotelossa. Esitäytetty ruisku on herkkä valolle.
Esitäytettyä ruiskua voidaan säilyttää huoneenlämmössä (20–25 °C) alkuperäisessä kartonkikotelossa enintään 24 tuntia.
Pakkauksen sisältö ja muuta tietoa
Mitä Vabysmo sisältää
- Vaikuttava aine on farisimabi. Yksi ml injektionestettä, liuosta, sisältää 120 mg farisimabia. Yksi esitäytetty ruisku sisältää 21 mg farisimabia 0,175 ml:ssa liuosta. Tästä saadaan käyttöannokseksi 0,05 ml:n kerta-annos liuosta, joka sisältää 6 mg farisimabia.
- Muut aineet ovat L‑histidiini, etikkahappo 30 % (E 260), L‑metioniini, natriumkloridi, sakkaroosi, polysorbaatti 20 (E 432), injektionesteisiin käytettävä vesi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Vabysmo sisältää natriumia” ja ”Vabysmo sisältää polysorbaattia”).
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Vabysmo 120 mg/ml injektioneste, liuos, (injektioneste) esitäytetyssä ruiskussa on kirkas tai opalisoiva, väritön tai ruskehtavankeltainen liuos.
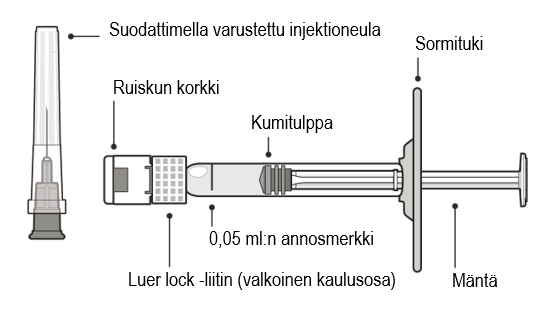
Pakkauskoko: yksi erittäin ohut steriili, suodattimella varustettu injektioneula (30G x ½”, 0,30 mm x 12,7 mm, 5 µm) yhteispakkauksessa yhden esitäytetyn ruiskun kanssa. Vain kertakäyttöön.
Myyntiluvan haltija
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Saksa
Valmistaja
Roche Pharma AG
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
België/Belgique/Belgien, Luxembourg/Luxemburg N.V. Roche S.A. België/Belgique/Belgien Tél/Tel: +32 (0) 2 525 82 11 | Lietuva UAB “Roche Lietuva” Tel: +370 5 2546799 |
България Рош България ЕООД Тел: +359 2 474 5444 | |
Česká republika Roche s. r. o. Tel: +420 - 2 20382111 | Magyarország Roche (Magyarország) Kft. Tel: +36 - 1 279 4500 |
Danmark Roche Pharmaceuticals A/S Tlf: +45 - 36 39 99 99 | |
Deutschland Roche Pharma AG Tel: +49 (0) 7624 140 | Nederland Roche Nederland B.V. Tel: +31 (0) 348 438050 |
Eesti Roche Eesti OÜ Tel: + 372 - 6 177 380 | Norge Roche Norge AS Tlf: +47 - 22 78 90 00 |
Ελλάδα, Κύπρος Roche (Hellas) A.E. Ελλάδα Τηλ: +30 210 61 66 100 | Österreich Roche Austria GmbH Tel: +43 (0) 1 27739 |
España Roche Farma S.A. Tel: +34 - 91 324 81 00 | Polska Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88. |
France Roche Tél: +33 (0)1 47 61 40 00 | Portugal Roche Farmacêutica Química, Lda Tel: +351 - 21 425 70 00 |
Hrvatska Roche d.o.o. Tel: + 385 1 47 22 333 | România Roche România S.R.L. Tel: +40 21 206 47 01 |
Ireland/Malta Roche Products (Ireland) Ltd. Ireland/L-Irlanda Tel: +353 (0) 1 469 0700 | Slovenija Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00 |
Ísland Roche Pharmaceuticals A/S c/o Icepharma hf Sími: +354 540 8000 | Slovenská republika Roche Slovensko, s.r.o. Tel: +421 - 2 52638201 |
Italia Roche S.p.A. Tel: +39 - 039 2471 | Suomi/Finland Roche Oy Puh/Tel: +358 (0) 10 554 500 |
Sverige Roche AB Tel: +46 (0) 8 726 1200 | |
Latvija Roche Latvija SIA Tel: +371 - 6 7039831 |
Tämä pakkausseloste on tarkistettu viimeksi toukokuussa 2025
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu.
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
Esitäytetyn ruiskun käyttöohjeet:
| Ennen aloittamista | |
| Lue kaikki ohjeet huolellisesti ennen Vabysmo-valmisteen käyttöä. | |
| Vabysmo-pakkaukseen sisältyy: | |
| Steriili esitäytetty ruisku avaamattomassa repäisypakkauksessa. Esitäytetty ruisku on tarkoitettu vain kerta-annoksen antamiseen. | |
| Steriili, erittäin ohut (30G x ½”) suodattimella varustettu injektioneula, jonka kannassa on sisäänrakennettu suodatin. Suodattimella varustettu injektioneula on tarkoitettu vain kertakäyttöön. | |
Käytä antoon vain pakkaukseen sisältyvää suodattimella varustettua injektioneulaa, sillä se on suunniteltu varmistamaan, että lääkevalmisteen käyttö silmään on turvallista. | |
| Vabysmo pitää säilyttää jääkaapissa 2–8 ºC:n lämpötilassa. | |
| Ei saa jäätyä. | |
| Anna Vabysmo-valmisteen lämmetä huoneenlämpöiseksi (20–25 °C) ennen kuin siirryt sen antamiseen. | |
 | Pidä avaamaton repäisypakkaus ennen käyttöä alkuperäisessä kartonkikotelossa. Esitäytetty ruisku on herkkä valolle. Esitäytettyä ruiskua voidaan säilyttää huoneenlämmössä alkuperäisessä kartonkikotelossa enintään 24 tuntia. |
| Vabysmo-valmiste pitää tarkistaa silmämääräisesti ennen antoa. | |
| Ei saa käyttää, jos kartonkikotelon sinettejä on peukaloitu. | |
| Ei saa käyttää, jos pakkaus, esitäytetty ruisku ja/tai suodattimella varustettu injektioneula on vaurioitunut, niiden viimeinen käyttöpäivämäärä on ohitettu tai niitä on peukaloitu. | |
| Ei saa käyttää, jos suodattimella varustettu injektioneula puuttuu. | |
| Sormitukea ei saa poistaa ruiskusta. | |
| Ei saa käyttää, jos ruiskun korkki on irrotettu Luer lock ‑liittimestä. | |
| Ei saa käyttää, jos havaitaan hiukkasia, samentumaa tai värimuutos. Vabysmo on kirkas tai opalisoiva ja väritön tai ruskehtavankeltainen nestemäinen liuos. | |
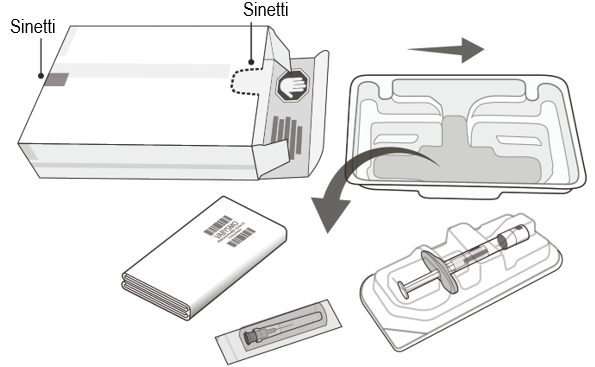
| Kartonkikotelon sisältö | ||
Kuva A | ||
| Antolaitteen kuvaus | ||
Kuva B | ||
| Noudata ruiskun poistamisessa repäisypakkauksestaan (vaihe 1) ja kaikissa seuraavissa vaiheissa aseptista tekniikkaa. | ||
| Avaa repäisypakkaus ja poista ruiskun korkki | ||
| 1 | Vedä ruiskun repäisypakkauksen kansi irti ja poista esitäytetty ruisku repäisypakkauksesta aseptisesti. | |
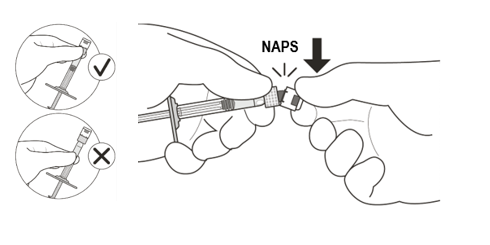
| 2 | Pitele ruiskua valkoisesta kaulusosasta ja napsauta ruiskun korkki irti (ks. kuva C). | |
| Älä kierrä korkkia irti. | ||
Kuva C | ||
| Kiinnitä suodattimella varustettu injektioneula | ||
| 3 | Poista suodattimella varustettu injektioneula pakkauksestaan aseptisesti. | |
| 4 | Kiinnitä suodattimella varustettu injektioneula aseptisesti ja tukevasti kiinni Luer lock ‑ruiskuun (ks. kuva D). | |
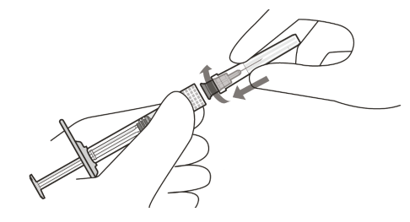 Kuva D | Käytä antoon vain pakkaukseen sisältyvää suodattimella varustettua injektioneulaa | |
| 5 | Irrota neulansuojus vetämällä se varovasti suoraan irti. | |
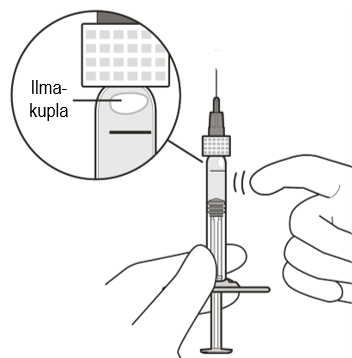
| Poista ilmakuplat | ||
| 6 | Pitele ruiskua suodattimella varustettu injektioneula ylöspäin osoittaen ja tarkista, onko ruiskussa ilmakuplia. | |
| 7 | Jos näet ilmakuplia, naputtele ruiskua varovasti sormella, kunnes kuplat nousevat yläosaan (ks. kuva E). | |
Kuva E | ||
| Säädä lääkevalmisteannos ja poista ilma | ||
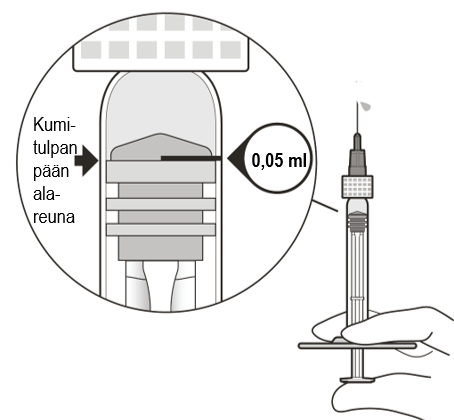
| 8 | Pitele ruiskua silmiesi tasolla ja paina mäntää hitaasti, kunnes kumitulpan pään alareuna on 0,05 ml:n annosmerkin kohdalla (ks. kuva F). Näin ilma ja ylimääräinen tilavuus poistuvat ruiskusta ja jäljelle jää 0,05 ml:n annos. | |
| Varmista, että injektio annetaan heti annoksen valmistelun jälkeen. | ||
Kuva F | ||
| Injektion antaminen | ||
| 9 | Injektio on annettava aseptisissa olosuhteissa. Injisoi hitaasti, kunnes kumitulppa on painettu ruiskun pohjaan ja 0,05 ml:n tilavuus on siten annettu. Älä laita neulansuojusta takaisin suodattimella varustetun injektioneulan päälle tai irrota neulaa ruiskusta. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti. | |