Pakkausseloste
CUTAQUIG injektionsvätska, lösning 165 mg/ml
Tilläggsinformation
Cutaquig 165 mg/ml, injektionsvätska, lösning
humant normalt immunoglobulin (SCIg)
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Cutaquig är och vad det används för
2. Vad du behöver veta innan du använder Cutaquig
3. Hur du använder Cutaquig
4. Eventuella biverkningar
5. Hur Cutaquig ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Cutaquig är
Cutaquig tillhör läkemedelsgruppen med s.k. humana normala immunglobuliner. Immunglobuliner kallas även antikroppar och är proteiner som finns i blodet hos friska personer. Antikroppar är del av immunsystemet (kroppens naturliga försvar) och hjälper kroppen att bekämpa infektioner.
Hur Cutaquig verkar
Cutaquig innehåller immunglobuliner som har framställts av blod från friska personer. Medicinen fungerar på exakt samma sätt som de immunglobuliner som finns naturligt i ditt blod.
Vad Cutaquig används för
Cutaquig används hos patienter som inte har tillräckligt med antikroppar för att bekämpa infektioner och därmed har en benägenhet för att ofta få infektioner. Regelbunden användning av Cutaquig i tillräcklig dos kan höja onormalt låga immunglobulinnivåer i blodet till normala nivåer (ersättningsbehandling).
Cutaquig ordineras till vuxna och barn (0‑18 år) i följande situationer:
Behandling av patienter som föds med nedsatt förmåga eller oförmåga att producera antikroppar (primär immunbrist).
Patienter med förvärvad brist på antikroppar (sekundär immunbrist) på grund av specifika sjukdomar och/eller behandlingar och som upplever svåra eller återkommande infektioner.
Vad du behöver veta innan produkten används
Använd inte Cutaquig:
- om du är allergisk mot humant immunglobulin eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Injicera INTE Cutaquig i ett blodkärl.
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder Cutaquig.
Du kan vara allergisk (överkänslig) mot immunglobulin utan att veta om det.
Allvarliga allergiska reaktioner, som till exempel plötsligt blodtrycksfall eller anafylaktisk chock (ett kraftigt blodtrycksfall med andra symtom som svullnad i halsen, andningssvårigheter och hudutslag) är sällsynta men kan förekomma emellanåt även om du har fått humana immunglobuliner tidigare och tålt det bra. Det kan hända om du inte har tillräckligt med immunglobulin typ A (IgA) i blodet (IgA-brist) och har antikroppar mot IgA.
- Före behandling, tala om för läkare eller sjukvårdspersonal om du har brist på immunglobulin typ IgA. Cutaquig innehåller restmängder av IgA, som kan orsaka en allergisk reaktion.
I sådana sällsynta fall kan allergiska reaktioner som till exempel plötsligt blodtrycksfall eller chock inträffa (se även avsnitt Eventuella biverkningar).
Tecken och symtom på dessa sällsynta allergiska reaktioner omfattar- ostadighetskänsla, yrsel, svimning
- hudutslag och klåda, svullnad i mun eller svalg, andningssvårigheter, väsande andning
- onormal hjärtfrekvens, bröstsmärtor, blå missfärgning av läppar eller fingrar och tår
- dimsyn.
Tala omedelbart om för läkaren om du märker sådana tecken under Cutaquig-infusionen.
Läkaren avgör om infusionshastigheten ska sänkas eller om infusionen ska avbrytas helt och hållet.
- Tala om för läkaren om du tidigare har haft en hjärt–kärlsjukdom eller blodproppar, har tjockt blod eller har varit immobiliserad en längre tid. Dessa saker kan öka risken för att du ska få en blodpropp efter att ha använt Cutaquig. Tala även om för läkaren vilka läkemedel du använder, eftersom vissa läkemedel, till exempel sådana som innehåller hormonet östrogen (till exempel p-piller), kan öka risken för att du ska få en blodpropp. Kontakta din läkare omedelbart om du får tecken och symtom som andfåddhet, bröstsmärta, smärta och svullnad i en arm eller ett ben, svaghet eller domningar i ena sidan av kroppen efter att ha fått Cutaquig.
- Kontakta din läkare om du får följande tecken och symtom: svår huvudvärk, stel nacke, dåsighet, feber, ljuskänslighet, illamående och kräkning efter att ha fått Cutaquig. Detta kan vara tecken på aseptisk meningit. Din läkare avgör om det behövs fler tester och om behandlingen med Cutaquig ska fortsätta.
- Cutaquig innehåller blodgruppsantikroppar som kan orsaka nedbrytning av röda blodkroppar och därmed anemi (lågt antal röda blodkroppar).
Hälso- och sjukvårdspersonalen kommer att undvika eventuella komplikationer genom att säkerställa att:
- du inte är överkänslig mot humant normalt immunglobulin.
Läkemedlet ska infunderas långsamt i början. Den rekommenderade infusionshastigheten som anges i avsnitt Hur produkten används ska följas noggrant. - du noggrant övervakas för eventuella symtom under hela infusionsperioden, i synnerhet om:
- du får humant normalt immunglobulin för första gången
- du har bytt från ett annat läkemedel till Cutaquig
- det har varit ett långt uppehåll (mer än åtta veckor) sedan den föregående infusionen.
I dessa fall rekommenderas att du noggrant övervakas under den första infusionen och därefter i en timme. Om ovanstående punkter inte gäller för dig rekommenderas att du observeras i minst 20 minuter efter att du fått läkemedlet.
Barn och ungdomar
Listade varningar och försiktighetsåtgärder gäller för både barn och för vuxna.
Andra läkemedel och Cutaquig
- Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
- Du får inte blanda Cutaquig med andra läkemedel.
- Före vaccination ska du tala om för den vaccinerande läkaren att du behandlas med Cutaquig. Cutaquig (liksom alla lösningar med humana normala immunglobuliner) kan försämra effekten av vissa levande virusvacciner, som vaccin mot mässling, påssjuka, röda hund och vattkoppor. Efter att fått läkemedlet bör du därför vänta upp till 3 månader innan du får dessa vacciner. För mässlingvaccinationer kan denna försämring kvarstå i upp till ett år.
- Blodglukostester
Vissa system för blodglukostester (s.k. glykometertest) tolkar felaktigt maltosen som finns i Cutaquig som glukos. Det kan leda till att glukosnivåerna under en infusion och upp till 15 timmar efter infusionens slut, felaktigt avläses som förhöjda och till att insulinbehandling ges utan att det behövs, vilket kan leda till livshotande hypoglykemi (sänkt blodsockernivå).
Verklig hypoglykemi kan dessutom förbli obehandlad, om en för låg blodsockernivå maskeras av en felaktigt förhöjd glukosavläsning.
När Cutaquig eller andra produkter som innehåller maltos används ska blodsockret därför mätas med ett testsystem som tillämpar glukosspecifika metoder. System som bygger på glukosdehydrogenaspyrrolokinolinkinon (GDH PQQ) eller oxidoreduktasmetoder för glukosbestämning med färgindikator bör inte användas.
Läs produktinformationen för blodglukostestet noga – även informationen om testremsorna – för att avgöra om systemet lämpar sig för användning med parenterala produkter som innehåller maltos. Om du är osäker, fråga din behandlande läkare för att fastställa om systemet är lämpligt att använda tillsammans med parenterala produkter som innehåller maltos.
Cutaquig med mat och dryck
Inga effekter har noterats.
Graviditet, amning and fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel. Läkemedlet ska endast användas under graviditet eller amning efter samråd med läkare.
Inga kliniska studier har utförts med Cutaquig på gravida kvinnor. Däremot har läkemedel som innehåller immunglobuliner använts av gravida eller ammande kvinnor i många år och inga skadliga effekter på graviditetsförloppet, fostret eller det nyfödda barnet har observerats.
Om du ammar och får Cutaquig kan läkemedlets immunglobuliner också finnas i bröstmjölken. Därför kan ditt barn vara skyddat mot vissa infektioner.
Erfarenhet av immunglobuliner tyder på att inga skadliga effekter på fertilitet förväntas.
Körförmåga och användning av maskiner
Körförmågan och förmågan att använda maskiner kan försämras av vissa biverkningar som har samband med Cutaquig. Patienter som upplever biverkningar under behandlingen ska vänta tills dessa har gått över innan de kör eller använder maskiner.
Cutaquig innehåller natrium
Detta läkemedel innehåller 33,1 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska à 48 ml och 13,8 mg natrium per injektionsflaska à 20 ml. Detta motsvarar 1,7 % respektive 0,7 % det högsta rekommenderade dagliga dietära intag av natrium för vuxna.
Information om vad Cutaquig tillverkas av
Cutaquig framställs ur mänsklig blodplasma (den vätskeformiga delen av blodet). När läkemedel tillverkas av mänskligt blod eller plasma, vidtas speciella åtgärder för att förhindra att infektioner överförs till patienterna. Dessa omfattar:
- ett noggrant urval av blod- och plasmagivare för att säkerställa att personer med risk för att vara smittbärare utesluts
- test av enskilda donatorer och plasmapooler för tecken på virus/infektioner
- inkluderandet av steg vid beredningen av blod eller plasma som kan inaktivera eller avlägsna virus.
Trots dessa åtgärder kan risken för överföring av smittämnen inte helt uteslutas när läkemedel som framställts ur mänskligt blod eller plasma ges. Detta gäller även alla okända eller nya virus och andra typer av infektioner.
Vidtagna åtgärder anses vara effektiva mot virus med hölje, som humant immunbristvirus (hiv, viruset som orsakar aids), hepatit B-virus och hepatit C-virus.
Åtgärderna kan vara av begränsat värde mot icke höljeförsedda virus såsom hepatit A och parvovirus B19.
Inget samband har konstaterats mellan immunglobuliner och hepatit A och parvovirus B19. Detta kan bero på att produkten innehåller antikroppar mot dessa infektioner som skyddar mot smitta.
Varje gång du får en dos Cutaquig rekommenderas bestämt att läkemedlets namn och tillverkningssatsnummer journalförs för att ha en förteckning över tillverkningssatser som använts (se även bilaga I: Administreringsguide).
Hur produkten används
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Cutaquig ges som infusion under huden (subkutant, eller s.c.).
Behandlingen inleds av läkare eller sjuksköterska med erfarenhet av behandling av patienter med ett nedsatt immunsystem.
När läkaren/sjuksköterskan har fastställt vilken dos och infusionshastighet som passar dig och du har fått några infusioner under överinseende, kan du få ge dig själv läkemedlet i ditt hem eller få det i hemmet av din (utbildade) vårdgivare. Läkare eller sjuksköterska med erfarenhet av att vägleda patienter om behandling i hemmet säkerställer att du eller din vårdgivare får instruktioner och utförlig information om
- bakteriefri (aseptisk) infusionsteknik
- hur infusionsanordningen ska användas (vid behov)
- hur behandlingsdagboken ska föras
- vilka åtgärder som ska vidtas i händelse av en allvarlig biverkning (se även avsnitt Eventuella biverkningar).
När du klarar av att behandla dig själv och inga biverkningar har förekommit under behandlingen kan läkaren låta dig fortsätta behandlingen i hemmet.
Dosering
Läkaren beräknar den korrekta dosen och infusionshastigheten för dig, anpassat efter kroppsvikt, eventuell tidigare behandling och hur du svarar på behandling. Följ alltid läkarens anvisningar.
Substitutionsbehandling vid primära immunbristsyndrom:
Läkaren avgör om du behöver en laddningsdos (för vuxna och barn) på minst 1,2 till 3,0 mg/kg. Därefter får du Cutaquig med jämna mellanrum från högst en gång om dagen eller minst varannan vecka. Den kumulativa dosen per månad kommer att vara ungefär 2,4 till 4,8 ml/kg kroppsvikt. Hälso- och sjukvårdspersonalen kan justera dosen beroende på hur du svarar på behandlingen.
Substitutionsbehandling vid sekundär immunbrist:
Den rekommenderade dosen som administreras med upprepade intervall (ungefär en gång per vecka) är att uppnå en kumulativ månadsdos på 1,2–2,4 ml/kg. Varje enskild dos kan behöva injiceras på olika anatomiska ställen. Din vårdgivare kan anpassa din dos beroende på ditt behandligssvar.
Ändra inte dosen eller doseringsintervallet utan att rådfråga läkare. Om du tycker att du ska få Cutaquig oftare eller mer sällan, tala med din läkare. Om du tror att du har missat en dos, tala med din läkare snarast möjligt.
Administreringssätt och administreringsväg
Val av infusionsställe(n):
Rekommenderade områden för subkutan infusion av Cutaquig är buken, låren, överarmarna eller höftens utsida. Flera subkutana infusionsställen kan användas samtidigt. Antalet infusionsställen är obegränsat men ska vara på minst 5 cm avstånd från varandra. Växla mellan infusionsställen för varje behandlingstillfälle, enligt rekommendation från läkaren eller sjuksköterskan.
Vilken mängd som infunderas per ställe varierar men det rekommenderas att dela upp stora infusionsvolymer (> 30 ml) och infundera vid flera infusionsställen. Hos nyfödda och barn kan infusionsställe bytas var 5–15 ml.
Infusionshastighet:
Läkaren kommer att fastställa lämplig infusionshastighet för dig med hänsyn till din individuella dos, doseringsfrekvens och hur du tolererar läkemedlet.
Rekommenderad initial infusionshastighet är 15 ml/timme/ställe om du inte har fått SCIg-behandling tidigare. Om du redan får SCIg-behandling och du byter till Cutaquig bör de tidigare använda administreringshastigheterna användas för de initiala infusionerna. För efterföljande infusioner, om de tolereras väl, kan man gradvis höja infusionshastigheten med cirka 10 ml/timme/ställe varannan till var 4:e vecka för vuxna (≥ 40 kg) och upp till 10 ml/timme/ställe var 4:e vecka för barn (< 40 kg).
Därefter, om du tolererar de initiala infusionerna vid full dos per ställe och maximal hastighet, kan en ökning av infusionshastigheten för efterföljande infusioner övervägas tills en maximal flödeshastighet på 67,5 ml/timme/ställe för vuxna (≥ 40 kg) och 25 ml/timme/ställe för barn (< 40 kg) uppnås.
Detaljerade instruktioner för användning ges nedan.
Cutaquig är endast avsett för subkutan (under huden) användning. Injicera inte i ett blodkärl.
Använd endast Cutaquig i hemmet om du har fått instruktioner och vägledning av hälso- och sjukvårdspersonal.
Följ administreringsguiden i slutet av denna bipacksedel (bilaga I) steg för steg och använd aseptisk/steril teknik när du administreras Cutaquig.
När du bereder infusionen, använd handskar om du har blivit tillsagd att göra så.
Användning för barn och ungdomar
Samma indikationer, doser och infusionsfrekvenser som för vuxna gäller för barn och ungdomar (0‑18 år).
Om du använt för stor mängd av Cutaquig
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 0800 147 111) för bedömning av risken samt rådgivning.
Om du har glömt att använda Cutaquig
Informera läkare eller hälso- och sjukvårdspersonal snarats möjligt om du har missat en dos. Infundera inte dubbel dos för att kompensera för glömd dos.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, som till exempel frossa, huvudvärk, yrsel, feber, kräkningar, allergiska reaktioner, illamående, ledvärk, lågt blodtryck och måttlig ryggvärk, men alla användare behöver inte få dem.
Vissa biverkningar som till exempel huvudvärk, frossa eller kroppssmärta, kan reduceras genom att minska infusionshastigheten.
Inga relaterade allvarliga läkemedelsreaktioner observerades hos patienter behandlade med Cutaquig under de kliniska studierna som gjordes för att utvärdera säkerhet.
Du kan vara allergisk (överkänslig) mot immunglobuliner och allergiska reaktioner som till exempel plötsligt blodtrycksfall eller chock kan inträffa. Läkare känner till dessa möjliga biverkningar och kommer att övervaka dig efter de första infusionerna.
Tala omedelbart om för läkaren om du märker någon av följande:
- du känner dig yr eller svimfärdig
- hudutslag och klåda, svullnad i mun eller svalg, andningssvårigheter, väsande andning
- onormal hjärtfrekvens, bröstsmärtor, blå missfärgning av läppar eller fingrar och tår
- dimsyn.
Vid användning av Cutaquig i hemmet kan du ge infusionen i närvaro av din vårdgivare som kan hjälpa dig att hålla uppsikt över tecken på en allergisk reaktion. Vid symtom på en allergisk reaktion, avbryt infusionen och uppsök hjälp om så behövs.
Se även avsnitt Vad du behöver veta innan produkten används i denna bipacksedel om risken för allergiska reaktioner.
Följande biverkningar är mycket vanliga (kan förekomma vid 1 av 10 infusioner):
- reaktioner vid injektionsstället som till exempel rodnad, svullnad, klåda och obehag.
Följande biverkningar är mindre vanliga (kan förekomma vid fler än 1 av 1 000 och färre än 1 av 100 infusioner):
- huvudvärk
- illamående
- trötthet.
Följande biverkningar är sällsynta (kan förekomma för 1 av 10 000 infusioner):
- yrsel
- buksmärta
- uppsvälld buk
- kräkningar
- kväljningar
- muskelvärk
- ledvärk
- feber
- frossa
- obehag i bröstet
- influensaliknande sjukdom
- smärta
- allmän sjukdomskänsla
- blodprov positivt för antikroppar
- oregelbundna blodprovsresultat visar nedbrytning av röda blodkroppar
- förhöjt hemoglobin
- förhöjt blodkreatinin
- utslag
- hudreaktioner
- höga halter av vissa leverenzymer som kallas transaminaser.
Ytterligare biverkningar som inte uppkom i kliniska prövningar, men som också har rapporterats är:
- överkänslighet (t.ex. erytem, nässelutslag)
- förhöjt blodtryck
- problem på grund av bildning av blodproppar i blodkärlen (t.ex. djup ventrombos, stroke)
- blodproppar i blodkärlen (se även avsnitt Vad du behöver veta innan produkten används ”Varningar och försiktighet”)
- klåda
- ryggvärk.
Biverkningar som setts med liknande läkemedel
Dessutom har följande biverkningar observerats med infusion av subkutant humant normalt immunglobulin. Det är möjligt att personer som använder Cutaquig kan få dem.
- rysningar
- blekhet
- diarré
- smärta vid injektionsstället
- snabb rodnad av hals-/ansiktsområdet
- en känsla av värme
- köldkänsla
- svaghet
- trång känsla i halsen
- andningssvårigheter
- astmaliknande symtom
- hosta
- ansiktssvullnad
- ett syndrom som kallas aseptisk meningit (se även avsnitt Vad du behöver veta innan produkten används ”Varningar och försiktighetsåtgärder”).
Tala omedelbart om för läkaren om du får något av följande symtom. Detta kan vara tecken på ett allvarligt problem.
- Svår huvudvärk med illamående, kräkningar, nackstelhet, feber och ljuskänslighet. Detta kan vara tecken på en tillfällig och reversibel, icke smittsam svullnad i membranen som omger hjärnan och ryggraden (hjärnhinneinflammation).
- Smärta, svullnad, värmekänsla, rodnad, eller en knöl i benen eller armarna, oförklarlig andfåddhet, bröstsmärtor eller obehag som förvärras vid djupandning, oförklarlig snabb puls, domningar eller svaghet i ena sidan av kroppen, plötslig förvirring eller talsvårigheter. Detta kan vara tecken på en blodpropp.
Den här sortens biverkningar kan förekomma även om du har fått humant immunglobulin tidigare och tålt det bra.
Mer information om omständigheter som ökar risken för biverkningar finns i avsnitt Vad du behöver veta innan produkten används.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på etiketten och kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2‑8 °C). Får ej frysas. Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
Inom hållbarhetstiden kan produkten förvaras i rumstemperatur (vid högst 25 °C) i upp till 9 månader utan att förvaras i kylskåp igen, och måste kastas om den inte används efter detta.
Efter öppnande ska läkemedlet användas omedelbart.
Använd inte Cutaquig om lösningen är grumlig eller innehåller partiklar.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är humant normalt immunglobulin 165 mg/ml (av vilket minst 95 % är immunglobulin G)
- IgG1 ……….. 71 %
- IgG2 ……….. 25 %
- IgG3 ……….. 3 %
- IgG4………… 2 %
Övriga innehållsämnen är maltos, polysorbat 80 och vatten för injektionsvätskor.
Maximalt IgA-innehåll är 300 mikrogram/ml.
Cutaquig innehåller ≤ 30 mmol/l natrium.
Läkemedlets utseende och förpackningsstorlekar
Cutaquig är en injektionsvätska, lösning.
Lösningen är klar och färglös.
Vid förvaring kan lösningen bli lätt opaliserande och svagt gul.
Cutaquig finns tillgängligt som:
6, 12, 24 eller 48 ml lösning i en injektionsflaska (typ I-glas) med en propp av bromobutylgummi. Förpackningsstorlek: 1, 10 eller 20 injektionsflaskor.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning:
Octapharma AB
Lars Forssells gata 23
112 75 Stockholm
Sverige
Tillverkare:
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235
1100 Wien
Österrike
Octapharma AB
Lars Forssells gata 23
112 75 Stockholm
Sverige
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
| Belgien, Bulgarien, Danmark, Estland, Finland, Frankrike, Irland, Island, Italien, Kroatien, Lettland, Litauen, Luxembourg, Malta, Nederländerna, Norge, Österrike, Polen, Portugal, Rumänien, Slovakien, Slovenien, Spanien, Storbritannien (Norra Irland), Sverige, Tjeckiska republiken, Tyskland, Ungern: | Cutaquig® |
Denna bipacksedel ändrades senast 21.12.2023.
Tilläggsanvisningar
Bilaga I – Administreringsguide
1. Förbered det antal Cutaquig injektionsflaskor som behövs
- Låt injektionsflaskor som förvarats i kylskåp stå minst 90 minuter i rumstemperatur före infusionen.
- Injektionsflaskorna får inte värmas eller köras i mikrovågsugn.
- Undvik skumbildning genom att inte skaka injektionsflaskorna.
2. Så här förbereder du dig för infusionen
- Välj och förbered en ren arbetsyta med antiseptiska våtservetter eller desinfektionslösning (figur 1).
Figur 1
- Samla ihop infusionsutrustningen:
- infusionspump (alternativ) och passande spruta/sprutor
- nål (för att dra upp läkemedlet ur injektionsflaskan)
- infusionsaggregat
- infusionsslangar och Y-koppling (vid behov)
- alkohol och spritsuddar/antiseptiska våtservetter
- gasväv eller transparent förband och tejp
- behållare för stickande och skärande avfall
- behandlingsdagbok och penna.
- Tvätta händerna noga och låt dem torka (figur 2). Använd desinfektionsgel så som du har visats.
Figur 2
- Vid behov kan pumpen programmeras enligt bruksanvisningen och så som du har visats av hälso- och sjukvårdspersonal.
3. Så här kontrollerar du och öppnar injektionsflaskan
- Inspektera varje injektionsflaska för:
- korrekt märkt dos enligt din ordination
- kontrollera lösningens utseende (den ska vara klar och färglös till svagt gul eller ljusbrun)
- försäkra dig om att skyddshylsan inte är bruten eller saknas
- kontrollera utgångsdatum och tillverkningssatsnummer.
- Använd inte lösningen om den är grumlig eller innehåller partiklar.
- Ta av skyddshylsan.
- Desinficera gummiproppen med en antiseptisk våtservett och låt den torka (figur 3).
Figur 3
4. Så här förbereder du och fyller sprutan
- Öppna den sterila sprutan och nålen.
- Skruva fast nålen på sprutan.
- Dra tillbaka kolven för att fylla sprutan med luft vilket ska utgöra ungefär halva mängden lösnings som behövs från injektionsflaskan.
- Stick in nålen in injektionsflaskan och vänd den upp och ner. Injicera luft – kontrollera att nålspetsen inte befinner sig i lösningen för att undvika skumbildning.
- Dra sedan upp Cutaquig samtidigt som du ser till att nålen förblir i lösningen hela tiden (figur 4).

Figur 4
- Dra ut nålen ur injektionsflaskan.
- Denna procedur kan behöva upprepas om du behöver flera injektionsflaskor för den beräknade dosen.
- När du är klar tar du ut nålen och kastar den i behållaren för stickande och skärande avfall.
- Gå genast vidare till nästa steg eftersom IgG-lösningen ska användas omgående.
5. Så här förbereder du infusionspumpen och slangarna (valfritt)
- Följ tillverkarens anvisningar när du förbereder infusionspumpen.
- Prima administreringsslangen genom att ansluta sprutan till infusionsslangen och försiktig trycka in kolven för att fylla slangen med Cutaquig och avlägsna all luft (figur 5).
Figur 5
6. Så här väljer du infusionsställe och för in infusionsnålen/-nålarna
- Cutaquig kan infunderas i följande områden: buk, lär, överarm och sidan av höften (figur 6).
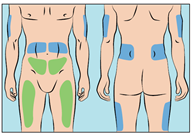
Figur 6
- Infusionsställena ska vara på minst 5 cm avstånd från varandra.
- Använd andra infusionsställen än de du använde för den föregående administrationen.
- Undvik att sticka in nålen i ärr, tatueringar, hudbristningar eller skadad/inflammerad/röd hud.
- Rengör huden runt valt/valda infusionsställe/-n med en antiseptisk våtservett och låt huden torka.
- Nyp ihop huden med tummen och pekfingret runt injektionsstället (figur 7), ta försiktigt av nålhylsan och stick in nålen under huden (figur 8). Nålens vinkel beror på vilken typ av infusionsaggregat som används.

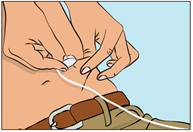
Figur 7 Figur 8
7. Så här kontrolleras infusionen
- Lösningen ska inte infunderas in ett blodkärl.
- Fäst nålen med hjälp av steril gasväv och tejp eller ett transparent förband (figur 9).
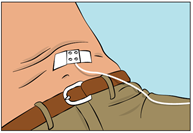
Figur 9
8. Så här påbörjar du infusionen
- Starta infusionen. Följ tillverkarens anvisningar om du använder en infusionspump för administrering.
9. Så här dokumenteras infusionen
- På varje injektionsflaska med Cutaquig finns en avdragbar etikett som anger tillverkningssatsnumret. Fäst etiketten i patients behandlingsdagbok eller infusionsloggbok. Anteckna dos, datum, tid, infusionsställe och eventuella infektioner, biverkningar eller andra kommentarer i samband med infusionen.
10. Efter avslutad infusion
- Dra försiktigt ut nålen/nålarna och kastar i behållaren för stickande och skärande avfall.
- Tryck vid behov en bit gasväv på insticksstället och sätt på ett förband.
- Kasta alla förbrukningsartiklar samt allt oanvänt läkemedel och tomma injektionsflaskor enligt rekommendation av hälso- och sjukvårdspersonal och enligt lokala bestämmelser.
Städa upp och placera all återanvändbar utrustning (t.ex. pump) på en säker plats tills nästa infusionstillfälle.