Pakkausseloste
GAMUNEX infuusioneste, liuos 100 mg/ml
Gamunex 100 mg/ml infuusioneste, liuos
ihmisen normaali immunoglobuliini (IVIg)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Gamunex on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Gamunex‑valmistetta
- Miten Gamunex‑valmistetta käytetään
- Mahdolliset haittavaikutukset
- Gamunex‑valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Gamunex on
Gamunex sisältää ihmisen normaalia immunoglobuliinia (vasta-aineita) erittäin puhdistettuna proteiinina, joka on uutettu ihmisen plasmasta (luovutetun veren osasta). Tämä lääke kuuluu laskimoon annettavien immunoglobuliinien lääkeryhmään. Tähän ryhmään kuuluvia lääkkeitä käytetään sellaisten sairauksien hoitoon, joissa elimistön immuunipuolustus ei toimi kunnolla.
Mihin Gamunex‑valmistetta käytetään
Sellaisten aikuisten, lasten ja nuorten (0–18-vuotiaiden) hoito, joilla ei ole riittävästi vasta-aineita (korvaushoito), kuten:
- potilaat, joilla on primaarinen immuunipuutosoireyhtymä (PID), eli joilla on syntymästä asti puuttunut vasta-aineita
- potilaat, joilla on hankittu immuunipuutos (SID) ja vaikeita tai toistuvia infektioita ja joilla mikrobilääkitykset eivät ole tehonneet ja joilla on joko todennettu spesifin vasta-aineen toimimattomuus tai seerumin IgG-pitoisuus < 4 g/l.
-
Taudille alttiille aikuisten, lasten ja nuorten (0-18-vuotiaiden) hoito, kun he ovat altistuneet tuhkarokolle tai ovat vaarassa altistua sille, eikä aktiivinen tuhkarokkorokotus ole aiheellista tai suositeltavaa.
Sellaisten aikuisten, lasten ja nuorten (0–18-vuotiaiden) hoito, joilla on tiettyjä autoimmuunisairauksia (immuunivasteen säätely), joita on viisi ryhmää:
- idiopaattinen trombosytopeeninen purppura (ITP), tila, jossa verihiutaleiden määrä verenkierrossa on vähentynyt huomattavasti. Verihiutaleet ovat tärkeä osa veren hyytymisprosessia ja niiden määrän vähenemisestä voi aiheutua haittavaikutuksina verenvuotoja ja mustelmia. Valmistetta käytetään myös potilaille, joilla on suuri verenvuotoriski tai joiden verihiutalemäärä on korjattava ennen leikkausta.
- Guillain-Barrén oireyhtymä, jossa immuunijärjestelmä vahingoittaa hermoja ja estää niitä toimimasta oikein
- Kawasakin tauti (tässä tapauksessa yhdessä asetyylisalisyylihappohoidon kanssa). Kawasakin tauti on lasten sairaus, jossa elimistön verisuonet (valtimot) suurenevat.
- krooninen tulehduksellinen demyelinoiva polyradikuloneuropatia (CIDP), joka on harvinainen etenevä sairaus, josta aiheutuu raajojen heikkoutta, tunnottomuutta ja kipua sekä yleistä väsymystä
- multifokaalinen motorinen neuropatia (MMN), joka harvinainen sairaus, josta aiheutuu hitaasti etenevää raajojen heikkoutta ilman tuntoaistin heikentymistä.
Sellaisten aikuisten (vähintään 18-vuotiaiden) hoito, joilla on:
- myasthenia gravisin vaikea äkillinen pahenemisvaihe. Myasthenia gravis on lihasheikkoutta aiheuttava sairaus, jonka pahenemisvaiheissa etenkin nieleminen, puhuminen ja hengittäminen vaikeutuvat.
Ihmisen normaalia immunoglobuliinia, jota Gamunex sisältää, voidaan joskus käyttää myös muiden kuin tässä pakkausselosteessa mainittujen sairauksien hoitoon. Kysy neuvoa lääkäriltä, apteekkihenkilökunnalta tai muulta terveydenhuollon ammattilaiselta tarvittaessa ja noudata aina heiltä saamiasi ohjeita.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Gamunex-valmistetta
- jos olet allerginen ihmisen normaalille immunoglobuliinille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla ei ole tarpeeksi IgA-immunoglobuliinia veressäsi ja sinulle on kehittynyt IgA-vasta-aineita.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät Gamunex‑valmistetta.
Infuusioreaktiot ja yliherkkyys
Tietyt haittavaikutukset saattavat liittyä infuusionopeuteen. Siksi suositettuja antonopeuksia on noudatettava (ks. ”Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille” tämän pakkausselosteen lopussa).
Tiettyjä haittavaikutuksia voi ilmaantua tavallista useammin
- jos infuusionopeus on suuri
- jos potilaalla on täydellinen gammaglobuliinien puutos tai gammaglobuliinien pitoisuus veressä on pieni (agammaglobulinemia tai hypogammaglobulinemia) riippumatta siitä, liittykö tähän IgA-puutos vai ei
- jos potilas saa ihmisen normaalia immunoglobuliinia ensimmäistä kertaa tai harvinaisissa tapauksissa, jos immunoglobuliinivalmistetta vaihdetaan tai jos hoitojen välillä on pitkä aika.
Mahdollisia komplikaatioita voidaan usein välttää varmistamalla
- ettet ole yliherkkä ihmisen immunoglobuliinille, kun annetaan Gamunex‑valmistetta alkuun hitaasti infusoituna.
- että sinua seurataan tarkoin koko infuusion ajan mahdollisten oireiden varalta. Sinua on tarkkailtava erityisen tarkoin, jos saat ihmisen immunoglobuliinia ensimmäistä kertaa, jos kyseessä on eri immunoglobuliini kuin aikaisemmalla infuusiokerralla tai jos et ole saanut immunoglobuliinihoitoa pitkään aikaan. Näissä tapauksissa sinua on seurattava koko ensimmäisen infuusion ajan ja vielä tunti sen päätyttyäkin mahdollisten haittavaikutusten varalta.
Jos haittavaikutuksia ilmaantuu, infuusionopeutta on hidastettava tai infuusio on keskeytettävä kunnes oireet ovat hävinneet. Jos oireet infuusion keskeyttämisestä huolimatta jatkuvat, on aloitettava asianmukainen hoito. Jos ilmaantuu sokkireaktio (anafylaktinen sokki ja voimakas verenpaineen lasku), valmisteen anto on heti lopetettava ja asianmukainen lääketieteellinen sokin hoito on aloitettava.
Potilaat, joilla on munuaisongelmia ja muita riskitekijöitä
Laskimoon annettavien immunoglobuliinihoitojen yhteydessä on havaittu munuaisten toimintahäiriöitä ja äkillistä munuaisten vajaatoimintaa. Näiden komplikaatioiden riski on erityisen suuri, jos sinulla jo ennestään on tiettyjä riskitekijöitä, kuten munuaisten vajaatoimintaa, diabetes mellitus (sokeritauti) tai pienentynyt veritilavuus (hypovolemia). On myös katsottu, että seuraavat tekijät lisäävät riskiä: ylipaino, samanaikainen hoito munuaisiin haitallisesti vaikuttavilla lääkkeillä ja/tai yli 65 vuoden ikä. Noudata joka tapauksessa seuraavia varotoimia:
- Ennen hoidon aloittamista sinun on juotava tarpeeksi riittävän nesteytyksen varmistamiseksi.
- Lääkärin pitää seurata virtsan eritystäsi ja munuaistesi toimintaa.
- Älä käytä samanaikaisesti tiettyjä virtsan eritystä lisääviä lääkkeitä (ns. loop-diureetteja).
Infuusionopeuden ja immunoglobuliinivalmisteliuoksen pitoisuuden on oltava mahdollisimman pieni.
Jos munuaisten toimintahäiriö ilmenee, lääkäri harkitsee immunoglobuliinihoidon keskeyttämistä.
Hemolyysi (punasolujen epänormaali hajoaminen)
Immunoglobuliinien on raportoitu suurentavan yleisesti veren punasolujen hajoamisen (hemolyysin) riskiä sekä aikuisilla että lapsilla. Jos olet saanut suuria IVIg-annoksia joko yhtenä tai useana päivänä ja veriryhmäsi on A, B tai AB ja/tai sairastat perussairautena tulehdussairautta, sinulla saattaa olla suurentunut veren punasolujen hajoamisen (hemolyysin) riski.
Valmisteen markkinoille tulon jälkeen on havaittu, että lapsille etenkin Kawasakin taudin hoitoon annettuihin suuriin IVIg-annoksiin on liittynyt hemolyyttisiä reaktioita koskevien raporttien lisääntymistä verrattuna IVIg-valmisteen muihin lapsia koskeviin käyttöaiheisiin.
Hakeudu lääkärinhoitoon, jos sinulle ilmaantuu kalpeutta, heikotusta (letargiaa), tummaa virtsaa, hengenahdistusta tai sydämentykytystä (nopea sydämen syke).
Hemolyysiin liittyvä munuaisten toimintahäiriö/munuaisten vajaatoiminta on yksittäisissä tapauksissa johtanut potilaan kuolemaan.
Infektioita koskevaa tietoa turvallisuudesta
Kun valmistetaan lääkkeitä ihmisen verestä tai plasmasta, tietyt turvatoimenpiteet siirtyvien infektioiden estämiseksi ovat välttämättömiä. Näitä toimenpiteitä ovat
- huolellinen veren ja plasman luovuttajien valinta, jotta varmistetaan, ettei luovuttajilla ole veren tai plasman mukana siirtyviä infektioita
- jokainen luovutettu plasmaerä ja niistä muodostettu plasmapooli testataan virusten ja infektioiden suhteen
- varotoimenpiteet virusten poistamiseksi tai inaktivoimiseksi veren tai plasman käsittelyprosessin aikana.
Näistä turvatoimista huolimatta ei siirtyvän infektion mahdollisuutta voida aivan kokonaan poistaa, kun annetaan ihmisen verestä tai plasmasta valmistettuja lääkkeitä. Tämä koskee myös nykyisellään tuntemattomia ja kehittymässä olevia viruksia sekä muita infektioita.
Mainitut turvatoimet ovat yleisen näkemyksen mukaan riittävän tehokkaita poistamaan vaipallisia viruksia, kuten ihmisen immuunikatoviruksen (HIV), hepatiitti B -viruksen ja hepatiitti C -viruksen. Turvatoimet saattavat kuitenkin olla riittämättömät vaipattomia viruksia, kuten hepatiitti A ‑virusta ja/tai parvovirus B19:ää, vastaan. Immunoglobuliinihoitoihin ei kuitenkaan ole liittynyt hepatiitti A‑ eikä parvovirus B19 ‑infektioita, mikä ehkä johtuu siitä, että itse valmisteessa on näiltä infektioilta suojaavia vasta-aineita.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per kerta-annos (enintään 2 g/kg) eli sen voidaan sanoa olevan ”natriumiton”.
Aina kun sinulle annetaan tätä lääkettä, on erittäin suositeltavaa, että valmisteen nimi ja eränumero merkitään potilasasiakirjoihin, jotta voidaan pitää kirjaa käytetyistä lääke-eristä.
Muut lääkevalmisteet ja Gamunex
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Vältä sellaisten lääkkeiden samanaikaista käyttöä, jotka lisäävät nesteen poistumista elimistöstä (loop-diureetit), Gamunex‑hoidon aikana.
Vaikutus rokotteisiin: Gamunex voi vähentää tiettyjen rokotetyyppien (elävien, heikennettyjen virusrokotteiden) tehoa. Vihurirokko-, sikotauti- ja vesirokkorokotteet tulee antaa vasta, kun tämän lääkkeen saamisesta on kulunut 3 kuukautta. Tuhkarokkorokotteella vastaava aika on 1 vuosi.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
Joskus voi ilmetä huimausta tai muita reaktioita, jotka voivat mahdollisesti vaikuttaa ajokykyyn ja koneiden käyttökykyyn. Jos tällaisia reaktioita ilmenee, odota kunnes ne ovat menneet ohi ennen kuin ajat tai käytät koneita.
Lääke voi heikentää kykyä kuljettaa moottoriajoneuvoa tai tehdä tarkkaa keskittymistä vaativia tehtäviä. On omalla vastuullasi arvioida, pystytkö näihin tehtäviin lääkehoidon aikana. Lääkkeen vaikutuksia ja haittavaikutuksia on kuvattu muissa kappaleissa. Lue koko pakkausseloste opastukseksesi. Keskustele lääkärin tai apteekkihenkilökunnan kanssa, jos olet epävarma.
Miten valmistetta käytetään
Lääkäri antaa Gamunex-valmisteen laskimoon. Lääkäri määrittää sinulle annettavan annoksen hoidettavan sairautesi ja painosi perusteella (ks. hoitoalan ammattilaisille tarkoitettu kohta tämän pakkausselosteen lopussa).
Infuusion alussa Gamunex-valmistetta annetaan sinulle hitaalla nopeudella. Vointisi mukaan lääkäri saattaa sen jälkeen asteittain lisätä infuusionopeutta.
Jos lopetat Gamunex-valmisteen käytön
Jos tämän lääkkeen käyttö lopetetaan, kliininen tilasi voi heiketä. Keskustele hoidostasi vastaavan lääkärin kanssa, jos itse haluat lopettaa tämän lääkkeen käytön ennenaikaisesti.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Seuraavia haittavaikutuksia on harvinaisissa tai yksittäisissä tapauksissa raportoitu immunoglobuliinivalmisteiden käytön yhteydessä. Hakeudu välittömästi lääkärinhoitoon, jos infuusion aikana tai sen jälkeen ilmaantuu jokin seuraavista haittavaikutuksista:
- äkillinen verenpaineen lasku ja yksittäisissä tapauksissa anafylaktinen sokki (jonka oireita ovat mm. ihottuma, matala verenpaine, nopeat tai epäsäännölliset sydämenlyönnit, hengityksen vinkuna, yskä, aivastelu ja hengitysvaikeudet), vaikka sinulla ei olisikaan esiintynyt allergisia reaktioita aiempien antokertojen yhteydessä
- ohimenevä infektioon liittymätön aivokalvotulehdus (jonka oireita ovat mm. päänsärky, silmien valonarkuus ja niskan jäykkyys)
- ohimenevä veren punasolumäärän lasku (korjautuva hemolyyttinen anemia / veren punasolujen hajoaminen)
- ohimenevät ihoreaktiot
- seerumin kreatiniinipitoisuuden (munuaisten toimintaa mittaava laboratoriokoe) suureneminen ja/tai akuutti munuaisten vajaatoiminta (jonka oireita ovat alaselkäkipu, väsymys ja virtsamäärän pieneneminen)
- tromboemboliset reaktiot (verisuonitukokset), kuten sydäninfarkti (jonka oireita ovat puristuksen tunne rinnassa ja tunne siitä, että sydän lyö liian nopeasti), aivohalvaus (jonka oireita ovat lihasheikkous kasvoissa, käsivarressa tai jalassa, puhevaikeudet tai vaikeudet ymmärtää muiden puhetta) keuhkoveritulppa (jonka oireita ovat hengenahdistus, rintakipu ja väsymys) ja syvät laskimotukokset (jonka oireita ovat kipu ja turvotus raajassa)
- keuhkojen äkillinen verensiirtovaurio (TRALI-reaktio), josta aiheutuu hapenpuutetta kudoksissa (hypoksia), hengitysvaikeuksia, nopeaa hengitystä, ihon ja limakalvojen sinerrystä, kuumetta ja matala verenpaine.
Gamunex-valmisteella tehdyissä kliinisissä tutkimuksissa on havaittu seuraavia haittavaikutuksia:
Seuraavat haittavaikutukset olivat yleisiä (saattavat esiintyä enintään yhdessä infuusiossa 10:stä):
- päänsärky
- kuume.
Seuraavat haittavaikutukset olivat melko harvinaisia (saattavat esiintyä enintään yhdessä infuusiossa 100:sta):
- huimaus
- nokkosihottuma (nokkosrokko, punoitus, ihon kutina)
- kutina
- ihottuma
- pahoinvointi
- oksentelu
- korkea verenpaine
- kurkun tulehdus
- yskä
- nenän tukkoisuus
- hengityksen vinkuminen
- nivelkipu
- selkäkipu
- flunssan kaltainen sairaus
- uupumus
- vilunväreet
- voimattomuus
- lihaskipu.
Seuraavat haittavaikutukset olivat harvinaisia (saattavat esiintyä enintään yhdessä infuusiossa 1 000:sta):
- hemolyyttinen anemia (veren punasolujen hajoaminen)
- hengenahdistus
- sivuontelotulehdus
- ihon kuoriutuminen
- ahdistuneisuus
- pienentynyt hemoglobiiniarvo
- ruoansulatusvaivat
- ruhjevammat
- kasvojen punoitus
- luustolihaksiston jäykkyys
- kämmenten punoitus
- äänen häviäminen
- pienentynyt veren valkosolumäärä
- ihotulehdus (dermatiitti) tai kosketusihottuma
- vatsakipu
- ripuli
- matala verenpaine
- niskakipu
- tuki- ja liikuntaelimistön kipu
- rintakipu
- huonovointisuus
- injektiokohdan reaktio
- virtsaputkitulehdus (kipu virtsatessa tai virtsaamisvaikeudet)
- viruksen aiheuttama ylähengitystieinfektio (akuutti nenän, nenän sivuonteloiden tai nielun tulehdus)
- tietyntyyppisten veren valkosolujen määrän suurentuminen (lymfosytoosi)
- yliherkkyys (allerginen reaktio)
- silmien herkkyys valolle
- äkillinen voimakas verenpaineen nousu (hypertensiivinen kriisi)
- verenkierron vilkastuminen (hyperemia)
- veressä happea kuljettavan valkuaisaineen epänormaalin suuri määrä virtsassa (hemoglobinuria)
- kohonnut verenpaine
- vapaan hemoglobiinin esiintyminen (hemoglobiinia verenkierrossa veren punasolujen ulkopuolella)
- kohonnut laskoarvo (punasolujen laskeutumisnopeus koeputkessa).
Mihin toimiin tulee ryhtyä, jos haittavaikutuksia ilmaantuu?
Jos haittavaikutuksia ilmaantuu, on infuusionopeutta pienennettävä tai infuusion anto keskeytettävä, kunnes oireet ovat hävinneet. Jos oireet jatkuvat infuusion keskeyttämisestä huolimatta, on ryhdyttävä asianmukaisiin hoitotoimenpiteisiin.
Jos ilmaantuu vaikea yliherkkyysreaktio, johon liittyy verenpaineen laskua ja hengenahdistusta, tai jos tilanne etenee vakavaksi yleistyneeksi yliherkkyysreaktioksi (anafylaktiseksi sokiksi), tämän lääkkeen käyttö on heti lopetettava ja on ryhdyttävä asianmukaisiin vastatoimiin.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa ja injektiopullossa mainitun viimeisen käyttöpäivämäärän jälkeen. Kestoaika on 3 vuotta.
Säilytä jääkaapissa (2 - 8 °C). Ei saa jäätyä. Pidä injektiopullo ulkopakkauksessa.
Lääkettä voi säilyttää ulkopakkauksessaan enintään 6 kuukauden ajan huoneenlämmössä (alle 25 °C:ssa); valmisteen kestoaika päättyy tämän 6 kuukauden jälkeen riippumatta alkuperäisestä viimeisestä käyttöpäivästä. Uusi viimeinen käyttöpäivämäärä on merkittävä ulkopakkaukseen. Uusi viimeinen käyttöpäivä ei kuitenkaan voi olla pakkauksiin painettua viimeistä käyttöpäivää myöhäisempi päivämäärä. Valmistetta ei saa enää uudelleen säilyttää jääkaapissa.
Yksittäisen injektiopullon avaamisen jälkeen sen sisältö on käytettävä heti. Käyttämättä jäänyt lääke on hävitettävä. Tämän jälkeen valmistetta ei saa säilyttää, ei edes jääkaapissa, koska valmisteeseen on saattanut kulkeutua taudinaiheuttajia.
Pakkauksen sisältö ja muuta tietoa
Mitä Gamunex sisältää
Vaikuttava aine on ihmisen normaali immunoglobuliini (IVIg). Yksi ml tätä lääkettä sisältää injektionesteisiin käytettävässä vedessä 100 mg proteiinia, jonka IgG-sisältö on vähintään 98 %.
Yksi 10 ml:n injektiopullo sisältää: 1 g ihmisen normaalia immunoglobuliinia
Yksi 50 ml:n injektiopullo sisältää: 5 g ihmisen normaalia immunoglobuliinia
Yksi 100 ml:n injektiopullo sisältää: 10 g ihmisen normaalia immunoglobuliinia
Yksi 200 ml:n injektiopullo sisältää: 20 g ihmisen normaalia immunoglobuliinia
Yksi 400 ml:n injektiopullo sisältää: 40 g ihmisen normaalia immunoglobuliinia
IgG-alaluokkien prosentuaaliset osuudet ovat noin 62,8 % (IgG1), 29,7 % (IgG2), 4,8 % (IgG3), 2,7 % (IgG4). IgA-pitoisuus on enintään 84 mikrogrammaa/ml.
Muut aineet ovat glysiini ja injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Gamunex on infuusioneste, liuos. Liuos on kirkasta tai hieman opaalinhohtoista ja väritöntä tai vaaleankeltaista.
Pakkauskoot ovat 10 ml, 50 ml, 100 ml, 200 ml ja 400 ml. Pakkauksessa on lasista valmistettu injektiopullo, jossa on tulppa (klooributyyliä) sekä etiketti, josta voidaan repäisemällä saada ripustin, sekä pakkausseloste.
Myyntiluvan haltija
Grifols Deutschland GmbH
Colmarer Straße 22
60528 Frankfurt
Saksa
Puh.: +49-69-660 593 100
Valmistaja
Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
08150 Barcelona
Espanja
Tällä lääkkeellä on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa ja Iso-Britanniassa (Pohjois-Iranti) seuraavilla kauppanimillä:
Itävalta, Belgia, Kypros, Irlanti, Saksa, Luxemburg, Alankomaat, Puola, Portugali, Iso-Britannia (Pohjois-Irlanti): Gamunex 10% 100 mg/ml
Tšekin tasavalta, Tanska, Suomi, Ranska, Unkari, Italia, Norja, Espanja, Ruotsi, Slovakia: Gamunex 100 mg/ml
Kreikka: Gaminex 10% 100 mg/ml
Tämä pakkausseloste on tarkistettu viimeksi 24.10.2022
Ohjeet terveydenhuollon ammattilaiselle
Käytä infuusioliuos vain, jos se on kirkasta tai hieman opaalinhohtoista ja väritöntä tai vaaleankeltaista, eikä siinä ole hiukkasia – ei saa ravistaa. Ennen infuusiota Gamunex‑valmisteen on oltava huoneen‑ tai kehonlämpöinen (lämpötila voidaan tarvittaessa nostaa vesihauteessa, jonka lämpötila ei saa ylittää 37 °C:a).
Injektiopullossa on sen ripustamiseen soveltuva etiketti (kuva 1). Kiinnitä infuusiolaite (kuva 2), käännä injektiopullo ylösalaisin, ja taita etiketin ripustinosa taaksepäin (kuva 3). Purista sormin voimakkaasti niin, että kohtaan, jossa ripustinosa kiinnittyy etiketin muuhun osaan, muodostuu taite (kuva 4). Ripusta tämän jälkeen injektiopullo ripustinsilmukasta infuusiotelineeseen (kuva 5).
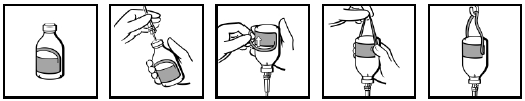
Kuva 1 Kuva 2 Kuva 3 Kuva 4 Kuva 5
Annostus ja antotapa
Annos sekä infuusioiden välinen aika riippuvat lääkkeen käyttöaiheesta. Annos sovitetaan jokaiselle potilaalle yksilöllisesti kliinisen vasteen mukaan. Painoon perustuvan annoksen muuttaminen saattaa olla tarpeen ali- tai ylipainoisille potilaille. Seuraavat annostukset ovat ohjeellisia.
Annossuositusten yhteenveto on seuraavassa taulukossa:
|
Käyttöaihe |
Annos |
Infuusioiden antoväli |
|
Korvaushoito: |
||
|
Primaariset immuunipuutosoireyhtymät |
Aloitusannos: 0,4–0,8 g/kg
Ylläpitoannos: 0,2–0,8 g/kg |
3–4 viikon välein |
|
Sekundaariset immuunipuutokset |
0,2–0,4 g/kg |
3–4 viikon välein |
|
Tuhkarokon estohoito ennen altistusta/altistuksen jälkeen: |
||
|
Estohoito altistuksen jälkeen herkillä potilailla |
0,4 g/kg |
Mahdollisimman pian ja 6 päivän kuluessa, mahdollisesti toistetaan kerran 2 viikon jälkeen, jotta tuhkarokon vasta-aineiden pitoisuus seerumissa säilyy tasolla > 240 mIU/ml |
|
Altistuksen jälkeinen estohoito PID/SID- potilailla |
0,4 g/kg |
Ylläpitohoidon lisäksi, ylimääräisenä annoksena 6 päivän kuluessa altistuksesta |
|
Altistusta edeltävä estohoito PID/SID- potilailla |
0,53 g/kg |
Jos potilaan ylläpitoannos on alle 0,53 g/kg 3–4 viikon välein, kyseinen annos pitää kerran suurentaa vähintään annokseen 0,53 g/kg |
|
Immuunivasteen säätely: |
||
|
Idiopaattinen trombosytopeeninen purppura
|
0,8–1 g/kg
tai |
päivänä 1, voidaan tarvittaessa toistaa kerran 3 päivän kuluessa
|
|
0,4 g/kg/vrk |
2–5 päivän ajan |
|
|
Guillain-Barrén oireyhtymä |
0,4 g/kg/vrk |
5 päivän ajan |
|
Kawasakin tauti |
2 g/kg |
yhtenä annoksena yhdessä asetyylisalisyylihapon kanssa |
|
Krooninen tulehduksellinen demyelinoiva polyradikuloneuropatia (CIDP) |
Aloitusannos: 2 g/kg |
jaettuina annoksina 2–5 päivän aikana |
|
Ylläpitoannos: 1 g/kg |
3 viikon välein jaettuina annoksina 1–2 päivän aikana |
|
|
|
|
|
|
Multifokaalinen motorinen neuropatia (MMN) |
Aloitusannos: 2 g/kg
|
jaettuina annoksina 2–5 peräkkäisen päivän aikana
|
|
|
Ylläpitoannos: 1 g/kg tai
2 g/kg |
2–4 viikon välein
tai
4–8 viikon välein jaettuina annoksina 2–5 päivän aikana
|
|
Myasthenia gravisin vaikeat akuutit pahenemisvaiheet |
2 g/kg |
2 peräkkäisen päivän aikana |
Antotapa
Laskimoon.
Ihmisen normaalin immunoglobuliinin infuusionopeus on aluksi 0,6–1,2 ml/kg/h puolen tunnin ajan. Jos haittavaikutuksia ilmaantuu, infuusionopeutta on hidastettava tai infuusio on keskeytettävä. Jos potilas sietää infuusion hyvin, infuusionopeutta voi asteittain suurentaa korkeintaan nopeuteen 4,8–8,4 ml/kg/h.
Pediatriset potilaat
Lasten ja nuorten (0–18 vuotta) annostus ei eroa aikuisten annostusohjeista, koska annos määräytyy kussakin käyttöaiheessa painon ja kliinisen vasteen mukaan.
Gamunex‑valmistetta ei saa sekoittaa muihin infuusioliuoksiin eikä muihin lääkkeisiin. Jos valmistetta on laimennettava ennen infuusiota, voidaan laimentamiseen käyttää 50 mg/ml glukoosiliuosta. Älä laimenna keittosuolaan.
Gamunex-valmistetta ja hepariinia ei saa antaa samanaikaisesti saman infuusiojärjestelmän kautta.
Gamunex‑infuusiossa käytetyt infuusioletkut voidaan huuhdella 50 mg/ml glukoosiliuoksella tai natriumkloridiliuoksella (9 mg/ml) eikä niitä saa huuhdella hepariinilla.
Heparin Lock, jonka kautta Gamunex on annettu, tulee huuhdella 50 mg/ml glukoosiliuoksella tai natriumkloridiliuoksella (9 mg/ml) eikä sitä saa huuhdella hepariinilla.