Pakkausseloste
ZADITEN ögondroppar, lösning 0,25 mg/ml (recept)
Tilläggsinformation
Zaditen 0,25 mg/ml ögondroppar, lösning
ketotifen
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar
I denna bipacksedel finns information om följande
- Vad Zaditen är och vad det används för
- Vad du behöver veta innan du använder Zaditen
- Hur du använder Zaditen
- Eventuella biverkningar
- Hur Zaditen ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Zaditen innehåller den aktiva substansen ketotifen som är ett antiallergiskt medel.
Zaditen används vid behandling av ögonbesvär vid pollenallergi.
Ketotifen som finns i Zaditen kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apoteks- eller annan hälso- och sjukvårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Vad du behöver veta innan produkten används
Använd inte Zaditen
Om du är allergisk (överkänslig) mot ketotifen eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Zaditen.
Andra läkemedel och Zaditen
Om du använder andra ögonprodukter samtidigt med Zaditen, bör du vänta 5 minuter mellan användning av produkterna.
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel. Detta är särskilt viktigt om du tar läkemedel som används för behandling av:
- depression, ångest och sömnstörningar
- allergi (t.ex. antihistaminer)
Zaditen med mat, dryck och alkohol
Det är möjligt att Zaditen kan öka effekten av alkohol.
Graviditet och amning
Om du är gravid, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Zaditen kan användas vid amning.
Körförmåga och användning av maskiner
Om du upplever dimsyn, trötthet eller yrsel efter att ha använt Zaditen, bör du vänta tills dessa symtom har avklingat innan du kör bil eller använder maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med läkare eller apotekspersonal om du är osäker.
Zaditen innehåller bensalkoniumklorid
Detta läkemedel innehåller 2,6 mikrogram bensalkoniumklorid per droppe.
Bensalkoniumklorid kan tas upp av mjuka kontaktlinser och kan missfärga kontaktlinserna. Ta ut kontaktlinser innan du använder läkemedlet och vänta minst 15 minuter innan kontaktlinserna sätts in igen.
Bensalkoniumklorid kan vara irriterande för ögon, särskilt om du har torra ögon eller problem med hornhinnan (den klara hinnan längst fram i ögat). Om du känner irritation, stickningar eller smärta i ögat efter att ha använt läkemedlet, kontakta läkare.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Rekommenderad dos för vuxna, äldre och barn från 3 års ålder är en droppe i vartdera ögat två gånger dagligen (morgon och kväll).
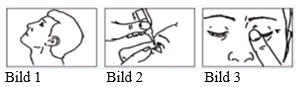
Bruksanvisning
- Tvätta händerna
- Öppna flaskan. Rör inte vid spetsen efter öppning.
- Böj huvudet bakåt (bild 1).
- Dra ned det undre ögonlocket med ett finger. Håll ögondroppsflaskan i den andra handen. Tryck på flaskan så att en droppe faller i ögat (bild 2).
- Slut ögat och tryck en fingertopp mot ögonvrån i ca 1-2 minuter. Detta förhindrar att droppen rinner ner i svalget genom tårkanalen. En större del av droppen blir då kvar i ögat (bild 3). Upprepa steg 3-5 för det andra ögat om det behövs.
- Stäng flaskan efter användning.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Om du har använt för stor mängd av Zaditen
Det finns ingen risk om du råkar få några droppar Zaditen i munnen. Inte heller ska du vara orolig om mer än en droppe råkar droppas i ett öga. Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 0800 147 111) för bedömning av risken samt rådgivning.
Om du har glömt att ta Zaditen
Om du har glömt att ta dina ögondroppar, ta då dessa så snart som möjligt och gå därefter tillbaka till din vanliga dosering.
Ta inte dubbel dos för att kompensera för glömd dos.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Följande biverkningar har rapporterats.
Vanliga (kan förekomma hos upp till 1 av 10 användare):
- ögonirritation eller ögonsmärta
- ögoninflammation
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare):
- dimsyn vid applicering av ögondropparna i ögat
- torra ögon
- ögonlocksförändringar
- inflammation i ögats ytskikt
- ökad ljuskänslighet i ögonen
- synlig blödning under ögats yta
- huvudvärk
- dåsighet
- hudutslag (som även kan klia)
- eksem (kliande, röda, brännande utslag)
- muntorrhet
- allergisk reaktion (inklusive svullnad av ansikte och ögonlock) och försämring av befintliga allergiska tillstånd som astma och eksem.
Har rapporterats (förekommer hos ett okänt antal användare):
- yrsel
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras vid högst 25 °C.
Flaskan är inte steril i sig, men innehållet är sterilt tills flaskan öppnats.
Ögondropparna ska användas inom 4 veckor efter det att förpackningen öppnats.
Används före utgångsdatum som anges på kartongen och flaskan. Utgångsdatumet är den sista dagen i angiven månad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är ketotifen. Varje ml innehåller 0,345 mg ketotifenfumarat motsvarande 0,25 mg ketotifen.
- Övriga innehållsämnen är bensalkoniumklorid, glycerol (E 422), natriumhydroxid (E 524), vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Zaditen är en klar lösning, färglös till svagt gul. En flaska innehåller 5 ml.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning:
Laboratoires THEA – 12, rue Louis Blériot – 63017 Clermont-Ferrand Cedex 2 – Frankrike
Tillverkare:
Excelvision, 27 rue de la Lombardière, 07100 Annonay, Frankrike
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
Danmark: Zaditen
England: Zaditen 0.25 mg/ml eye drops, solution
Finland: Zaditen 0,25 mg/ml silmätipat, liuos
Grekland: Zaditor οfθaλµικές staγόνeς
Irland: Zaditen 0.25mg/ml eye drops, solution
Island: Zaditen
Luxemburg: Zaditen 0,25 mg/ml, collyre en solution
Nederländerna: Zaditen 0,25 mg/ml, oogdruppels, oplossing
Norge: Zaditen
Portugal: Zaditen 0,25 mg/ml colírio, solução
Spanien: Zaditen colirio
Sverige: Zaditen 0,25 mg/ml ögondroppar, lösning
Tyskland: Zaditen ophtha 0,25 mg/ml Augentropfen
Österrike: Zaditen 0,025% - Augentropfen
Denna bipacksedel ändrades senast 11.09.2025