Pakkausseloste
UPTRAVI filmdragerad tablett 200 mikrog, 400 mikrog, 600 mikrog, 800 mikrog, 1000 mikrog, 1200 mikrog, 1400 mikrog, 1600 mikrog
Tilläggsinformation
Uptravi 100 mikrogram filmdragerade tabletter
Uptravi 200 mikrogram filmdragerade tabletter
Uptravi 400 mikrogram filmdragerade tabletter
Uptravi 600 mikrogram filmdragerade tabletter
Uptravi 800 mikrogram filmdragerade tabletter
Uptravi 1 000 mikrogram filmdragerade tabletter
Uptravi 1 200 mikrogram filmdragerade tabletter
Uptravi 1 400 mikrogram filmdragerade tabletter
Uptravi 1 600 mikrogram filmdragerade tabletter
selexipag
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor, vänd dig till läkare eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Uptravi är och vad det används för
2. Vad du behöver veta innan du tar Uptravi
3. Hur du tar Uptravi
4. Eventuella biverkningar
5. Hur Uptravi ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Uptravi är ett läkemedel som innehåller den aktiva substansen selexipag. Det verkar på blodkärlen på liknande sätt som den naturliga substansen prostacyklin, som får kärlen att slappna av och vidgas.
Uptravi används för långtidsbehandling av pulmonell arteriell hypertension (PAH) hos vuxna patienter vars sjukdom inte kan kontrolleras av behandling med andra typer av läkemedel mot PAH, så kallade endotelinreceptor-antagonister och fosfodiesteras 5-hämmare. Uptravi kan användas ensamt om dessa läkemedel inte är lämpliga för patienten.
Vid PAH är trycket för högt i de blodkärl som leder blod från hjärtat till lungorna (lungartärerna). Hos personer som har PAH blir dessa artärer trängre och hjärtat måste därför arbeta hårdare för att pumpa fram blodet genom dem. Det kan göra att man känner sig trött, yr, andfådd eller får andra symtom.
Genom att efterlikna verkan av det naturliga ämnet prostacyklin vidgar detta läkemedel lungartärerna och gör att de inte blir så stela. Det blir då lättare för hjärtat att pumpa blod genom lungartärerna. Uptravi minskar trycket i lungartärerna, lindrar symtomen på PAH och saktar ned sjukdomsförloppet.
Vad du behöver veta innan produkten används
Ta inte Uptravi
- om du är allergisk mot selexipag eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har hjärtproblem, till exempel:
- dåligt blodflöde till hjärtmuskeln (svår hjärtsjukdom eller instabil kärlkramp), med symtom som till exempel bröstsmärtor
- haft hjärtinfarkt under de senaste 6 månaderna
- svagt hjärta (dekompenserad hjärtsvikt) som inte är under noggrann medicinsk kontroll
- mycket oregelbunden hjärtrytm
- fel på hjärtklaffarna (medfött eller förvärvat) som gör att hjärtat fungerar dåligt (utan samband med pulmonell hypertension)
- om du har haft en stroke under de senaste 3 månaderna eller någon annan händelse som minskat blodtillförseln till hjärnan (t.ex. transitorisk ischemisk attack, så kallad TIA).
- om du tar gemfibrozil (ett läkemedel för att minska mängden fettämnen (lipider) i blodet).
Varningar och försiktighet
Tala med PAH-läkaren eller sjuksköterska innan du tar Uptravi om du
- tar medicin mot högt blodtryck
- har lågt blodtryck med symtom som till exempel yrsel
- nyligen har haft en större blodförlust eller vätskeförlust, t.ex. kraftig diarré eller kräkningar
- har problem med sköldkörteln
- har svåra problem med njurarna eller genomgår dialys
- har eller har haft svåra problem med att levern inte fungerar som den ska
Om du märker något av ovanstående tecken eller om ditt tillstånd förändras, tala omedelbart om det för läkaren.
Barn och ungdomar
Ge inte detta läkemedel till barn under 18 år.
Äldre patienter
Erfarenheten av att använda Uptravi hos patienter som är äldre än 75 år är begränsad. Uptravi ska användas med försiktighet till denna åldersgrupp.
Andra läkemedel och Uptravi
Tala om för läkare om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Andra läkemedel kan påverka effekten av Uptravi.
Tala med PAH-läkaren eller sjuksköterska om du tar något av följande läkemedel:
- Gemfibrozil (används för att minska mängden fettämnen (lipider) i blodet)
- Klopidogrel (används för att förhindra att blodproppar bildas vid kranskärlssjukdom)
- Deferasirox (används för att minska mängden järn i blodet)
- Teriflunomid (för behandling av skovvis förlöpande multipel skleros)
- Karbamazepin (för behandling av vissa former av epilepsi, nervsmärtor, eller för att hantera allvarliga humörsvängningar när vissa andra läkemedel inte har fungerat)
- Fenytoin (läkemedel mot epilepsi)
- Valproinsyra (läkemedel mot epilepsi)
- Probenecid (läkemedel mot gikt)
- Flukonazol, rifampicin eller rifapentin (antibiotika mot infektioner)
Graviditet och amning
Uptravi rekommenderas inte under graviditet och amning. Om du är kvinna och kan bli gravid ska du använda ett effektivt preventivmedel under tiden som du tar Uptravi. Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel.
Körförmåga och användning av maskiner
Uptravi kan orsaka biverkningar såsom huvudvärk och lågt blodtryck (se avsnitt Eventuella biverkningar), som kan påverka din körförmåga. Symtomen från din sjukdom kan också göra dig olämplig som förare.
Hur produkten används
Uptravi ska endast ordineras av en läkare som har erfarenhet av att behandla PAH. Ta alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker eller har några frågor.
Om du får biverkningar, tala med läkaren, då han/hon kan rekommendera att du ändrar din Uptravi-dos.
Om du har problem med att din lever inte fungerar som den ska eller tar andra läkemedel, informera läkaren. Läkaren kan då rekommendera att du tar en lägre dos Uptravi två gånger dagligen eller att du endast tar det en gång dagligen.
Om du har nedsatt syn eller synbortfall, se till att få hjälp av någon när du tar Uptravi under perioden då din dos ställs in (processen med att gradvis öka din dos).
Hitta rätt dos för dig
Om läkaren ordinerar 200‑mikrogramstabletter
Vid behandlingsstart kommer de flesta patienter ta en 200‑mikrogramstablett på morgonen och en 200‑mikrogramstablett på kvällen, med cirka 12 timmars mellanrum. Det är rekommenderat att påbörja behandlingen på kvällen. Läkaren kommer ge dig instruktioner om att öka dosen stegvis. Det här kallas titrering. Titreringen gör att kroppen kan vänja sig vid det nya läkemedlet. Målet är att hitta den dos som är mest lämplig. Det kommer vara den högsta dos du kan tolerera, vilket kan vara upp till maxdosen på 1 600 mikrogram morgon och kväll.
Den första tablettförpackningen du får innehåller de ljusgula 200‑mikrogramstabletterna.
Läkaren kommer säga åt dig att öka dosen stegvis, oftast en gång i veckan, men det kan också gå längre tid mellan ökningarna.
Vid varje steg lägger du till en 200-mikrogramstablett på morgonen och en 200-mikrogramstablett på kvällen. Första gången du tar den högre dosen är det rekommenderat att det sker på kvällen. Diagrammet nedan visar antalet tabletter du ska ta varje morgon och varje kväll under de första fyra stegen.
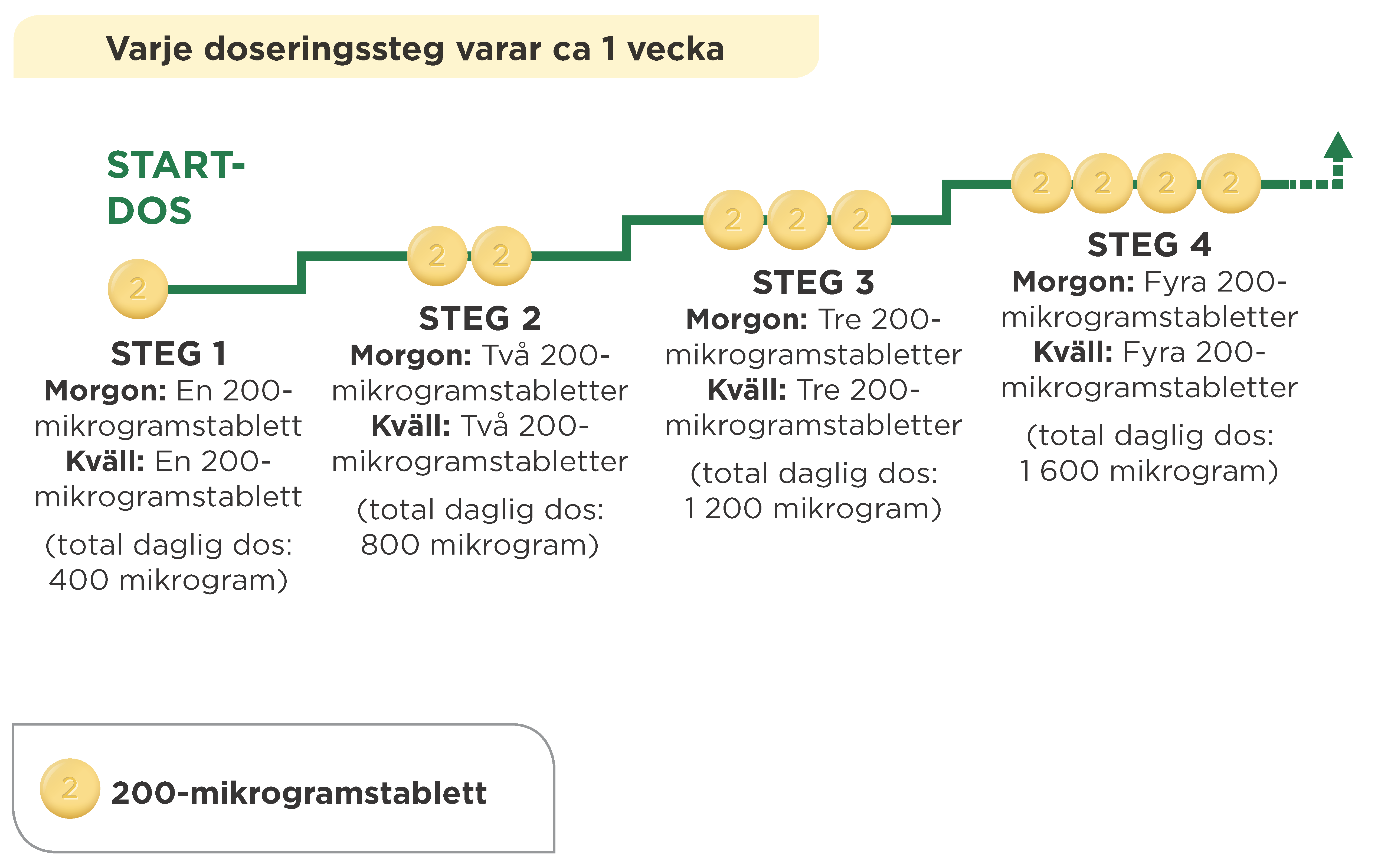
Om läkaren säger att du ska öka dosen ytterligare lägger du till en 200-mikrogramstablett på morgonen och en 200-mikrogramstablett på kvällen vid varje nytt steg. Första gången du tar den högre dosen är det rekommenderat att det sker på kvällen.
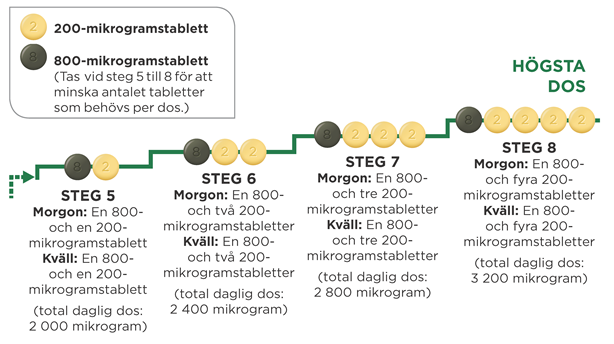
Om läkaren säger att du ska öka dosen ytterligare och gå vidare till steg 5, kan du göra det genom att ta en grön 800-mikrogramstablett och en ljusgul 200-mikrogramstablett på morgonen och en 800-mikrogramstablett och en 200-mikrogramstablett på kvällen.
Maxdosen av Uptravi är 1 600 mikrogram på morgonen och 1 600 mikrogram på kvällen. Alla patienter når dock inte upp till den här dosen eftersom olika patienter behöver olika doser.
Diagrammet nedan visar hur många tabletter som ska tas varje morgon och varje kväll i respektive steg, med början vid steg 5.
Om läkaren ordinerar 100-mikrogramstabletter
Om din lever inte fungerar som den ska eller du tar vissa andra läkemedel kan läkaren ordinera 100‑mikrogramstabletter som startdos.
Vid behandlingsstart kommer du ta en 100‑mikrogramstablett på morgonen och en 100‑mikrogramstablett på kvällen, med cirka 12 timmars mellanrum. Det är rekommenderat att påbörja behandlingen på kvällen. Läkaren kommer ge dig instruktioner om att öka dosen stegvis. Det här kallas titrering. Titreringen gör att kroppen kan vänja sig vid det nya läkemedlet. Målet är att hitta den dos som är mest lämplig. Det kommer vara den högsta dos du kan tolerera, vilket kan vara upp till maxdosen på 800 mikrogram morgon och kväll.
Läkaren kommer säga åt dig att öka dosen stegvis, oftast en gång i veckan, men det kan också gå längre tid mellan ökningarna.
Vid varje steg lägger du till en 100-mikrogramstablett på morgonen och en 100‑mikrogramstablett på kvällen. Första gången du tar den högre dosen är det rekommenderat att det sker på kvällen. Se titreringsguiden för patienter, som medföljer titreringsförpackningen, för instruktioner om hur du ökar din dos.
Berätta för läkaren om du slutar ta eller eventuellt kommer sluta ta några läkemedel eftersom din dos av selexipag kan behöva justeras.
Om läkaren säger att du ska öka dosen ytterligare lägger du till en 100‑mikrogramstablett på morgonen och en 100‑mikrogramstablett på kvällen vid varje nytt steg. Första gången du tar den högre dosen är det rekommenderat att det sker på kvällen.
Om läkaren säger åt dig att ytterligare öka dosen över 400 mikrogram kan detta göras genom att ta en röd 400‑mikrogramstablett och en ljusgul 100‑mikrogramstablett på morgonen samt en 400‑mikrogramstablett och en 100‑mikrogramstablett på kvällen. Se titreringsguiden för patienter, som medföljer titreringsförpackningen, för instruktioner om hur du ökar dosen.
När upptitrering sker med 100-mikrogramstabletter är maxdosen av Uptravi 800 mikrogram på morgonen och 800 mikrogram på kvällen. Alla patienter når dock inte upp till den här dosen eftersom olika patienter behöver olika doser.
Använda titreringsguiden vid titrering
Du kommer att få titreringsförpackningen som innehåller en titreringsguide och bipacksedeln. I titreringsguiden finns information om titreringen. Där kan du skriva upp antalet tabletter du tar varje dag.
Kom ihåg att skriva upp antalet tabletter du tar varje dag i titreringsdagboken. Varje steg varar ungefär en vecka. Om läkaren säger att du ska fortsätta med ett steg längre än en vecka finns det extra sidor i dagboken där du kan fortsätta att skriva. Kom ihåg att tala med PAH-läkaren eller sjuksköterska med jämna mellanrum under titreringen.
Trappa ner till en lägre dos på grund av biverkningar
Under titreringen kan du få biverkningar såsom huvudvärk, diarré, illamående, kräkningar, käksmärta, muskelvärk, värk i benen, ledvärk eller ansiktsrodnad (se avsnitt Eventuella biverkningar). Om du har svårt att stå ut med biverkningarna ska du tala med din läkare om hur de kan hanteras eller behandlas. Det finns behandlingar som kan lindra biverkningarna. Smärta och huvudvärk kan till exempel behandlas med smärtstillande preparat som paracetamol.
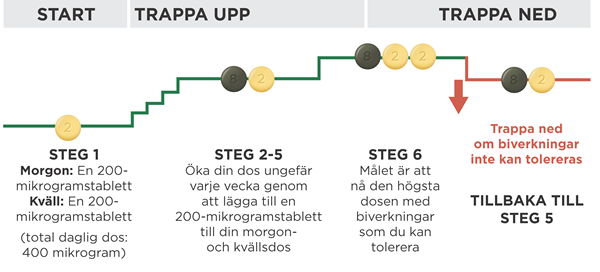
Om biverkningarna inte kan behandlas eller inte gradvis blir bättre på den dos du tar kan läkaren ändra dosen genom att minska antalet ljusgula tabletter som du tar med en på morgonen och en på kvällen. Diagrammet nedan visar hur du trappar ner till en lägre dos. Gör detta endast om läkaren har sagt åt dig att göra det.
Titrering med 200‑mikrogramstabletter
Om du titrerar med 100‑mikrogramstabletter, se instruktionerna i titreringsguiden för patienter som medföljer titreringsförpackningen om hur du trappar ned.
Om biverkningarna kan tolereras när du har minskat dosen kan läkaren bestämma att du ska stanna kvar på den dosen. I avsnittet om underhållsdos nedan finns mer information.
Underhållsdos
Den högsta dosen du kan tolerera under titreringsfasen blir din underhållsdos. Underhållsdosen är den dos som du ska fortsätta att ta regelbundet.
Läkaren skriver ut lämplig(a) tablettstyrka(or) för underhållsdosen. Det kan göra att du bara behöver ta en tablett på morgonen och en på kvällen i fortsättningen, i stället för flera stycken.
En fullständig beskrivning av Uptravi-tabletterna, med färg och märkning, finns i avsnitt Förpackningens innehåll och övriga upplysningar i denna bipacksedel.
Läkaren kan justera din underhållsdos längre fram om det behövs.
Om du får biverkningar som du inte kan tolerera eller biverkningar som påverkar ditt dagliga liv, när du tagit samma dos under lång tid, ska du kontakta din läkare eftersom dosen kan behöva sänkas. Läkaren kan då skriva ut en lägre dos. Kom ihåg att hantera oanvända tabletter på rätt sätt (se avsnitt Hur produkten ska förvaras).
Ta Uptravi en gång på morgonen och en gång på kvällen med ungefär 12 timmars mellanrum.
Ta tabletterna vid måltid eftersom du kan tolerera medicinen bättre då. Tablettdrageringen ger ett skydd. Svälj dem hela med ett glas vatten. Tabletterna får inte delas eller krossas.
Om du har tagit för stor mängd av Uptravi
Om du har tagit fler tabletter än du ska måste du rådfråga läkaren.
Om du har glömt att ta Uptravi
Om du har glömt att ta Uptravi ska du ta en dos så snart du kommer ihåg det. Fortsätt sedan ta tabletterna vid den vanliga tiden. Om det snart är dags för nästa dos (mindre än 6 timmar kvar innan du ska ta den), ska du hoppa över den glömda dosen och sedan fortsätta ta tabletterna på vanlig tid. Ta inte dubbel dos för att kompensera för en glömd tablett.
Om du slutar att ta Uptravi
Om du plötsligt slutar ta Uptravi kan det leda till att dina symtom blir värre. Sluta inte att ta Uptravi om inte läkaren säger åt dig att göra det. Du kan behöva sänka dosen stegvis innan du slutar helt.
Om du av någon anledning missat att ta Uptravi mer än tre dagar i följd (om du missat tre morgon- och tre kvällsdoser, eller sex doser i rad eller fler), kontakta omedelbart läkare eftersom dosen kan behöva ändras för att du ska slippa biverkningar. Läkaren kan bestämma att du ska börja om behandlingen med en lägre dos och stegvis öka tills du nått den tidigare underhållsdosen.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem. Biverkningar kan uppkomma inte bara under titreringsperioden när dosen ökas, utan även senare när du tagit samma dos under lång tid.
Om du får svullnad i ansiktet, läpparna, munnen, tungan eller halsen, som kan göra det svårt att svälja eller andas (angioödem), ska du omedelbart kontakta läkare.
Om du får några av följande biverkningar och inte kan tolerera dem eller som inte går att behandla, ska du kontakta läkare eftersom dosen kan vara för hög för dig och behöva minskas: huvudvärk, diarré, illamående, kräkningar, käksmärta, muskelvärk, värk i benen, ledvärk eller ansiktsrodnad.
Mycket vanliga biverkningar (kan förekomma hos fler än 1 av 10 personer)
- Huvudvärk
- Ansiktsrodnad
- Illamående och kräkningar
- Diarré
- Käksmärta, muskelvärk, ledvärk, värk i benen
- Nasofaryngit (nästäppa)
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 personer)
- Anemi (lågt antal röda blodkroppar)
- Hypertyreos (överaktiv sköldkörtel)
- Minskad aptit
- Viktminskning
- Hypotoni (lågt blodtryck)
- Ont i magen, inklusive matsmältningsbesvär
- Smärta
- Förändring av vissa blodprover som till exempel visar antalet blodkroppar eller sköldkörtelfunktionen
- Hudutslag, däribland nässelutslag som kan orsaka en brännande eller svidande känsla och hudrodnad
- Angioödem och dess symtom som beskrivs i början av detta avsnitt
Mindre vanliga biverkningar (kan förekomma hos upp till 1 av 100 personer)
- Snabbare hjärtslag
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och blisterförpackningen eller burketiketten efter ”EXP”. Utgångsdatumet är den sista dagen i angiven månad.
Använd Uptravi 100 mikrogram filmdragerade tabletter inom 5 månader efter första öppnandet av burken eller före utgångdatum (beroende på vilket som inträffar först).
Inga särskilda förvaringsanvisningar.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är selexipag.
Uptravi 100 mikrogram filmdragerade tabletter innehåller 100 mikrogram selexipag
Uptravi 200 mikrogram filmdragerade tabletter innehåller 200 mikrogram selexipag
Uptravi 400 mikrogram filmdragerade tabletter innehåller 400 mikrogram selexipag
Uptravi 600 mikrogram filmdragerade tabletter innehåller 600 mikrogram selexipag
Uptravi 800 mikrogram filmdragerade tabletter innehåller 800 mikrogram selexipag
Uptravi 1 000 mikrogram filmdragerade tabletter innehåller 1 000 mikrogram selexipag
Uptravi 1 200 mikrogram filmdragerade tabletter innehåller 1 200 mikrogram selexipag
Uptravi 1 400 mikrogram filmdragerade tabletter innehåller 1 400 mikrogram selexipag
Uptravi 1 600 mikrogram filmdragerade tabletter innehåller 1 600 mikrogram selexipag
Övriga innehållsämnen är:
Tablettkärna
Mannitol (E421)
Majsstärkelse
Lågsubstituerad hydroxipropylcellulosa
Hydroxipropylcellulosa
Magnesiumstearat
Filmdragering
Hypromellos (E464)
Propylenglykol (E1520)
Titandioxid (E171)
Järnoxider (E172)
Karnaubavax
Uptravi 100 mikrogram filmdragerade tabletter innehåller gul och svart järnoxid (E172) samt talk.
Uptravi 200 mikrogram filmdragerade tabletter innehåller gul järnoxid (E172).
Uptravi 400 mikrogram filmdragerade tabletter innehåller röd järnoxid (E172).
Uptravi 600 mikrogram filmdragerade tabletter innehåller röd och svart järnoxid (E172).
Uptravi 800 mikrogram filmdragerade tabletter innehåller gul och svart järnoxid (E172).
Uptravi 1 000 mikrogram filmdragerade tabletter innehåller röd och gul järnoxid (E172).
Uptravi 1 200 mikrogram filmdragerade tabletter innehåller svart och röd järnoxid (E172).
Uptravi 1 400 mikrogram filmdragerade tabletter innehåller gul järnoxid (E172).
Uptravi 1 600 mikrogram filmdragerade tabletter innehåller svart, röd och gul järnoxid (E172).
Läkemedlets utseende och förpackningsstorlekar
Uptravi 100 mikrogram filmdragerade tabletter: Runda, ljusgula filmdragerade tabletter med en diameter på 3,0 mm, präglade med ”1” på ena sidan.
Uptravi 200 mikrogram filmdragerade tabletter: Runda, ljusgula filmdragerade tabletter med en diameter på 7,3 mm, präglade med ”2” på ena sidan.
Uptravi 400 mikrogram filmdragerade tabletter: Runda, röda filmdragerade tabletter med en diameter på 7,3 mm, präglade med ”4” på ena sidan.
Uptravi 600 mikrogram filmdragerade tabletter: Runda, ljuslila filmdragerade tabletter med en diameter på 7,3 mm, präglade med ”6” på ena sidan.
Uptravi 800 mikrogram filmdragerade tabletter: Runda, gröna filmdragerade tabletter med en diameter på 7,3 mm, präglade med ”8” på ena sidan.
Uptravi 1 000 mikrogram filmdragerade tabletter: Runda, orange filmdragerade tabletter med en diameter på 7,3 mm, präglade med ”10” på ena sidan.
Uptravi 1 200 mikrogram filmdragerade tabletter: Runda, mörklila filmdragerade tabletter med en diameter på 7,3 mm, präglade med ”12” på ena sidan.
Uptravi 1 400 mikrogram filmdragerade tabletter: Runda, mörkgula filmdragerade tabletter med en diameter på 7,3 mm, präglade med ”14” på ena sidan.
Uptravi 1 600 mikrogram filmdragerade tabletter: Runda, bruna filmdragerade tabletter med en diameter på 7,3 mm, präglade med ”16” på ena sidan.
Uptravi 100 mikrogram filmdragerade tabletter är förpackade i burkar med 60 eller 140 tabletter (titreringsförpackning).
Uptravi 200 mikrogram filmdragerade tabletter är förpackade i blisterkartor med 10 eller 60 tabletter och 60 eller 140 tabletter (titreringsförpackningar).
Uptravi 400 mikrogram, 600 mikrogram, 800 mikrogram, 1 000 mikrogram, 1 200 mikrogram, 1 400 mikrogram och 1 600 mikrogram filmdragerade tabletter är förpackade i blisterkartor med 60 tabletter.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
Janssen-Cilag International NV
Turnhoutseweg 30
B-2340 Beerse
Belgien
Tillverkare
Janssen Pharmaceutica NV
Turnhoutseweg 30
B-2340 Beerse
Belgien
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
| Suomi/Finland Janssen-Cilag Oy Puh/Tel: +358 207 531 300 jacfi@its.jnj.com |
Denna bipacksedel ändrades senast 02/2026
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu.