Pakkausseloste
FICOXIL purutabletti 57 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Ficoxil 57 mg purutabletit koiralle
VAIKUTTAVAT JA MUUT AINEET
Yksi tabletti sisältää:
Vaikuttava aine:Firokoksibi 57 mg
Apuaineet:Punainen rautaoksidi (E172) 0,131 mg
Keltainen rautaoksidi (E172) 0,056 mg
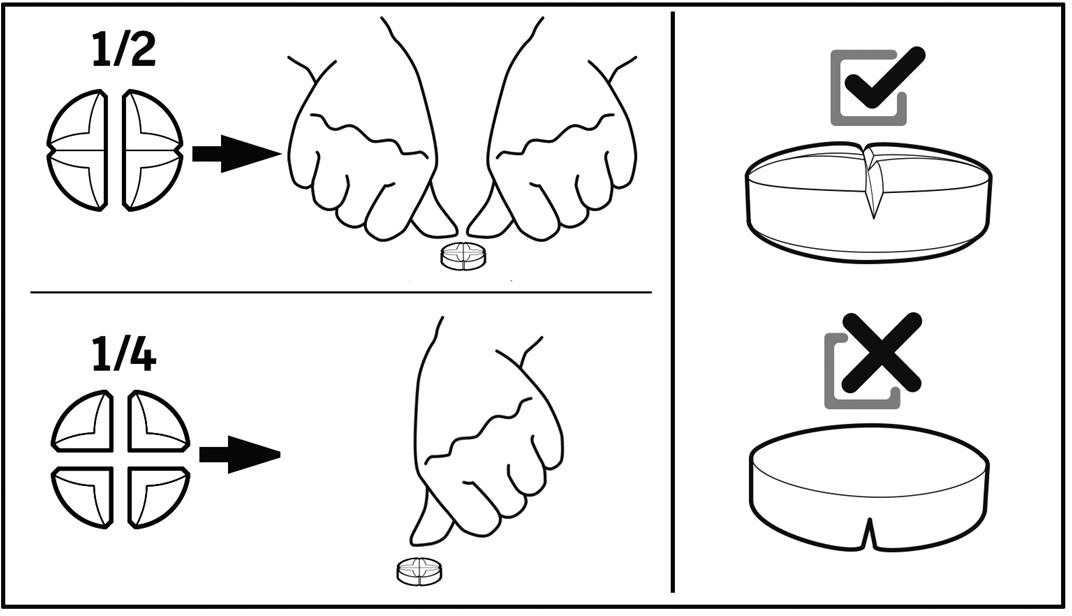
Pyöreä, vaaleanpunertava kaksoiskupera tabletti, jonka toisella puolella on ristikkäisjakouurre ilman merkintää.
Tabletin voi jakaa kahteen tai neljään yhtä suureen osaan.
KÄYTTÖAIHEET
Koirien nivelrikkoon liittyvän kivun ja tulehdusreaktion lievittäminen.
Koirien pehmytkudoskirurgiaan, ortopediaan ja hammaskirurgiaan liittyvän toimenpiteen jälkeisen kivun ja tulehdusreaktion lievittäminen.
VASTA-AIHEET
Valmistetta ei saa käyttää tiineille eikä imettäville nartuille.
Valmistetta ei saa käyttää alle 10-viikkoisille eikä alle 3 kg painaville eläimille.
Valmistetta ei saa käyttää eläimille, joilla on ruuansulatuskanavan verenvuoto, häiriöitä verenkuvassa tai verenvuotohäiriö.
Valmistetta ei saa käyttää samanaikaisesti kortikosteroidien eikä muiden tulehduskipulääkkeiden (NSAID) kanssa.
Ei saa käyttää tapauksissa tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
HAITTAVAIKUTUKSET
Oksentelua ja ripulia on ilmennyt silloin tällöin. Nämä reaktiot ovat yleensä ohimeneviä ja korjautuvia, kun hoito lopetetaan. Koirilla on hyvin harvinaisina tapauksina raportoitu maksan ja/tai munuaisten toimintahäiriöitä suositellun annoksen antamisen jälkeen. Hoitoa saaneilla koirilla on raportoitu hyvin harvoin hermostollisia häiriöitä.
Jos haittavaikutuksia, kuten oksentelua, toistuvaa ripulia, ulosteen piiloverisyyttä, äkillistä painonlaskua, ruokahaluttomuutta, uupumista, munuais- tai maksa-arvojen poikkeamia ilmenee, valmisteen käyttö on lopetettava ja on konsultoitava eläinlääkäriä. Valmisteen käytön yhteydessä voi ilmetä vakavia haittavaikutuksia, kuten muidenkin tulehduskipulääkkeiden käytön yhteydessä. Hyvin harvoissa tapauksissa haittavaikutukset voivat olla kuolemaan johtavia.
Haittavaikutusten esiintyvyys määritellään seuraavasti:
- hyvin yleinen (useampi kuin 1/10 hoidettua eläintä saa haittavaikutuksen)
- yleinen (useampi kuin 1 mutta alle 10 /100 hoidettua eläintä)
- melko harvinainen (useampi kuin 1 mutta alle 10 / 1000 hoidettua eläintä)
- harvinainen (useampi kuin 1 mutta alle 10 / 10.000 hoidettua eläintä)
- hyvin harvinainen (alle 1 / 10.000 hoidettua eläintä, mukaan lukien yksittäiset ilmoitukset).
Jos havaitset haittavaikutuksia, myös sellaisia joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä että lääke ei ole tehonnut, ilmoita asiasta eläinlääkärillesi.
Vaihtoehtoisesti voit ilmoittaa kansallista raportointijärjestelmää käyttäen {www.fimea.fi/elainlaakkeet/}.
KOHDE-ELÄINLAJI
Koira.

ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Anna 5 mg firokoksibia painokiloa kohti kerran vuorokaudessa.
Leikkauksen jälkeisen kivun ja tulehdusreaktion lievittämiseen hoito voidaan aloittaa noin 2 tuntia ennen leikkausta ja hoitoa voidaan jatkaa enintään 3 vuorokauden ajan tarpeen mukaan. Ortopedisen leikkauksen jälkeen ja saavutetusta hoitovasteesta riippuen hoitoa voidaan jatkaa vielä kolmen ensimmäisen vuorokauden jälkeen hoitavan lääkärin arvion perusteella.
Suun kautta alla olevan taulukon mukaisesti, joka on tarkoitettu ohjeeksi eläinlääkevalmisteen antamiselle suositellulla annoksella.
| Paino (kg) |
Tablettien määrä koon mukaan |
mg/kg vaihteluväli |
|
| 57 mg |
227 mg |
||
| 3,0–5,5 |
½ |
5,2–9,5 |
|
| 5,6–7,5 |
¾ |
5,7–7,6 |
|
| 7,6–10 |
1 tai ¼ |
5,7–7,5 |
|
| 10,1–13 |
1 ¼ |
5,5–7,1 |
|
| 13,1–16 |
1 ½ |
5,3–6,5 |
|
| 16,1–18,5 |
1 ¾ |
5,4–6,2 |
|
| 18,6–22,5 |
½ |
5,0–6,1 |
|
| 22,6–34 |
¾ |
5,0–7,5 |
|
| 34,1–45 |
1 |
5,0–6,7 |
|
| 45,1–56 |
1 ¼ |
5,1–6,3 |
|
| 56,1–68 |
1 ½ |
5,0–6,1 |
|
| 68,1–79 |
1 ¾ |
5,0–5,8 |
|
| 79,1–90 |
2 |
5,0–5,7 |
|

![]() = ¼ tabletti = ½ tabletti = ¾ tabletti = 1 tabletti
= ¼ tabletti = ½ tabletti = ¾ tabletti = 1 tabletti
Tarkkaa annostelua varten tabletit voidaan jakaa kahteen tai neljään yhtä suureen osaan.
ANNOSTUSOHJEET
Tabletit voidaan antaa ruoan kanssa tai ilman ruokaa. Annossuositusta ei saa ylittää.
Hoidon kesto määräytyy todetun vasteen mukaan. Koska kenttätutkimuksen kesto oli pisimmillään 90 vuorokautta, pitkäaikaisen hoidon tarpeellisuutta on harkittava tarkoin ja eläinlääkärin on seurattava eläintä säännöllisesti.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville. Ei erityisiä säilytysohjeita.
Osittain käytetty tabletti on laitettava takaisin läpipainopakkaukseen ja käytettävä seuraavan annostelun yhteydessä 7 vuorokauden kuluessa.
Älä käytä tätä eläinlääkevalmistetta viimeisen käyttöpäivän jälkeen, joka on ilmoitettu pahvirasiassa merkinnän EXP jälkeen. Erääntymispäivällä tarkoitetaan kuukauden viimeistä päivää.
ERITYISVAROITUKSET
Erityisvaroitukset kohde-eläinlajeittain:
Ei ole.
Eläimiä koskevat erityiset varotoimet:
Koska tableteissa on makuainetta, ne on säilytettävä turvallisessa paikassa poissa eläinten ulottuvilta. Annostustaulukon mukaista suositeltua enimmäisannosta ei pidä ylittää.
Valmisteen käyttöön voi liittyä suurempi riski, jos sitä käytetään erittäin nuorille eläimille tai eläimille, joilla epäillään tai on todettu munuaisten, sydämen tai maksan vajaatoiminta. Jos käyttö tällaisissa tapauksissa on välttämätöntä, eläimet vaativat huolellista eläinlääkärin seurantaa.
Vältä valmisteen käyttöä kuivuneille, pienestä veritilavuudesta tai alhaisesta verenpaineesta kärsiville eläimille, koska tähän liittyy suurentunut munuaistoksisuuden riski. Valmisteen samanaikaista käyttöä mahdollisesti munuaistoksisten lääkkeiden kanssa on vältettävä.
Tätä valmistetta saa käyttää vain tarkassa eläinlääkärin seurannassa, jos eläimellä on ruoansulatuselimistön verenvuodon vaara tai jos tiedetään, että eläin sietää tulehduskipulääkkeitä huonosti. Koirilla on hyvin harvinaisina tapauksina raportoitu maksan ja/tai munuaisten toimintahäiriöitä suositellun annoksen antamisen jälkeen. On mahdollista, että osalla näistä koirista oli jo ennen hoidon aloittamista munuais- tai maksasairaus, jonka kliinisiä merkkejä ei ollut havaittavissa. Tämän vuoksi suositellaan soveltuvien laboratoriokokeiden ottamista maksa- ja munuaisarvojen perustason määrittämiseksi ennen hoidon aloittamista ja säännöllisesti hoidon aikana.
Hoito on lopetettava, jos seuraavia oireita havaitaan: toistuvaa ripulia, oksentelua, ulosteen piiloverisyyttä, äkillistä painon laskua, ruokahaluttomuutta, uupumista, munuais- tai maksa-arvojen poikkeamia.
Erityiset varotoimenpiteet, joita eläinlääkevalmistetta antavan henkilön on noudatettava:
Tämä valmiste saattaa olla haitallinen, jos sitä niellään vahingossa.
Jotta lapset eivät pääsisi valmisteeseen käsiksi, tabletit on annosteltava ja säilytettävä poissa lasten näkyviltä ja ulottuvilta. Puolitetut tai neljään osaan jaetut tabletit on asetettava takaisin
läpipainopakkaukseen ja suljettava ulkopakkaukseen. Kaniineille ja rotille tehdyt laboratoriotutkimukset ovat osoittaneet, että firokoksibi voi vaikuttaa lisääntymiseen ja aiheuttaa sikiöille epämuodostumia. Raskaana olevien naisten tai naisten, jotka suunnittelevat raskautta, tulee antaa valmistetta varoen.
Pese kädet valmisteen käytön jälkeen.
Jos tabletteja niellään vahingossa, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Tiineys ja imetys:
Ei saa käyttää tiineille eikä imettäville nartuille.
Kaniineille tehdyt laboratoriokokeet ovat osoittaneet, että annoksilla, jotka ovat suunnilleen samat kuin koiralle suositeltu hoitoannos, ilmenee emossa ja sikiössä toksisia vaikutuksia.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Aiempi hoito muilla tulehdusta lievittävillä valmisteilla voi lisätä tai pahentaa haittavaikutuksia, joten ennen hoidon aloittamista on pidettävä vähintään 24 tunnin tauko tällaisten lääkkeiden käyttämisestä. Hoidottoman ajanjakson pituuden arvioimisessa on kuitenkin otettava huomioon aiemmin käytettyjen valmisteiden farmakokineettiset ominaisuudet.
Valmistetta ei saa antaa yhdessä muiden tulehduskipulääkkeiden eikä glukokortikosteroidien kanssa. Kortikosteroidit voivat pahentaa ruoansulatuskanavan haavaumia eläimillä, joille on annettu steroideihin kuulumattomia tulehduskipulääkkeitä.
Samanaikainen hoito lääkkeillä, jotka vaikuttavat munuaisten virtsaneritykseen, esim. diureeteilla tai angiotensiinikonvertaasin (ACE) estäjillä, edellyttää kliinistä seurantaa. Valmisteen samanaikaista käyttöä mahdollisesti munuaistoksisten lääkkeiden kanssa on vältettävä, koska tämä voi lisätä munuaistoksisuuden vaaraa. Koska anesteetit voivat vaikuttaa munuaisperfuusioon, parenteraalista nestehoitoa on harkittava leikkauksen aikana vähentämään mahdollisia munuaishaittoja, kun tulehduskipulääkkeitä (NSAID) käytetään perioperatiivisesti.
Samanaikainen muiden voimakkaasti proteiineihin sitoutuvien lääkkeiden käyttö voi syrjäyttää firokoksibin ja johtaa näin toksisiin vaikutuksiin.
Yliannostus (oireet, hätätoimenpiteet, vastalääkkeet):
Koirilla, jotka hoidon alussa olivat kymmenen viikon ikäisiä, havaittiin seuraavat toksisuuden oireet, kun annos oli vähintään 25 mg/kg/vrk (viisinkertainen suositusannos) kolmen kuukauden ajan: painon lasku, huono ruokahalu, maksamuutokset (lipidin kertyminen), aivomuutokset (vakuolisaatiota), muutokset pohjukaissuolessa (haavaumia) ja kuolema. Kun annos oli vähintään 15 mg/kg/vrk (kolminkertainen suositusannos) kuuden kuukauden ajan, todettiin samanlaiset kliiniset löydökset, tosin lievempinä ja harvemmin eikä pohjukaissuolihaavaumia havaittu.
Näissä kohde-eläintä koskevissa turvallisuustutkimuksissa kliiniset toksisuuden oireet korjautuivat joillakin koirilla, kun hoito lopetettiin.
Koirilla, jotka hoidon alussa olivat seitsemän kuukauden ikäisiä, havaittiin ruoansulatuskanavan haittavaikutuksia, eli oksentelua, kun annos oli vähintään 25 mg/kg/vrk (viisinkertainen suositusannos) kuuden kuukauden ajan.
Yliannostustutkimuksia ei ole tehty 14 kuukautta vanhemmille koirille. Jos yliannostuksen kliinisiä oireita havaitaan, hoito on keskeytettävä.
Yhteensopimattomuudet:
Ei oleellinen.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa heittää viemäriin eikä hävittää talousjätteiden mukana.
Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi tai apteekista. Nämä toimenpiteet on tarkoitettu ympäristön suojelemiseksi.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
04.06.2021
MUUT TIEDOT
Pakkauskoot:
- 1 pahvirasia, joka sisältää yhden 10 tabletin läpipainopakkauksen (10 tablettia).
- 1 pahvirasia, joka sisältää kolme 10 tabletin läpipainopakkausta (30 tablettia).
- 1 pahvirasia, joka sisältää kuusi 10 tabletin läpipainopakkausta (60 tablettia).
- 1 pahvirasia, joka sisältää kymmenen 10 tabletin läpipainopakkausta (100 tablettia).
- 1 pahvirasia, joka sisältää kahdeksantoista 10 tabletin läpipainopakkausta (180 tablettia).
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija LIVISTO Int'l, SL
Av. Universitat Autònoma, 29 08290 Cerdanyola del Vallès (Barcelona), Espanja
Erän vapauttamisesta vastaava valmistaja: aniMedica Herstellungs GmbH
Im Südfeld 9
48308 Senden-Bösensell Saksa
aniMedica GmbH Im Südfeld 9
48308 Senden-Bösensell Saksa
Industrial Veterinaria, SA Esmeralda 19,
08950 Esplugues de Llobregat (Barcelona), Espanja