Pakkausseloste
BRAVECTO spot-on, lösning 112,5 mg, 250 mg, 500 mg
DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN
Bravecto 112,5 mg spot-on, lösning för små katter (1,2 - 2,8 kg)
Bravecto 250 mg spot-on, lösning för medelstora katter (>2,8 - 6,25 kg)
Bravecto 500 mg spot-on, lösning för stora katter (>6,25 - 12,5 kg)
DEKLARATION AV AKTIVA SUBSTANSER OCH ÖVRIGA SUBSTANSER
Varje ml innehåller 280 mg fluralaner.
Varje pipett innehåller:
|
Bravecto spot-on lösning |
Pipettinnehåll (ml) |
Fluralaner (mg) |
|
För små katter 1,2 - 2,8 kg |
0,4 |
112,5 |
|
För medelstora katter >2,8 - 6,25 kg |
0,89 |
250 |
|
För stora katter >6,25 - 12,5 kg |
1,79 |
500 |
Klar, färglös till gul lösning.
ANVÄNDNINGSOMRÅDEN
För behandling av fästing- och loppangrepp hos katt.
Detta läkemedel är en systemisk insekticid (medel mot insekter) och akaricid (medel mot kvalster), som ger omedelbar och bestående avdödande effekt mot loppor (Ctenocephalides felis) och fästingar (Ixodes ricinus) under 12 veckor.
Loppor och fästingar måste sätta sig fast på/bita värddjuret och via intag exponeras för den aktiva substansen.
Läkemedlet kan användas som en del av behandlingsstrategin mot allergisk hudinflammation orsakad av loppor (flea allergy dermatitis FAD).
För behandling av öronskabb (Otodectes cynotis).
KONTRAINDIKATIONER
Använd inte vid överkänslighet mot den aktiva substansen eller mot något av hjälpämnena.
BIVERKNINGAR
Katt:
Vanliga (1 till 10 av 100 behandlade djur): | Hudreaktioner vid appliceringsstället (såsom hudrodnad (erytem), klåda (pruritus), håravfall (alopeci))# |
Mindre vanliga (1 till 10 av 1 000 behandlade djur): | Skakningar (muskeltremor). Apati, aptitlöshet (anorexi), kräkningar, dreglande. |
Mycket sällsynta (färre än 1 av 10 000 behandlade djur, enstaka rapporterade händelser inkluderade): | Klåda Ataxi (svårighet att samordna rörelser), krampanfall |
#Milda och övergående
Det är viktigt att rapportera biverkningar. Det möjliggör fortlöpande säkerhetsövervakning av ett läkemedel. Om du observerar biverkningar, även sådana som inte nämns i denna bipacksedel, eller om du tror att läkemedlet inte har fungerat, meddela i första hand din veterinär. Du kan också rapportera eventuella biverkningar till innehavaren av godkännande för försäljning genom att använda kontaktuppgifterna i slutet av denna bipacksedel, eller via ditt nationella rapporteringssystem: Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea, webbplats: https://fimea.fi/sv/veterinar.
DJURSLAG
Katt.
DOSERING FÖR VARJE DJURSLAG, ADMINISTRERINGSSÄTT OCH ADMINISTRERINGSVÄGAR
För spot-on användning.
Läkemedlet ska ges i enlighet med tabellen nedan (vilket motsvarar en dos om 40 - 94 mg fluralaner/kg kroppsvikt):
|
Kattens kroppsvikt (kg) |
Antal pipetter och styrka som ska appliceras |
||
|
Bravecto 112,5 mg |
Bravecto 250 mg |
Bravecto 500 mg |
|
|
1,2 - 2,8 |
1 |
|
|
|
> 2,8 - 6,25 |
|
1 |
|
|
>6,25 - 12,5 |
|
|
1 |
För katter som väger mer än 12,5 kg ska en kombination av två pipetter användas som närmast motsvarar kroppsvikten.
Underdosering kan resultera i ineffektiv behandling och kan gynna resistensutveckling.
ANVISNING FÖR KORREKT ADMINISTRERING
Hur du ger läkemedlet:
Steg 1: Öppna innerpåsen i omedelbar anslutning till användandet och ta ut pipetten. Ta på skyddshandskar. För att öppna pipetten håll den upprätt i övre delen av basen eller på den övre stela delen under locket med toppen uppåt. Vrid locket medsols eller motsols ett helt varv. Locket ska sitta kvar på pipetten; det är inte möjligt att ta bort det. Pipetten är öppen och klar för användning när det känns att förseglingen bryts.
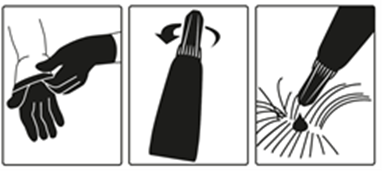
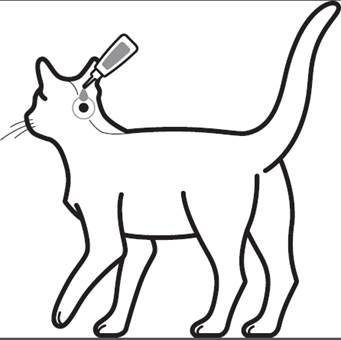
Steg 2: Katten ska stå eller ligga med ryggen i horisontellt läge för att underlätta appliceringen. Placera pipettspetsen vid kattens skallbas.
Steg 3: Kläm försiktigt på pipetten och applicera hela innehållet direkt på kattens hud. Till katter som väger upp till 6,25 kg ska läkemedlet appliceras på ett ställe vid skallbasen. Till katter som väger över 6,25 kg ska två appliceringsställen användas.
Behandlingsschema:
Vid angrepp av loppor och fästingar ska behov och frekvens av återbehandling(ar) baseras på professionell rådgivning och hänsyn ska tas till den lokala förekomsten av smitta och djurets livsstil.
För optimal kontroll av fästing- och loppangrepp ska läkemedlet ges med 12 veckors intervall.
Vid behandling av öronskabb (Otodectes cynotis) ska en engångsdos av läkemedlet appliceras. En ytterligare veterinärundersökning 28 dagar efter behandling rekommenderas, eftersom vissa djur kan kräva ytterligare behandling med ett alternativt veterinärmedicinskt läkemedel.
KARENSTIDER
Ej relevant.
SÄRSKILDA FÖRVARINGSANVISNINGAR
Förvaras utom syn- och räckhåll för barn.
Inga särskilda temperaturanvisningar.
Pipetterna ska förvaras i ytterförpackningen för att skydda mot avdunstning eller fuktupptag.
Innerpåsen ska endast öppnas i direkt anslutning till att läkemedlet ska användas.
Använd inte detta läkemedel efter utgångsdatumet på förpackningen efter Exp. Utgångsdatumet är den sista dagen i angiven månad.
SÄRSKILDA VARNINGAR
Särskilda varningar:
Parasiten måste via intag få i sig fluralaner för att exponeras för substansen, därför kan risk för parasitöverförda sjukdomar inte uteslutas.
Onödig användning av läkemedel för behandling av parasitsjukdomar eller användning som avviker från instruktionerna i produktresumén kan öka urvalstrycket för resistensutveckling och leda till minskad effekt. Ett beslut om att använda läkemedlet bör baseras på bekräftelse av parasitarten och parasitbördan, eller på risken för angrepp baserat på parasitens lokala förekomst, för varje enskilt djur.
Möjligheten att andra djur i samma hushåll kan vara en källa till återinfektion med parasiter bör övervägas, och dessa bör vid behov behandlas med ett lämpligt veterinärmedicinskt läkemedel.
Särskilda försiktighetsåtgärder för säker användning hos det avsedda djurslaget:
Var försiktig så att läkemedlet inte kommer i kontakt med djurets ögon.
Använd inte direkt på skadad hud.
Eftersom information saknas ska detta läkemedel inte användas till kattungar yngre än 9 veckor och/eller till katter som väger mindre än 1,2 kg.
Använd inte läkemedlet med kortare intervall än 8 veckor, då säkerheten för kortare intervall inte har fastställts.
Läkemedlet är avsett för topikal behandling (via huden) och får inte administreras oralt (via munnen).
Låt inte djur som nyligen behandlats putsa varandra.
Särskilda försiktighetsåtgärder för personer som ger läkemedlet till djur:
Kontakt med detta läkemedel bör undvikas och tillgängliga engångsskyddshandskar måste bäras vid hantering av läkemedlet av följande skäl:
Överkänslighetsreaktioner, som kan bli allvarliga, har rapporterats hos ett fåtal personer.
Personer med överkänslighet mot fluralaner eller mot något hjälpämne bör undvika exponering för läkemedlet.
Läkemedlet binder till hud och kan vid spill även binda till andra ytor.
Hudutslag, stickningar eller domningar efter hudkontakt har rapporterats hos ett fåtal individer.
Vid hudkontakt, tvätta omedelbart det område som kommit i kontakt med lösningen med tvål och vatten. I vissa fall är tvål och vatten inte tillräckligt för att få bort medel som hamnat på fingrarna. Kontakt med läkemedlet kan också ske vid hantering av ett behandlat djur.
Se till att fläcken där läkemedlet applicerats inte längre syns på djuret innan du vidrör appliceringsstället. Detta inkluderar att kela och dela säng med djuret. Det tar upp till 48 timmar för appliceringsstället att bli torrt men det kan synas längre.
Om hudreaktion uppstår, kontakta läkare och visa förpackningsmaterialet.
Personer med känslig hud eller känd allmän allergi, t.ex. mot andra läkemedel av denna typ bör hantera detta läkemedel och behandlade djur med försiktighet.
Detta läkemedel kan orsaka ögonirritation. Vid kontakt med ögonen, skölj omedelbart och noggrant med vatten.
Detta läkemedel är skadligt att förtära. Förvara läkemedlet i originalförpackningen tills det ska användas så att barn inte kommer i direktkontakt med läkemedlet. Släng omedelbart en använd pipett.
Vid oavsiktligt intag, uppsök läkare och visa denna information eller etiketten.
Detta läkemedel är mycket brandfarligt. Förvara det åtskilt från värme, gnistor, öppen eld eller andra antändningskällor.
Vid spill på t ex bord eller golvytor, torka upp allt spill med papper och rengör området med rengöringsmedel.
Dräktighet, digivning och fertilitet:
Säkerheten för detta läkemedel har inte fastställts under dräktighet och digivning. Använd endast i enlighet med ansvarig veterinärs nytta/riskbedömning.
Interaktioner med andra läkemedel och övriga interaktioner:
Inga kända.
Fluralaner binds i hög grad till plasmaproteiner (proteiner i blodet) och kan konkurrera med andra starkt bundna aktiva substanser såsom icke-steroida antiinflammatoriska läkemedel (NSAID) och kumarinderivatet warfarin. Inkubation av fluralaner i närvaro av karprofen eller warfarin i hundplasma vid maximala förväntade koncentrationer i plasma minskade inte proteinbindningen av fluralaner, karprofen eller warfarin.
I laboratorie- och fältstudier har inga interaktioner mellan läkemedlet och andra rutinmässigt använda läkemedel observerats.
Överdosering:
Läkemedlets säkerhet har fastställts hos kattungar i åldern 9 - 13 veckor, med en vikt av 0,9 – 1,9 kg och som behandlades med överdoser på upp till 5 gånger den högsta rekommenderade dosen vid 3 tillfällen med kortare intervall än rekommenderat (8 veckors intervall).
Oralt upptag av läkemedlet vid den högsta rekommenderade dosen tolererades väl hos katter, bortsett från enstaka, övergående ökad salivutsöndring och hosta eller kräkning omedelbart efter administrering.
Viktiga blandbarhetsproblem:
Inga kända.
SÄRSKILDA FÖRSIKTIGHETSÅTGÄRDER FÖR DESTRUKTION AV EJ ANVÄNT LÄKEMEDEL ELLER AVFALL, I FÖREKOMMANDE FALL
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall.
Läkemedlet får inte släppas ut i vattendrag på grund av att fluralaner kan vara farligt för vattenlevande, ryggradslösa djur.
Använd retursystem för kassering av ej använt läkemedel eller avfall från läkemedelsanvändningen i enlighet med lokala bestämmelser. Dessa åtgärder är till för att skydda miljön.
Fråga veterinär eller apotekspersonal hur man gör med läkemedel som inte längre används.
DATUM DÅ BIPACKSEDELN SENAST GODKÄNDES
24.7.2025
Utförlig information om detta läkemedel finns i unionens produktdatabas (https://medicines.health.europa.eu/veterinary).
Läkemedlet bidrar till att kontrollera populationen av loppor i omgivningen som behandlade katter vistas i.
Effekten sätter in inom 12 timmar mot loppor (C. felis) och inom 48 timmar mot fästingar (I. ricinus).
NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND SOM ANSVARAR FÖR FRISLÄPPANDE AV TILLVERKNINGSSATS, OM OLIKA
Innehavare av godkännande för försäljning och kontaktuppgifter för att rapportera misstänkta biverkningar:
Intervet International B.V.
Wim de Körverstraat 35
5831 AN Boxmeer
Nederländerna
Finland
Tel: + 358 10 2310 750
Tillverkare ansvarig för frisläppande av tillverkningssats:
Intervet Productions S.A.
Rue de Lyons
27460 Igoville
Frankrike