Pakkausseloste
GAMMAGARD S/D pulver och vätska till infusionsvätska, lösning
Tilläggsinformation
Gammagard S/D pulver och vätska till infusionvätska, lösning
humant normalt immunglobulin
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal, eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal, eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Gammagard S/D är och vad det används för
2. Vad du behöver veta innan du använder Gammagard S/D
3. Hur du använder Gammagard S/D
4. Eventuella biverkningar
5. Hur Gammagard S/D ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Gammagard S/D tillhör en grupp läkemedel som kallas immunglobuliner. Dessa läkemedel innehåller humana antikroppar, som också finns i ditt blod. Antikroppar hjälper kroppen att bekämpa infektioner. Läkemedel som Gammagard S/D används hos patienter som inte har tillräckligt med antikroppar i blodet och som ofta drabbas av infektioner. De kan också användas hos patienter som behöver ytterligare antikroppar för behandling av vissa inflammatoriska sjukdomar (autoimmuna sjukdomar).
Gammagard S/D används för:
Behandling av patienter som inte har tillräckligt med antikroppar (substitutionsterapi). Det finns fem grupper:
- Patienter med medfödd brist på antikroppsproduktion (primära immunbristsyndrom).
- Patienter med cancer i blodet (kronisk lymfatisk leukemi) som leder till brist på antikroppsproduktion och återkommande infektioner, där antibiotika i förebyggande syfte inte har fungerat.
- Patienter med cancer i benmärgen (multipla myelom) och brist på antikroppsproduktion med återkommande infektioner, och som inte svarat på vaccin mot vissa bakterier (pneumokocker).
- Barn och ungdomar (0 till 18 år) med AIDS från födelsen och återkommande bakteriella infektioner.
- Patienter med låg produktion av antikroppar efter transplantation av benmärgsceller från en annan person.
Behandling av patienter med vissa inflammatoriska sjukdomar (immunmodulering). Det finns tre grupper:
- Patienter som inte har tillräckligt med blodplättar (primär immuntrombocytopeni) och som löper stor risk att drabbas av blödning eller som ska opereras inom kort.
- Patienter som har en sjukdom som ger upphov till åtskilliga inflammationer i kroppens nerver (Guillain-Barrés syndrom).
- Patienter som har en sjukdom som ger upphov till åtskilliga inflammationer i flera av kroppens organ (Kawasakis sjukdom).
Vad du behöver veta innan produkten används
Använd inte Gammagard S/D
- om du är allergisk mot humant normalt immunglobulin, särskilt om du har antikroppar mot immunglobulin A (IgA) i ditt blod eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Gammagard S/D.
Hur lång övervakning krävs under infusionen
Risken för biverkningar kan vara större:
- om Gammagard S/D administreras i hög hastighet
- om du lider av ett tillstånd med låga halter av antikroppar i blodet (hypo- eller agammaglobulinemi)
- om du inte har fått det här läkemedlet tidigare eller om det var länge sedan du fick det (t. ex. flera veckor). Du kommer att övervakas noggrant under infusionen och en timme efter att infusionen avslutats, för att säkerställa att du inte drabbas av en reaktion.
Om du redan har fått Gammagard S/D tidigare och fick den senaste behandlingen nyligen, kommer du att observeras under infusionen och under minst 20 minuter efter infusionen. Din läkare kommer att säkerställa att den hastighet som Gammagard S/D ges med passar dig.
Om infusionshastigheten måste minskas eller infusionen avbrytas
I sällsynta fall kanske din kropp tidigare har reagerat på specifika antikroppar och kan därför vara känslig för läkemedel som innehåller antikroppar. Detta gäller särskilt om du lider av immunglobulin A-brist. I dessa sällsynta fall kan du drabbas av allergiska reaktioner som plötsligt blodtrycksfall eller chock, även om du fått behandling med läkemedel som Gammagard S/D tidigare.
Om du upplever någon av följande reaktioner under infusionen med Gammagard S/D, tala om det för din läkare eller sjuksköterska med en gång:
- Plötsligt väsande andning, svårigheter att andas eller tryck över bröstet
- Huvudvärk
- Feber
- Svullnad av ögonlock, ansikte, läppar eller blodkärl
- Knölar i huden eller röda kliande utslag
- Klåda över hela kroppen.
Din läkare kommer att fatta beslut om huruvida infusionshastigheten behöver minskas eller infusionen avbrytas helt.
Speciella patientgrupper
Din läkare kommer att vara extra försiktig om du är överviktig, äldre, eller oförmögen att röra dig. Tala med läkare eller sjuksköterska innan du får Gammagard om du har:
- diabetes
- högt blodtryck
- liten blodvolym (hypovolemi)
- förhöjd blodviskositet eller problem med blodkärlen (kärlsjukdomar). Din läkare kommer då att observera dig noggrant. Vid dessa tillstånd kan immunglobulinerna öka risken för hjärtinfarkt, slaganfall, lungemboli eller djup ventrombos. Detta är dock mycket sällsynt.
Tala om för din läkare eller sjuksköterska:
- om du har eller tidigare har haft problem med njurarna
- om du tar läkemedel som kan skada njurarna (nefrotoxiska läkemedel), det finns en mycket liten risk för akut njursvikt
- om du har en njursjukdom. Proteininnehållet kan öka blodets viskositet. Din läkare kommer att vidta särskilda försiktighetsåtgärder
Påverkan på resultat av blodprover
Gammagard S/D innehåller en mängd olika antikroppar och vissa av dessa kan påverka blodprover. Om du tar ett blodprov efter du har fått Gammagard S/D, ska du informera den som tar blodprovet eller läkaren om att du tar detta läkemedel.
Information om ursprungsmaterialet i Gammagard S/D
När läkemedel framställs av human plasma eller blod, vidtas speciella åtgärder för att förhindra att infektioner överförs till patienter. Detta inkluderar noggrant urval av blod- och plasmagivare för att försäkra sig om att personer med risk för att vara smittbärare utesluts, samt test av enskilda donationer och plasmapooler för tecken på virus/infektion. Tillverkarna av dessa produkter inkluderar dessutom steg i processningen av blod och plasma som kan inaktivera och avskilja virus. Trots detta kan risken för överföring av infektion inte helt uteslutas när läkemedel som tillverkats av humant blod eller plasma ges. Detta gäller även nya, hittills okända virus samt andra typer av infektioner.
De åtgärder som vidtagits anses vara effektiva mot höljeförsedda virus, såsom HIV, hepatit B och hepatit C virus.
Åtgärderna kan vara av begränsat värde mot icke höljeförsedda virus såsom hepatit A virus och parvovirus B19.
När du ges Gammagard S/D rekommenderas att produktnamn och satsnummer registreras för att möjliggöra spårandet av använd produkt.
Andra läkemedel och Gammagard S/D
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit, eller kan tänkas ta andra läkemedel.
- Om du har vaccinerat dig under de senaste 6 veckorna och upp till tre månader kan infusion av immunglobuliner som Gammagard S/D påverka effekten av vissa levande virusvacciner, t.ex. mässling, röda hund, påssjuka och vattkoppor. När du fått dessa läkemedel kan du behöva vänta upp till tre månader innan du kan få levande försvagat vaccin. Du kan behöva vänta upp till ett år efter du fått immunglobuliner innan du kan få mässlingvaccin.
Graviditet, amning och fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel. Din läkare kommer att besluta om du får använda Gammagard S/D under graviditeten och när du ammar.
Inga kliniska studier har gjorts med Gammagard S/D på gravida eller ammande kvinnor. Läkemedel som innehåller antikroppar har dock använts av gravida och ammande kvinnor och det har visat att det inte finns några skadliga effekter på graviditeten eller det väntade barnet.
Om du ammar och tar Gammagard S/D kan antikropparna finnas i bröstmjölken. Därför kan ditt barn vara skyddat mot vissa infektioner.
Inga skadliga effekter på fertiliteten kan förväntas.
Körförmåga och användning av maskiner
Patienter kan uppleva biverkningar (till exempel yrsel och illamående) under behandlingen med Gammagard S/D, vilket kan påverka förmågan att framföra fordon och använda maskiner. Om detta inträffar bör du vänta tills reaktionen har försvunnit.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med läkare eller apotekspersonal om du är osäker.
Gammagard S/D innehåller glukos och natrium
Gammagard S/D innehåller cirka 20 mg/ml glukos. Detta bör beaktas av patienter med diabetes mellitus.
Detta läkemedel innehåller 668 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska (10 g). Detta motsvarar 34 % av högsta rekommenderat dagligt intag av natrium för vuxna.
Hur produkten används
Gammagard S/D är avsett för intravenös administrering (infusion i en ven). Det är läkaren eller sjuksköterskan som ger dig infusionen. Doseringen och hur ofta du får infusionen varierar beroende på ditt tillstånd och din kroppsvikt.
I början av infusionen får du Gammagard S/D med långsam hastighet. Beroende på hur du mår, kan din läkare därefter sakta öka infusionshastigheten.
Användning för barn
Samma indikationer, dos och infusionsfrekvens som för vuxna gäller för barn (0-18 år).
Om du har använt för stor mängd av Gammagard S/D
Eftersom läkemedlet ges till dig på sjukhus är det inte troligt att du får för lite eller för mycket läkemedel. Om du har några frågor, prata med din läkare eller sjukvårdspersonalen.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller sjukvårdspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla behöver inte få dem.
Följande biverkningar kan inträffa emellanåt efter behandling med immunglobuliner (läkemedel som Gammagard S/D): frossa, huvudvärk, feber, kräkningar, allergiska reaktioner, illamående, ledvärk, lågt blodtryck och måttlig smärta i ländryggen.
I sällsynta fall kan plötsligt blodtrycksfall och eksem-liknande symtom ses (övergående hudreaktioner) samt i enstaka fall allergiska reaktioner (anafylaktisk chock), även om ingen reaktion har skett vid tidigare infusioner.
Fall av övergående hjärnhinneinflammation (reversibel aseptisk meningit) och fall av tillfällig minskning av antalet röda blodkroppar (reversibel hemolytisk anemi/hemolys) samt ökning av blodkreatinin och njursvikt har observerats.
Mycket sällsynt: Blodproppsbildning i blodkärlen (tromboemboliska reaktioner) som kan leda till hjärtattack, slaganfall, lungskada (lungemboli) och djup ventrombos.
Nedan följer en lista över biverkningar som rapporterats för Gammagard S/D:
- Vanliga (förekommer hos färre än 1 av 10 patienter):
huvudvärk, rodnad, kräkningar, illamående, trötthet, frossa, feber
- Mindre vanliga (förekommer hos färre än 1 av 100 patienter):
Influensa, minskad aptit, ångest, upphetsning, onormal sömnighet, dimsyn, hjärtklappning, blodtrycksförändringar, andnöd, näsblod, diarré, inflammation i munnen, smärta i övre delen av magen, obehagskänsla i magen, nässelutslag, klåda, kallsvettning, stegrad svettning, ryggont, muskelkramp (spasm), smärta i ben och armar, bröstsmärta, sjukdomskänsla, smärta, obehagskänsla i bröstet, onormal känsla, känna sig kall, känna sig varm, influensaliknande sjukdom, rodnad vid infusionsstället, läckage av infusionsvätska vid infusionsstället, smärta vid infusionsstället, förhöjt blodtryck.
- Har rapporterats (förekommer hos okänt antal användare):
Hjärnhinneinflammation, nedbrytning av röda blodkroppar, blodbrist, minskat antal blodplättar, svullna lymfkörtlar, allvarliga allergiska reaktioner (anafylaktiska eller anafylaktoida reaktioner), anafylaktisk chock (allergisk chock), överkänslighet, rastlöshet, stroke, övergående slaganfall, krampanfall, migrän, yrsel, onormal känsla i huden t ex stickningar och brännande känsla, svimning, ofrivilliga skakningar, blödningar i hjärnan, blodpropp i ett blodkärl i ögat, synstörningar, ögonsmärta, ljuskänslighet, hjärtattack, blåaktigfärg i huden pga nedsatt syresättning av blodet, ökad puls, långsam puls, blodpropp i blodkärlen, inflammation i venerna, lågt blodtryck, högt blodtryck, blekhet, blodpropp i blodkärl i lungan, vätska i lungorna, minskad mängd syre i blodet, svårighet att andas pga kramp i luftvägarna, väsande andning, kraftfull och snabb andning, sammandragen strupe, hosta, magsmärta, matsmältningsbesvär, inflammation i levern (icke-infektiös hepatit), svullnad i huden, inflammation i huden, rodnad i huden, utslag, led- och muskelvärk, njursvikt, reaktioner vid injektions- och infusionsstället, kraftlöshet, svullnad i kroppsvävnader, positivt test för påvisan av antikroppar.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till (se
detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea,
Biverkningsregistret,
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatumet som anges på etiketten och kartongen efter Utg. dat.. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 25 ºC.
Får ej frysas.
Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är humant normalt immunglobulin (IVIg). Humant proteininnehåll är 50 mg/ml varav minst 90 % är immunoglobulin G (IgG).
- Övriga innehållsämnen är Pulver: Humant albumin (0,06 g/g IgG), glycin, natriumklorid, glukosmonohydrat, saltsyra, natriumhydroxid. Spädningsvätska: Vatten för injektionsvätskor
Läkemedlets utseende och förpackningsstorlekar
Frystorkat vitt eller mycket blekt gult pulver (kaka).
Gammagard S/D finns tillgängligt i 5 g och 10 g förpackningar.
Varje förpackning på 5 g och 10 g innehåller spädningsvätskan (96 ml respektive 192 ml), ett sterilt transferset samt ett sterilt administreringsset med filter.
Innehavare av godkännande för försäljning och tillverkare
Baxalta Innovations GmbH
Industriestrasse 67
1221 Wien,
Österrike
Tillverkare:
Baxalta Belgium Manufacturing S.A.
Boulevard René Branquart 80
7860 Lessines
Belgien
Ombud i Finland
Takeda Oy, PL 1406, 00101 Helsingfors, tel. 0800 774 051
Denna bipacksedel ändrades senast i Finland: 1.11.2025
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal
- Gammagard S/D bör värmas till rums- eller kroppstemperatur innan användning.
- Fullständig upplösning sker vanligtvis inom 30 minuter.
- Eventuell oanvänd lösning eller avfall hanteras enligt gällande riktlinjer.
Hållbarhet i bruten förpackning
Kemiska och fysikaliska data visar att Gammagard S/D är stabilt i 24 timmar vid 2ºC-8ºC.
Ur mikrobiologisk synpunkt bör produkten användas omedelbart. Om den inte används omedelbart är förvaringstid och förvaringsvillkor före administrering användarens ansvar och ska normalt inte vara mer än 24 timmar vid 2ºC-8ºC, om inte spädning har ägt rum under kontrollerade och validerade aseptiska förhållanden.
Beredning
Aseptisk teknik skall användas.
Förpackningarna 5 g och 10 g
Se till att Gammagard S/D och sterilt vatten för injektionsvätskor (spädningsvätska) håller rumstemperatur. Denna temperatur behöver hållas tills pulvret är fullständigt löst.
A. Lösning 50 mg/ml (5 %)
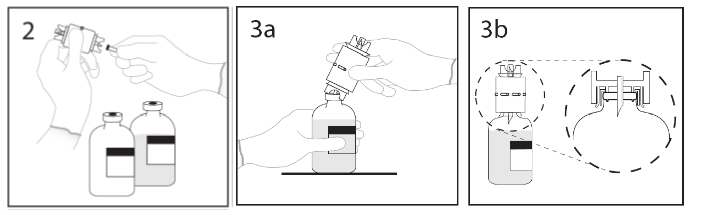
1. Ta bort skyddshättorna från flaskorna och rengör gummipropparna med antibakteriell lösning.
2. Ta bort skyddet från ena änden av överföringsenheten. Rör inte vid spetsen.
3 a. Placera vattenflaskan på en plan yta. Stick spetsen på överföringsenheten genom centrum av vattenflaskans propp. OBS: Om nålen inte hamnar mitt på gummiproppen kan det leda till att proppen rubbas.
b. Säkerställ att kragen trycks in helt i överföringsenheten genom att trycka hårt nedåt. Håll i överföringsenheten, och ta bort skyddet från andra änden. Rör inte vid spetsen.
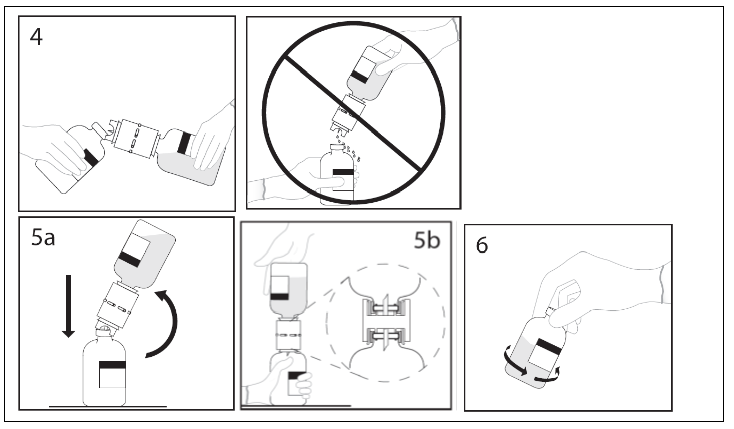
4. Håll vattenflaskan med överföringsenheten fastsatt i vinkel mot pulverflaskan för att förhindra att vattnet spills ut. OBS: Håll inte vattenflaskan upp och ner, då detta kan leda till spill.
5 a. Stick andra spetsen på överföringsenheten genom centrum av pulverflaskans propp och vänd snabbt vattenflaskan över pulverflaskan för att förhindra att vattnet spills ut. OBS: Om nålen inte hamnar mitt på gummiproppen kan det leda till att proppen rubbas och vacuumet förloras.
b. Säkerställ att kragen trycks in helt i överföringsenheten genom att trycka vattenflaskan hårt nedåt.
6. När vattnet runnit ned i flaskan med pulver, avlägsna den tomma vattenflaskan och överföringsenheten. Vänd och rotera försiktigt flaskan för att blanda innehållet
OBS: Skaka inte flaskan. Undvik skumbildning.
Kassera överföringsenheten efter användning.
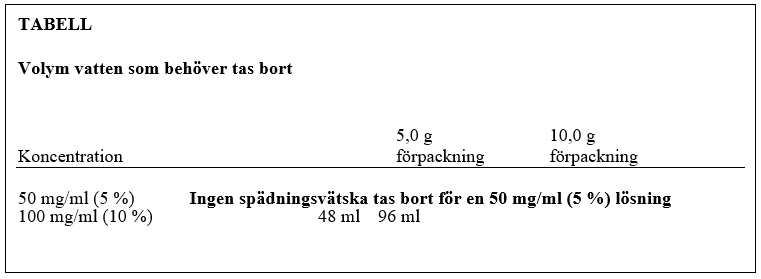
B. Lösning 100 mg/ml (10 %)
- Ta bort skyddshättorna från flaskorna och rengör gummipropparna med antibakteriell lösning.
- För att bereda en 100 mg/ml (10 %) lösning måste halva volymen spädningsvätska tas bort. Tabellen nedan visar den volym spädningsvätska som ska tas bort från flaskan innan överföringsenheten sätts fast för att ge en koncentration på 100 mg/ml (10 %). Aseptisk teknik ska användas. Aspirera den överflödiga volymen vatten med en steril injektionsnål och spruta. Kassera den fyllda sprutan och nålen.
- Följ steg 3-6 som beskrivits ovan under A med det vatten som finns kvar i flaskan.
ADMINISTRERING
Aseptisk teknik skall användas.
Färdigställd produkt bör inspekteras visuellt avseende partiklar och missfärgning innan administrering. Lösningen ska vara klar till lätt opalescent och färglös eller svagt gulaktig lösning. Använd inte lösning som är grumlig eller har fällning.
Förpackningarna 5 g och 10 g
Följ anvisningarna på administreringssetet, som finns i förpackningen. Om ett annat set används, se till att filtret är likvärdigt.
Administreringssätt
Intravenös användning.
Om möjligt bör antekubitala vener bör användas för Gammagard 100 mg/ml. Det minskar risken för att patienten upplever obehag vid infusionsstället.
Gammagard S/D 50 mg/ml (5 %) ska ges som intravenös infusion med en initial infusionshastighet på 0,5 ml/kg/h. Om detta tolereras väl kan infusionshastigheten gradvis ökas till maximalt 4,0 ml/kg/h. Patienter som tolererar 50 mg/ml (5 %) lösningar vid 4 ml/kg/h kan infunderas med Gammagard S/D 100 mg/ml (10 %) lösning med en initial infusionshastighet på 0,5 ml/kg/h. Om inga biverkningar inträffar kan infusionshastigheten gradvis ökas till maximalt 8,0 ml/kg/h.
Särskilda försiktighetsåtgärder
Vid eventuella infusionrelaterade biverkningar ska administeringshastigheten minskas eller infusionen avbrytas.
Det rekommenderas bestämt att varje gång Gammagard S/D administreras till en patient ska produktens namn och satsnummer noteras i patientjournalen.
Inkompatibiliteter
Denna produkt får ej blandas med andra läkemedel eller ges samtidigt som andra intravenösa lösningar.