Pakkausseloste
GAMMAGARD S/D infuusiokuiva-aine ja liuotin, liuosta varten
Gammagard S/D infuusiokuiva-aine ja liuotin, liuosta varten
ihmisen normaali immunoglobuliini
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Gammagard S/D on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät Gammagard S/D -valmistetta
3. Miten Gammagard S/D -valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. Gammagard S/D -valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Gammagard S/D -valmiste kuuluu immunoglobuliinilääkkeisiin. Näissä lääkkeissä on ihmisen verestä peräisin olevia vasta-aineita. Vasta-aineet auttavat taistelemaan elimistöön tunkeutuvia taudinaiheuttajia vastaan. Gammagard S/D -valmisteen kaltaisia lääkkeitä käytetään täydentämään riittämätöntä vasta-ainemäärää potilaan veressä. Näillä potilailla on taipumus saada toistuvia infektioita. Gammagard S/D -valmistetta voidaan myös käyttää tiettyjen tulehdussairauksien (autoimmuunisairaudet) hoidossa, kun potilas tarvitsee lisää vasta-aineita.
Gammagard S/D -valmistetta käytetään
Niiden potilaiden hoidossa, joilla ei ole riittävästi vasta-aineita (korvaushoito). Näitä potilaita on viisi ryhmää:
- Potilaat, joiden vasta-ainetuotanto on synnynnäisesti puutteellinen (primaari immuunivajavuustila PID)
- Potilaat, joilla on verisyöpä (krooninen lymfaattinen leukemia), jonka seurauksena vasta-ainetuotanto on puutteellinen ja joilla on toistuvia infektioita joihin estohoito antibiooteilla ei tehoa.
- Potilaat, joilla on luuydinsyöpä (multippeli myelooma) ja puutteellinen vasta-ainetuotanto ja toistuvia infektioita, ja joilla ei ole saatu vastetta pneumokokkirokotukseen
- Lapset ja nuoret (0-18-vuotiaat), joilla on synnynnäinen AIDS ja toistuvia infektioita.
- Potilaat, joilla on matala vasta-ainetuotanto toiselta henkilöltä saadun luuytimensiirron jälkeen.
Niiden potilaiden hoidossa, joilla on tiettyjä tulehdussairauksia (immunomodulaatio). Näitä potilaita on kolme ryhmää:
- Potilaat, joilla ei ole riittävästi verihiutaleita (idiopaattinen trombosytopeeninen purppura), ja on suuri vaara vuotoihin tai ovat menossa leikkaukseen lähiaikoina
- Potilaat, joiden sairauteen liittyy koko kehon äkillinen hermojuuritulehdus (Guillain-Barrén oireyhtymä)
- Potilaat, joilla on useissa elimissä tulehduksia (Kawasakin tauti).
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Gammagard S/D -valmistetta
- jos olet allerginen ihmisen normaalille immunoglobuliinille, etenkin, jos sinulla on immunoglobuliini A:n vasta-aineita veressäsi, tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät Gammagard S/D -valmistetta.
Kuinka kauan infuusion aikana pitää tarkkailla potilasta
Haittavaikutusten vaara on suurempi:
- jos Gammagard S/D -valmiste annetaan nopeasti
- jos sinulla on pieni vasta-ainemäärä veressä (hypo- tai agammablobulinemia)
- jos et ole aiemmin saanut tätä lääkettä tai olet saanut edellisen kerran tätä lääkettä kauan (useita viikkoja) sitten.
Näissä tapauksissa sinua tarkkaillaan huolellisesti infuusion ajan ja tunti sen jälkeen, jotta voidaan varmistua että et saa haittavaikutuksia.
Jos olet saanut Gammagard S/D -valmistetta äskettäin, sinua tarkkaillaan infuusion ajan ja vähintään 20 minuuttia sen jälkeen. Lääkäri varmistaa, että Gammagard S/D –infuusion nopeus sopii sinulle.
Milloin infuusionopeutta pitää hidastaa tai infuusio keskeyttää tai lopettaa
Harvinaisissa tapauksissa elimistösi on voinut aiemmin reagoida tietyille vasta-aineille ja voi siksi olla herkkä vasta-aineita sisältäville lääkkeille. Tämä voi varsinkin olla mahdollista silloin kun sinulla on immunoglobuliini A:n puutos. Näissä harvinaisissa tapauksissa voit saada allergisen reaktion, kuten verenpaineen äkillinen lasku tai sokki, vaikka olisit saanut aiemminkin lääkevalmistetta kuten Gammagard S/D.
Jos saat jonkun seuraavista haittavaikutuksista Gammagard S/D –hoidon aikana, kerro niistä heti lääkärille tai hoitajalle:
- Äkillinen hengityksen vinkuna, hengitysvaikeudet tai painon tunne rinnassa
- Päänsärky
- Kuume
- Silmäluomien, kasvojen, huulien tai verisuonien turpoaminen
- Kyhmyt tai kutiavat punaiset läiskät iholla
- Koko kehon kutina
Lääkäri päättää tuleeko infuusiota hidastaa vai pitääkö se lopettaa.
Erityiset potilasryhmät
Lääkäri seuraa sinua erityisen tarkasti, jos olet ylipainoinen, iäkäs tai jos olet liikuntakyvytön. Kerro lääkärille tai sairaanhoitajalle ennen Gammagard S/D –hoitoa, jos sinulla on:
- diabetes
- korkea verenpaine
- pieni verivolyymi (hypovolemia)
- suurentunut veren viskositeetti tai verisuoniongelmia (verenkiertosairauksia). Lääkäri seuraa sinua tarkasti. Näissä tiloissa immunoglobuliinit voivat lisätä sydänkohtauksen, aivohalvauksen, aivoverenkiertohäiriön, keuhkotulpan tai syvien laskimotukosten vaaraa. Nämä ovat kuitenkin harvinaisia.
Kerro lääkärille tai sairaanhoitajalle:
- jos sinulla on/on ollut aiemmin munuaisongelmia
- jos saat munuaisia mahdollisesti vahingoittavia lääkkeitä (nefrotoksiset lääkkeet), silloin on hyvin pieni mahdollisuus akuuttiin munuaisen toiminnan vajaukseen.
- jos sinulla on munuaissairaus. Proteiinipitoisuus voi suurentaa veren viskositeettia. Lääkäri noudattaa erityistä varovaisuutta.
Vaikutus verikokeisiin
Gammagard S/D -valmisteessa on paljon erilaisia vasta-aineita, joista jotkut voivat vaikuttaa verikokeiden tuloksiin. Jos sinusta otetaan verikoe, kerro verikokeen ottajalle, että olet saanut Gammagard S/D -valmistetta.
Gammagard S/D -valmisteen aineista
Kun lääkkeitä valmistetaan ihmisen verestä tai plasmasta, käytetään toimenpiteitä, joilla estetään infektioiden siirtyminen potilaisiin. Näitä toimenpiteitä ovat veren ja plasman luovuttajien huolellinen valinta, jotta voidaan sulkea pois luovutuksista sellaiset henkilöt, jotka saattavat olla infektioiden kantajia, sekä jokaisen luovutuksen ja plasmapoolin tutkiminen virusten/infektioiden ilmenemisen suhteen. Lisäksi veri- ja plasmaperäisten lääkkeiden valmistuksessa on vaiheita, jotka tekevät viruksia tehottomaksi tai poistavat niitä. Näistä toimenpiteistä huolimatta infektion siirtymisen mahdollisuutta ei voida täysin sulkea pois, kun annetaan ihmisen verestä tai plasmasta valmistettuja lääkkeitä. Tämä koskee myös tuntemattomia tai odottamattomia viruksia tai muun tyyppisiä taudinaiheuttajia.
Tehtyjen toimenpiteiden voidaan katsoa olevan tehokkaita vaipallisiin viruksiin, kuten ihmisen immuunikatovirus (HIV), hepatiitti B -virus ja hepatiitti C -virus sekä vaipattomiin viruksiin kuten hepatiitti A -virus ja parvovirus B19.
Suositellaan, että valmisteen nimi ja eränumero merkitään ylös, kun sinulle annetaan Gammagard S/D –valmistetta.
Muut lääkevalmisteet ja Gammagard S/D
Kerro lääkärille jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä .
- Jos sinut on rokotettu viimeisen 6 viikon – 3 kuukauden aikana, immunoglobuliinit, kuten Gammagard S/D, voivat heikentää joidenkin elävistä viruksista valmistettujen rokotteiden, kuten tuhkarokko-, vihurirokko-, vesirokko- ja sikotautirokotteiden tehoa. Sen vuoksi valmisteen annon jälkeen voi joutua odottamaan jopa 3 kuukautta, ennen kuin voi saada tiettyjä rokotteita. Tuhkarokkorokotuksessa odotusaika voi olla jopa 1 vuosi Gammagard S/D -valmisteen annon jälkeen.
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä.. Lääkäri päättää, voidaanko Gammagard S/D -valmistetta antaa raskauden tai imetyksen aikana.
Gammagard S/D -valmisteen käyttöä raskaana oleville ja imettäville naisille ei ole tutkittu kliinisissä kokeissa. Immunoglobuliinien käytöstä saatujen kliinisten kokemusten perusteella oletetaan, että immunoglobuliinien aiheuttamia haittavaikutuksia raskauden aikana tai sikiölle tai vastasyntyneelle ei ole odotettavissa.
Jos imetät Gammagard S/D -hoidon aikana, voi vasta-aineita erittyä äidinmaitoon. Siten lapsesi voi saada suojan tiettyjä infektioita vastaan.
Haitallisia vaikutuksia hedelmällisyyteen ei ole odotettavissa.
Ajaminen ja koneiden käyttö
Potilaat voivat tuntea haittavaikutuksia (esimerkiksi pyörrytystä tai pahoinvointia) Gammagard S/D ‑hoidon aikana, mikä voi vaikuttaa ajokykyyn tai kykyyn käyttää koneita. Jos näin käy, odota haittavaikutusten loppumista.
Olet itse vastuussa päätöksestä kykenetkö ajamaan ajoneuvoa tai tekemään tarkkuutta vaativaa työtä. Lääkkeiden käytöstä aiheutuvat vaikutukset ja/tai haittavaikutukset voivat vaikuttaa ajokykyyn tai kykyyn käyttää koneita. Nämä vaikutukset ja haittavaikutukset ovat kuvattuna toisessa kappaleessa.
Tämän takia on hyvä lukea koko pakkausseloste huolellisesti. Jos olet epävarma keskustele lääkärin tai apteekkihenkilökunnan kanssa.
Gammagard S/D sisältää glukoosia ja natriumia
Gammagard S/D sisältää glukoosia 20 mg/ml. Tämä on otettava huomioon potilailla, joilla on diabetes.
Tämä lääkevalmiste sisältää 668 mg natriumia (ruokasuolan toinen ainesosa) per injektiopullo (10 g). Tämä vastaa 34 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
Miten valmistetta käytetään
Gammagard S/D -valmiste on tarkoitettu annettavaksi laskimoon. Lääkäri tai hoitaja antaa sen. Annos ja annostiheys vaihtelee ja riippuu sairauden tilastasi ja painostasi.
Gammagard S/D annetaan infuusion alussa sinulle hitaasti. Riippuen voinnistasi lääkäri voi lisätä infuusionopeutta.
Käyttö lapsille
Lapsilla (0-18-vuotiaat) on samat käyttöaiheet, annokset ja infuusiotiheys.
Jos käytät enemmän Gammagard S/D -valmistetta kuin sinun pitäisi
Koska tämä lääkevalmiste annetaan sinulle sairaalassa, on epätodennäköistä, että saisit sitä liian vähän tai liikaa. Jos sinulla on kysymyksiä, keskustele lääkärin tai sairaanhoitohenkilökunnan kanssa.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Seuraavia haittavaikutuksia voi toisinaan esiintyä immunoglobuliinihoidon aikana (lääkevalmisteet kuten Gammagard S/D): vilunväreet, päänsärky, kuume, oksentelu, allergiset reaktiot, pahoinvointi, nivelsärky, matala verenpaine ja kohtalainen alaselän särky.
Harvinaisissa tapauksissa voi esiintyä äkkinäistä verenpaineen laskua, ihottuman kaltaisia oireita (ohimenevät ihoreaktiot) sekä yksittäisiä allergisia reaktioita (anafylaktinen sokki), myös potilailla, joilla ei aiemmissa infuusioissa ole tullut mitään reaktioita
Lyhytaikaista aivokuumetta (ohimenevä septinen meningiitti), yksittäisiä tapauksia ohimenevää punasolujen määrän laskua (palautuva hemolyyttinen anemia/hemolyysi), munuaistoiminnan heikkenemistä (kreatiniinin lisääntyminen veressä) ja munuaisten vajaatoimintaa on myös havaittu.
Hyvin harvinaisia haittavaikutuksia: verihyytymät suonissa (syvä laskimotukos), joista voi aiheutua sydänkohtaus, aivoverenkiertohäiriö, aivohalvaus, keuhkovaurioita (keuhkoveritulppa) ja syvä laskimotukos.
Alla on lueteltu haittavaikutukset, joita potilaat ovat raportoineet Gammagard S/D -valmisteelle:
Yleinen haittavaikutus (esiintyy harvemmalla kuin 1 potilaalla kymmenestä):
päänsärky, punastelu, oksentelu, pahoinvointi, väsymys, vilunväreet, kuume.
Melko harvinainen haittavaikutus (esiintyy harvemmalla kuin 1 potilaalla sadasta):
Influenssa, ruokahaluttomuus, ahdistus, kiihtymys, epätavallinen uneliaisuus, sumentunut näkö, sydämentykytys, verenpaineen muutokset, hengästyminen, nenäverenvuoto, ripuli, suutulehdus, ylävatsakipu, epämukava olo vatsassa, nokkosihottuma, kutina, kylmä hiki, voimakas hikoilu, selkäkipu, lihaskouristukset, raajojen kipu, rintakipu, sairauden tunne, kipu, epämukava tunne rinnassa, epätavallinen olo, kylmän tunne, kuuman tunne, influenssan kaltaiset oireet, pistoskohdan punoitus, infuusionesteen valuminen pistoskohdan suonen ulkopuolelle, pistoskohdan kipu, verenpaineen nouseminen.
Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin):
Aivokalvontulehdus, punasolujen hajoaminen, punasolujen lukumäärän väheneminen, verihiutaleiden lukumäärän väheneminen, turvonneet imusolmukkeet, anafylaktiset tai anafylaktoidiset reaktiot, anafylaktinen sokki, yliherkkyys, levottomuus, ohimenevä aivohalvaus, aivoverenkiertohäiriö, kohtaukset, migreeni, pyörrytys, epänormaali ihotunto, tajuttomuus, tahaton vapina, aivojen verenpurkaumat, silmän verisuonen tukkeuma, näköhäiriöt, silmäkipu, valoarkuus, sydänkohtaus, ihon sinerrys, sydämen tiheälyöntisyys tai harvalyöntisyys, verisuonen tukkeuma, suonen tulehdus, matala verenpaine, korkea verenpaine, kalpeus, keuhkoverisuonten tukkeuma, nestettä keuhkossa, alentunut hapen määrä veressä, kouristukset hengitysteissä, jonka seurauksena hengitysvaikeuksia, hengityksen vinkuminen, liikahengitys, karhea kurkku, yskä, vatsakipu, ruoansulatusvaivat, maksatulehdus (ei tarttuva), ihonalaiskerrosten allerginen turpoaminen, ihotulehdus, ihon punoitus, ihottuma, nivel- ja lihaskipu, munuaisten vajaatoiminta, pistoskohdan reaktiot, yleinen heikkous, kudosten turpoaminen, Coombsin kokeen positiivinen tulos.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä
pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla).
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen
turvallisuudesta.
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea,
Lääkkeiden haittavaikutusrekisteri,
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän (Käyt. viim.) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä alle 25 °C.
Ei saa jäätyä.
Säilytä lääkevalmiste pahvipakkauksessaan. Herkkä valolle.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Gammagard S/D sisältää
- Gammagard S/D -valmisteen vaikuttava aine on ihmisen normaali immunoglobuliini. Ihmisen plasmaproteiinipitoisuus on 50 mg/ml, josta Immunoglobuliini G:n (IgG) osuus on vähintään 90 %.
- Muut aineet ovat Kuiva-aine: Ihmisen albumiini (0,06 g/g IgG), glysiini, natriumkloridi, glukoosimonohydraatti, suolahappo, natriumhydroksidi Liuotin: Injektionesteisiin käytettävä vesi
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Kylmäkuivattu, valkea tai hieman kellertävä jauhe (jauhekakku).
Gammagard S/D on saatavilla 5 g ja 10 g pakkauksissa.
5 g ja 10 g pakkauksessa on liuotinpullo (96 ml, 192 ml), steriili siirtolaite ja steriili infuusioletkusto, jossa suodatin
Myyntiluvan haltija ja valmistaja
Baxalta Innovations GmbH
Industriestrasse 67
1221 Wien
Itävalta
Valmistaja
Baxalta Belgium Manufacturing S.A.
Boulevard René Branquart 80
7860 Lessines,
Belgia
Edustaja Suomessa
Takeda Oy, PL 1406, 00101 Helsinki, puh. 0800 774 051
Tämä pakkausseloste on tarkistettu viimeksi 1.11.2025
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille:
- Gammagard S/D tulee lämmittää huoneen- tai ruumiinlämpöiseksi ennen käyttöä.
- Liuos on täysin liuennut tavallisesti noin 30 minuutissa.
- Käyttämätön liuos tai jäte käsitellään paikallisten ohjeiden mukaisesti.
Avatun pakkauksen säilyvyys
Liuotetun Gammagard S/D:n kemiallinen ja fysikaalinen säilyvyys on osoitettu 24 tunniksi 2–8 ºC:ssa.
Mikrobiologiselta kannalta valmiste olisi käytettävä heti, muuten säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla, eivätkä normaalisti saa ylittää 24 tuntia 2–8 ºC:ssa, ellei valmiste on liuotettu aseptisissa valvotuissa ja validoiduissa oloissa.
Liuottamisohjeet
Käytä aseptista tekniikkaa.
5 g ja 10 g pakkaukset
Varmistu, että sekä Gammagard S/D-infuusiokuiva-aine ja injektionesteisiin käytettävä vesi (liuotin) ovat huoneenlämpöisiä. Tämä lämpötila on tarpeen kunnes infuusiokuiva-aine on täysin liuennut.
A. 50 mg/ml (5 %) liuos:
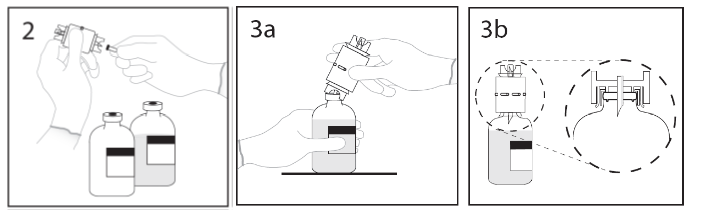
1. Poista molempien injektiopullojen suojakorkit ja desinfioi tulpat.
2. Poista suojus siirtolaitteen toisesta päästä. Älä koske kärkeen.
3a. Aseta liuotinpullo tasaiselle alustalle. Työnnä siirtolaitteen kärki liuotinpulloon tulpan keskiosan läpi.
Huom. Jos kärki ei mene tulpan läpi keskeltä tulppaa, tulppa voi siirtyä paikaltaan.
3b. Varmistu, että pullon suuosa on kunnollisesti siirtolaitteen sisällä painamalla siirtolaitetta lujasti alaspäin. Samalla kun pidät siirtolaitteesta kiinni, poista suojus toisesta päästä. Älä koske kärkeen.
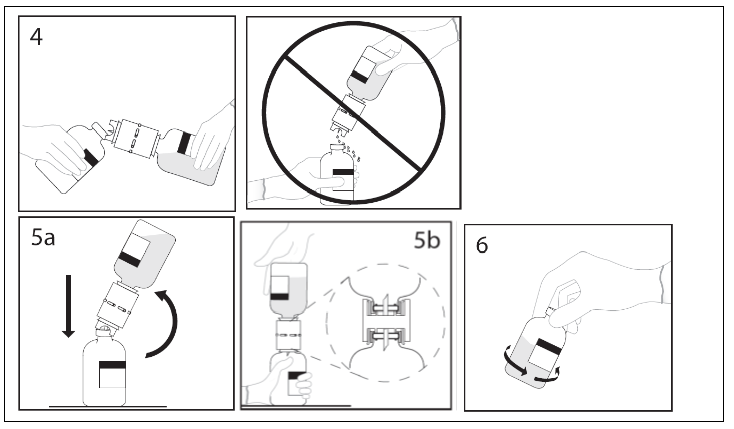
4. Pidä liuotinpulloa ja siinä kiinni olevaa siirtolaitetta kulma-asennossa infuusiokuiva-ainepulloon nähden, jotta liuotinta ei valu hukkaan.
Huom. Älä pidä liuotinpulloa ylösalaisin, koska tällöin liuotinta voi valua hukkaan.
5a. Työnnä siirtolaitteen vapaa kärki infuusiokuiva-ainepullon tulpan läpi kohtisuoraan keskeltä tulppaa ja käännä vesipullo nopeasti ylösalaisin infuusiokuiva-ainepullon yläpuolelle jotta liuotinta ei valu hukkaan.
HUOM. Jos kärki ei mene infuusiokuiva-ainepullon tulpan läpi keskeltä tulppaa, tulppa voi siirtyä paikaltaan ja pullon alipaine hävitä.
5b. Varmistu, että infuusiokuiva-ainepullon suuosa on täysin siirtolaitteen sisällä painamalla lujasti liuotinpulloa, jossa on siirtolaite, alaspäin.
6. Kun kaikki liuotin on infuusiokuiva-ainepullossa, irrota siirtolaite ja tyhjä liuotinpullo. Pyörittele heti pulloa varovasti, jotta sisältö sekoittuu kunnolla.
HUOM. Älä ravista pulloa. Vältä vaahtoamista.
Hävitä kertakäyttöinen siirtolaite käytön jälkeen.
B. 100 mg/ml (10 %) liuos
1. Poista molempien injektiopullojen suojakorkit ja desinfioi tulpat.
2. Kun valmistetaan 100 mg/ml (10 %) liuos pitää puolet liuottimen määrästä poistaa. Taulukossa on liuotinmäärät, jotka poistetaan liuotinpullosta ennen siirtolaitteen liittämistä liuotinpulloon 100 mg/ml (10 %) liuoksen valmistamiseksi. Käytä aseptista tekniikkaa. Vedä ylimääräinen liuotin injektioneulan avulla ruiskuun. Hävitä ruisku liuottimineen.
3. Käytä liuotinpulloon jäänyt liuotin, noudata kohtia 2-6 aiemmasta A-kohdasta.
TAULUKKO
Poistettava liuotinmäärä
|
Infuusiokuiva-aine |
5 g |
10 g |
|
|
50 mg/ml (5 %) liuos |
Älä poista |
liuotinta 50mg/ml |
liuosta varten |
|
100 mg/ml (10 %) liuos |
48 ml |
96 ml |
VALMISTEEN ANTAMINEN
Käytä aseptista tekniikkaa. Liuoksen on oltava kirkasta tai hieman opaaliin vivahtavaa ja väritöntä tai hieman kellertävää. Älä käytä liuosta, jos se on sameaa tai siinä on sakkaa.
5 g ja 10 g pakkauskoot
Noudata pakkauksessa olevan letkuston käyttöohjetta. Jos käytetään jotain muuta annostelulaitetta valmisteen antamiseen, pitää varmistua että siinä on samanlainen suodatin
Gammagard S/D-valmisteen antaminen
Jos mahdollista käytä kyynärpään etupuolisia suonia Gammagard 100 mg/ml antamiseen pienentääksesi potilaalle aiheutuvaa epämukavuutta infuusion antopaikassa.
Gammagard S/D 50 mg/ml (5 %) pitää antaa laskimoon alkunopeudella 0,5 ml/kg/tunti. Jos tämä siedetään hyvin, antonopeutta voidaan asteittain lisätä suurimpaan antonopeuteen, 4 ml/kg/tunti.
Potilaille, jotka sietävät Gammagard S/D 50 mg/ml annon infuusionopeudella 4 ml/kg/tunti, voidaan 100 mg/ml (10 %) infuusio antaa laskimoon alkunopeudella 0,5 ml/kg/tunti. Jos ei ilmene haittavaikutuksia, infuusionopeutta voidaan asteittain lisätä suurimpaan antonopeuteen 8 ml/kg/tunti.
Erityiset varotoimet
- Infuusion haittavaikutuksia hoidetaan hidastamalla infuusiota tai lopettamalla se.
- Kehotetaan kirjaamaan aina Gammagard S/D -valmistetta annettaessa valmisteen nimi ja erä potilasasiakirjoihin, jotta ne ovat tiedossa tarvittaessa.
Yhteensopimattomuudet
Gammagard S/D -valmistetta ei saa sekoittaa muihin lääkevalmisteisiin. Annostellaan erillään muista lääkeaineista, joita potilas mahdollisesti saa.