Pakkausseloste
NUMETA G19E infusionsvätska, emulsion
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till ditt barns läkare, apotekspersonal eller sjuksköterska.
- Om ditt barn får biverkningar, tala med ditt barns läkare eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Numeta G19E är och vad det används för
- Vad du behöver veta innan ditt barn får Numeta G19E
- Hur Numeta G19E fås
- Eventuella biverkningar
- Hur Numeta G19E ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Numeta G19E är en emulsion som innehåller näring speciellt utformad för barn äldre än 2 år och ungdomar upp till 18 år. Det ges genom en slang som placeras i ditt barns ven när ditt barn inte kan få i sig all den näring som han eller hon behöver genom att äta.
Numeta G19E tillhandahålls som en trekammarpåse där de åtskilda kamrarna innehåller:
- 50 mg/ml glukoslösning (socker)
- 5,9 mg/ml aminosyralösning och elektrolyter (protein-byggstenar och salter)
- 12,5 mg/ml lipidemulsion (fetter).
Beroende på ditt barns behov blandas två eller tre av dessa lösningar inuti infusionspåsen, innan läkemedlet ges till ditt barn.
Användande av Numeta G19E måste ske under medicinsk övervakning.
Vad du behöver veta innan produkten används
Ditt barn ska inte få Numeta G19E i följande fall:
När två lösningar blandats i påsen (“2 i 1”):
- om ditt barn är allergiskt mot äggprotein, soja, jordnötter eller mot något av innehållsämnena i glukos- eller aminosyrekammaren (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om ditt barns kropp inte kan utnyttja byggstenarna i protein.
- om ditt barn har höga koncentrationer i blodet av någon av elektrolyterna som ingår i Numeta G19E.
- om ditt barn har hyperglykemi (för höga sockernivåer i blodet).
När tre lösningar blandats i påsen (“3 i 1”):
- vid samtliga ovan situationer som nämns för “2 i 1” samt följande:
- om ditt barn har höga fettnivåer i blodet.
I samtliga fall, ska läkaren basera sitt beslut om eventuell behandling med Numeta G19E på faktorer som ålder, vikt och kliniskt tillstånd. Läkaren kommer också att ta hänsyn till resultaten av eventuella tester som utförts.
Varningar och försiktighet
Tala med ditt barns läkare eller sjuksköterska innan barnet får Numeta G19E.
Allergiska reaktioner:
Infusionen måste avbrytas omedelbart om några tecken eller symtom på allergisk reaktion (som feber, svettningar, frossa, huvudvärk, hudutslag eller andningssvårigheter) utvecklas. Detta läkemedel innehåller sojaolja, vilket i sällsynta fall kan orsaka överkänslighetsreaktioner. I mindre vanliga fall har man sett att vissa personer som är allergiska mot jordnötsprotein också är allergiska mot sojaprotein.
Numeta G19E innehåller glukos framställd av majsstärkelse. Numeta G19E ska användas med försiktighet till patienter med känd allergi mot majs eller majsprodukter.
Risk för partikelbildning med ceftriaxon (ett anitibiotika):
Ett visst antibiotika, som kallas ceftriaxon, får inte blandas eller ges samtidigt med kalciuminnehållande lösningar (inklusive Numeta G19E) då det ges till dig som dropp i en ven. Läkaren vet om detta och kommer inte att ge dem tillsammans till dig, inte ens via olika infusionsslangar eller på olika infusionsställen.
Läkaren kan dock ge kalcium och ceftriaxon efter varandra om infusionsslangar på olika infusionsställen används, eller om infusionsslangarna byts ut, eller spolas noggrant med fysiologisk koksaltslösning mellan infusionerna, för att undvika partikelbildning.
Bildande av små partiklar i lungornas blodkärl:
Andningssvårigheter kan vara ett tecken på att små partiklar har bildats som blockerar blodkärlen i lungorna (pulmonära vaskulär utfällningar). Tala med läkare eller sjuksköterska om ditt barn får svårigheter att andas. De kommer att fatta beslut om lämpliga åtgärder.
Infektioner och blodförgiftning:
Läkaren kommer noga att övervaka ditt barn med avseende på eventuella tecken på infektion. Användning av aseptisk teknik (en teknik fri från bakterier) vid placering och skötsel av katetern, samt när näringslösningen bereds, kan minska risken för infektion.
Ibland kan barn utveckla infektion och sepsis (bakterier i blodet) när de har en slang i en ven (intravenös kateter). Vissa läkemedel och sjukdomar kan öka risken för att infektion eller sepsis utvecklas. Patienter som behöver parenteral näring (näringstillförsel via en slang in i ett blodkärl) kan ha lättare att utveckla en infektion på grund av sitt medicinska tillstånd.
Fettöverbelastningssyndrom
Fettöverbelastningssyndrom har rapporterats för liknande läkemedel. Minskad eller begränsad förmåga att göra sig av med fetterna i Numeta G19E eller överdos kan leda till “fettöverbelastningssyndrom” (se avsnitt Hur produkten används och avsnitt Eventuella biverkningar).
Förändringar i blodets kemiska nivåer:
Läkaren kommer att kontrollera och övervaka ditt barns vätskenivåer, blodets kemiska balans och andra blodnivåer, eftersom näringstillförsel till någon som är kraftigt undernärd ibland kan leda till förändringar av blodets kemiska nivåer. Extra vätska i vävnaderna och svullnad kan också utvecklas. Det rekommenderas att parenteral näring påbörjas långsamt och försiktigt.
Övervakning och justering:
Läkaren kommer att noga övervaka och justera dosen av Numeta G19E så att det motsvarar ditt barns speciella behov, om barnet har följande tillstånd:
- allvarligt posttraumatiskt tillstånd
- allvarlig diabetes mellitus (sockersjuka)
- chock
- hjärtattack
- svår infektion
- vissa typer av koma.
Används med försiktighet vid:
Numeta G19E ska användas med försiktighet om barnet har:
- lungödem (vätska i lungorna) eller hjärtsvikt
- allvarliga leverproblem
- svårighet att tillgodogöra sig näringsämnen
- högt blodsocker
- njurproblem
- allvarliga ämnesomsättningsrubbningar (när olika ämnen inte bryts ned på normalt sätt i kroppen)
- koaguleringssjukdom (rubbningar i blodets förmåga att levras).
Barnets vätskestatus, levervärden och/eller blodvärden kommer att övervakas noga.
Andra läkemedel och Numeta G19E
Tala om för läkare om ditt barn använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Numeta G19E får inte ges samtidigt som:
- ceftriaxon (ett antibiotikum), även via olika infusionslinjer på grund av risken för partikelbildning.
- blod genom samma infusionsaggregat på grund av risk för pseudoagglutination (att de röda blodkropparna klumpar ihop sig).
- ampicillin, fosfenytoin eller furosemid via samma infusionslinjer på grund av risken för partikelbildning.
Kumarin och warfarin (blodförtunnande):
Läkaren kommer noga att övervaka ditt barn om barnet behandlas med kumarin och warfarin. Oliv- och sojaolja innehåller naturligt vitamin K1. Vitamin K1 kan interagera med läkemedel som exempelvis kumarin och warfarin. Det är blodförtunnande läkemedel som används för att förhindra att blodet koagulerar.
Laboratorietester:
Lipiderna i denna emulsion kan påverka resultaten av vissa laboratorieprover. Laboratorieprover kan tas efter 5 till 6 timmar om inga ytterligare lipider ges.
Interaktioner med Numeta G19E och läkemedel som kan påverka kaliumnivåerna/nedbrytningen:
Numeta G19E innehåller kalium. Höga nivåer av kalium i blodet kan orsaka onormal hjärtrytm. Särskild försiktighet måste iakttas för patienter som tar diuretika (urindrivande läkemedel) eller ACE-hämmare (läkemedel mot högt blodtryck), eller angiotensin II-receptorantagonister (läkemedel mot högt blodtryck), eller immunosuppressiva läkemedel (läkemedel som kan hämma kroppens normala immunförsvar). Dessa typer av läkemedel kan höja kaliumnivåerna.
Graviditet, amning och fertilitet
Tillräckligt med data från behandling av gravida eller ammande kvinnor med Numeta G19E saknas. Läkaren ska noggrant överväga de potentiella riskerna och fördelarna för varje patient innan Numeta G19E ordineras.
Hur produkten används
Ditt barn ska alltid få Numeta G19E enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Åldersgrupper
Numeta G19E har utvecklats för att motsvara näringsbehoven hos barn äldre än 2 år och ungdomar upp till 18 år.
Läkaren avgör om detta läkemedel är lämpligt för ditt barn.
Administrering
Detta läkemedel är en emulsion för infusion. Det ges genom en plastslang i en ven i ditt barns arm eller i en stor ven i ditt barns bröst.
Ditt barns läkare kan välja att inte ge lipider (fetter) till ditt barn. Påsen med Numeta G19E är utformad så att endast förslutningen mellan kamrarna med aminosyror/elektrolyter och glukos kan brytas om nödvändigt. Förslutningen mellan kamrarna med aminosyror och lipider förblir i så fall intakt. Innehållet i påsen kan därefter infunderas utan lipider.
Dosering och behandlingens längd
Ditt barns läkare avgör vilken dos barnet ska få och under hur lång tid läkemedlet ska ges. Dosen beror på barnets näringsbehov. Doseringen avgörs utifrån barnets vikt, medicinska tillstånd och kroppens förmåga att bryta ned och tillgodogöra sig innehållsämnena i Numeta G19E. Extra näringsämnen eller proteiner kan också ges, antingen via munnen eller som infusion till blodet.
Om ditt barn har fått för stor mängd av Numeta G19E
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112 i Sverige, 0800 147 111 i Finland) för bedömning av risken samt rådgivning.
Symtom
För mycket av detta läkemedel eller att det ges för snabbt kan leda till följande:
- illamående
- kräkningar
- frossa
- elektrolytrubbningar (olämpliga mängder elektrolyter i blodet)
- tecken på hypervolemi (ökad cirkulerande blodvolym)
- acidos (ökad surhetsgrad på blodet).
I sådana situationer måste infusionen avbrytas omedelbart. Ditt barns läkare kommer att avgöra om ytterligare åtgärder krävs.
En överdos av fetterna i Numeta G19E kan leda till “fettöverbelastningssyndrom”, som oftast är reversibelt när infusionen stoppats. Hos nyfödda och spädbarn har fettöverbelastningssyndrom associerats med andningsstörning som leder till minskad syrehalt i kroppen (andnöd) och tillstånd som leder till ökad surhetsgrad i blodet (acidos).
För att förhindra detta ska läkaren regelbundet övervaka ditt barns tillstånd och testa barnets blodvärden under behandlingen.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla barn behöver inte få dem.
Om du märker någon förändring i hur ditt barn mår under eller efter behandlingen, kontakta omedelbart läkare eller sjuksköterska.
Testerna som läkaren utför medan ditt barn får detta läkemedel ska minimera risken för biverkningar.
Om tecken på allergisk reaktion uppkommer ska infusionen omedelbart avbrytas och läkare kontaktas. Detta kan vara allvarligt och symtomen kan vara:
- svettningar
- frossa
- huvudvärk
- hudutslag
- andningssvårigheter.
Andra biverkningar som har observerats är:
Vanliga: kan förekomma hos upp till 1 av 10 användare
- Låg fosfatnivå i blodet (hypofosfatemi)
- Hög sockernivå i blodet (hyperglykemi)
- Hög kalciumnivå i blodet (hyperkalcemi)
- Hög triglyceridnivå i blodet (hypertriglyceridemi)
- Elektrolytrubbningar (hyponatremi).
Mindre vanliga: kan förekomma hos upp till 1 av 100 användare
- Höga halter av fetter i blodet (hyperlipidemi)
- Tillstånd där galla inte kan flöda från levern till tolvfingertarmen (gallstas). Tolvfingertarmen är en av tarmarna.
Har rapporterats: förekommer hos ett okänt antal användare (Dessa biverkningar har endast rapporterats för Numeta G13E och G16E som administrerats perifert och i otillräcklig spädning).
- Hudnekros
- Mjukdelsskada
- Läckage av läkemedlet utanför blodkärlet (extravasering).
Följande biverkningar har rapporterats med andra läkemedel för parenteral nutrition:
Minskad eller begränsad förmåga att göra sig av med fetterna i Numeta G19E kan leda till fettöverbelastningssyndrom. Följande tecken och symtom på detta syndrom är oftast reversibla när infusionen av lipidemulsionen stoppats:
- Plötslig och abrupt försämring av patientens medicinska tillstånd
- Höga fettnivåer i blodet (hyperlipidemi)
- Feber
- Fettinfiltration i levern (hepatomegali)
- Försämrad leverfunktion
- Minskat antal röda blodkroppar (anemi), vilket kan leda till blek hud och orsaka svaghet eller andnöd
- Lågt antal vita blodkroppar (leukopeni), vilket kan öka infektionsrisken
- Lågt antal blodplättar (trombocytopeni), vilket kan öka risken att få blåmärken och/eller blödningar
- Koaguleringssjukdomar som påverkar blodets levringsförmåga
- Andningsstörning som leder till minskad syrehalt i kroppen (andnöd)
- Tillstånd som leder till ökad surhetsgrad i blodet (acidos)
- Koma, som kräver sjukhusinläggning.
Bildning av små partiklar som kan blockera blodkärlen i lungorna (pulmonära vaskulära utfällningar) eller andningssvårigheter.
Rapportering av biverkningar
Om ditt barn får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information.
Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Webplats: www.fimea.fi
Säkerhets- och utvecklingcentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på påsen och den yttre förpackningen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Får ej frysas.
Förvaras i ytterpåsen.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Läkemedlets utseende och förpackningsstorlekar
Numeta G19E tillhandahålls i en påse med tre kamrar. Varje påse innehåller en steril kombination av en glukoslösning, en aminosyralösning för barn med elektrolyter samt en lipidemulsion enligt beskrivningen nedan.
| Förpackningens storlek | 50 g/100 ml glukoslösning | 5,9 g/100 ml aminosyralösning med elektrolyter | 12,5 g/100 ml lipidemulsion |
| 1000 ml | 383 ml | 392 ml | 225 ml |
Utseende före beredning:
- Lösningarna i aminosyra- och glukoskamrarna är klara, färglösa eller lätt gulfärgade.
- Kammaren med lipidemulsionen innehåller en homogen vätska med ett mjölkliknande utseende.
Utseende efter beredning:
- “2 i 1”-lösningen för infusion är klar, färglös eller svagt gul.
- “3 i 1”-emulsionen för infusion är homogen och mjölkliknande.
Påsen med tre kamrar är tillverkad av flerskiktad plast.
För att undvika kontakt med luften är Numeta G19E förpackad i en ytterpåse med en syrebarriär som innehåller en syreabsorberande påse och en syreindikator.
Förpackningsstorlekar
1000 ml påse: 6 st i varje kartong.
1 påse med 1000 ml.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Baxter Oy
PB 119
00181 Helsingfors
Tillverkare
Baxter S.A.
Boulevard Rene Branquart, 80
7860 Lessines
Belgien
Denna bipacksedel ändrades senast 26.06.2024 (i Finland)
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal*
* Vänligen observera att i vissa fall kan denna produkt administreras i hemmet av föräldrar eller andra vårdgivare. I sådana fall bör förälder/vårdgivare läsa följande information.
Inga tillsatser till påsen får göras utan att blandbarheten har kontrollerats. Detta kan leda till bildande av partiklar eller nedbrytning av lipiderna, som i sin tur kan resultera i att blodkärlen täpps till.
Numeta G19E ska uppnå rumstemperatur före användning.
Innan Numeta G19E ges ska påsen beredas enligt bilderna nedan.
Kontrollera att påsen inte är skadad. Använd endast påsen om den är oskadad. En oskadad påse ser ut så här:
- De icke-permanenta förslutningarna är obrutna. Detta syns genom att det inte har skett någon blandning av de tre kamrarna.
- Aminosyralösningen och glukoslösningen är klara, färglösa eller lätt gulfärgade och utan synliga partiklar.
- Lipidemulsionen är en homogen vätska med ett mjölkliknande utseende.
Innan du öppnar ytterpåsen, kontrollera färgen på syreindikatorn.
- Jämför den med referensfärgen som finns tryckt bredvid OK-symbolen på indikatorns etikett.
- Använd inte produkten om syreindikatorns färg inte överensstämmer med referensfärgen som finns tryckt bredvid OK-symbolen.
I figur 1 och 2 illustreras hur den skyddande ytterpåsen avlägsnas. Kasta ytterpåsen, syreindikatorn och syreabsorberaren.
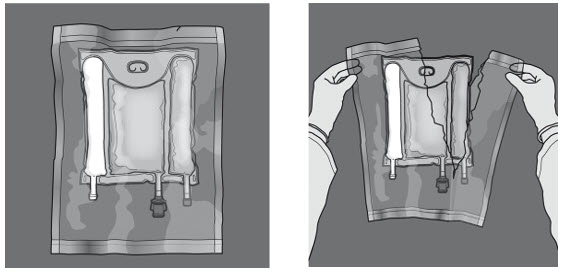
Figur 1 Figur 2
Beredning av den blandade emulsionen:
- Produkten ska vara rumstempererad när de icke-permanenta förslutningarna bryts.
- Placera påsen på en plan ren yta.
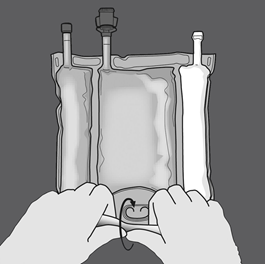
Aktivering av trekammarpåsen (blandning av tre lösningar genom att bryta de icke-permanenta förslutningarna)
Steg 1: Börja rulla påsen från D-hängarsidan.
Steg 2: Tryck tills förslutningen öppnats
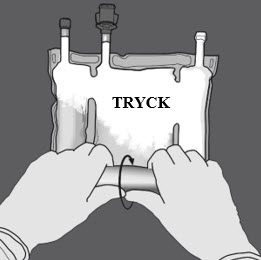
Steg 3: Byt sedan riktning genom att rulla påsen mot D-hängaren.
Fortsätt tills förslutningen är helt öppen.
Fortsätt på samma sätt för att öppna den andra förslutningen.
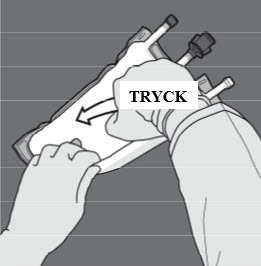
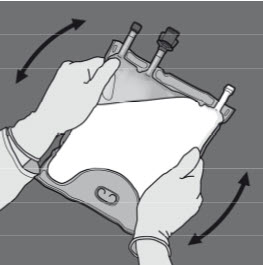
Steg 4: Vänd på påsen minst tre gånger för att blanda innehållet ordentligt.
Blandningens utseende efter beredning är en mjölkliknande emulsion.
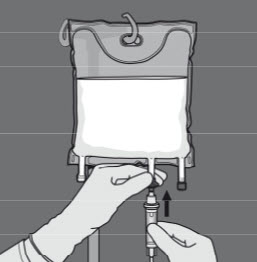
Steg 5: Avlägsna skyddslocket från administreringsporten och för in infusionsaggregatet.
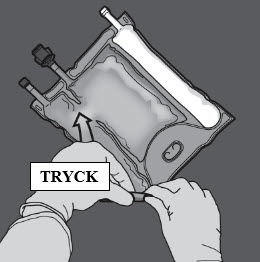
Aktivering av tvåkammarpåsen (blandning av två lösningar genom att bryta den icke-permanenta förslutningen mellan aminosyra- och glukoskamrarna)
Steg 1: För att blanda endast två lösningar rullar du påsen från det övre (änden med hängaren) hörnet på förslutningen som separerar lösningarna.
Tryck för att öppna förslutningen mellan kamrarna med glukos och aminosyror.
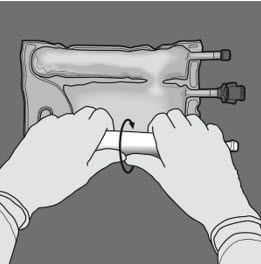
Steg 2: Vänd påsen så att kammaren med lipidemulsion befinner sig närmast den som bereder lösningen.
Rulla påsen samtidigt som du skyddar kammaren med lipidemulsion med händerna.
Steg 3: Tryck med den ena handen och rulla påsen mot portarna.
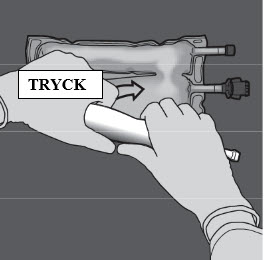
Steg 4: Ändra riktning genom att rulla påsen mot överdelen (änden med hängaren).
Tryck med den andra handen och fortsätt tills förslutningen mellan aminosyra- och glukoskamrarna har öppnats helt.
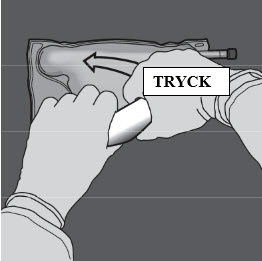
Steg 5: Vänd på påsen minst tre gånger för att blanda innehållet ordentligt.
Blandningens utseende efter beredning ska vara klar, färglös eller svagt gul.
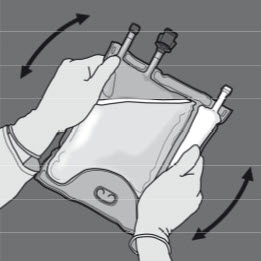
Steg 6: Avlägsna skyddslocket från administreringsporten och för in infusionsaggregatet.
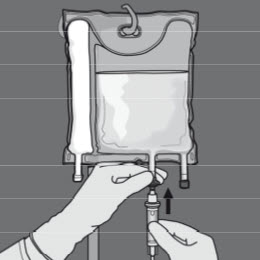
Flödeshastigheten ska ökas gradvis under den första timmen. Administreringshastigheten måste justeras utifrån följande faktorer:
- vilken dos som administreras
- det dagliga volymintaget
- infusionens varaktighet.
Administreringssätt:
Emulsion (i påser och infusionsaggregatet) ska skyddas mot ljus ända från blandning t.o.m. administrering av infusionen.
Användning av ett filter med storleken 1,2 mikrometer rekommenderas vid administrering av Numeta G19E.
På grund av dess höga osmolaritet kan ospädd Numeta G19E endast administreras via en central ven. Dock kan tillräcklig spädning av Numeta G19E med vatten för injektionsvätskor minska osmolariteten och möjliggöra perifer infusion. Formeln nedan anger hur spädning påverkar osmolariteten i påsarna.
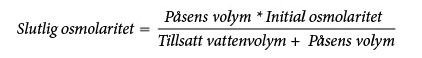
Tabellen nedan visar exempel på osmolaritet för aktiverade 2SP- och aktiverade 3SP-blandningar efter tillsats av vatten för injektion:
| Aminosyror, glukos och lipider (aktiverad trekammarpåse) | |
| Initial volym i påsen (ml) | 1000 |
| Initial osmolaritet (mOsm/l, ca.) | 1400 |
| Tillsatt vattenmängd (ml) | 1000 |
| Slutlig volym efter tillsatser (ml) | 2000 |
| Osmolaritet efter tillsatser (mOsm/l, ca.) | 730 |
Tillsatser
Skydda mot ljus ända från tillsättningen i påsen av tillsatserna t.o.m. administrering av infusionen, då tillsatserna utgörs av spårämnen och vitaminer. Exponering för omgivande ljus genererar peroxider och andra nedbrytningsprodukter vilka kan reduceras om produkten är skyddad mot ljus.
Kompatibla tillsatser kan göras via injektionsport i den färdigberedda blandningen (efter att de icke-permanenta förslutningarna har öppnats och innehållet i de två eller tre kamrarna har blandats).
Vitaminer kan också tillsättas i glukoskammaren innan blandningen har beretts (innan de icke-permanenta förslutningarna har öppnats och innan lösningarna och emulsionen har blandats).
Kompatibilitetstabellen 1–6 nedan anger hurdana kommersiellt tillgängliga spårämneslösningar (identifierade som SÄ1, SÄ2 och SÄ4), vitaminer (vitaminlyofilisat, identifierade som V1 och V2) och elektrolyter kan tilläggas i nämnda kvantiteter.
- Kompatibilitet med SÄ4, V1 och V2
Tabell 1: Kompatibilitet när tre kamrar är öppnad (“3 i 1”) med eller utan spädning med vatten
| Per 1000 ml (3 i 1 tillägg med lipider) | ||||||
| Blandning utan utspädning | Blandning med utspädning | |||||
| Tillsatser | Mängd som ingår | Maximal ytterligare tillsats | Maximal total mängd | Mängd som ingår | Maximal ytterligare tillsats | Maximal total mängd |
| Natrium (mmol) | 45,8 | 105 | 151 | 45,8 | 105 | 151 |
| Kalium (mmol) | 32,0 | 118 | 150 | 32,0 | 118 | 150 |
| Magnesium (mmol) | 2,6 | 7,8 | 10,4 | 2,6 | 7,8 | 10,4 |
| Kalcium (mmol) | 3,8 | 20,5 | 24,3 | 3,8 | 20,5 | 24,3 |
| Fosfat* (mmol) | 9,4 | 14,6 | 24,0 | 9,4 | 14,6 | 24,0 |
| Spårämnen och vitaminer | - | 34 ml SÄ4 + 3,4 injektions-flaskor V1 + 38 ml V2 | 34 ml SÄ4 + 3,4 injektions-flaskor V1 + 38 ml V2 | - | 34 ml SÄ4 + 3,4 injektions-flaskor V1 + 38 ml V2 | 34 ml SÄ4 + 3,4 injektions-flaskor V1 + 38 ml V2 |
| Vatten för injektionsvätskor | - | - | - | - | 1450 ml | 1450 ml |
* Organiskt fosfat
Tabell 2: Kompatibilitet när två kamrar är öppnad (“2 i 1”)
| Per 775 ml (2 i 1 tillägg utan lipider) | |||
| Mängd som ingår | Mängd som ingår | Maximal ytterligare tillsats | Maximal total mängd |
| Mängd som ingår | 45,1 | 32,0 | 77,1 |
| Mängd som ingår | 32,0 | 45,6 | 77,6 |
| Mängd som ingår | 2,6 | 5,2 | 7,8 |
| Mängd som ingår | 3,8 | 19,4 | 23,2 |
| Mängd som ingår | 7,2 | 16,0 | 23,2 |
| Mängd som ingår | - | 10 ml SÄ4 + 1 injektiosflaska V1 | 10 ml SÄ4 + 1 injektiosflaska V1 |
* Organiskt fosfat
- Kompatibilitet med SÄ1-, V1- och V2
Tabell 3: Kompatibilitet när tre kamrar är öppnad (“3 i 1”)
| Per 1000 ml (3 i 1 tillägg med lipider) | |||
| Tillsatser | Mängd som ingår | Maximal ytterligare tillsats | Maximal total mängd |
| Natrium (mmol) | 45,8 | 0 | 45,8 |
| Kalium (mmol) | 32,0 | 0 | 32,0 |
| Magnesium (mmol) | 2,6 | 0 | 2,6 |
| Kalcium (mmol) | 3,8 | 6,4 | 10,2 |
| Fosfat* (mmol) | 9,4 | 0 | 9,4 |
| Spårämnen och vitaminer | - | 15 ml SÄ1 + 1 injektionsflaska V1 + 10 ml V2 | 15 ml SÄ1 + 1 injektionsflaska V1 + 10 ml V2 |
* Organiskt fosfat
Tabell 4: Kompatibilitet när två kamrar är öppnad (“2 i 1”)
| Per 775 ml (2 i 1 tillägg utan lipider) | |||
| Tillsatser | Mängd som ingår | Maximal ytterligare tillsats | Maximal total mängd |
| Natrium (mmol) | 45,1 | 32,0 | 77,1 |
| Kalium (mmol) | 32,0 | 45,6 | 77,6 |
| Magnesium (mmol) | 2,6 | 5,2 | 7,8 |
| Kalcium (mmol) | 3,8 | 19,4 | 23,2 |
| Fosfat* (mmol) | 7,2 | 16,0 | 23,2 |
| Spårämnen och vitaminer | - | 10 ml SÄ1 + 1 injektionsflaska V1 | 10 ml SÄ1 + 1 injektionsflaska V1 |
* Organiskt fosfat
- Kompatibilitet med SÄ2-, V1- och V2
Tabell 5: Kompatibilitet när två kamrar är öppnad (“2 i 1”)
| Per 775 ml (2 i 1 tillägg utan lipider) | |||
| Tillsatser | Mängd som ingår | Maximal ytterligare tillsats | Maximal total mängd |
| Natrium (mmol) | 45,1 | 32,0 | 77,1 |
| Kalium (mmol) | 32,0 | 45,6 | 77,6 |
| Magnesium (mmol) | 2,6 | 5,2 | 7,8 |
| Kalcium (mmol) | 3,8 | 19,4 | 23,2 |
| Fosfat* (mmol) | 7,2 | 16,0 | 23,2 |
| Spårämnen och vitaminer | - | 15 ml SÄ2 + 1 injektionsflaska V1 | 15 ml SÄ2 + 1 injektionsflaska V1 |
* Organiskt fosfat
Tabell 6: Kompatibilitet när tre kamrar är öppnad (“3 i 1”)
| Per 1000 ml (3 i 1 tillägg med lipider) | |||
| Tillsatser | Mängd som ingår | Maximal ytterligare tillsats | Maximal total mängd |
| Natrium (mmol) | 45,8 | 0 | 45,8 |
| Kalium (mmol) | 32,0 | 0 | 32,0 |
| Magnesium (mmol) | 2,6 | 0 | 2,6 |
| Kalcium (mmol) | 3,8 | 6,4 | 10,2 |
| Fosfat* (mmol) | 9,4 | 0 | 9,4 |
| Spårämnen och vitaminer | - | 15 ml SÄ2 + 1 injektionsflaska V1 + 10 ml V2 | 15 ml SÄ2 + 1 injektionsflaska V1 + 10 ml V2 |
* Organiskt fosfat
Sammansättning av de kommersiella vitaminberedningar och spårämnesberedningar som används illustreras i tabellerna 7 och 8.
Tabell 7: Sammansättning av de kommersiella spårämnesberedningar (SÄ) som används
| Sammansättning per 10 ml | SÄ1 | SÄ2 | SÄ4 |
| Järn | - | 8,9 mikromol eller 0,5 mg | - |
| Zink | 38,2 mikromol eller 2,5 mg | 15,3 mikromol eller 1 mg | 15,3 mikromol eller 1 mg |
| Selen | 0,253 mikromol eller 0,02 mg | 0,6 mikromol eller 0,05 mg | 0,253 mikromol eller 0,02 mg |
| Koppar | 3,15 mikromol eller 0,2 mg | 4,7 mikromol eller 0,3 mg | 3,15 mikromol eller 0,2 mg |
| Jod | 0,0788 mikromol eller 0,01 mg | 0,4 mikromol eller 0,05 mg | 0,079 mikromol eller 0,01 mg |
| Fluor | 30 mikromol eller 0,57 mg | 26,3 mikromol eller 0,5 mg | - |
| Molybden | - | 0,5 mikromol eller 0,05 mg | - |
| Mangan | 0,182 mikromol eller 0,01 mg | 1,8 mikromol eller 0,1 mg | 0,091 mikromol eller 0,005 mg |
| Krom | - | 0,4 mikromol eller 0,02 mg | - |
| Kobolt | - | 2,5 mikromol eller 0,15 mg | - |
Tabell 8: Sammansättning av de kommersiella vitaminberedningar (V1 och V2) som används
| Sammansättning per flaska | V1 | V2 |
| Vitamin B1 | 2,5 mg | - |
| Vitamin B2 | 3,6 mg | - |
| Nikotinamid | 40 mg | - |
| Vitamin B6 | 4,0 mg | - |
| Pantotensyra | 15,0 mg | - |
| Biotin | 60 mikrog | - |
| Folsyra | 400 mikrog | - |
| Vitamin B12 | 5,0 mikrog | - |
| Vitamin C | 100 mg | - |
| Vitamin A | - | 2300 IE |
| Vitamin D | - | 400 IE |
| Vitamin E | - | 7 IE |
| Vitamin K | - | 200 mikrog |
Göra en tillsats:
- Aseptiska förhållanden måste iakttas.
- Förbered påsens injektionsport.
- Punktera injektionsporten och injicera tillsatserna med en kanyl eller ett hjälpmedel för beredning innehållande en kanyl.
- Blanda innehållet i påsen och tillsatserna.
Förbereda infusionen:
- Aseptiska förhållanden måste iakttas.
- Häng upp påsen.
- Avlägsna plastskyddet från administreringsporten.
- För in infusionsaggregatets spike ordentligt i administreringsporten.
Administrering av infusionen:
- Endast för engångsbruk.
- Administrera produkten först efter att de icke-permanenta förslutningarna mellan de två eller tre kamrarna har öppnats och innehållet i de två eller tre kamrarna har blandats.
- Se till att den slutliga aktiverade trekammarpåse-emulsionen för infusion inte visar några tecken på fasseparation eller att den slutliga tvåkammarpåse-lösningen för infusion inte innehåller synliga partiklar.
- Det rekommenderas att innehållet används omedelbart efter att de icke-permanenta förslutningarna mellan de tre kamrarna har öppnats. Innehållet ska inte sparas för senare infusioner. Anslut inte delvis förbrukade påsar.
- Seriekoppla inte påsarna. Risk finns att luftemboli kan uppstå på grund av kvarvarande luft i den primära påsen.
- Användning av ett filter med storleken 1,2 mikrometer rekommenderas vid administrering av Numeta G19E.
- Ej använt läkemedel, avfall och allt använt engångsmaterial ska kasseras.
Hållbarhet efter att lösningarna har blandats
Produkten ska användas omedelbart efter att de icke-permanenta förslutningarna mellan de två eller tre kamrarna har öppnats. Hållbarhetsstudier av blandningarna har gjorts för 7 dagar mellan 2 °C och 8 °C, följt av 48 timmar vid 30 °C.
Hållbarhet efter tillsatser (elektrolyter, spårämnen, vitaminer, vatten)
För specifika tillsatsblandningar har stabilitet påvisats hos Numeta G19E i 7 dagar vid 2 °C till 8 °C följt av 48 timmar vid högst 30°C.
Från mikrobiologisk synvinkel ska blandningen användas omedelbart. Om den inte används omedelbart, ligger ansvaret för lagringstid och lagringsförhållanden före användning på användaren. Lagringstiden bör normalt inte överstiga 24 timmar vid 2 °C till 8 °C, såvida inte beredning/spädning/tillsats skett enligt kontrollerade och validerade aseptiska förhållanden.
Använd inte Numeta G19E om påsen är skadad. En skadad påse ser ut så här:
- De icke-permanenta förslutningarna är brutna.
- Någon av kamrarna innehåller en blandning av flera lösningar.
- Aminosyra- och glukoslösningen är inte klara, färglösa eller lätt gulfärgade, och/eller innehåller synliga partiklar.
- Lipidemulsionen är inte en homogen vätska med ett mjölkliknande utseende.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Innehållsdeklaration Numeta G19E
De aktiva substanserna är:
| Sammansättning | ||
| Aktiva ämnen | Aktiverad tvåkammarpåse (775 ml) | Aktiverad trekammarpåse (1000 ml) |
| Aminosyrakammaren | ||
| Alanin | 1,83 g | 1,83 g |
| Arginin | 1,92 g | 1,92 g |
| Asparaginsyra | 1,37 g | 1,37 g |
| Cystein | 0,43 g | 0,43 g |
| Glutaminsyra | 2,29 g | 2,29 g |
| Glycin | 0,91 g | 0,91 g |
| Histidin | 0,87 g | 0,87 g |
| Isoleucin | 1,53 g | 1,53 g |
| Leucin | 2,29 g | 2,29 g |
Lysinmonohydrat (motsvarar lysin) | 2,82 g (2,51 g) | 2,82 g (2,51 g) |
| Metionin | 0,55 g | 0,55 g |
Ornitinhydroklorid (motsvarar ornitin) | 0,73 g (0,57 g) | 0,73 g (0,57 g) |
| Fenylalanin | 0,96 g | 0,96 g |
| Prolin | 0,69 g | 0,69 g |
| Serin | 0,91 g | 0,91 g |
| Taurin | 0,14 g | 0,14 g |
| Treonin | 0,85 g | 0,85 g |
| Tryptofan | 0,46 g | 0,46 g |
| Tyrosin | 0,18 g | 0,18 g |
| Valin | 1,74 g | 1,74 g |
| Natriumklorid | 1,79 g | 1,79 g |
| Kaliumacetat | 3,14 g | 3,14 g |
| Kalciumkloriddihydrat | 0,56 g | 0,56 g |
| Magnesiumacetattetrahydrat | 0,55 g | 0,55 g |
| Natriumglycerofosfat, hydratiserat | 2,21 g | 2,21 g |
| Glukoskammaren | ||
Glukosmonohydrat (motsvarar vattenfri glukos) | 210,65 g (191,50 g) | 210,65 g (191,50 g) |
| Lipidkammaren | ||
| Raffinerad olivolja (ca. 80 %) + Raffinerad sojaolja (ca. 20 %) | - | 28,1 g |
Den färdigberedda lösningen/emulsionen består av följande:
| Sammansättning | ||||
| Aktiverad tvåkammarpåse | Aktiverad trekammarpåse | |||
| Per volymenhet (ml) | 775 | 100 | 1000 | 100 |
| Kväve (g) | 3,5 | 0,45 | 3,5 | 0,35 |
| Aminosyror (g) | 23,0 | 3,0 | 23,0 | 2,3 |
| Glukos (g) | 192 | 24,7 | 192 | 19,2 |
| Lipider (g) | 0 | 0 | 28,1 | 2,8 |
| Energi | ||||
| Kalorier totalt (kcal) | 858 | 111 | 1139 | 114 |
| Icke-proteinkalorier (kcal) | 766 | 99 | 1047 | 105 |
| Glukoskalorier (kcal) | 766 | 99 | 766 | 77 |
| Lipidkalorier (kcal)a | 0 | 0 | 281 | 28 |
| Icke-proteinkalorier/kväve (kcal/g kväve) | 220 | 220 | 301 | 301 |
| Lipidkalorier/icke-proteinkalorier (g/100 ml) | Inte tillämpligt | Inte tillämpligt | 27 | 27 |
Lipidkalorier/kalorier totalt (g/100 ml) | Inte tillämpligt | Inte tillämpligt | 25 | 25 |
| Elektrolyter | ||||
| Natrium (mmol) | 45,1 | 5,8 | 45,8 | 4,6 |
| Kalium (mmol) | 32,0 | 4,1 | 32,0 | 3,2 |
| Magnesium (mmol) | 2,6 | 0,33 | 2,6 | 0,26 |
| Kalcium (mmol) | 3,8 | 0,50 | 3,8 | 0,38 |
| Fosfat (mmol)b | 7,2 | 0,93 | 9,4 | 0,93 |
| Acetat (mmol) | 37,1 | 4,8 | 37,1 | 3,71 |
| Malat (mmol) | 8,8 | 1,1 | 8,8 | 0,88 |
| Klorid (mmol) | 42,6 | 5,5 | 42,6 | 4,3 |
| pH (ca.) | 5,5 | 5,5 | 5,5 | 5,5 |
| Osmolaritet, ca. (mOsm/l) | 1835 | 1835 | 1460 | 1460 |
a Inkluderar kalorier från äggfosfolipider.
b Inkluderar fosfat som kommer från lipidemulsionens äggfosfolipidkomponent för injektion.
Övriga innehållsämnen är:
| L-äppelsyraa |
| Saltsyraa |
| Äggfosfolipider för injektion |
| Glycerol |
| Natriumoleat |
| Natriumhydroxida |
| Vatten för injektionsvätskor |
a för pH-justering