Pakkausseloste
NUMETA G19E infuusioneste, emulsio
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lapsesi lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Jos havaitset haittavaikutuksia, käänny lapsesi lääkärin tai sairaanhoitajan puoleen, vaikka kokemiasi haittavaikutuksia ei olisikaan mainittu tässä pakkausselosteessa. Katso kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Numeta G19E on ja mihin sitä käytetään
- Mitä sinun on tiedettävä ennen kuin lapsellesi annetaan Numeta G19E-valmistetta
- Miten Numeta G19E-valmistetta annetaan
- Mahdolliset haittavaikutukset
- Numeta G19E-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Numeta G19E on erityinen lapsille tarkoitettu ravintoemulsio (yli 2-vuotialle ja nuorille 18-vuotiaaksi asti. Numeta G19E annetaan infuusioletkulla lapsesi laskimoon, kun hän ei pysty syömään kaikkea tarvitsemaansa ravintoa.
Numeta G19E on pakattu kolmiosastoiseen pussiin, jossa yksittäinen osasto sisältää;
- 50 mg/ml glukoosiliuosta (sokeria)
- 5,9 mg/ml elektrolyyttejä sisältävää aminohapoliuosta (proteiinien rakennusaineita ja suoloja)
- 12,5 mg/ml lipidiemulsiota (rasvoja).
Riippuen lapsesi ravinnontarpeesta, kaksi tai kolme näistä liuoksista sekoitetaan keskenään infuusiopussissa ennen lääkkeen antamista lapselle.
Numeta G19E-valmistetta on käytettävä lääkärin valvonnassa.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Lapsellesi ei pidä antaa Numeta G19E-valmistetta, jos
Pussi, jossa on sekoitettuna kaksi liuosta:
- jos lapsesi on allerginen kananmunan proteiinille, soijalle, maapähkinöille tai jollekin glukoosi- tai aminohappoliuoksen aineelle (ks. kohta Pakkauksen sisältö ja muuta tietoa).
- jos lapsesi elimistö ei pysty hyödyntämään proteiinien rakennusaineita.
- jos lapsellasi on jonkin Numeta G19E-valmisteen sisältämän elektrolyytin suuri pitoisuus veressä.
- jos lapsellasi on hyperglykemia (liian korkea verensokeri).
Pussi, jossa on sekoitettuna kaikki kolme liuosta:
- kaikki edellä mainitut tilanteet koskien pussia, jossa on sekoitettuna kaksi liuosta ja seuraava:
- jos lapsesi veren rasva-arvot ovat erityisen korkeat.
Lääkäri tekee päätöksen siitä, voiko lapsellesi antaa tätä lääkevalmistetta. Lääkärin päätös perustuu lapsen ikään, painoon ja terveydentilaan. Lääkäri ottaa huomioon myös mahdollisten kokeiden tulokset.
Varoitukset ja varotoimet
Keskustele lapsesi lääkärin tai sairaanhoitajan kanssa ennen kuin lapsellesi annetaan Numeta G19E-valmistetta.
Allergiset reaktiot:
Infuusio on lopetettava välittömästi, jos potilaalla esiintyy allergisia reaktioita tai niiden oireita (kuten kuumetta, hikoilua, vilunväreitä, päänsärkyä, ihottumaa tai hengitysvaikeuksia). Tämä lääkevalmiste sisältää soijaöljyä, joka voi harvinaisissa tapauksissa aiheuttaa yliherkkyysreaktioita. Joidenkin maapähkinän proteiineille allergisten henkilöiden on havaittu harvinaisissa tapauksissa olevan allergisia myös soijan proteiineille.
Numeta G19E sisältää glukoosia, joka on peräisin maissitärkkelyksestä. Tämän vuoksi Numeta G19E-valmistetta on annettava varoen potilaille, jotka ovat allergisia maissille tai maissituotteille.
Partikkelien muodostumisen riski keftriaksonin (antibiootti) käytön yhteydessä:
Erästä antibioottia, keftriaksonia, ei saa sekoittaa taa antaa samanaikaisesti minkään laskimoon annettavan kalsiumia sisältävän liuoksen (mukaan lukien Numeta G19E) kanssa. Lääkärisi tietää tämän eikä anna näitä sinulle yhdessä edes erillisten infuusioletkujen tai infuusiokohtien kautta.
Lääkärisi voi kuitenkin antaa kalsiumia ja keftriaksonia peräkkäin, jos käytetään eri infuusiokohtia, tai infuusioletkut vaihdetaan tai huuhdellaan huolellisesti fysiologisella suolaliuokselle infuusioiden välillä saostumisen välttämiseksi.
Pienten partikkelien muodostuminen keuhkojen verisuonissa:
Hengitysvaikeudet voivat olla merkki pienten partikkelien muodostumisesta, mikä aiheuttaa tukkeumia keuhkojen verisuonia (keuhkoverenkierron saostumat). Jos lapsellasi on hengitysvaikeuksia, kerro tästä hänen lääkärille tai sairaanhoitajalle. He päättävät jatkotoimenpiteistä.
Infektiot ja sepsis:
Lääkäri tarkkailee lastasi huolellisesti infektion oireiden varalta. Infektiotartunnan vaaraa voidaan vähentää käyttämällä ns. aseptista tekniikkaa (mikrobitonta tekniikkaa) katetrin asetuksessa ja hoidossa sekä ravintovalmisteen valmistuksessa.
Laskimossa oleva infuusioletku (laskimonsisäinen katetri) voi joskus aiheuttaa lapsille infektion tai sepsiksen (bakteerien aiheuttaman verenmyrkytyksen). Tietyt lääkkeet ja sairaudet voivat suurentaa infektion tai verenmyrkytyksen riskiä. Jos lapsi tarvitsee parenteraalista (laskimoon infuusioletkulla annettavaa) ravintoa, hän voi todennäköisemmin saada infektion terveydentilastaan johtuen.
Rasvakuormitusoireyhtymä:
Rasvakuormitusoireyhtymää on raportoitu samanlaisten valmisteiden käytön yhteydessä. Heikentynyt tai rajoittunut kyky metaboloida Numeta G19E-valmisteen sisältämiä lipidejä tai yliannostus voi aiheuttaa rasvakuormituksen nimellä tunnetun oireyhtymän (ks. kohta Miten valmistetta käytetään ja kohta Mahdolliset haittavaikutukset).
Muutokset veren kemiallisessa koostumuksessa:
Lääkäri tarkkailee lapsesi nestetasapainoa, veren kemiallista koostumusta ja muita veriarvoja, koska ravinnon anto vaikeasti aliravitulle potilaalle voi joskus muuttaa veren kemiallisten aineiden pitoisuuksia. Potilaan kudoksiin voi myös kertyä nestettä, mikä aiheuttaa turvotusta. Parenteraalisen ravinnon anto tulisi aloittaa hitaasti ja varovasti.
Seuranta ja annoksen sovitus:
Lääkäri tarkkailee lastasi huolellisesti ja muuttaa Numeta G19E-valmisteen annostusta lapsen tarpeiden mukaan, jos hänellä on jokin seuraavista:
- vaikea vammanjälkeinen tila
- vaikea diabetes mellitus
- sokki
- sydäninfarkti
- vaikea infektio
- tietyntyyppinen kooma.
Varovaisuutta on noudatettava:
Numeta G19E-valmistetta on käytettävä varoen lapsella, jos hänellä on:
- keuhkoedeema (nestettä keuhkoissa) tai sydämen vajaatoiminta
- vaikea maksan toimintahäiriöravinteiden hyväksikäytössä ongelmia
- korkea verensokeri
- munuaisongelmia
- vaikea aineenvaihdunnan häiriö (kun elimistö ei pysty hajoittamaan aineita normaalisti)
- veren hyytymishäiriö.
Lapsesi nestetasapainoa, maksakokeita ja/ tai veriarvoja tarkkaillaan huolellisesti.
Muut lääkevalmisteet ja Numeta G19E
Kerro lääkärille, jos lapsesi parhaillaan käyttää tai on äskettäin käyttänyt tai saattaa joutua käyttämään muita lääkkeitä.
Numeta G19E-valmistetta ei saa antaa samanaikaisesti:
- keftriaksonin (antibiootti) kanssa edes erillisen infuusiolinjan kautta hiukkasten muodostumisen riskin takia.
- veren kanssa samalla infuusiovälineistöllä punasolujen sakkaantumisen vaaran vuoksi (punasolut voivat takertua toisiinsa).
- ampisilliinin, fosfenytoiinin tai furosemidin kanssa saman infuusiolinjan kautta partikkelien muodostumisen riskin takia.
Kumariini ja varfariini (antikoagulantit):
Lääkäri tarkkailee lastasi huolellisesti, jos hän saa kumariinia tai varfariinia.
Oliivi- ja soijaöljy sisältävät luonnostaan K1-vitamiinia. K1-vitamiini voi vaikuttaa tiettyihin lääkeaineisiin, kuten kumariiniin ja varfariiniin. Nämä lääkkeet ovat antikoagulantteja, joilla estetään veren hyytyminen.
Laboratoriokokeet:
Emulsion sisältämät lipidit voivat vääristää tiettyjen laboratoriotestien tuloksia. Laboratoriotestejä voidaan tehdä, kun potilaalle ei ole annettu lipidejä 5–6 tuntiin.
Numeta G19E-valmisteen ja kaliumin pitoisuuteen/aineenvaihduntaan vaikuttavien lääkkeiden yhteisvaikutukset:
Numeta G19E sisältää kaliumia. Veren suuri kaliumpitoisuus voi aiheuttaa epänormaalin sydämen rytmin. Erityistä varovaisuutta on noudatettava potilailla, jotka käyttävät diureetteja (lääkkeitä, jotka vähentävät nesteen kertymistä) tai ACE-estäjiä (verenpainetta alentavia lääkkeitä) tai angiotensiini II reseptorin antagonisteja (verenpainetta alentavia lääkkeitä) tai immunosupressantteja (lääkkeitä, jotka voivat alentaa elimistön normaalia immuunipuolustusta). Nämä lääkkeet voivat suurentaa kaliumpitoisuutta.
Raskaus, imetys ja hedelmällisyys
Ei ole olemassa tarkkoja tietoja Numeta G19E-valmisteen käytöstä raskaana oleville tai imettäville naisille. Lääkärin punnitsee tarkkaan mahdollisia hyötyjä ja haittoja kullakin potilaalla ennen Numeta G19E-valmisteen määräämistä.
Miten valmistetta käytetään
Lapsellesi annetaantätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Kohde ikä
Numeta G19E on tarkoitettu, yli 2-vuotiaiden lasten ja nuorten (18-vuoden ikään asti) ravitsemustarpeisiin.
Lääkäri päättää, onko tämä lääke sopiva lapsellesi.
Annostelu
Tämä lääke on infuusioneste, emulsio, joka annetaan muoviletkulla lapsen käsivarren laskimoon tai rintakehän suureen laskimoon.
Lapsesi lääkäri voi päättää olla antamatta lipidejä lapsellesi. Numeta G19E-pakkauksen suunnittelu antaa mahdollisuuden rikkoa vain yhden sauman aminohappo/elektrolyyttiosaston ja glukoosiosaston välillä. Aminohappo-osaston ja lipidiemulsio-osaston välinen sauma jää tässä tapauksessa koskemattomaksi. Tällöin pussin sisältö voidaan infusoida ilman lipidejä.
Annostus ja hoidon kesto
Lapsesi lääkäri päättää annoksesta ja kauanko infuusiota annetaan. Annos riippuu lapsesi ravitsemustarpeista. Annos perustuu lapsesi painoon, terveydentilaan, ja hänen elimistönsä kykyyn suodattaa ja käyttää Numeta G19E-valmisteen ainesosia. Lisäravintoa tai proteiineja suun kautta/suoliston kautta voidaan myös harkita.
Jos lapsellesi annetaan liikaa Numeta G19E-valmistetta
Jos olet ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 0800 147 111 Suomessa, 112 Ruotsissa) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Oireet
Liian suuri annos tai liian nopea lääkkeen anto voivat aiheuttaa seuraavia oireita:
- pahoinvointi
- oksentelu
- vilunväreet
- elektrolyyttihäiriöt (elektrolyyttien väärä pitoisuus veressä)
- hypervolemia (verenkierron tilavuuden suureneminen)
- asidoosi (veren happamoituminen).
Näissä tapauksissa infuusio on keskeytettävä heti. Lapsen lääkäri päättää lisätoimenpiteistä.
Numeta G19E-valmisteen sisältämien lipidien yliannostus voi aiheuttaa “rasvakuormitusoireyhtymän”, joka tavallisesti häviää infuusion lopettamisen jälkeen. Vastasyntyneillä ja pienillä lapsilla (vauvoilla) rasvakuormitusoireyhtymä on yhdistetty hengityshäiriöön, joka johtaa alentuneeseen hapen määrään kehossa (hengitysvaikeudet) ja tiloihin, jotka johtavat veren happamuuden lisääntymiseen (asidoosi).
Lääkäri valvoo lapsesi vointia ja veriarvoja säännöllisesti hoidon aikana, jotta nämä oireet vältettäisiin.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki lapset eivät kuitenkaan niitä saa.
Kerro heti lääkärille tai hoitajalle, jos lapsesi vointi muuttuu hoidon aikana tai sen jälkeen.
Lääkärin lapselle määräämät kokeet lääkevalmisteen ottamisen aikana pienentävät haittavaikutusten riskiä.
Jos allergisen reaktion oireita esiintyy, infuusio on lopettava heti ja otettava yhteyttä lääkäriin. Tämä voi olla vakavaa ja seuraavia oireita voi esiintyä:
- hikoilu
- vilunväreet
- päänsärky
- ihottuma
- hengitysvaikeudet.
Muut havaitut haittavaikutukset:
Yleiset (voi vaikuttaa 1:llä 10 potilaasta):
- Veren matala fosfaattipitoisuus (hyporfosfatemia)
- Korkea verensokeri (hyperglykemia)
- Veren suuri kalsiumpitoisuus (hyperkalsemia)
- Veren suuri triglyseridipitoisuus (hypertriglyseridemia)
- Elektrolyyttihäiriöt (hyponatremia).
Melko harvinaiset (voi vaikuttaa 1:llä 100 potilaasta):
- Veren suuri lipidipitoisuus (hyperlipidemia)
- Tila, jossa sappineste ei pääse virtaamaan maksasta pohjukaissuoleen (kolestaasi). Pohjukaissuoli on suoliston osa.
Tuntematon: koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin (Näitä haittavaikutuksia on raportoitu vain Numeta G13E ja G16E-valmisteille, kun niitä on annettu ääreislaskimoon riittämättömällä laimennuksella)
- Ihon kudoskuolio
- Pehmytkudosvaurio
- Lääkkeen vuotaminen verisuonen ulkopuolelle (ekstravasaatio).
Heikentynyt tai rajoittunut kyky poistaa Numeta G19E-valmisteen sisältämiä lipidejä voi johtaa rasvakuormitusoireyhtymään (eli fat overload syndrome). Seuraavat oireyhtymän oireet ja merkit häviävät tavallisesti, kun lipidiemulsioinfuusio lopetetaan:
- potilaan terveydentilan äkillinen ja odottamaton heikentyminen
- veren suuri lipidipitoisuus (hyperlipidemia)
- kuume
- rasvan kertyminen maksaan (hepatomegalia)
- maksan toiminnan heikentyminen
- punasolujen määrän väheneminen (anemia), joka voi aiheuttaa kalpeutta ja heikkoutta tai hengitysvaikeuksia
- valkosolujen niukkuus (leukopenia), joka voi suurentaa infektiotartunnan vaaraa verihiutaleiden niukkuus (trombosytopenia), joka voi suurentaa mustelmien ja/tai verenvuodon vaaraa
- koagulaatiohäiriöt, jotka vaikuttavat veren hyytymiseen
- hengityshäiriöt. jotka johtavat alentuneeseen hapen määrään kehossa (hengitysvaikeudet)
- tilat, jotka johtavat veren happamuuden lisääntymiseen (asidoosi)kooma, joka edellyttää sairaalahoitoa.
- kooma, joka edellyttää sairaalahoitoa.
Pienten partikkelien muodostuminen, mikä voi johtaa tukkeumiin keuhkoverisuonissa (keuhkoverenkierron saostumat) ja hengitysvaikeuksiin.
Epäillyistä haittavaikutuksista ilmoittaminen
Jos havaitset lapsellasi haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös kaikkia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville, kun valmistetta ei anneta.
Älä käytä tätä lääkettä pakkauksessa ja ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Ei saa jäätyä.
Säilytettävä päällyspussissa.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Lääkevalmisteen kuvaus ja pakkauskoot
Numeta G19E on pakattu kolmiosastoiseen pussiin. Kukin pussi sisältää steriiliä glukoosiliuosta, lapsille tarkoitettua elektrolyyttejä sisältävää aminohappoliuosta ja lipidiemulsiota seuraavat määrät:
| Pussin koko | Glukoosiliuos, 50 g/100ml | Elektrolyyttejä sisältävä aminohappoliuos, 5,9 g/100ml | Lipidiemulsio, 12,5g/100ml |
| 1000 ml | 383 ml | 392 ml | 225 ml |
Ulkonäkö ennen sekoitusta:
- Aminohappo- ja glukoosiliuokset ovat kirkkaita, värittömiä tai hieman kellertäviä.
- Lipidiemulsio on homogeeninen ja maitomainen.
Ulkonäkö sekoituksen jälkeen:
- Kun pussista on sekoitettu kahden osaston sisältö, liuos on kirkasta ja väritöntä tai kellertävää.
- Kun pussista on sekoitettu kolmen osaston sisältö, emulsio on homogeeninen ja maitomainen.
Kolmiosastoinen pussi on monikerroksinen muovipussi.
Jotta valmisteeseen ei pääse ilmaa, Numeta G19E on pakattu happitiiviiseen päällyspussiin, jossa on happea imevä tyyny ja happi-indikaattori.
Pakkauskoot
1000 ml:n pussi: 6 pussia laatikossa.
1 pussi, jossa 1000 ml.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija ja valmistaja
Myyntiluvan haltija
Baxter Oy
PL 119
00181 Helsinki
Valmistaja
Baxter S.A.
Boulevard Rene Branquart, 80
7860 Lessines
Belgia
Tämä pakkausseloste on tarkistettu viimeksi 26.06.2024
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille*
*Huomioi, että tietyissä tapauksissa vanhemmat tai muut huoltajat voivat annostella tätä lääkettä kotona. Sellaisissa tapauksissa vanhempien/ huoltajien tulee lukea seuraavat tiedot.
Pussiin ei saa lisätä muita aineita, ennen kuin niiden yhteensopivuus on varmistettu. Muutoin valmisteeseen voi saostua hiukkasia tai lipidiemulsion rakenne voi muuttua. Se voi aiheuttaa verisuonitukoksen.
Numeta G19E-valmisteen tulee olla annettaessa huoneenlämpöistä.
Numeta G19E-pussi valmistellaan seuraavasti ennen lääkevalmisteen käyttöä.
Varmista, että pussi on ehjä. Älä käytä pussia, jos se on vahingoittunut. Ehjä pussi näyttää tältä:
- Avautuvat saumat ovat ehjät. Tällöin minkään kolmen osaston sisältö ei ole sekoittunut.
- Aminohappo- ja glukoosiliuokset ovat kirkkaita ja värittömiä tai kellertäviä, eikä niissä ole näkyviä hiukkasia.
- Lipidiemulsio on homogeeninen ja maitomaisen valkoinen neste.
Ennen kuin avaat päällyspussin, tarkista happi-indikaattorin väri.
- Tarkista OK-symbolin vieressä näkyvä vertailuväri, joka on indikaattorin etiketin tulostetulla alueella.
- Älä käytä pussia, jos happi-indikaattorin väri ei ole sama kuin OK-symbolin vieressä näkyvä vertailuväri.
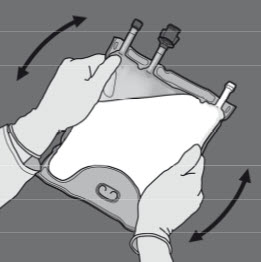
Kuvassa 1 ja 2 kuvataan kuinka suojaava päällyspussi poistetaan. Hävitä päällyspussi, happi-indikaattori ja happea imevä tyyny.
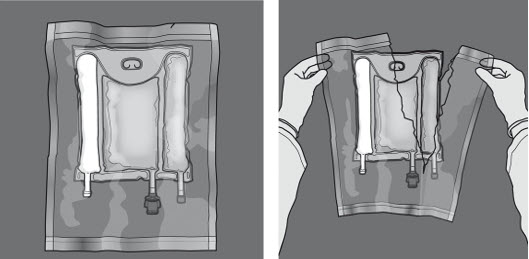
Kuva 1 Kuva 2
Sekoitetun emulsion valmisteleminen:
- Valmisteen on oltava huoneenlämpöistä, kun avaat osastojen väliset saumat.
- Aseta pussi vaakasuoralle ja puhtaalle alustalle.
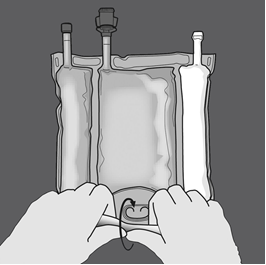
Kolmen osaston sisällön sekoittaminen (kolmen liuoksen sekoittaminen kaksi saumaa avaamalla)
Vaihe 1: Ala rullata pussia D-ripustinpäästä.
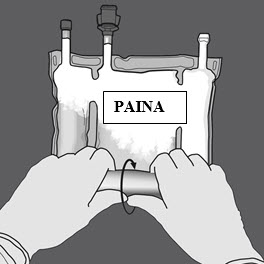
Vaihe 2: Avaa sauma painamalla.
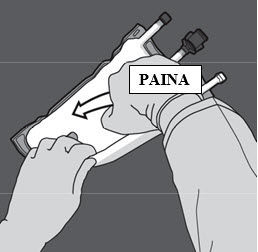
Vaihe 3: Muuta sitten suuntaa rullaamalla pussia kohti D-ripustinta.
Jatka rullaamista kunnes sauma on täysin auki.
Etene samaan suuntaan toisen sauman avaamiseksi.
Vaihe 4: Sekoita pussin sisältö huolellisesti kääntämällä pussi ylösalaisin vähintään kolme kertaa. Sekoitettu liuos on maitomaisen valkoinen emulsio.
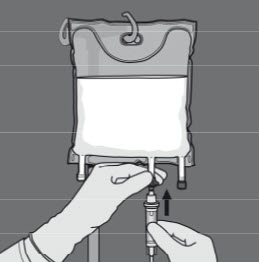
Vaihe 5: Irrota suojus annosteluportista ja kiinnitä siihen infuusioletkusto.
Kahden osaston sisällön sekoittaminen (kahden liuoksen sekoittaminen avaamalla aminohappo- ja glukoosikammioiden välinen sauma)
Vaihe 1: Jos sekoitat vain kaksi liuosta, rullaa pussia yläreunasta (ripustinpäästä) kahden liuoksen välisen sauman nurkasta.
Avaa glukoosi- ja aminohappoliuosten välinen sauma painamalla.
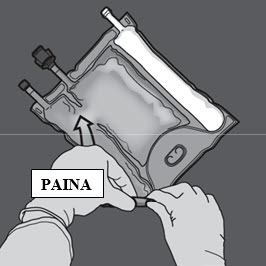
Vaihe 2: Aseta pussi niin, että lipidiemulsio-osasto on lähimpänä itseäsi.
Rullaa pussia ja suojaa samalla lipidiemulsio-osastoa kämmenillä.
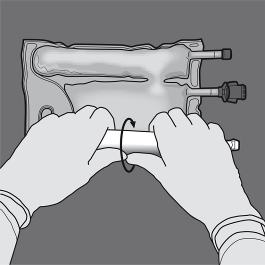
Vaihe 3: Rullaa painamalla pussia toisella kädellä porttien suuntaan.
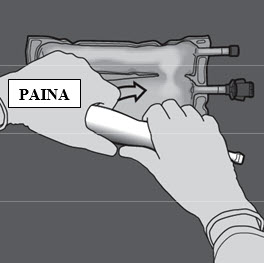
Vaihe 4: Vaihda suuntaa ja rullaa pussia yläreunan (ripustinpään) suuntaan.
Paina pussia toisella kädellä, kunnes aminohappo- ja glukoosiliuososastojen välinen sauma on kokonaan auki.
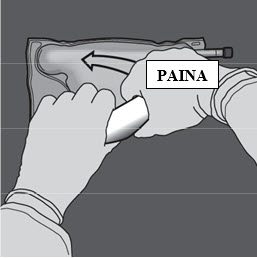
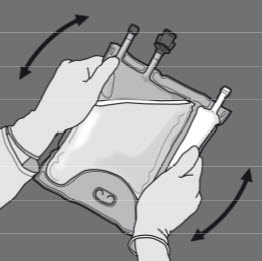
Vaihe 5: Sekoita pussin sisältö huolellisesti kääntämällä pussi ylösalaisin vähintään kolme kertaa. Sekoitettu liuos on kirkasta, väritöntä tai hieman kellertävää.
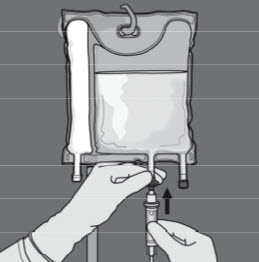
Vaihe 6: Irrota suojus annosteluportista ja kiinnitä siihen infuusioletkusto.
Infuusionopeutta suurennetaan vähitellen ensimmäisen tunnin aikana. Antonopeutta määrättäessä on otettava huomioon seuraavat tekijät:
- annoksen suuruus
- saantitilavuus vuorokaudessa
- infuusion kesto.
Antotapa
Emulsio (pusseissa ja antovälineistössä) on suojattava valolta sekoittamisesta aina siihen saakka, kunnes valmisteen antaminen on saatettu loppuun.
1,2 mikrometrin suodattimen käyttöä suositellaan Numeta G19E-valmisteen annostelussa.
Suuren osmolaarisuuden vuoksi laimentamaton Numeta G19E voidaan antaa vain keskuslaskimoon. Jos Numeta G19E-valmistetta laimennetaan kuitenkin riittävästi injektionesteisiin käytettävällä vedellä, sen osmolaarisuus laskee ja se voidaan antaa ääreislaskimoon.
Alla olevalla kaavalla esitetään, miten laimennus vaikuttaa pussien sisällön osmolarisuuteen.
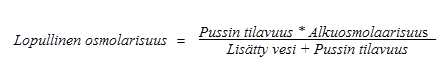
Alla olevassa taulukossa on esimerkkejä pussien osmolaarisuudesta injektionesteisiin käytettävän veden lisäämisen jälkeen, kun pussista on sekoitettu kolmen osaston sisältö:
| Aminohappo- ja glukoosiliuos sekä lipidiemulsio (kolme osastoa sekoitettu) | |
| Pussin alkutilavuus (ml) | 1000 |
| Pussin alkuosmolaarisuus (mOsm/l, n.) | 1460 |
| Lisätyn veden tilavuus (ml) | 1000 |
| Lopullinen tilavuus lisäysten jälkeen (ml) | 2000 |
| Osmolaarisuus lisäysten jälkeen (mOsm/l, n.) | 730 |
Lisäykset
Seos on suojattava valolta hivenaine- ja vitamiinilisäyksiä tehtäessä ja aina valmisteen annosteluun asti. Altistuminen ympäröivälle valolle tuottaa peroksideja ja muita hajoamistuotteita, joiden määrää voidaan vähentää suojaamalla valmiste valolta.
Yhteensopivien aineiden lisäykset voidaan tehdä injektioportin kautta käyttökuntoon saatettuun seokseen (kun osastojen väliset saumat on avattu ja kahden tai kolmen pussin sisältö on sekoitettu).
Vitamiineja voidaan lisätä myös glukoosia sisältävään osastoon ennen kuin sekoittamista (ennen saumojen avaamista ja liuoksen ja emulsion sekoittamista).
Mahdolliset kaupallisten hivenainevalmisteiden (eli HA1-, HA2- ja HA4-valmisteiden), vitamiinivalmisteiden (eli V1- ja V2-kuiva-aineiden) ja elektrolyyttien lisäykset tietyissä määrissä on esitetty alla olevissa taulukossa 1–6.
- Yhteensopivuus HA4-, V1- ja V2-valmisteiden kanssa
Taulukko 1: Yhteensopivuus, kun kolmen osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 1000 ml (aminohapot, glukoosi ja lipidit (kolme osastoa sekoitettu)) | ||||||
| Laimentamaton seos | Laimennettu seos | |||||
| Lisäys | Valmis-teessa | Enimmäislisäys | Sisältää enintään | Valmis-teessa | Enimmäis-lisäys | Sisältää enintään |
| Natrium (mmol) | 45,8 | 105 | 151 | 45,8 | 105 | 151 |
| Kalium (mmol) | 32,0 | 118 | 150 | 32,0 | 118 | 150 |
| Magnesium (mmol) | 2,6 | 7,8 | 10,4 | 2,6 | 7,8 | 10,4 |
| Kalsium (mmol) | 3,8 | 20,5 | 24,3 | 3,8 | 20,5 | 24,3 |
| Fosfaatti* (mmol) | 9,4 | 14,6 | 24,0 | 9,4 | 14,6 | 24,0 |
| Hivenaineet ja vitamiinit | - | 34 ml HA4-valmistetta + 3,4 injektio-pulloa V1-valmistetta + 38 ml V2-valmistetta | 34 ml HA4-valmistetta + 3,4 injektio-pulloa V1-valmistetta + 38 ml V2-valmistetta | - | 34 ml HA4-valmistetta + 3,4 injektio-pulloa V1-valmistetta + 38 ml V2-valmistetta | 34 ml HA4-valmistetta + 3,4 injektio-pulloa V1-valmistetta + 38 ml V2-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 1450 ml | 1450 ml |
* Orgaaninen fosfaatti
Taulukko 2: Yhteensopivuus, kun kahden osaston sisältö on sekoitettu
| Per 775 ml (aminohapot ja glukoosi (kaksi osastoa sekoitettu)) | |||
| Lisäys | Valmis-teessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 45,1 | 32,0 | 77,1 |
| Kalium (mmol) | 32,0 | 45,6 | 77,6 |
| Magnesium (mmol) | 2,6 | 5,2 | 7,8 |
| Kalsium (mmol) | 3,8 | 19,4 | 23,2 |
| Fosfaatti* (mmol) | 7,2 | 16,0 | 23,2 |
| Hivenaineet ja vitamiinit | - | 10 ml HA4-valmistetta + 1 injektiopullo V1-valmistetta | 10 ml HA4-valmistetta + 1 injektiopullo V1-valmistetta |
* Orgaaninen fosfaatti
- Yhteensopivuus HA1-, V1- ja V2-valmisteiden kanssa
Taulukko 3: Yhteensopivuus, kun kolmen osaston sisältö on sekoitettu
| Per 1000 ml (aminohapot, glukoosi ja lipidit (kolme osastoa sekoitettu)) | |||
| Lisäys | Valmis-teessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 45,8 | 0 | 45,8 |
| Kalium (mmol) | 32,0 | 0 | 32,0 |
| Magnesium (mmol) | 2,6 | 0 | 2,6 |
| Kalsium (mmol) | 3,8 | 6,4 | 10,2 |
| Fosfaatti* (mmol) | 9,4 | 0 | 9,4 |
| Hivenaineet ja vitamiinit | - | 15 ml HA1-valmistetta + 1 injektiopullo V1-valmistetta + 10 ml V2-valmistetta | 15 ml HA1-valmistetta + 1 injektiopullo V1-valmistetta + 10 ml V2-valmistetta |
* Orgaaninen fosfaatti
Taulukko 4: Yhteensopivuus, kun kahden osaston sisältö on sekoitettu
| Per 775 ml (aminohapot ja glukoosi (kaksi osastoa sekoitettu)) | |||
| Lisäys | Valmis-teessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 45,1 | 32,0 | 77,1 |
| Kalium (mmol) | 32,0 | 45,6 | 77,6 |
| Magnesium (mmol) | 2,6 | 5,2 | 7,8 |
| Kalsium (mmol) | 3,8 | 19,4 | 23,2 |
| Fosfaatti* (mmol) | 7,2 | 16,0 | 23,2 |
| Hivenaineet ja vitamiinit | - | 10 ml HA1-valmistetta + 1 injektiopullo V1-valmistetta | 10 ml HA1-valmistetta + 1 injektiopullo V1-valmistetta |
* Orgaaninen fosfaatti
- Yhteensopivuus HA2-, V1- ja V2-valmisteiden kanssa
Taulukko 5: Yhteensopivuus, kun kahden osaston sisältö on sekoitettu
| Per 775 ml (aminohapot ja glukoosi (kaksi osastoa sekoitettu)) | |||
| Lisäys | Valmis-teessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 45,1 | 32,0 | 77,1 |
| Kalium (mmol) | 32,0 | 45,6 | 77,6 |
| Magnesium (mmol) | 2,6 | 5,2 | 7,8 |
| Kalsium (mmol) | 3,8 | 19,4 | 23,2 |
| Fosfaatti* (mmol) | 7,2 | 16,0 | 23,2 |
| Hivenaineet ja vitamiinit | - | 15 ml HA2-valmistetta + 1 injektiopullo V1-valmistetta | 15 ml HA2-valmistetta + 1 injektiopullo V1-valmistetta |
* Orgaaninen fosfaatti
Taulukko 6: Yhteensopivuus, kun kolmen osaston sisältö on sekoitettu
| Per 1000 ml (aminohapot, glukoosi ja lipidit (kolme osastoa sekoitettu)) | |||
| Lisäys | Valmis-teessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 45,8 | 0 | 45,8 |
| Kalium (mmol) | 32,0 | 0 | 32,0 |
| Magnesium (mmol) | 2,6 | 0 | 2,6 |
| Kalsium (mmol) | 3,8 | 6,4 | 10,2 |
| Fosfaatti* (mmol) | 9,4 | 0 | 9,4 |
| Hivenaineet ja vitamiinit | - | 15 ml HA2-valmistetta + 1 injektiopullo V1-valmistetta + 10 ml V2-valmistetta | 15 ml HA2-valmistetta + 1 injektiopullo V1-valmistetta + 10 ml V2-valmistetta |
* Orgaaninen fosfaatti
Vitamiini- ja hivenainevalmisteiden koostumus on esitetty alla olevissa taulukoissa 7 ja 8.
Taulukko 7: Käytettyjen kaupallisten hivenainevalmisteiden koostumus
| Koostumus per 10 ml | HA1 | HA2 | HA4 |
| Rauta | - | 8,9 mikromol tai 0,5 mg | - |
| Sinkki | 38,2 mikromol tai 2,5 mg | 15,3 mikromol tai 1 mg | 15,3 mikromol tai 1 mg |
| Seleeni | 0,253 mikromol tai 0,02 mg | 0,6 mikromol tai 0,05 mg | 0,253 mikromol tai 0,02 mg |
| Kupari | 3,15 mikromol tai 0,2 mg | 4,7 mikromol tai 0,3 mg | 3,15 mikromol tai 0,2 mg |
| Jodi | 0,0788 mikromol tai 0,01 mg | 0,4 mikromol tai 0,05 mg | 0,079 mikromol tai 0,01 mg |
| Fluori | 30 mikromol tai 0,57 mg | 26,3 mikromol tai 0,5 mg | - |
| Molybdeeni | - | 0,5 mikromol tai 0,05 mg | - |
| Mangaani | 0,182 mikromol tai 0,01 mg | 1,8 mikromol tai 0,1 mg | 0,091 mikromol tai 0,005 mg |
| Kromi | - | 0,4 mikromol tai 0,02 mg | - |
| Koboltti | - | 2,5 mikromol tai 0,15 mg | - |
Taulukko 8: Käytettyjen kaupallisten vitamiinivalmisteiden koostumus
Injektiopullon koostumus | V1 | V2 |
| B1-vitamiini | 2,5 mg | - |
| B2-vitamiini | 3,6 mg | - |
| Nikotiiniamidi | 40 mg | - |
| B6-vitamiini | 4,0 mg | - |
| Pantoteenihappo | 15,0 mg | - |
| Biotiini | 60 mikrog | - |
| Foolihappo | 400 mikrog | - |
| B12-vitamiini | 5,0 mikrog | - |
| C-vitamiini | 100 mg | - |
| A-vitamiini | - | 2300 KY |
| D-vitamiini | - | 400 KY |
| E-vitamiini | - | 7 KY |
| K-vitamiini | - | 200 mikrog |
Lisää aineet seuraavasti:
- Huolehdi aseptisista olosuhteista.
- Valmistele pussin injektioportti.
- Lävistä injektioportti ja lisää muut aineet injektioneulalla tai lääkkeenlisäysvälikappaleella.
- Sekoita pussin sisältö ja lisäaineet.
Infuusion valmisteleminen:
- Huolehdi aseptisista olosuhteista.
- Ripusta pussi.
- Irrota annosteluportin muovisuojus.
- Työnnä infuusioletkuston piikkiliitin tiiviisti annosteluporttiin.
Infuusion antaminen:
- Vain kerta-antoon
- Aloita valmisteen antaminen potilaalle vasta, kun kahden tai kolmen osaston väliset saumat on avattu ja kahden tai kolmen osaston sisältö on sekoittunut.
- Varmista, että käyttövalmiissa infuusioemulsiossa (pussissa, josta on sekoitettu kolmen osaston sisältö) ei näy merkkejä faasien erottumisesta tai että käyttövalmiissa infuusioliuoksessa (pussissa, josta on sekoitettu kahden osaston sisältö) ei näy hiukkasia.
- Valmisteen käyttämistä suositellaan välittömästi, kun osastojen väliset saumat on avattu. Valmistetta ei saa säilyttää myöhempää infuusiota varten. Osittain käytettyä pussia ei saa käyttää uudelleen.
- Pusseja ei saa kytkeä sarjaan, koska ensimmäiseen pussiin mahdollisesti jäänyt ilma voi aiheuttaa ilmaemboliavaaran.
- 1,2 mikrometrin suodattimen käyttöä suositellaan Numeta G19E-valmisteen annostelussa.
- Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Kestoaika liuosten sekoituksen jälkeen
Käytä valmiste heti, kun kahden tai kolmen osaston väliset saumat on avattu. Sekoitetun valmisteen on osoitettu olevan stabiili enintään 7 päivän ajan 2–8 °C:n lämpötilassa ja sen jälkeen enintään 48 tuntia 30 °C:n lämpötilassa.
Kestoaika lisäysten (elektrolyytit, hivenaineet, vitamiinit, vesi) jälkeen
Numeta G19E-formulaation, johon on tehty tiettyjä lisäyksiä, on osoitettu olevan stabiili enintään 7 päivän ajan 2–8 °C:n lämpötilassa ja sen jälkeen enintään 48 tuntia 30 °C:n lämpötilassa.
Mikrobiologiselta kannalta valmiste olisi käytettävä heti. Jos valmistetta ei käytetä heti, säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla. Säilytysaika ei tavallisesti saa ylittää 24 tuntia 2–8 ºC:ssa, ellei lisäyksiä ole tehty valvotuissa ja validoiduissa aseptisissa olosuhteissa.
Älä käytä Numeta G19E-valmistetta, jos pussi on vahingoittunut. Vahingoittunut pussi näyttää tältä:
- Avautuvat saumat ovat rikki.
- Minkä tahansa osaston sisältö on sekoittunut toisen liuoksen kanssa.
- Aminohappo- ja glukoosiliuokset eivät ole kirkkaita ja värittömiä tai kellertäviä, ja/tai niissä on näkyviä hiukkasia.
- Lipidiemulsio ei ole homogeeninen ja maitomaisen valkoinen.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Mitä Numeta G19E sisältää
Vaikuttavat aineet ovat:
| Koostumus | ||
| Vaikuttava aine | Kaksi osastoa sekoitettu (775 ml) | Kolme osastoa sekoitettu (1000 ml) |
| Aminohappoliuososasto | ||
| Alaniini | 1,83 g | 1,83 g |
| Arginiini | 1,92 g | 1,92 g |
| Asparagiinihappo | 1,37 g | 1,37 g |
| Kysteiini | 0,43 g | 0,43 g |
| Glutamiinihappo | 2,29 g | 2,29 g |
| Glysiini | 0,91 g | 0,91 g |
| Histidiini | 0,87 g | 0,87 g |
| Isoleusiini | 1,53 g | 1,53 g |
| Leusiini | 2,29 g | 2,29 g |
Lysiinimonohydraatti (lysiininä) | 2,82 g (2,51 g) | 2,82 g (2,51 g) |
| Metioniini | 0,55 g | 0,55 g |
Ornitiinihydrokloridi (ornitiinina) | 0,73 g (0,57 g) | 0,73 g (0,57 g) |
| Fenyylialaniini | 0,96 g | 0,96 g |
| Proliini | 0,69 g | 0,69 g |
| Seriini | 0,91 g | 0,91 g |
| Tauriini | 0,14 g | 0,14 g |
| Treoniini | 0,85 g | 0,85 g |
| Tryptofaani | 0,46 g | 0,46 g |
| Tyrosiini | 0,18 g | 0,18 g |
| Valiini | 1,74 g | 1,74 g |
| Natriumkloridi | 1,79 g | 1,79 g |
| Kaliumasetaatti | 3,14 g | 3,14 g |
| Kalsiumklorididihydraatti | 0,56 g | 0,56 g |
| Magnesiumasetaattitetrahydraatti | 0,55 g | 0,55 g |
| Natriumglyserofosfaatti, hydratoitu | 2,21 g | 2,21 g |
| Glukoosiliuososasto | ||
Glukoosimonohydraatti (vedettömänä glukoosina) | 210,65 g (191,50 g) | 210,65 g (191,50 g) |
| Lipidiemulsio-osasto | ||
| Puhdistettu oliiviöljy (n. 80 %) + puhdistettu soijaöljy (n. 20 %) | – | 28,1 g |
Käyttökuntoon saatetun Numeta G19E-liuoksen/-emulsion koostumus:
| Koostumus | ||||
Kaksi osastoa sekoitettu | Kolme osastoa sekoitettu | |||
| Tilavuusyksikkö kohden (ml) | 775 | 100 | 1000 | 100 |
| Typpi (g) | 3,5 | 0,45 | 3,5 | 0,35 |
| Aminohapot (g) | 23,0 | 3,0 | 23,0 | 2,3 |
| Glukoosi (g) | 192 | 24,7 | 192 | 19,2 |
| Lipidit (g) | 0 | 0 | 28,1 | 2,8 |
| Energia | ||||
| Kokonaiskalorit (kcal) | 858 | 111 | 1139 | 114 |
| Proteiinittomat kalorit (kcal) | 766 | 99 | 1047 | 105 |
| Glukoosikalorit (kcal) | 766 | 99 | 766 | 77 |
| Lipidikalorit (kcal)a | 0 | 0 | 281 | 28 |
| Proteiinittomien kalorien kalori-typpisuhde (kcal/g typpi) | 220 | 220 | 301 | 301 |
| Lipidikaloreiden osuus proteiinittomista kaloreista (%) | Ei oleellinen | Ei oleellinen | 27 | 27 |
| Lipidikaloreiden osuus kokonaiskaloreista (%) | Ei oleellinen | Ei oleellinen | 25 | 25 |
| Elektrolyytit | ||||
| Natrium (mmol) | 45,1 | 5,8 | 45,8 | 4,6 |
| Kalium (mmol) | 32,0 | 4,1 | 32,0 | 3,2 |
| Magnesium (mmol) | 2,6 | 0,33 | 2,6 | 0,26 |
| Kalsium (mmol) | 3,8 | 0,50 | 3,8 | 0,38 |
| Fosfaatti (mmol)b | 7,2 | 0,93 | 9,4 | 0,93 |
| Asetaatti (mmol) | 37,1 | 4,8 | 37,1 | 3,71 |
| Malaatti (mmol) | 8,8 | 1,1 | 8,8 | 0,88 |
| Kloridi (mmol) | 42,6 | 5,5 | 42,6 | 4,3 |
| pH (noin) | 5,5 | 5,5 | 5,5 | 5,5 |
| Osmolaarisuus n.(mOsm/l) | 1835 | 1835 | 1460 | 1460 |
a Sisältää kananmunan fosfolipidien (injektionestettä varten) kalorit.
b Sisältää lipidiemulsion sisältämän kananmunan fosfolipidien (injektionestettä varten) fosfaatin.
Muut aineet ovat:
| L-omenahappoa |
| Suolahappoa |
| Fosfolipidit (muna) injektionestettä varten |
| Glyseroli |
| Natriumoleaatti |
| Natriumhydroksidia |
| Injektionesteisiin käytettävä vesi |
a pH:n säätöön