Pakkausseloste
CLUVOT injektio-/infuusiokuiva-aine ja liuotin, liuosta varten 250 IU, 1250 IU
Cluvot 250 IU
Cluvot 1250 IU
injektio/infuusiokuiva-aine ja liuotin, liuosta varten
ihmisen hyytymistekijää XIII sisältävä konsentraatti
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Cluvot on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Cluvot-valmistetta
- Miten Cluvot-valmistetta käytetään
- Mahdolliset haittavaikutukset
- Cluvot-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Cluvot on?
Cluvot koostuu valkoisesta kuiva-aineesta ja liuottimesta. Niistä sekoitetaan liuos, joka annetaan ruiskeena laskimoon.
Cluvot on ihmisen plasmasta (veren nestemäisestä osasta) valmistettu hyytymistekijä XIII:a (FXIII) sisältävä valmiste. Hyytymistekijällä XIII on tärkeä tehtävä verenvuodon tyrehtymisessä (hemostaasissa).
Mihin Cluvot-valmistetta käytetään?
Cluvot-valmistetta käytetään aikuisille ja lapsille
- synnynnäisen hyytymistekijä XIII:n puutoksen estohoitoon
- leikkauksen aikaisen verenvuodon hoitoon synnynnäisen hyytymistekijä XIII:n puutoksen yhteydessä.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Seuraavissa kohdissa on tietoa, joka lääkärin on huomioitava ennen kuin saat Cluvot-hoitoa.
Älä käytä Cluvot-valmistetta
- jos olet allerginen vaikuttavalle aineelle tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Kerro lääkärille, jos olet allerginen jollekin lääkkeelle tai ruoka-aineelle.
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen kuin käytät Cluvot-valmistetta
- jos sinulla on aiemmin esiintynyt allergisia reaktioita hyytymistekijä XIII:n käytön yhteydessä. Sinun on käytettävä estohoitona antihistamiineja ja kortikosteroideja, jos lääkäri on niin kehottanut.
- kun sinulla on allergisia tai anafylaksian kaltaisia reaktioita (vakava allerginen reaktio, joka aiheuttaa vaikeita hengitysvaikeuksia tai huimausta). Cluvot-valmisteen antaminen on tällöin lopetettava heti (esim. injektion/infuusion anto on keskeytettävä). Jos joudut sokkiin, on noudatettava voimassa olevia sokin hoitotoimenpiteitä.
- jos sinulla on äskettäin ollut verisuonitukos (tromboosi). Hoidossa pitää tällöin olla varovainen, koska hyytymistekijä XIII:lla on fibriiniä stabiloiva vaikutus.
- Vasta-aineiden (lääkkeen vaikutusta neutraloivien vasta-aineiden) muodostuminen on hoidon tunnettu haittavaikutus ja merkitsee sitä, ettei hoito enää tehoa. Jos verenvuodot eivät pysy Cluvot-hoidon avulla hallinnassa, käänny heti lääkärin puoleen. Vointiasi on seurattava tarkoin vasta-aineiden kehittymisen havaitsemiseksi.
Lääkäri punnitsee tarkoin Cluvot-hoidon hyödyt näiden lisäsairauksien riskiin nähden.
Virusturvallisuus
Kun ihmisen verestä tai plasmasta valmistetaan lääkkeitä, infektioiden siirtymistä potilaisiin estetään tietyin toimenpitein. Tällaisia ovat:
- veren ja plasman luovuttajien tarkka valinta sen varmistamiseksi, että infektioita mahdollisesti kantavat henkilöt voidaan sulkea pois
- kaikesta luovutetusta verestä ja plasmasta sekä plasmapooleista tutkitaan viruksiin/infektioihin viittaavat merkit
- veri- tai plasmavalmisteiden valmistuksessa käytettävät vaiheet, joissa virukset voidaan inaktivoida tai poistaa.
Tällaisista toimenpiteistä huolimatta taudinaiheuttajien siirtymisen mahdollisuutta ei voida täysin sulkea pois, kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkevalmisteita. Tämä koskee myös tuntemattomia tai vasta kehittymässä olevia viruksia tai muuntyyppisiä infektioita.
Käytössä olevien toimenpiteiden katsotaan tehoavan vaipallisiin viruksiin, kuten ihmisen immuunikatovirukseen (HIV), hepatiitti B -virukseen ja hepatiitti C -virukseen sekä vaipattomiin viruksiin, kuten hepatiitti A -virus ja parvovirus B19.
Potilaalle annetun valmisteen nimi ja eränumero (mainittu pakkausmerkinnöissä) kehotetaan kirjaamaan Cluvot-valmisteen jokaisen antokerran yhteydessä.
Lääkäri saattaa suositella rokotuksen ottamista hepatiitti A:ta ja B:tä vastaan, jos saat säännöllisesti/toistuvasti ihmisen plasmasta valmistettuja lääkevalmisteita.
Muut lääkevalmisteet ja Cluvot
- Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
- Ihmisen hyytymistekijä XIII:a sisältävällä konsentraatilla ei ole tunnettuja yhteisvaikutuksia muiden lääkevalmisteiden kanssa.
- Cluvot-valmistetta ei saa sekoittaa muiden lääkevalmisteiden, laimentimien ja liuottimien kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Pakkauksen sisältö ja muuta tietoa, joten se on annettava erillisen infuusiolaitteen kautta.
Raskaus, imetys ja hedelmällisyys
- Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
- Cluvot-valmisteen käytöstä raskauden aikana on vähän tietoa, mutta siihen ei ole todettu liittyneen haitallisia vaikutuksia raskauden kulkuun eikä sikiön tai vastasyntyneen kehitykseen. Cluvot-valmistetta voidaan siksi käyttää raskauden aikana, jos tarpeen.
- Ei ole tietoa, erittyykö Cluvot ihmisen rintamaitoon. Suuren molekyylikoon vuoksi erittyminen ihmisen rintamaitoon on kuitenkin epätodennäköistä, ja valmisteen proteiiniluonteen vuoksi ei ole todennäköistä, että molekyylejä siirtyisi muuttumattomina imeväiseen. Tästä syystä valmistetta voi käyttää rintaruokinnan aikana.
- Hedelmällisyyttä koskevia tietoja ei ole saatavissa.
Ajaminen ja koneiden käyttö
Tutkimuksia valmisteen vaikutuksista ajokykyyn tai koneiden käyttökykyyn ei ole tehty.
Cluvot sisältää natriumia
Huomioi, että Cluvot sisältää natriumia. Potilaiden, joilla on ruokavalion natriumrajoitus, tulee ottaa tämä huomioon. Cluvot sisältää natriumia 124,4–195,4 mg (5,41–8,50 mmol) per annos (40 IU/noin 70 kg:n painoinen potilas), jos annetaan suositeltu annos (2800 IU = 44,8 ml).
Miten valmistetta käytetään
- Cluvot-hoidon antaa tavallisesti lääkäri.
- Cluvot on tarkoitettu vain annettavaksi laskimoon.
Annostus
Lääkäri laskee oikean annoksen ja päättää hoidosta saadun vaikutuksen perusteella sen, miten usein Cluvot-hoitoa annetaan.
Ks. lisätietoja kohdasta Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille.
Jos käytät enemmän Cluvot-valmistetta kuin sinun pitäisi
Yliannostapauksia ei ole raportoitu eikä niitä odoteta esiintyvän, koska terveydenhuollon ammattilainen antaa lääkkeen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Seuraavia haittavaikutuksia on havaittu harvoin (yhdellä tai useammalla potilaalla 10 000:stä, mutta harvemmalla kuin yhdellä potilaalla 1 000:sta):
- allergisia reaktioita, kuten yleistynyttä nokkosihottumaa (kutisevaa ihon turpoamista), ihottumaa, verenpaineen laskua (mistä saattaa aiheutua heikotusta tai huimausta) ja hengitysvaikeuksia.
- ruumiinlämmön kohoamista.
Seuraavia haittavaikutuksia on havaittu hyvin harvoin (harvemmalla kuin yhdellä potilaalla 10 000:stä)
- vasta-aineiden kehittymistä hyytymistekijä XIII:lle.
Jos allergisia reaktioita ilmaantuu, Cluvot-valmisteen antaminen on keskeytettävä heti ja asianmukainen hoito on aloitettava. Sokin voimassa olevat hoitosuositukset on huomioitava.
Haittavaikutukset lapsilla ja nuorilla
Lasten haittavaikutusten odotetaan olevan samanlaisia kuin aikuisten.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
- Säilytä jääkaapissa (2 °C – 8 °C).
- Ei saa jäätyä.
- Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
- Cluvot ei sisällä säilytysainetta. Valmiste on käytettävä välittömästi käyttökuntoon saattamisen jälkeen. Jos sitä ei käytetä heti, säilytysaika voi olla enintään 4 tuntia huoneenlämmössä. Käyttökuntoon saatettua liuosta ei saa säilyttää jääkaapissa eikä se saa jäätyä.
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä etiketissä ja ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen.
Pakkauksen sisältö ja muuta tietoa
Mitä Cluvot sisältää
Vaikuttava aine on:
Yksi injektiopullo sisältää 250 IU tai 1250 IU ihmisen hyytymistekijää XIII.
(IU = ky = kansainvälistä yksikköä)
Muut aineet ovat:
Ihmisen albumiini, glukoosimonohydraatti, natriumkloridi, natriumhydroksidi (pieninä määrinä pH:n säätöön)
Liuotin: Injektionesteisiin käytettävä vesi
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Cluvot on valkoinen kuiva-aine, jonka lisäksi pakkaus sisältää injektionesteisiin käytettävää vettä liuottimena käytettäväksi.
Käyttövalmiiksi sekoitetun liuoksen on oltava väritöntä ja kirkasta tai hieman opaalinhohtoista. Liuos ei saa valoa vasten katsottuna olla sameaa eikä sisältää jäämiä (sakkaa/hiukkasia).
Pakkaus
Yksi 250 IU:n pakkaus sisältää:
- yhden injektiopullon kuiva-ainetta
- yhden 4 ml injektionesteisiin käytettävää vettä sisältävän injektiopullon
- yhden suodattimella varustetun siirtolaitteen 20/20 (Mix2Vial)
Annostelutarvikkeet (sisälaatikko):
- 1 kertakäyttöinen 5 ml:n ruisku
- 1 laskimopunktiosetti
- 2 desinfektiopyyhettä
- 1 ei-steriili laastari
Yksi 1250 IU:n pakkaus sisältää:
- yhden injektiopullon kuiva-ainetta
- yhden 20 ml injektionesteisiin käytettävää vettä sisältävän injektiopullon
- yhden suodattimella varustetun siirtolaitteen 20/20 (Mix2Vial)
Annostelutarvikkeet (sisälaatikko):
- 1 kertakäyttöinen 20 ml:n ruisku
- 1 laskimopunktiosetti
- 2 desinfektiopyyhettä
- 1 ei-steriili laastari
Myyntiluvan haltija ja valmistaja
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg
Saksa
Lisätietoa tästä valmisteesta antaa myyntiluvan haltijan edustaja:
CSL Behring AB
Box 712
182 17 Danderyd
Ruotsi
Tämä pakkausseloste on tarkistettu viimeksi: 21.12.2018.
---------------------------------------------------------------------------------------
Ohjeet terveydenhuollon ammattilaiselle
Annostus
1 ml vastaa noin 62,5 IU:ta, ja 100 IU vastaa 1,6 ml:aa.
Tärkeää:
Annettava määrä ja antotiheys on aina sovitettava kullekin potilaalle yksilöllisen kliinisen tehon mukaan.
Annos
Annostus on yksilöllinen potilaan painon, laboratorioarvojen ja kliinisen tilan mukaan.
Annostus rutiiniluonteisessa estohoidossa
Aloitusannos
- 40 kansainvälistä yksikköä (IU) per painokilo (IU/kg)
- Injektionopeus ei saa ylittää 4 ml:aa minuutissa.
Seuraavat annokset
- Annos määritellään viimeisimmän pienimmän FXIII-aktiivisuuden perusteella, ja antotiheys on kerran 28 vuorokaudessa (4 viikossa), jotta pienimpänä FXIII-aktiivisuutena säilyy noin 5−20 %.
- Annosmuutossuosituksen ± 5 IU/kg pitää perustua taulukossa 1 esitettyyn pienimpään FXIII-aktiivisuuteen ja potilaan kliiniseen tilaan.
- Annosmuutokset on toteutettava FXIII-pitoisuuden spesifisen, herkän määrityksen perusteella. Taulukossa 1 esitetään esimerkki annosmuutoksesta standardin Berichrom®-aktiivisuusmäärityksen perusteella.
Taulukko 1. Annosmuutos Berichrom®-aktiivisuusmäärityksen perusteella
| Hyytymistekijän XIII pienin aktiivisuus (%) | Annosmuutos |
| Pienin pitoisuusmääritystulos kerran < 5 % | Suurenna 5 yksikköä/kg |
| Pienin pitoisuusmääritystulos 5-20 % | Ei muutosta |
| Pienin pitoisuusmääritystulos kaksi kertaa > 20 % | Pienennä 5 yksikköä/kg |
| Pienin pitoisuusmääritystulos kerran > 25 | Pienennä 5 yksikköä/kg |
Yksikköinä ilmoitettu teho on määritetty Berichrom®-aktiivisuusmäärityksellä, johon viitataan voimassa olevassa hyytymistekijän XIII kansainvälisessä standardissa. Yksikkö vastaa siten kansainvälistä yksikköä.
Estohoito ennen leikkausta
Jos potilaalle suunnitellaan leikkausta ja hän on saanut viimeisen tavanomaisen estohoitoannoksen:
- 21–28 vuorokauden kuluttua: potilaalle annetaan juuri ennen leikkausta koko estohoitoannos, ja seuraava estohoitoannos annetaan 28 vuorokauden kuluttua.
- 8–21 vuorokauden kuluttua: ennen leikkausta voidaan antaa lisäannos (koko annos tai osa-annos). Annos pitää määritellä potilaan FXIII-aktiivisuuden ja kliinisen tilan mukaan ja sovitettava Cluvot-valmisteen puoliintumisajan mukaan.
- 7 vuorokauden kuluessa viimeisimmästä annoksesta: lisäannosta ei välttämättä tarvita.
Annosmuutokset saattavat poiketa näistä suosituksista ja niiden pitää olla yksilöllisiä FXIII-aktiivisuuden ja potilaan kliinisen tilan mukaan. Kaikkia potilaita on seurattava tarkoin leikkauksen aikana ja sen jälkeen.
Näin ollen FXIII -aktiivisuuden lisääntymistä suositellaan seuraamaan FXIII:n määritysten avulla. Jos potilaalle tehdään suuri leikkaus ja verenvuodot ovat oletettavasti runsaita, tavoitteena on saavuttaa lähes normaaliarvot (terveet yksilöt: 70–140 %).
Pediatriset potilaat
Lapsille ja nuorille käytettävä annos ja antotapa perustuvat painoon, joten heihin voi yleensä soveltaa samoja ohjeita kuin aikuisiin. Annos ja/tai antotiheys on kussakin tapauksessa määritettävä kliinisen tehon ja FXIII-aktiivisuuden perusteella.
Iäkkäät potilaat
Iäkkäiden potilaiden (> 65-vuotiaiden) annostusta ja antotapaa ei ole dokumentoitu kliinisissä tutkimuksissa.
Antotapa
Yleiset ohjeet
- Liuoksen on oltava kirkasta tai hieman opaalinhohtoista. Kun käyttökuntoon saatettu valmiste on suodatettu/vedetty ruiskuun (ks. jäljempänä), se on tarkistettava ennen antoa silmämääräisesti, ettei liuoksessa ole hiukkasia tai värimuutoksia.
- Älä käytä liuosta, jos se on sameaa tai siinä on sakkaa tai hiukkasia.
- Valmisteen käyttökuntoon saattaminen ja vetäminen ruiskuun on tehtävä aseptisissa olosuhteissa.
Käyttökuntoon saattaminen
Anna liuottimen lämmetä huoneenlämpöiseksi. Varmista, että kuiva-aineen ja liuottimen sisältävien injektiopullojen irti napsautettavat flip-off-sulkimet on poistettu ja tulpat on käsitelty aseptisella liuoksella. Tulpan on sen jälkeen annettava kuivua ennen Mix2Vial-pakkauksen avaamista.
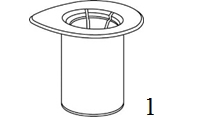 |
1. Avaa Mix2Vial-pakkaus vetämällä suojakansi pois. Älä ota Mix2Vial-laitetta pois pakkauksesta! |
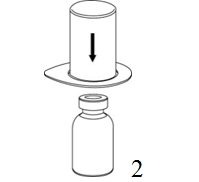 |
2. Aseta liuottimen sisältävä injektiopullo tasaiselle, puhtaalle alustalle ja ota injektiopullosta tukeva ote. Ota Mix2Vial sekä pakkaus ja paina sinisen sovittimen piikki suoraan liuotinpullon tulpan läpi. |
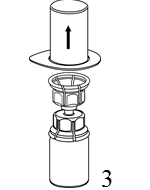 |
3. Poista pakkaus varovasti Mix2Vial-laitteesta siten, että pidät pakkauksen reunasta kiinni ja vedät kohtisuoraan ylöspäin. Varmista, että vedät pois vain pakkauksen etkä Mix2Vial-laitetta. |
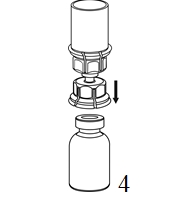 |
4. Aseta kuiva-aineen sisältävä injektiopullo tasaiselle ja tukevalle alustalle. Käännä liuotinpullo ja siihen kiinnitetty Mix2Vial ylösalaisin, ja paina läpinäkyvän sovittimen piikki suoraan kuiva-aineinjektiopullon tulpan läpi. Liuotin siirtyy automaattisesti kuiva-aineen sisältävään injektiopulloon. |
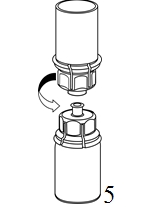 |
5. Ota toisella kädellä kiinni Mix2Vial-laitteen kuiva-aineen sisältävän injektiopullon puolelta ja toisella kädellä liuottimen sisältävän injektiopullon puolelta ja kierrä laite varovasti kahteen osaan. Hävitä liuotinpullo ja siihen kiinnitetty sininen Mix2Vial-sovitin. |
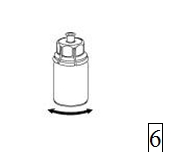 |
6. Pyörittele kuiva-aineinjektiopulloa ja siihen kiinnitettyä läpinäkyvää sovitinta, kunnes kuiva-aine on liuennut täysin. Ei saa ravistaa. |
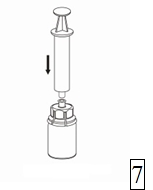 |
7. Vedä tyhjään, steriiliin ruiskuun ilmaa. Kun kuiva-aineen sisältävä injektiopullo on oikeinpäin, kiinnitä ruisku Mix2Vial-sovittimen Luer Lock liittimeen. Ruiskuta ilma kuiva-aineen sisältävään injektiopulloon. |
Valmisteen vetäminen ruiskuun ja anto
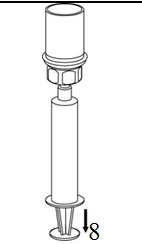 |
8. Kun ruiskun mäntä on alas painettuna, käännä laite ja injektiopullo ylösalaisin ja vedä liuos ruiskuun vetämällä mäntää hitaasti ulospäin. |
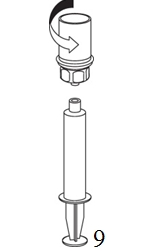 |
9. Kun liuos on nyt siirretty ruiskuun, ota tukeva ote ruiskun kammiosta (pitäen ruiskun mäntää samalla alaspäin) ja irrota ruiskusta läpinäkyvä Mix2Vial-sovitin. |
Veren pääsyä valmisteen sisältävään ruiskuun on vältettävä, koska tällöin on riski, että veri hyytyy ruiskuun ja potilas saattaa saada injektion mukana fibriinihyytymän.
Käyttökuntoon saatettu liuos on annettava hitaana injektiona/infuusiona laskimoon erillisellä injektio-/infuusiolaitteella (mukana pakkauksessa). Antonopeus ei saa ylittää 4 ml:aa minuutissa.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.