Pakkausseloste
BEXSERO injektionsvätska, suspension i förfylld spruta
Tilläggsinformation
Bexsero injektionsvätska, suspension i förfylld spruta
Meningokock grupp B‑vaccin (rDNA, komponent, adsorberat)
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du eller ditt barn börjar använda detta läkemedel. Den innehåller information som är viktig för dig eller ditt barn.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller sjuksköterska.
- Detta vaccin har ordinerats enbart åt dig eller ditt barn.
- Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Bexsero är och vad det används för
2. Vad du behöver veta innan du eller ditt barn använder Bexsero
3. Hur du använder Bexsero
4. Eventuella biverkningar
5. Hur Bexsero ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Bexsero är ett meningokock grupp B‑vaccin.
Bexsero innehåller fyra olika rekombinanta proteiner och komponenter från ytan på bakterien Neisseria meningitidis grupp B.
Bexsero ges till personer från 2 månaders ålder och hjälper till att skydda mot sjukdomar orsakade av bakterien Neisseria meningitidis grupp B. Denna bakterie kan orsaka allvarliga och ibland livshotande infektioner som t.ex. meningit (inflammation i hjärnans och ryggmärgens hinnor) och sepsis (blodförgiftning).
Vaccinet fungerar genom att stimulera kroppens naturliga försvarssystem på ett specifikt sätt hos den vaccinerade personen. Detta leder till skydd mot sjukdomen.
Vad du behöver veta innan produkten används
Använd INTE Bexsero
- om du eller ditt barn är allergisk(t) mot aktiva substanser eller något annat innehållsämne i detta vaccin (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Tala med läkare eller sjuksköterska innan du eller ditt barn använder Bexsero
- om du eller ditt barn har en kraftig infektion med hög feber. I så fall kommer vaccinationen att skjutas upp. Förekomsten av en smärre infektion, t.ex. förkylning, bör inte leda till att vaccinationen skjuts upp, men tala med läkare eller sjuksköterska först.
- om du eller ditt barn har blödarsjuka eller något annat problem som kan förhindra att blodet koagulerar ordentligt, t.ex. behandling med blodförtunnande medel (antikoagulantia). Tala med läkare eller sjuksköterska först.
- om du eller ditt barn får behandling som hämmar den del av immunförsvaret som kallas komplementaktivering, som exempelvis med ekulizumab. Även om du eller ditt barn har vaccinerats med Bexsero kommer du eller ditt barn ha en kvarstående ökad risk att drabbas av sjukdom orsakad av Neisseria meningitidis grupp B bakterier.
- om ditt barn föddes för tidigt (före eller under graviditetsvecka 28), i synnerhet om det hade andningssvårigheter. Andningsstillestånd eller oregelbunden andning under en kort tid kan vara vanligare hos dessa barn under de första tre dagarna efter vaccination och de kan behöva särskild övervakning.
- om du eller ditt barn har allergi mot kanamycin (antibiotika). Om det förekommer, är nivån av kanamycin i vaccinet låg. Om du eller ditt barn är allergiska mot kanamycin, tala med läkare eller sjuksköterska först.
Svimning, svimningskänsla eller andra stressrelaterade reaktioner kan inträffa som en reaktion på nålstick. Tala om för läkaren eller sjuksköterskan om du tidigare har upplevt den här typen av reaktion.
Det finns inga data på användningen av Bexsero på personer över 50 år. Det finns begränsade data på användningen av Bexsero hos patienter med kroniska medicinska tillstånd eller med nedsatt immunförsvar. Om du eller ditt barn har nedsatt immunförsvar (till exempel på grund av användning av immundämpande medicinering eller HIV‑infektion eller ärftliga defekter i kroppens naturliga försvarssystem) är det möjligt att effekten av Bexsero är reducerad.
Som för alla vacciner är det inte säkert att Bexsero ger fullständigt skydd hos alla som blir vaccinerade.
Andra läkemedel och Bexsero
Tala om för läkare eller sjuksköterska om du eller ditt barn tar, nyligen har tagit eller kan tänkas ta andra läkemedel, eller nyligen har fått något annat vaccin.
Bexsero kan ges samtidigt med andra vacciner såsom vaccin mot: difteri, stelkramp, kikhosta, Haemophilus influenzae typ b, polio, hepatit B, pneumokocker, mässling, påssjuka, röda hund, vattkoppor och meningokockinfektion serogrupp A, C, W, Y. Tala med läkare eller sjuksköterska för mer information.
När det ges samtidigt som andra vacciner måste Bexsero ges på ett separat injektionsställe.
Läkaren eller sjuksköterskan kan be dig att ge ditt barn mediciner som sänker feber när Bexsero har getts. Detta hjälper till att minska vissa av biverkningarna av Bexsero.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan Bexsero ges. Läkaren kan ändå rekommendera att du ska få Bexsero om du löper risk att exponeras för meningokockinfektion.
Körförmåga och användning av maskiner
Bexsero har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Vissa av de effekter som nämns i avsnitt Eventuella biverkningar ”Eventuella biverkningar” kan emellertid tillfälligt påverka förmågan att framföra fordon eller använda maskiner.
Bexsero innehåller natriumklorid
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per dos, dvs. är i stort sett ”natriumfritt”.
Hur produkten används
Bexsero (0,5 ml) ges till dig eller ditt barn av läkare eller sjuksköterska. Det injiceras i en muskel, oftast i låret på spädbarn eller i överarmen på barn, ungdomar och vuxna.
Det är viktigt att följa läkarens eller sjuksköterskans anvisningar så att du eller ditt barn genomför hela injektionsserien.
Spädbarn i åldrarna 2 till 5 månader vid tidpunkten för den första dosen
Ditt barn ska få en första omgång bestående av två eller tre injektioner av vaccinet, följt av en ytterligare injektion (boosterdos).
- Den första injektionen ska inte ges före 2 månaders ålder.
- Om tre doser ges i den första omgången ska intervallet mellan injektionerna vara minst 1 månad.
- Om två doser ges i den första omgången ska intervallet mellan injektionerna vara minst 2 månader.
- En boosterdos ges mellan 12 och 15 månaders ålder efter ett intervall på minst 6 månader efter den sista dosen i den första omgången. Vid försening bör boosterdosen inte ges senare än vid 24 månaders ålder.
Spädbarn i åldrarna 6 till 11 månader vid tidpunkten för den första dosen
Spädbarn i åldrarna 6 till 11 månader ska få två injektioner av vaccinet, följt av en ytterligare injektion (boosterdos).
- Intervallet mellan varje injektion ska vara minst 2 månader.
- En boosterdos ges under det andra levnadsåret efter ett intervall på minst 2 månader efter den andra injektionen.
Barn i åldrarna 12 till 23 månader vid tidpunkten för den första dosen
Barn i åldrarna 12 till 23 månader ska få två injektioner av vaccinet, följt av en ytterligare injektion (boosterdos).
- Intervallet mellan injektionerna ska vara minst 2 månader.
- En boosterdos ges efter ett intervall på 12 till 23 månader efter den andra injektionen.
Barn 2 till 10 år vid tidpunkten för den första dosen
Barn i åldrarna 2 till 10 år ska få två injektioner av vaccinet.
- Intervallet mellan varje injektion ska vara minst 1 månad.
Ditt barn kan få ytterligare en injektion (booster).
Ungdomar och vuxna från 11 års ålder vid tidpunkten för den första dosen
Ungdomar (från 11 års ålder) och vuxna ska få två injektioner av vaccinet.
- Intervallet mellan varje injektion ska vara minst 1 månad.
Du kan få ytterligare en injektion (booster).
Personer över 50 år
Det finns inga data för personer över 50 år. Rådgör med läkare om det kan vara till nytta för dig att få Bexsero.
Om du har ytterligare frågor om Bexsero, kontakta läkare eller sjuksköterska.
Eventuella biverkningar
Liksom alla vacciner kan detta vaccin orsaka biverkningar, men alla användare behöver inte få dem.
När Bexsero ges till dig eller ditt barn är de mycket vanliga biverkningarna (kan drabba fler än 1 av 10 personer) som du eller ditt barn kan få (rapporteras i samtliga åldersgrupper):
- smärta/ömhet på injektionsstället, hudrodnad på injektionsstället, svullnad i huden vid injektionsstället, förhårdnad i huden vid injektionsstället.
Följande biverkningar kan också förekomma efter att du eller barnet fått vaccinet.
Spädbarn och barn (upp till 10 år)
Mycket vanliga (kan drabba fler än 1 av 10 personer): feber (≥38 °C), minskad aptit, ömhet på injektionsstället (inklusive kraftig ömhet på injektionsstället som leder till att barnet skriker när man rör på den injicerade kroppsdelen), smärta i lederna, hudutslag (barn, 12 till 23 månaders ålder) (sällsynt efter boosterdosen), sömnighet, känsla av irritation, ovanligt skrikande, kräkningar (mindre vanliga efter boosterdos), diarré, huvudvärk.
Vanliga (kan drabba upp till 1 av 10 personer): hudutslag (spädbarn och barn, 2 till 10 års ålder).
Mindre vanliga (kan drabba upp till 1 av 100 personer): hög feber (≥40 °C), krampanfall (inklusive feberkramper), torr hud, blekhet (sällsynt efter boosterdos).
Sällsynta (kan drabba upp till 1 av 1 000 personer): Kawasakis sjukdom som kan omfatta symptom som feber som varar mer än fem dagar förknippat med hudutslag på bålen, vilket ibland följs av att huden på händer och fingrar flagar, svullna körtlar på halsen, röda ögon, läppar, hals och tunga, kliande utslag, hudutslag.
Ungdomar (från 11 år) och vuxna
Mycket vanliga (kan drabba fler än 1 av 10 personer): smärta på injektionsstället som leder till oförmåga att utföra normala dagliga aktiviteter, smärta i muskler och leder, illamående, allmän sjukdomskänsla, huvudvärk.
Följande biverkningar har rapporterats under användning efter marknadsintroduktion:
Förstorade lymfkörtlar
Allergiska reaktioner som kan omfatta kraftigt svullna läppar, mun, hals (som kan göra det svårt att svälja), andningssvårigheter med väsningar eller hosta, utslag, medvetslöshet och mycket lågt blodtryck.
Kollaps (plötsligt uppkommande muskelslapphet), mindre mottaglig än normalt eller nedsatt medvetande och blekhet eller blåaktig missfärgning av huden hos små barn.
Svimningskänsla eller svimning.
Hudutslag (ungdomar från 11 år och vuxna).
Feber (ungdomar från 11 år och vuxna). Reaktioner vid injektionsstället såsom omfattande svullnad av den vaccinerade kroppsdelen blåsor på eller runt injektionsstället och hård knöl vid injektionsstället (som kan bestå i mer än en månad).
Nackstelhet eller obehaglig ljuskänslighet (fotofobi) som tyder på retning av hjärnhinnor, har rapporterats sporadiskt kort efter vaccination; symtomen har varit av mild och övergående karaktär.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta vaccin utom syn‑ och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och på den förfyllda sprutan efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C – 8 °C). Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga läkare eller sjuksköterska hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
En dos (0,5 ml) innehåller:
Aktiva substanser:
| Rekombinant Neisseria meningitidis grupp B NHBA‑fusionsprotein 1, 2, 3 | 50 mikrogram |
| Rekombinant Neisseria meningitidis grupp B NadA‑protein 1, 2, 3 | 50 mikrogram |
| Rekombinant Neisseria meningitidis grupp B fHbp‑fusionsprotein 1, 2, 3 | 50 mikrogram |
| Yttre membranblåsor (outer membrane vesicles, OMV) från Neisseria meningitidis grupp B stam NZ98/254 uppmätt i form av mängden totalt protein innehållande PorA P1.4 2 | 25 mikrogram |
1 producerat i E. coli med rekombinant DNA‑teknologi
2 adsorberat på aluminium hydroxid (0,5 mg Al³+)
3 NHBA (heparinbindande Neisseriaantigen), NadA (Neisseria adhesin A), fHbp (faktor H‑bindande protein)
Övriga innehållsämnen:
Natriumklorid, histidin, sukros och vatten för injektionsvätskor (se avsnitt Vad du behöver veta innan produkten används för mer information om natrium).
Läkemedlets utseende och förpackningsstorlekar
Bexsero är en opalskimmrande suspension.
Bexsero tillhandahålls i en förfylld spruta innehållande 1 dos med eller utan separata nålar, i förpackningar om 1 eller 10 stycken.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning:
GSK Vaccines S.r.l.
Via Fiorentina 1
53100 Siena
Italien
Tillverkare:
GSK Vaccines S.r.l.
Bellaria‑Rosia
53018 Sovicille (Siena)
Italien
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Suomi/Finland
GlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Denna bipacksedel ändrades senast 9.5.2024
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats: http://www.ema.europa.eu.
Direktiv för experterna inom hälsovården
Efter förvaring kan en tunn vitaktig avlagring observeras i den förfyllda sprutan med suspensionen.
Skaka vaccinet noga före användning för att få en homogen suspension.
Vaccinet ska inspekteras visuellt för partiklar och missfärgning före administrering. Om några främmande partiklar och/eller variation i det fysiska utseendet observeras ska vaccinet inte administreras. Om två nålar av olika längd medföljer förpackningen ska lämplig nål väljas för att säkerställa intramuskulär administrering.
Får ej frysas.
Bexsero får inte blandas med andra vacciner i samma spruta.
Om samtidig administrering med andra vacciner skulle bli nödvändigt ska vaccinerna administreras på separata injektionsställen.
Var noga med att endast injicera detta vaccin intramuskulärt.
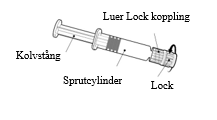
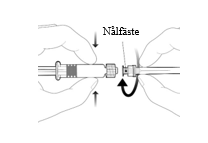
Instruktioner för den förfyllda sprutan
|
|
Håll alltid i sprutcylindern, inte i kolvstången. Skruva av locket på sprutan genom att vrida den motsols. |
|
|
Fäst nålen på sprutan genom att ansluta den till Luer Lock kopplingen och rotera ett kvarts varv medsols tills du känner att den låser sig. Dra inte ut kolvstången ur sprutcylindern, om detta sker ska vaccinet inte administreras. |
Destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.