Pakkausseloste
REFIXIA pulver och vätska till injektionsvätska, lösning 500 IU, 1000 IU, 2000 IU, 3000 IU
Tilläggsinformation
Refixia® 500 IE pulver och vätska till injektionsvätska, lösning
Refixia® 1 000 IE pulver och vätska till injektionsvätska, lösning
Refixia® 2 000 IE pulver och vätska till injektionsvätska, lösning
Refixia® 3 000 IE pulver och vätska till injektionsvätska, lösning
nonakog beta pegol
Utökad övervakning
▼ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar du eventuellt får. Information om hur du rapporterar biverkningar finns i slutet av avsnitt Eventuella biverkningar.
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Refixia® är och vad det används för
- Vad du behöver veta innan du använder Refixia®
- Hur du använder Refixia®
- Eventuella biverkningar
- Hur Refixia® ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Refixia® är
Refixia® innehåller den aktiva substansen nonakog beta pegol. Det är en långverkande version av faktor IX. Faktor IX är ett protein som finns naturligt i blodet och som hjälper till att stoppa blödningar.
Vad Refixia®används för
Refixia® används för att behandla och förebygga blödningar hos patienter i alla åldersgrupper med hemofili B (medfödd faktor IX-brist).
Hos patienter med hemofili B saknas eller fungerar inte faktor IX ordentligt. Refixia® ersätter det faktor IX som fungerar felaktigt eller saknas, och hjälper blodet att bilda koagel (levrat blod) där det blöder.
Vad du behöver veta innan produkten används
Använd inte Refixia®:
- om du är allergisk mot aktiv substans eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du är allergisk mot hamsterprotein.
Om du är osäker på om något av ovanstående gäller dig ska du tala med din läkare innan du använder detta läkemedel.
Varningar och försiktighet
Spårbarhet
Det är viktigt att du håller reda på Lot nummer på din Refixia®. Varje gång du får en ny förpackning med Refixia® ska du anteckna datum och Lot nummer (som finns på förpackningen efter Lot) och förvara denna information på en säker plats.
Allergiska reaktioner och utveckling av inhibitorer
Det finns en risk, fast det är sällsynt, att du får en plötslig och allvarlig allergisk reaktion (t ex anafylaktisk reaktion) mot Refixia®. Avbryt injektionen och kontakta din läkare eller en akutvårdsmottagning omedelbart om du uppvisar tecken på en allergisk reaktion såsom hudutslag, nässelutslag, klåda på stora områden av huden, röda och/eller svullna läppar, tunga, ansikte eller händer, svårighet att svälja eller andas, andnöd, väsande andning, trånghet i bröstet, blek och kall hud, hjärtklappning och/eller yrsel.
Din läkare kan behöva behandla dessa reaktioner omedelbart. Läkaren kan också ta ett blodprov för att kontrollera om du har utvecklat faktor IX-inhibitorer (neutraliserande antikroppar) mot ditt läkemedel, eftersom inhibitorer kan utvecklas tillsammans med allergiska reaktioner. Om du har sådana inhibitorer kan du ha en högre risk för plötsliga och allvarliga allergiska reaktioner (t ex anafylaktisk reaktion) under framtida behandlingar med faktor IX.
På grund av risken för allergiska reaktioner med faktor IX, ska den första behandlingen med Refixia® ges på en klinik eller i närvaro av sjukvårdspersonal med tillgång till lämplig medicinsk behandling för allergiska reaktioner om det skulle behövas.
Kontakta din läkare omedelbart om din blödning inte upphör som förväntat eller om du avsevärt måste öka den mängd av Refixia® du behöver för att stoppa en blödning. Din läkare kommer att ta ett blodprov för att kontrollera om du har utvecklat inhibitorer (neutraliserande antikroppar) mot Refixia®. Risken för att utveckla inhibitorer är som högst hos personer som inte tidigare behandlats med faktor IX-läkemedel, speciellt små barn.
Blodproppar
Tala om för din läkare om något av följande gäller för dig, eftersom det medför en ökad risk för blodproppar under behandling med Refixia®:
- du har nyligen blivit opererad
- du har en annan allvarlig sjukdom, t.ex. leversjukdom, hjärtsjukdom eller cancer
- du har riskfaktorer för hjärtsjukdom, t.ex. högt blodtryck, fetma eller rökning.
Njursjukdom (nefrotiskt syndrom)
Det finns en risk, fast det är sällsynt, för att utveckla en specifik njursjukdom som kallas ”nefrotiskt syndrom” efter höga doser av faktor IX hos patienter med hemofili B med faktor IX-inhibitorer och allergiska reaktioner i sjukdomshistorien.
Kateterrelaterade problem
Om du har ett hjälpmedel för central intravenös tillförsel kan det uppstå infektioner eller blodproppar där katetern sitter.
Andra läkemedel och Refixia®
Tala om för läkare om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder Refixia®.
Körförmåga och användning av maskiner
Refixia® påverkar inte körförmågan och förmågan att använda maskiner.
Refixia® innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per injektionsflaska, dvs. det är näst intill ”natriumfritt”. Vid behandling med flera injektionsflaskor ska den totala natriumhalten beaktas.
Hur produkten används
Behandling med Refixia® påbörjas av läkare med erfarenhet av att behandla patienter med hemofili B. Använd alltid detta läkemedel exakt enligt anvisningar från läkare. Rådfråga läkare om du är osäker på hur du ska använda Refixia®.
Läkaren beräknar rätt dos åt dig. Dosen beror på din vikt och vad läkemedlet används för.
Förebyggande av blödning
Den vanliga dosen Refixia® är 40 internationella enheter (IE) per kg kroppsvikt. Den ges som en injektion varje vecka. Din läkare kan välja en annan dos eller ändra hur ofta injektionerna ska ges baserat på ditt behov.
Behandling av blödning
Den vanliga dosen Refixia® är 40 internationella enheter (IE) per kg kroppsvikt. Beroende på var det blöder och hur allvarlig blödningen är, kan du behöva en högre dos (80 IE per kg) eller extra injektioner. Tala med din läkare om vilken dos och hur många injektioner du behöver.
Användning för barn och ungdomar
Refixia® kan användas till barn och ungdomar i alla åldrar. Dosen till barn och ungdomar beräknas också utifrån kroppsvikt och är samma dos som till vuxna.
Hur Refixia® ges
Refixia® finns tillgängligt som pulver och spädningsvätska som blandas till en lösning (beredning) och ges i form av en injektion i en ven. Se ”Bruksanvisning för Refixia®” för mer information.
Om du har använt för stor mängd av Refixia®
Om du har använt för stor mängd Refixia®, ska du kontakta din läkare.
Om du avsevärt måste öka den mängd av Refixia® som du behöver för att stoppa en blödning, ska du omedelbart kontakta läkare. För mer information, se avsnitt Vad du behöver veta innan produkten används ”Allergiska reaktioner och utveckling av inhibitorer”.
Om du har glömt att använda Refixia®
Om du har glömt en dos, ska du injicera den missade dosen så snart du kommer på det. Injicera inte dubbel dos för att kompensera för glömd dos. Rådfråga läkare om du är osäker.
Om du slutar att använda Refixia®
Om du slutar att använda Refixia® är det möjligt att du inte längre är skyddad mot blödningar eller att en pågående blödning inte upphör. Sluta inte att använda Refixia® utan att först tala med din läkare.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Allergiska reaktioner kan förekomma med detta läkemedel.
Om plötsliga och allvarliga allergiska reaktioner (t ex anafylaktiska reaktioner) uppstår måste injektionen omedelbart avbrytas. Du måste omedelbart kontakta läkare eller en akutvårdsmottagning om du får ett tidigt symtom på en allvarlig allergisk reaktion (anafylaktisk reaktion), såsom:
- svårt att svälja eller andas
- andnöd eller väsande andning
- trånghet i bröstet
- röda och/eller svullna läppar, tunga, ansikte eller händer
- hudutslag, nässelutslag eller klåda
- blek och kall hud, snabba hjärtslag och/eller yrsel (lågt blodtryck).
Hos barn som inte tidigare behandlats med faktor IX-läkemedel kan inhibitorer (se avsnitt Vad du behöver veta innan produkten används) bildas som vanligt förekommande (upp till 1 av 10 patienter). Om detta händer kan läkemedlet sluta att fungera ordentligt och ditt barn kan uppleva ihållande blödning. Om detta händer ska du omedelbart kontakta din läkare.
Följande biverkningar har observerats med Refixia®:
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 användare)
- allergiska reaktioner (överkänslighet). De kan bli allvarliga och potentiellt livshotande (anafylaktiska reaktioner)
- klåda
- hudreaktioner vid injektionsstället
- illamående
- extrem trötthet
- utslag
- barn som inte tidigare behandlats med faktor IX-läkemedel: neutraliserande antikroppar (inhibitorer), anafylaktiska reaktioner
Mindre vanliga biverkningar (kan förekomma hos upp till 1 av 100 användare)
- hjärtklappning
- blodvallning.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Använd Refixia® före utgångsdatum som anges efter ”EXP” på kartongen och på injektionsflaskans och den förfyllda sprutans etikett. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C – 8 °C). Får ej frysas. Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
Refixia® kan tas ut ur kylskåpet i en period på upp till 1 år och förvaras vid rumstemperatur (högst 30 °C). Anteckna datumet på kartongen då Refixia® tas ut ur kylskåpet och placeras i rumstemperatur. Det nya utgångsdatumet ska aldrig överskrida det ursprungliga utgångsdatum som anges på ytterkartongen. Om läkemedlet inte har använts före det nya utgångsdatumet ska det kasseras. Efter förvaring i rumstemperatur får läkemedlet inte sättas tillbaka in i kylskåpet.
Använd injektionen omedelbart efter att du gjort i ordning lösningen (beredningen). Om den inte kan användas omedelbart, använd den inom 24 timmar om den förvaras i kylskåp vid 2 °C – 8 °C eller inom 4 timmar om den förvaras utanför kylskåpet vid en temperatur på högst 30 °C.
Pulvret i injektionsflaskan är vitt till benvitt. Använd inte pulvret om färgen har ändrats.
Den beredda lösningen ska vara klar och färglös till svagt gul. Använd inte den beredda lösningen om du ser partiklar i lösningen eller om lösningen är missfärgad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är nonakog beta pegol (pegylerad human koagulationsfaktor IX (rDNA)). Varje injektionsflaska med Refixia® innehåller nominellt 500 IE, 1 000 IE, 2 000 IE eller 3 000 IE nonakog beta pegol vilket motsvarar cirka 125 IE/ml, 250 IE/ml, 500 IE/ml respektive 750 IE/ml efter beredning med histidinspädningsvätska.
- Övriga innehållsämnen i pulvret är natriumklorid, histidin, sackaros, polysorbat 80, mannitol, natriumhydroxid och saltsyra. Om du äter en natriumkontrollerad diet, se avsnitt Vad du behöver veta innan produkten används ”Refixia® innehåller natrium”.
- Innehållsämnen i den sterila spädningsvätskan är histidin, vatten för injektionsvätskor, natriumhydroxid och saltsyra.
Läkemedlets utseende och förpackningsstorlekar
- Refixia® tillhandahålls i form av ett pulver och vätska till injektionsvätska, lösning (500 IE, 1 000 IE, 2 000 IE eller 3 000 IE pulver i en injektionsflaska och 4 ml spädningsvätska i en förfylld spruta, en kolvstång med en adapter för injektionsflaska – förpackningsstorlek 1 st).
- Pulvret är vitt till benvitt och spädningsvätskan är klar och färglös.
Innehavare av godkännande för försäljning och tillverkare
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd, Danmark
Denna bipacksedel ändrades senast 9/2025
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats: http://www.ema.europa.eu.
Refixia® är ett varumärke som ägs av Novo Nordisk Health Care AG, Schweiz
© 2025
Novo Nordisk A/S
Direktiv för användaren
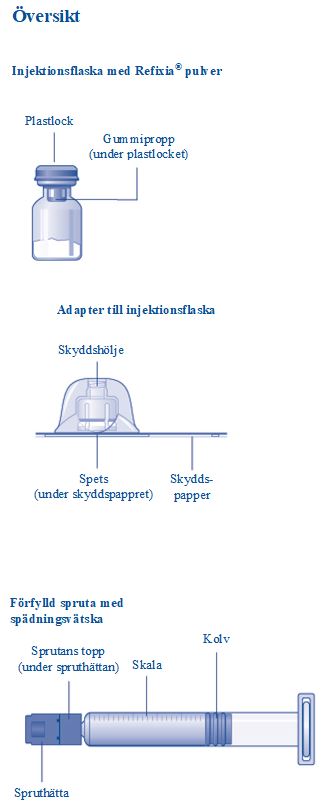
Bruksanvisning för Refixia® Läs dessa anvisningar noga innan du börjar använda Refixia®. Refixia® tillhandahålls i form av ett pulver. Före injektion måste en lösning göras i ordning (beredas) med spädningsvätskan som finns i sprutan. Spädningsvätskan är en histidinlösning. Den färdigberedda lösningen måste injiceras i en ven (intravenös (i.v.) injektion). Utrustningen i förpackningen är utformad för att användas till att bereda lösning och injicera Refixia®. Du behöver också ett infusionsset (slang med butterflynål), sterila desinfektionstorkar, kompresser och plåster. Dessa ingår inte i förpackningen med Refixia®. Använd inte utrustningen innan du fått upplärning av läkare eller sjuksköterska. Tvätta alltid händerna och se till att området runt omkring dig är rent. När du bereder och injicerar läkemedel direkt i en ven är det viktigt att använda en teknik så att renhet och bakteriefrihet bibehålls (aseptisk teknik). Felaktig hantering kan släppa in bakterier som kan infektera blodet. Öppna inte utrustningen förrän du är klar att använda den. Använd inte utrustningen om den har tappats eller skadats. Använd en ny förpackning i stället. Använd inte utrustningen om utgångsdatum har passerat. Använd en ny förpackning i stället. Utgångsdatum finns tryckt på ytterkartongen, injektionsflaskan, adaptern för injektionsflaskan och på den förfyllda sprutan. Använd inte utrustningen om du misstänker att den är förorenad. Använd en ny förpackning i stället. Kasta inte bort någon del av utrustningen innan du injicerat den beredda lösningen. Utrustningen är endast för engångsbruk. | |
Innehåll Förpackningen innehåller:
| |
1. Förbered injektionsflaskan och sprutan
| 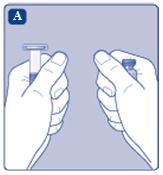 |
|  |
2. Sätta på adaptern
| 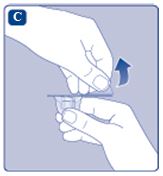 |
|  |
|  |
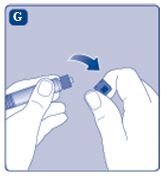
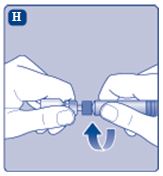
3. Sätta fast kolvstången på sprutan
| 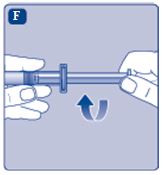 |
|  |
|  |
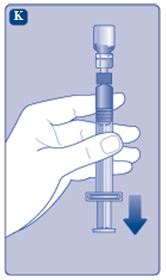
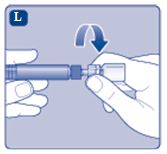
4. Lös upp pulvret i spädningsvätskan
|  |
|  |
Omedelbar användning av den beredda lösningen av Refixia® rekommenderas. Om den får stå, kan läkemedlet förlora sin sterilitet och orsaka infektioner. Om du inte kan använda den beredda lösningen av Refixia® omedelbart, ska den användas inom 4 timmar vid förvaring i rumstemperatur (vid högst 30 °C) och inom 24 timmar vid förvaring i kylskåp (2 °C – 8 °C). Förvara den beredda lösningen i injektionsflaskan. Frys inte den beredda lösningen av Refixia® och förvara den inte i injektionssprutor. Skydda den beredda lösningen av Refixia® mot direkt ljus.
| |
|  |
|  |
5. Injicera den beredda lösningen Refixia® är nu klar att injiceras i en ven.
Injicering av Refixia® via nålfria kopplingar för intravenösa (i.v.) katetrar Observera: Den förfyllda sprutan är av glas och utformad för att passa till standard luer-lock kopplingar. Vissa nålfria kopplingar med en inre spets passar inte med den förfyllda sprutan. Detta kan hindra administrering av läkemedlet och/eller resultera i att den nålfria kopplingen skadas. Injicering av lösning via ett hjälpmedel för central intravenös tillförsel såsom central venkateter eller subkutan port:
| |
Avfall
| 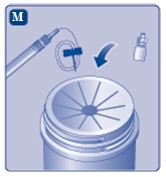 |
Ta inte isär utrustningen innan du kasserar den. Återanvänd inte utrustningen. | |