Pakkausseloste
HYRIMOZ injektionsvätska, lösning i förfylld spruta 20 mg
Tilläggsinformation
Hyrimoz 20 mg injektionsvätska, lösning i förfylld spruta
adalimumab
20 mg/0,2 ml
Allmänna direktiv
Läs noga igenom denna bipacksedel innan ditt barn börjar använda detta läkemedel. Den innehåller information som är viktig.
- Spara denna information, du kan behöva läsa den igen.
- Läkaren kommer även att ge ditt barn ett Patientkort, som innehåller viktig säkerhetsinformation som du måste vara medveten om innan ditt barn börjar använda Hyrimoz och under behandling med Hyrimoz. Behåll detta Patientkort under hela behandlingen och i ytterligare 4 månader efter att ditt barn fått den sista injektionen med Hyrimoz.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt ditt barn. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar ditt barns.
- Om ditt barn får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Hyrimoz är och vad det används för
2. Vad du behöver veta innan ditt barn använder Hyrimoz
3. Hur du använder Hyrimoz
4. Eventuella biverkningar
5. Hur Hyrimoz ska förvaras
6. Förpackningens innehåll och övriga upplysningar
7. Användarinstruktion
Vad produkten är och vad den används för
Hyrimoz innehåller den aktiva substansen adalimumab, som påverkar kroppens immunförsvar.
Hyrimoz är avsett för behandling av följande inflammatoriska sjukdomar:
- polyartikulär juvenil idiopatisk artrit,
- entesitrelaterad artrit,
- plackpsoriasis hos barn och ungdomar,
- Crohns sjukdom hos barn och ungdomar,
- uveit utan infektion hos barn och ungdomar.
Den aktiva substansen i Hyrimoz, adalimumab, är en monoklonal antikropp från människa. Monoklonala antikroppar är proteiner som fäster vid ett specifikt mål i kroppen.
Målet för adalimumab är ett protein som kallas tumörnekrosfaktor (TNFα), som förekommer i immunförsvaret och finns i förhöjda halter vid de inflammatoriska sjukdomar som anges ovan. Genom att binda till TNFα, kan Hyrimoz minska inflammationen vid dessa sjukdomar.
Polyartikulär juvenil idiopatisk artrit
Polyartikulär juvenil idiopatisk artrit är en inflammatorisk sjukdom i lederna.
Hyrimoz används för att behandla polyartikulär juvenil idiopatisk artrit hos barn och ungdomar 2 till 17 år. Patienten kan först få andra sjukdomsmodifierande läkemedel, såsom metotrexat. Om dessa läkemedel inte har tillräcklig effekt kan patienten få Hyrimoz som behandling av polyartikulär juvenil idiopatisk artrit.
Entesitrelaterad artrit
Entesitrelaterad artrit är en inflammatorisk sjukdom i lederna och de platser där senorna fäster på skelettet.
Hyrimoz används för att behandla entesitrelaterad artrit hos barn och ungdomar i åldrarna 6 till 17 år.
Patienten kan först få andra sjukdomsmodifierande läkemedel, såsom metotrexat.
Om dessa läkemedel inte har tillräcklig effekt kan patienten få Hyrimoz som behandling av entesitrelaterad artrit.
Plackpsoriasis hos barn och ungdomar
Plackpsoriasis är en inflammatorisk hudsjukdom som orsakar röda, flagiga och torra plack på huden som täcks av silvriga fjäll. Plackpsoriasis kan också involvera naglarna, som då kan smula sönder, bli tjockare och lyfta från nagelbädden, vilket kan vara smärtsamt. Psoriasis tros orsakas av en störning i kroppens immunsystem som leder till en ökad produktion av hudceller.
Hyrimoz används för att behandla svår plackpsoriasis hos barn och ungdomar 4–17 år där lokal behandling på huden och UV‑ljusbehandling inte har haft tillräcklig effekt eller inte är lämpligt.
Crohns sjukdom hos barn och ungdomar
Crohns sjukdom är en inflammatorisk tarmsjukdom.
Hyrimoz används för att behandla måttlig till svår Crohns sjukdom hos barn och ungdomar 6–17 år.
Ditt barn kan först få andra läkemedel. Om dessa läkemedel inte hjälper tillräckligt kommer ditt barn att få Hyrimoz för att minska symtomen på sjukdomen.
Uveit utan infektion hos barn och ungdomar
Uveit är en inflammatorisk sjukdom som påverkar vissa delar av ögat. Inflammationen kan leda till försämrad syn och/eller förekomst av floaters i ögat (svarta prickar eller tunna linjer som rör sig över synfältet). Hyrimoz verkar genom att minska denna inflammation.
Hyrimoz används för att behandla barn från 2 års ålder med kronisk uveit utan infektion där inflammationen påverkar främre delen av ögat
Ditt barn kan först få andra läkemedel. Om dessa läkemedel inte hjälper tillräckligt kommer ditt barn att få Hyrimoz för att minska symtomen på sjukdomen.
Vad du behöver veta innan produkten används
Använd inte Hyrimoz
- om ditt barn är allergiskt mot adalimumab eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om ditt barn har en allvarlig infektion, inklusive tuberkulos, sepsis (blodförgiftning) eller någon annan typ av opportunistisk infektion (sällsynta infektioner som kan uppstå vid nedsatt immunförsvar). Det är viktigt att du talar om för läkaren om ditt barn visar symtom på infektioner, t.ex. feber, sår, trötthetskänsla, tandproblem (se ”Varningar och försiktighet”).
- om ditt barn har måttlig eller svår hjärtsvikt. Det är viktigt att berätta för läkaren om ditt barn har eller har haft en allvarlig hjärtåkomma (se ”Varningar och försiktighet”).
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder Hyrimoz.
Allergisk reaktion
- Om ditt barn får allergiska reaktioner med symtom såsom trånghetskänsla i bröstet, väsande andning, yrsel, svullnad eller utslag, ska du sluta injicera Hyrimoz och kontakta din läkare omgående eftersom dessa reaktioner i sällsynta fall kan vara livshotande.
Infektioner
- Om ditt barn har någon infektion, inklusive kroniska infektioner eller lokala infektioner (t.ex. bensår) måste du rådgöra med läkaren innan ditt barn börjar med Hyrimoz. Om du är osäker, kontakta läkaren.
- Ditt barn kanske lättare får infektioner under behandlingen med Hyrimoz. Denna risk kan öka om ditt barn har nedsatt lungfunktion. Dessa infektioner kan vara allvarliga och omfatta tuberkulos, infektioner orsakade av virus, svamp, parasiter eller bakterier eller andra sällsynta smittämnen, eller sepsis (blodförgiftning). I sällsynta fall kan dessa infektioner bli livshotande. Det är viktigt att berätta för läkaren om ditt barn visar symtom såsom feber, sår, trötthetskänsla eller tandbesvär. Läkaren kan råda ditt barn att tillfälligt sluta använda Hyrimoz.
Tuberkulos
- Eftersom fall av tuberkulos har rapporterats hos patienter som behandlats med adalimumab, kommer läkaren att undersöka ditt barn avseende tecken och symtom på tuberkulos innan behandling med Hyrimoz påbörjas. Det innebär en grundlig sjukdomshistoria och screeningundersökningar (t.ex. lungröntgen och en tuberkulintest). Utförandet och resultaten av dessa tester ska anges på ditt barns patientkort. Det är mycket viktigt att du berättar för läkaren om ditt barn någonsin har haft tuberkulos, eller om barnet har varit in nära kontakt med någon som har haft tuberkulos. Tuberkulos kan utvecklas under behandling även om ditt barn har fått förebyggande behandling. Om symtom på tuberkulos (ihållande hosta, viktminskning, brist på energi, lätt feber), eller om någon annan infektion uppkommer under eller efter behandlingen, måste du genast berätta detta för läkaren.
Resor/återkommande infektioner
- Tala om för läkaren om ditt barn har bott eller rest i regioner där svampinfektioner såsom histoplasmos, koccidioidomykos eller blastomykos är mycket vanliga.
- Tala om för läkaren om ditt barn tidigare har haft problem med återkommande infektioner eller andra åkommor som ökar risken för infektioner.
Hepatit B‑virus
- Tala om för läkaren om ditt barn är bärare av hepatit B virus (HBV), om ditt barn har en aktiv HBV‑ infektion eller om du tror att ditt barn löper risk att få HBV. Läkaren bör testa ditt barn för Hepatit B. Adalimumab kan reaktivera HBV‑infektionen hos personer som bär på detta virus. I vissa sällsynta fall, speciellt ifall ditt barn tar andra läkemedel som hämmar immunförsvaret, kan reaktivering av HBV‑infektionen vara livshotande.
Operationer eller tandingrepp
- Om ditt barn ska genomgå en operation eller ett tandingrepp inom kort, ska du informera läkaren om att ditt barn tar Hyrimoz. Läkaren kan råda ditt barn att tillfälligt sluta använda Hyrimoz.
Demyeliniserande sjukdom
- Om ditt barn har eller utvecklar en demyeliniserande sjukdom (en sjukdom som påverkar det skyddande skiktet runt nerverna) såsom multipel skleros (MS), kommer läkaren att göra en bedömning om ditt barn kan få eller ska fortsätta behandlas med Hyrimoz. Berätta omedelbart för läkaren om ditt barn upplever symtom så som ändringar i synen, svaghet i armar eller ben, eller domningar eller stickningar någonstans på kroppen.
Vaccin
- Vissa vacciner innehåller levande men försvagade bakterier eller virus, och sådana vacciner ska inte ges under behandlingen med Hyrimoz eftersom det kan leda till infektioner. Kontrollera med läkaren innan ditt barn vaccineras. Det rekommenderas att barn, om möjligt, får alla vaccin som de ska ha enligt riktlinjerna för deras ålder innan behandlingen påbörjas.
- Om din dotter behandlas med Hyrimoz under en graviditet, så kan hennes nyfödda barn ha en ökad risk för att få en infektion i upp till fem månader efter den sista dosen din dotter fick under graviditeten. Det är viktigt att du berättar för barnläkaren och annan sjukvårdspersonal att din dotter har använt Hyrimoz under sin graviditet så att de kan avgöra när hennes nyfödda barn ska vaccineras.
Hjärtsvikt
- Det är viktigt att tala om för läkaren om ditt barn har eller har haft en allvarlig hjärtåkomma. Om ditt barn har mild hjärtsvikt och behandlas med Hyrimoz, måste hjärtproblemen övervakas noggrant av läkaren. Om ditt barn utvecklar nya symtom eller om symtomen på hjärtsvikt förvärras (t.ex. andfåddhet eller svullna fötter), måste du kontakta läkaren omedelbart.
Feber, blåmärken, blödningar eller blekhet
- Hos vissa patienter klarar inte kroppen att tillverka tillräckligt av de blodceller som bekämpar infektioner eller stoppa blödningar. Om ditt barn får feber som inte går ner, lätt får blåmärken, lätt blöder eller ser mycket blek ut ska du omedelbart ringa läkaren. Läkaren kan då besluta att behandlingen ska avbrytas.
Cancer
- Mycket sällsynta fall av vissa cancertyper har förekommit hos barn och vuxna som behandlas med adalimumab eller andra TNFα‑blockerare. Patienter med svårare reumatoid artrit som har haft sjukdomen under längre tid kan ha en förhöjd risk att utveckla lymfom och leukemi (cancertyper som påverkar blodkropparna och benmärgen). Om ditt barn behandlas med Hyrimoz kanske risken ökar för att utveckla lymfom, leukemi eller annan cancertyp. Vid sällsynta tillfällen har en specifik och allvarlig typ av lymfom observerats hos patienter som använder adalimumab. Vissa av dessa patienter behandlades också med läkemedlen azatioprin eller merkaptopurin. Berätta för läkaren om ditt barn tar azatioprin eller merkaptopurin tillsammans med Hyrimoz.
- Fall av icke‑melanom hudcancer har förekommit hos patienter som behandlas med adalimumab. Om nya områden med hudskador uppstår under eller efter behandling eller om befintliga märken eller skadade områden ändrar utseende, ska du berätta detta för läkaren.
- Andra cancerformer än lymfom har i vissa fall rapporterats hos patienter med lungsjukdomen kronisk obstruktiv lungsjukdom (KOL) som behandlats med en annan TNFα‑blockerare. Om ditt barn har KOL, eller är storrökare, ska du diskutera med läkaren huruvida behandling med TNFα‑blockerare är lämpligt.
Autoimmuna sjukdomar
- I sällsynta fall kan behandling med Hyrimoz ge ett lupusliknande syndrom. Kontakta läkaren om symtom som ihållande, oförklarliga utslag, feber, ledsmärta eller trötthet uppstår.
Barn och ungdomar
- Ge inte Hyrimoz till barn som har polyartikulär juvenil idiopatisk artrit och är under 2 år.
- Ge inte Hyrimoz till barn som har plackpsoriasis eller ulcerös kolit och är under 4 år.
- Ge inte Hyrimoz till barn som har Crohns sjukdom och är under 6 år.
- Använd inte den förfyllda sprutan med 40 mg för lägre doser än just 40 mg.
Andra läkemedel och Hyrimoz
Tala om för läkare eller apotekspersonal om ditt barn tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Hyrimoz kan tas tillsammans med metotrexat eller vissa sjukdomsmodifierande anti‑reumatiska medel (sulfasalazin, hydroxiklorokin, leflunomid och guldberedningar för injektion), kortikosteroider eller smärtstillande läkemedel, inklusive icke‑steroida anti‑inflammatoriska läkemedel (NSAID).
Ditt barn ska inte använda Hyrimoz tillsammans med läkemedel som innehåller de aktiva substanserna anakinra eller abatacept eftersom det ökar risken för allvarliga infektioner. Kombinationen av adalimumab eller andra TNF‑antagonister och anakinra eller abatacept rekommenderas inte eftersom det kan öka risken för infektioner, inklusive allvarliga infektioner och andra eventuella effekter. Om du har frågor, kontakta läkare.
Graviditet och amning
- Din dotter bör överväga att använda adekvat preventivmetod för att förhindra graviditet vid användning av Hyrimoz och fortsätta använda det i minst 5 månader efter den sista behandlingen med Hyrimoz.
- Om din dotter är gravid, tror att hon kan vara gravid eller planerar att skaffa barn ska du rådfråga läkaren innan hon använder detta läkemedel.
- Hyrimoz ska endast användas under graviditet om det behövs.
- Enligt en graviditetsstudie fanns ingen ökad risk för fosterskador när mamman hade fått adalimumab under graviditeten jämfört med mammor med samma sjukdom som inte använt adalimumab.
- Hyrimoz kan användas under amning.
- Om din dotter får Hyrimoz under sin graviditet, så kan hennes nyfödda barn ha en ökad risk för att få en infektion.
- Det är viktigt att du berättar för barnläkaren och annan sjukvårdspersonal att din dotter har använt Hyrimoz under graviditeten innan hennes nyfödda barn ska vaccineras. (För mer information om vacciner se avsnittet ”Varningar och försiktighet”).
Körförmåga och användning av maskiner
Hyrimoz kan ha en liten påverkan på ditt barns förmåga att köra bil, cykla eller använda maskiner. En känsla av att rummet snurrar (svindel) samt synstörningar kan inträffa när Hyrimoz används.
Hyrimoz innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per 0,2 ml dos, och är näst intill ’natriumfritt’.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
De rekommenderade doserna av Hyrimoz för varje godkänt användningsområde visas i tabellen nedan. Läkaren kan förskriva en annan styrka av Hyrimoz om ditt barn behöver en annan dosering.
| Polyartikulär juvenil idiopatisk artrit | ||
| Ålder eller kroppsvikt | Hur mycket och hur ofta ska läkemedlet tas? | Anmärkningar |
| Barn (från 2 års ålder), ungdomar och vuxna som väger 30 kg eller mer | 40 mg varannan vecka | Ej aktuellt |
| Barn (från 2 års ålder), ungdomar som väger från 10 kg till mindre än 30 kg | 20 mg varannan vecka | Ej aktuellt |
| Entesitrelaterad artrit | ||
| Ålder eller kroppsvikt | Hur mycket och hur ofta ska läkemedlet tas? | Anmärkningar |
| Barn (från 6 års ålder), ungdomar och vuxna som väger 30 kg eller mer | 40 mg varannan vecka | Ej aktuellt |
| Barn (från 6 års ålder), ungdomar som väger från 15 kg till mindre än 30 kg | 20 mg varannan vecka | Ej aktuellt |
| Plackpsoriasis hos barn och ungdomar | |||
| Ålder eller kroppsvikt | Hur mycket och hur ofta ska läkemedlet tas? | Anmärkningar | |
| Barn och ungdomar 4–17 år som väger 30 kg eller mer | Startdos på 40 mg, följt av 40 mg en vecka senare. Därefter är den vanliga dosen 40 mg varannan vecka. | Ej aktuellt | |
| Barn och ungdomar 4–17 år som väger från 15 kg till mindre än 30 kg | Startdos på 20 mg, följt av 20 mg en vecka senare. Därefter är den vanliga dosen 20 mg varannan vecka. | Ej aktuellt | |
| Crohns sjukdom hos barn och ungdomar | |||
| Ålder eller kroppsvikt | Hur mycket och hur ofta ska läkemedlet tas? | Anmärkningar | |
| Barn och ungdomar 6–17 år som väger 40 kg eller mer | Startdos på 80 mg, följt av 40 mg två veckor senare. Om ett snabbare svar behövs kan läkaren ordinera en startdos på 160 mg följt av 80 mg två veckor senare. Därefter är den vanliga dosen 40 mg varannan vecka. | Om dosen inte har tillräcklig effekt kan läkaren öka dosen till 40 mg varje vecka eller 80 mg varannan vecka. | |
| Barn och ungdomar 6–17 år som väger mindre än 40 kg | Startdos på 40 mg, följt av 20 mg varannan vecka med början två veckor senare. Om ett snabbare svar behövs kan läkaren ordinera en startdos på 80 mg följt av 40 mg två veckor senare. Därefter är den vanliga dosen 20 mg varannan vecka. | Om dosen inte har tillräcklig effekt kan läkaren öka dosen till 20 mg varje vecka. | |
| Uveit utan infektion hos barn och ungdomar | |||
| Ålder eller kroppsvikt | Hur mycket och hur ofta ska läkemedlet tas? | Anmärkningar | |
| Barn och ungdomar från 2 års ålder som väger 30 kg eller mer | 40 mg varannan vecka | Läkaren kan också ordinera en startdos på 80 mg som ges en vecka före start av den vanliga dosen på 40 mg varannan vecka. Hyrimoz rekommenderas att användas tillsammans med metotrexat. | |
| Barn och ungdomar från 2 års ålder som väger mindre än 30 kg | 20 mg varannan vecka | Läkaren kan också ordinera en startdos på 40 mg som ges en vecka före start av den vanliga dosen på 20 mg varannan vecka. Hyrimoz rekommenderas att användas tillsammans med metotrexat. | |
Hur Hyrimoz ges
Hyrimoz ges via en injektion under huden (subkutant).
Detaljerade instruktioner om hur Hyrimoz ska injiceras finns i avsnitt 7, ”Användarinstruktion”.
Om du använt mer Hyrimoz än du borde
Om du råkar injicera Hyrimoz oftare än vad ditt barn har ordinerats, kontakta läkare eller apotekspersonal och berätta att ditt barn har fått för mycket av läkemedlet. Ta alltid med dig den yttre kartongen, även om den är tom.
Om du har glömt att använda Hyrimoz
Om du glömmer bort att ge ditt barn en injektion, ska du injicera nästa dos av Hyrimoz så snart du kommer ihåg det. Ge sedan ditt barn nästa dos på den bestämda dagen som du skulle ha gjort, om du inte hade glömt bort en dos.
Om du slutar att använda Hyrimoz
Beslutet att sluta använda Hyrimoz ska diskuteras med ditt barns läkare. Ditt barns symtom kan återkomma då behandlingen avslutas.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem. De flesta biverkningar är milda till måttliga. Vissa kan emellertid vara allvarliga och kräva behandling. Biverkningar kan uppträda upp till minst 4 månader, eller ännu senare, efter den sista Hyrimoz‑injektionen.
Sök vård omedelbart om du upplever något av följande tecken på allergisk reaktion eller hjärtsvikt:
- allvarliga utslag, nässelutslag;
- svullet ansikte, svullna händer, fötter;
- ansträngd andning, svårt att svälja;
- andnöd vid fysisk aktivitet eller i liggande position eller om fötterna svullnar.
Berätta för din läkare så fort som möjligt om du märker något av följande:
- tecken och symtom på infektion såsom feber, illamående, sår, tandproblem, brännande känsla då man kissar, svaghets‑ eller trötthetskänsla eller hosta,
- symtom på nervproblem, till exempel stickningar, känselbortfall, dubbelseende eller arm‑ eller bensvaghet,
- tecken på hudcancer, till exempel en bula eller ett öppet sår som inte läker;
- tecken och symtom på blodsjukdomar såsom långvarig feber, blåmärken, blödning, blekhet.
Följande biverkningar har observerats vid användning av adalimumab:
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare)
- reaktioner på injektionsstället (inklusive smärta, svullnad, rodnad eller klåda);
- luftvägsinfektioner (inklusive förkylning, rinnande näsa, bihåleinflammation, lunginflammation);
- huvudvärk;
- buksmärta;
- illamående och kräkning;
- hudutslag;
- smärta i musklerna.
Vanliga (kan förekomma hos upp till 1 av 10 användare)
- allvarliga infektioner (inklusive blodförgiftning och influensa);
- infektioner i tarmarna (inklusive gastroenterit);
- hudinfektioner (inklusive cellulit och bältros);
- öroninfektioner;
- muninfektioner (inklusive tandinfektioner och munsår);
- infektioner i könsorganen;
- urinvägsinfektioner;
- svampinfektioner;
- ledinfektioner;
- godartade tumörer;
- hudcancer;
- allergiska reaktioner (inklusive säsongsallergi);
- uttorkning;
- humörsvängningar (inklusive depression);
- oro;
- problem att sova;
- känselstörningar såsom stickningar, myrkrypningar eller domning;
- migrän;
- symtom på nervrotskompression (med smärta i korsryggen och bensmärta);
- synstörningar;
- ögoninflammation;
- inflammation i ögonlocket och ögonsvullnad;
- svindel (känsla av att rummet snurrar);
- känsla av att hjärtat slår snabbt;
- högt blodtryck;
- rodnad;
- blödning (blåmärken);
- hosta;
- astma;
- andfåddhet;
- blödning i magtarmkanalen;
- dyspepsi (matsmältningsbesvär, uppblåsthet, halsbränna);
- sura uppstötningar;
- torra ögon och torr mun;
- klåda;
- kliande utslag;
- blåmärken;
- hudinflammation (som eksem);
- sköra naglar på fingrar och tår;
- ökad svettning;
- håravfall;
- nytt utbrott av eller förvärrande av psoriasis;
- muskelspasmer;
- blod i urinen;
- njurproblem;
- bröstsmärta;
- ödem (vätskeansamling i kroppen som gör att de berörda vävnaderna svullnar);
- feber;
- sänkt antal blodplättar (trombocyter) vilket ökar risken för blödning eller blåmärken;
- försämrad läkning.
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
- ovanliga infektioner (till exempel tuberkulos och andra infektioner) som kan uppstå då motståndskraften mot sjukdomar är nedsatt;
- neurologiska infektioner (inklusive hjärnhinneinflammation orsakad av virus);
- ögoninfektioner;
- bakterieinfektioner;
- divertikulit (inflammation och infektion av tjocktarmen);
- cancer, inklusive cancer som påverkar lymfsystemet (lymfom) och melanom (en typ av hudcancer);
- immunrubbningar som kan påverka lungor, hud och lymfkörtlar (yttrar sig oftast som sjukdomen sarkoidos);
- vaskulit (inflammation i blodkärlen);
- skakningar;
- neuropati (nervskador);
- stroke (slaganfall);
- hörselbortfall, ringande;
- känsla av att hjärtat slår oregelbundet såsom ett missat hjärtslag;
- hjärtproblem som kan orsaka andfåddhet eller svullna fötter;
- hjärtinfarkt;
- ett bråck i den stora artärväggen, inflammation och koagel i en ven, blockering av ett blodkärl;
- lungsjukdom som ger andfåddhet (inklusive lunginflammation);
- lungemboli (blockering i en lungartär);
- pleural effusion (onormal vätskeansamling mellan lungor och bröstkorg);
- inflammation i bukspottkörteln som orsakar svår smärta i buken och ryggen;
- svårighet att svälja;
- ansiktsödem (svullnad);
- gallblåseinflammation, gallstenar;
- fettlever (fettansamling i levercellerna);
- nattliga svettningar;
- ärr;
- onormalt muskelsönderfall;
- SLE, systemisk lupus erythomatosus (en immunsjukdom som innefattar inflammation av huden, hjärtat, lungor, leder och andra organsystem);
- störd sömn;
- impotens;
- inflammationer.
Sällsynta (kan förekomma hos upp till 1 av 1000 användare)
- leukemi (cancer som påverkar blod och benmärg);
- allvarlig allergisk reaktion med chock;
- MS, multipel skleros;
- nervrubbning (såsom inflammation i synnerven till ögat och Guillain‑Barré syndrom, ett tillstånd som kan orsaka muskelsvaghet, känselrubbningar, stickningar i armar och överkropp);
- hjärtstopp;
- lungfibros (ärrbildning i lungan);
- hål på tarmen;
- hepatit (leverinflammation);
- reaktivering av hepatit B‑infektion;
- autoimmun hepatit (leverinflammation orsakad av kroppens eget immunsystem);
- kutan vaskulit (inflammation av blodkärlen i huden);
- Stevens‑Johnson syndrom (en livshotande reaktion med influensaliknande symtom och hudutslag med blåsor);
- ansiktsödem (svullnad) associerat med allergiska reaktioner;
- erytema multiforme (inflammatoriska hudutslag);
- lupus‑liknande syndrom;
- angioödem (lokal svullnad av huden)
- lichenoida hudreaktioner (kliande röd-lila hudutslag).
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
- hepatosplenisk T‑cellslymfom (en sällsynt blodcancer som ofta är dödlig);
- Merkel‑cellcarcinom (en sorts hudcancer);
- Kaposis sarkom, en sällsynt cancer förknippad med infektion med humant herpesvirus 8. Kaposis sarkom uppträder oftast som purpurfärgade fläckar på huden;
- leversvikt;
- förvärrande av ett tillstånd som kallas dermatomyosit (ser ut som hudutslag och åtföljs av muskelsvaghet);
- viktökning (för de flesta patienter var viktökningen liten).
Vissa biverkningar som observerats med adalimumab kanske inte uppvisar symtom och kan endast påvisas genom blodprover. Dessa omfattar:
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare)
- låga blodvärden för vita blodceller;
- låga blodvärden för röda blodceller;
- förhöjda lipider i blodet;
- förhöjda leverenzymer.
Vanliga (kan förekomma hos upp till 1 av 10 användare)
- höga blodvärden för vita blodceller;
- låga blodvärden för blodplättar;
- förhöjd urinsyra i blodet;
- avvikande blodvärden för natrium;
- låga blodvärden för kalcium;
- låga blodvärden för fosfat;
- högt blodsocker;
- höga blodvärden för laktatdehydrogenas;
- autoantikroppar i blodet;
- låga blodvärden för kalium.
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
- förhöjda värden av bilirubin (blodprov för levern).
Sällsynta (kan förekomma hos upp till 1 av 1000 användare)
- låga blodvärden för vita blodceller, röda blodceller och blodplättar.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn‑ och räckhåll för barn.
Används före utgångsdatum som anges på etikett/blister/kartong efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C – 8 °C). Får inte frysas.
Förvara de förfyllda sprutorna i ytterkartongen. Ljuskänsligt.
Alternativ förvaring:
Vid behov (till exempel om du reser) kan Hyrimoz förvaras vid rumstemperatur (upp till 25 °C) under högst 42 dagar – se till att läkemedlet skyddas från ljus. När den förfyllda sprutan tas ur kylskåpet för att förvaras i rumstemperatur måste den användas inom 42 dagar eller kasseras, även om den senare läggs tillbaka i kylskåpet. Du ska skriva upp datumet då den förfyllda sprutan tas ur kylskåpet för första gången, och datumet då den ska kasseras.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är adalimumab. Varje förfylld spruta innehåller 20 mg adalimumab i 0,2 ml lösning.
- De andra innehållsämnena är adipinsyra, mannitol (E 421), polysorbat 80 (E 433), saltsyra (E 507), natriumhydroxid (E 524) och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Hyrimoz 20 mg injektionsvätska, lösning för injektion i förfylld spruta för barn och ungdomar tillhandahålls som 0,2 ml klar eller något opalskimrande, färglös till svagt gul lösning.
Hyrimoz tillhandahålls i en spruta av typ I‑glas för engångsbruk, med 29 Gauge nål i rostfritt stål med fingergrepp, nålhätta i gummi (termoplastisk elasomer) och kolvstång i plast. Varje spruta innehåller 0,2 ml lösning.
Multiförpackning innehållande 2 (2 × 1) förfyllda sprutor med Hyrimoz.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Hyrimoz finns tillgängligt som förfylld spruta samt som förfylld injektionspenna.
Innehavare av godkännande för försäljning
Sandoz GmbH
Biochemiestr. 10
6250 Kundl
Österrike
Tillverkare
Sandoz GmbH Schaftenau
Biochemiestr. 10
6336 Langkampfen
Österrike
Novartis Pharmaceutical Manufacturing GmbH
Biochemiestrasse 10
6336 Langkampfen
Österrike
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Suomi/Finland
Sandoz A/S
Puh/Tel: +358 10 6133 400
Denna text ändrades senast 09/2023
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.
Direktiv för användaren
7. Användarinstruktion
Det är viktigt att du följer de här instruktionerna för att minska risken för infektioner och för att säkerställa att du använder läkemedlet på rätt sätt.
Läs den här användarinstruktionen noggrant så att du förstår dem och kan följa dem innan du börjar injicera Hyrimoz. Din vårdgivare kommer att visa dig hur du förbereder och injicerar Hyrimoz på rätt sätt med den förfyllda endossprutan innan du själv får använda den för första gången. Prata med din vårdgivare om du har frågor.
Förfylld spruta med Hyrimoz för engångsbruk
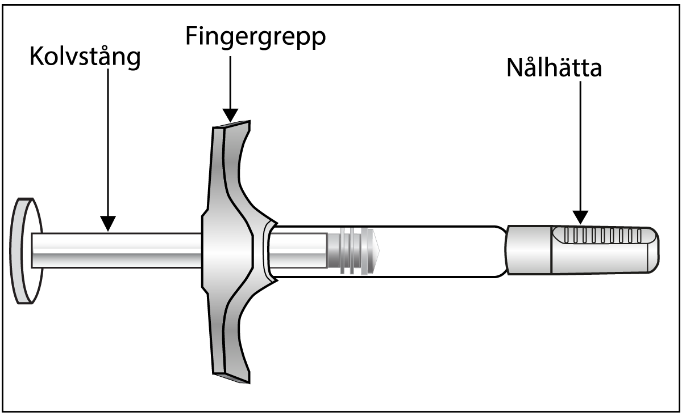 |
| Figur A: Förfylld spruta med Hyrimoz |
| Det är viktigt att du: |
|
| Hur ska Hyrimoz förfylld endosspruta förvaras? |
Förvara Hyrimoz och alla andra läkemedel utom syn‑ och räckhåll för barn. |
| Vad behövs för att genomföra en injektion? |
Lägg fram de saker som listas nedan på en ren, plan yta. Följande saker, som finns i förpackningen med förfyllda sprutor:
Följande saker, som inte finns i förpackningen med Hyrimoz förfyllda sprutor (se Figur B ):
Figur B: saker som inte finns i förpackningen |
| Förbereda den förfyllda sprutan |
Kontakta apotekspersonal om du misstänker något fel på den förfyllda sprutan efter kontrollerna ovan. |
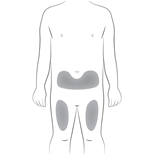
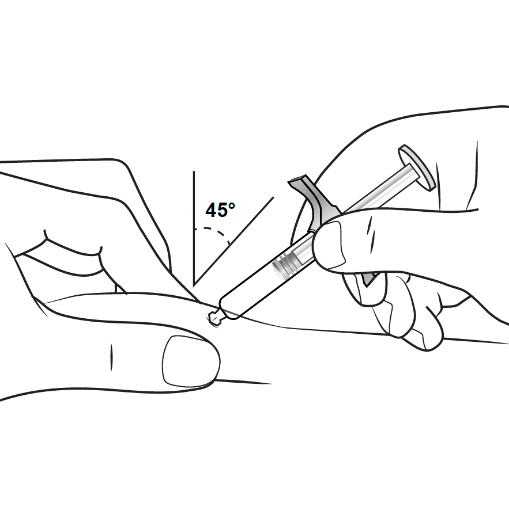
| 1. Välja injektionsställe: | |
Injektionsstället är den plats på kroppen där du ska injicera den förfyllda sprutan med Hyrimoz.
|
Figur C : välj injektionsställe |
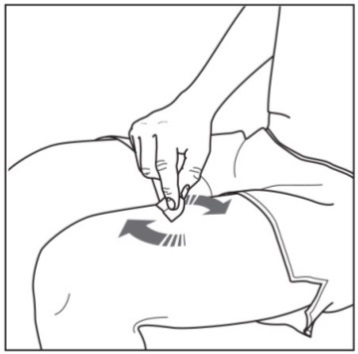
| 2. Rengöra injektionsstället: | |
|
Figur D : rengör injektionsstället |
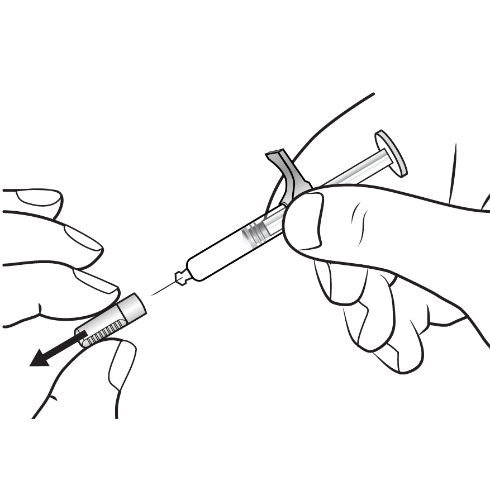
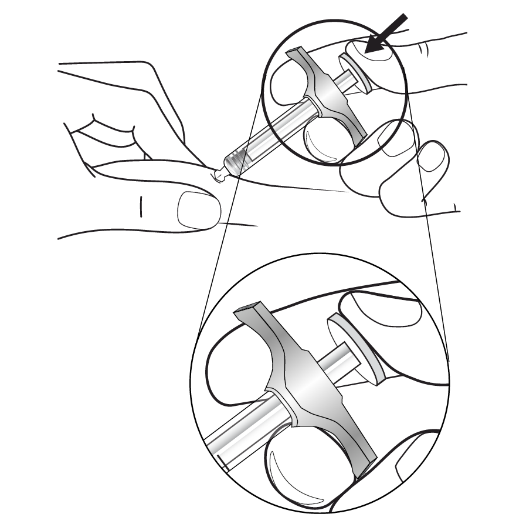
| 3. Genomföra injektionen: | |
|
Figur E : dra av nålhättan |
|
Figur F : stick in nålen |
|
Figur G: håll sprutan |
| 4. Kassera använda förfyllda sprutor: | |
|
Figur H: kassera den använda förfyllda sprutan |
Om du har frågor, prata med en läkare, apotekspersonal eller sjuksköterska som känner till Hyrimoz.