Pakkausseloste
FEIBA pulver och vätska till infusionsvätska, lösning 100 U/ml
Tilläggsinformation
Feiba 100 E/ml pulver och vätska till infusionsvätska, lösning
Faktor VIII inhibitor bypassing activity
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Feiba är och vad det används för
- Vad du behöver veta innan du använder Feiba
- Hur du använder Feiba
- Eventuella biverkningar
- Hur Feiba ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Feiba är en beredning som tillverkas av human plasma och som möjliggör att blodet stoppas, även när individuella koagulationsfaktorer är reducerade eller saknas.
Feiba används för behandling och förebyggande behandling (profylax) av blödningar hos hemofili A-patienter med inhibitorer.
Feiba används för behandling av blödningar hos hemofili B-patienter med inhibitorer.
Feiba används för behandling och förebyggande behandling (profylax) av patienter som inte har hemofili som har förvärvat inhibitorer av faktor VIII.
Dessutom används Feiba som förebyggande behandling (profylax) vid operationer hos hemofili A-patienter med inhibitorer.
Feiba kan användas av alla åldersgrupper.
Vad du behöver veta innan produkten används
Tala om för läkaren om du har en känd allergi.
Tala om för läkaren om du står på en diet med lågt natrium.
Använd inte Feiba
I följande situationer ska Feiba endast användas om man exempelvis på grund av mycket hög titer av inhibitorer inte kan få ett svar på behandling med lämpligt koagulationsfaktorkoncentrat som förväntas.
- om du är allergisk (överkänslig) mot faktor VIII inhibitor bypassing activity eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har disseminerad intravaskulär koagulation (DIC), ett livshotande tillstånd där omfattande blodkoagulation med uttalat bildande av blodproppar bildas i blodkärlen. Detta leder då till koagulationsfaktorer i kroppen förbrukas.
- vid hjärtinfarkt, akut blodpropp (trombos) och/eller att blodpropp spolas ut i blodomloppet (emboli): ska Feiba endast användas vid livshotande blödning.
Varningar och försiktighet
Tala med läkare innan du använder Feiba eftersom överkänslighetsreaktioner kan uppstå, i likhet med alla intravenöst administrerade plasmaprodukter. För att kunna känna igen en allergisk reaktion snarast möjligt bör du känna till potentiella tidiga tecken på en överkänslighetsreaktion, såsom
- erytem (hudrodnad)
- hudutslag
- nässelutslag på huden (urtikaria)
- klåda över hela kroppen
- svullnad av läppar och tunga
- andningsbesvär/dyspné
- obehag i bröstet
- allmän sjukdomskänsla
- yrsel
- blodtrycksfall
Andra symptom på överkänslighetsreaktioner mot produkter som tillverkats från plasma är medvetslöshet (letargi) och rastlöshet.
Om du noterar ett eller flera av dessa symptom ska du omedelbart avbryta infusionen och kontakta läkare. Ovannämnda symptom kan vara tidiga tecken på en anafylaktisk chock. Allvarliga symptom kräver omedelbar akutbehandling.
Din läkare kommer endast att återbehandla dig vid misstanke om överkänslighet mot produkten eller någon av dess beståndsdelar efter noga övervägande av den förväntade nyttan mot risken vid återinsättning och/eller om ingen reaktion kan förväntas med annan förebyggande behandling eller alternativa läkemedel.
- Om du upplever stora förändringar av blodtrycket eller puls, andningssvårigheter, hosta eller bröstsmärta ska du omedelbart avbryta infusionen och kontakta läkare. Din läkare kommer att sätta in lämpliga diagnostiska och terapeutiska åtgärder.
- Hos patienter som har hemofili med inhibitorer eller förvärvade inhibitorer av koagulationsfaktorer. Under behandlingen med Feiba kan dessa patienter ha ökad blödningstendens samt ökad risk för trombos samtidigt.
Att blodpropp inträffar som kan hamna i blodomloppet (trombotiska och tromboemboliska händelser), inklusive disseminerad intravaskulär koagulation (DIC), stopp i venerna på grund av blodproppar (ventrombos), blodpropp i lungan (lungemboli), hjärtinfarkt och stroke har förekommit under behandling med Feiba. Samtidig användning av rekombinant faktor VIIa (rFVIIa) ökar sannolikt risken för att utveckla en blodpropp som hamnar i blodomloppet (tromboembolisk händelse). Vissa av de tromboemboliska händelserna har inträffat vid behandling med höga doser av Feiba.
I en studie utförd av ett annat företag, där man undersökte emicizumab (ett läkemedel för att förhindra blödning hos patienter med hemofili A), behandlades några patienter som led av genombrottsblödningar med Feiba för att kontrollera blödningarna, och några få av dessa patienter utvecklade trombotisk mikroangiopati (TMA). TMA är ett allvarligt och potentiellt livshotande tillstånd. När man har detta tillstånd kan blodkärlens väggar skadas och blodproppar bildas i små blodkärl. I vissa fall kan detta skada njurar och andra organ. Om du får genombrottsblödning när du använder emicizumab som förebyggande läkemedel, kontakta din hemofililäkare eller hemofilicentrum omedelbart.
När läkemedel framställts av humant blod eller plasma vidtas speciella åtgärder för att förhindra att infektioner överförs till patienter. Detta inkluderar ett noggrant urval av blod- och plasmagivare för att säkerställa att de med risk för att bära på en infektion utesluts samt att varje donation av plasmapool testas för tecken på virus/infektion. Tillverkarna av dessa produkter inkluderar dessutom steg i processandet av blod och plasma som kan inaktivera eller avskilja virus. Trots detta kan risken för överföring av infektion inte helt uteslutas när läkemedel tillverkade av humant blod eller human plasma ges. Detta gäller även nya, hittills okända virus och andra typer av infektioner.
De åtgärder som vidtagits anses vara effektiva för höljeförsedda virus, t.ex. humant immunbristvirus (HIV), hepatit B-virus och hepatit C-virus och för det icke-höljeförsedda hepatit A-viruset. Åtgärderna kan vara av begränsat värde mot icke höljeförsedda virus som parvovirus B19. Infektion med parvovirus B19 kan vara allvarlig för gravida kvinnor (infektion av foster) och individer med försämrat immunförsvar eller patienter med viss anemi (t.ex. sickelcellsjukdom eller hemolytisk anemi).
Läkaren kan rekommendera att du överväger vaccination mot hepatit A och B om du regelbundet eller upprepat får faktor VIII-hämmande produkter som framställts från human plasma.
Efter administrering av höga doser av Feiba kan tillfällig ökning av passivt överförda hepatit B-ytantikropparna medföra missledande tolkning av positiva resultat i serologiska tester.
Feiba är en produkt som tillverkas från plasma och kan innehålla substanser som reagerar när de ges till en patient, vilket kan leda till att isohemagglutininer bildas (antikroppar som gör att röda blodkroppar från en annan person klumpar ihop sig). Detta kan leda till missvisande resultat på blodprover.
Det rekommenderas bestämt att notera namn och satsnummer på Feiba vid varje behandlingstillfälle för att upprätthålla en koppling mellan dig och produktens satsnummer.
Barn
Erfarenheten på barn under 6 år är begränsad. Samma dosering som för vuxna ska anpassas efter barnets hälsotillstånd.
Andra läkemedel och Feiba
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Inga tillräckliga och välkontrollerade studier av kombinerad eller sekventiell användning av Feiba och rekombinant faktor VIIa, blodstillande läkemedel (antifibrinolytika) eller emicizumab har genomförts. Möjligheten för blodproppsbildningar bör övervägas när systemiska antifibrinolytika som tranexamsyra och aminokapronsyra används under behandling med Feiba. Därför bör antifibrinolytika inte användas under cirka 6 till 12 timmar efter administrering av Feiba.
Vid samtidig användning av rFVIIa kan potentiell läkemedelsinteraktion inte uteslutas enligt tillgängliga in vitro-data och kliniska observationer, vilket potentiellt kan leda till en tromboembolisk händelse. Tala om för läkaren om du ska behandlas med Feiba efter att du har fått emicizumab (ett läkemedel som förhindrar blödning hos patienter med hemofili A) eftersom man måste följa vissa varningar och försiktighetsåtgärder. Läkaren måste övervaka dig noga.
I likhet med alla blodkoagulationsberedningar bör Feiba inte blandas med andra läkemedelsprodukter före administreringen, eftersom beredningens effektivitet och tolerans kan försämras. Det rekommenderas att en gemensam venåtkomst spolas med fysiologisk saltlösning före och efter administrering av Feiba.
Graviditet, amning och fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Läkaren avgör om Feiba kan användas under graviditet och amning. På grund av ökad risk för trombos under graviditet ska Feiba endast administreras under noggrann medicinsk övervakning och endast om det är absolut nödvändigt. Information om parvovirus B19 infektion ges i avsnittet varningar och försiktighet.
Körförmåga och användning av maskiner
Det finns inga tecken på att Feiba kan påverka förmågan att framföra fordon eller använda maskiner.
Feiba innehåller natrium
500 U
Detta läkemedel innehåller cirka 40 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 2 % av högsta rekommenderat dagligt intag av natrium för vuxna.
1 000 U
Detta läkemedel innehåller cirka 80 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 4 % av högsta rekommenderat dagligt intag av natrium för vuxna.
2 500 U
Detta läkemedel innehåller cirka 200 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 10 % av högsta rekommenderat dagligt intag av natrium för vuxna.
Hur produkten används
Rekonstituera det frystorkade Feiba-pulvret i medföljande spädningsvätska och administrera lösningen intravenöst.
Använd alltid detta läkemedel exakt enligt läkarens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Din läkare bestämmer doseringen, hur ofta du ska behandlas och behandlingens längd individuellt för dig, beroende på hur allvarlig din koagulationsstörning är, blödningens lokalisering och omfattning samt ditt allmänna tillstånd och svar på behandlingen. Ändra inte den dosering som läkaren har fastställt och sluta inte använda beredningen på egen hand.
Tala med läkare eller apotekspersonal om du har intryck av att effekten av Feiba är för stark eller för svag.
Värm upp produkten till rums- eller kroppstemperatur före administreringen om det behövs.
Feiba ska rekonstitueras omedelbart före administreringen. Lösningen ska användas omedelbart (eftersom beredningen inte innehåller konserveringsmedel).
Snurra flaskan försiktigt tills allt pulver har lösts upp. Se till att Feiba löses upp helt, annars kommer färre Feiba-enheter att passera igenom anordningens filter.
Lösningar som är grumliga eller har fällningar ska kasseras på lämpligt sätt.
Återanvänd inte öppnade behållare.
Använd endast medföljande vatten för injektionsvätskor och det anordningsset som medföljer för beredning.
Om andra anordningar än de som medföljer används, kontrollera att ett lämpligt filter med en porstorlek på minst 149 µm används.
Använd inte produkten om den sterila barriären har brutits, förpackningen är skadad eller om den visar tecken på försämring.
Får inte förvaras i kylskåp efter rekonstitution.
Efter att Feiba har rekonstituerats helt ska injektion eller infusion påbörjas omedelbart och slutföras inom tre timmar efter rekonstitutionen.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
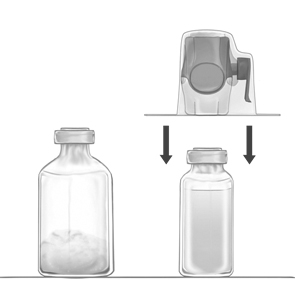
Rekonstitution av pulvret för att bereda en infusionslösning med BAXJECT II Hi-Flow:
1. Värm den oöppnade injektionsflaskan med spädningsvätska (vatten för injektionsvätskor) till rumstemperatur eller högst +37 °C om det behövs, t.ex. i vattenbad i några minuter.
2. Ta bort hättorna från flaskorna med pulver och vatten och desinficera gummipropparna. Placera flaskorna på en plan yta.
3. Öppna förpackningen med BAXJECT II Hi-Flow genom att dra bort skyddsfolien utan att vidröra förpackningens innehåll (Bild a). Ta inte ut tillbehöret ur förpackningen.
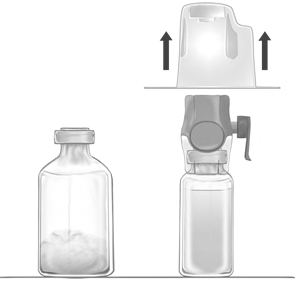
4. Vänd på förpackningen och tryck den klara plastspetsen genom vattenflaskans gummipropp (Bild b). Ta tag i förpackningens kanter och dra bort förpackningen från BAXJECT II Hi-Flow (Bild c). Ta inte bort det blå skyddet från BAXJECT II Hi-Flow.
5. Vänd på hela systemet med BAXJECT II Hi-Flow fastsatt vid vattenflaskan så att vattenflaskan hamnar överst. Tryck den lila plastspetsen genom gummiproppen på flaskan med pulver. Vattnet kommer att sugas in i Feiba-flaskan genom vakuum (Bild d).
6. Rotera flaskan försiktigt (skaka inte), tills allt pulver är helt upplöst. Kontrollera att Feiba är helt upplöst annars kan aktiv substans fastna i filtret.
| Bild a | Bild b | Bild c |
 |  |  |
Infusion
Använd aseptisk teknik genom hela proceduren!
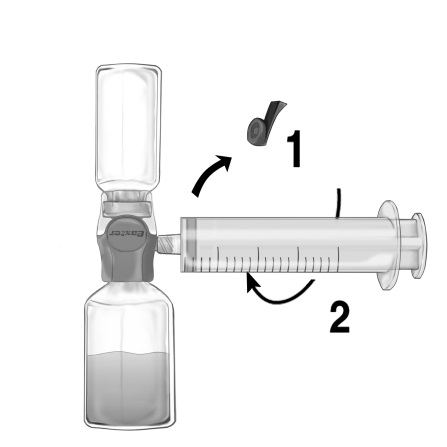
- Ta bort det blå skyddet från BAXJECT II Hi-Flow. Ta sprutan och koppla den till BAXJECT II Hi-Flow. DRA INTE IN LUFT I SPRUTAN (Bild e). Användning av en luerlock-spruta rekommenderas starkt för att försäkra en tät koppling mellan sprutan och BAXJECT II Hi-Flow (vrid sprutan medsols tills det tar stopp).
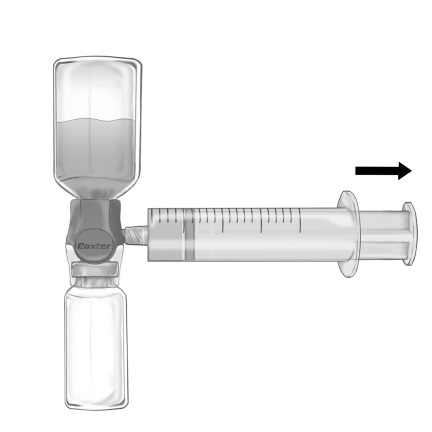
- Vänd på systemet upp och ner så att flaskan med upplöst Feiba hamnar överst. Dra LÅNGSAMT in lösningen i sprutan genom att försiktigt dra ut sprutkolven och se till att en ordentlig anslutning mellan BAXJECT II Hi-Flow och sprutan bibehålls under hela uppdragningsprocessen (Bild f).
- Ta loss sprutan.
- Om skumbildning sker, avvakta tills skummet försvunnit. Administrera lösningen långsamt intravenöst med det medföljande infusionssetet.
| Bild d | Bild e | Bild f |
 |  |  |
Överskrid inte en infusionshastighet av 10 enheter Feiba/kg kroppsvikt per minut.
Om du har använt för stor mängd av Feiba
Informera omedelbart din läkare. Överdosering av Feiba kan öka risken för biverkningar, t.ex. tromboemboli (att en blodpropp bildas som spolas in i blodkärlen), konsumtionskoagulopati (uttalad blodproppsbildning i blodkärlen, DIC) eller hjärtinfarkt. Vissa av de rapporterade tromboemboliska händelserna inträffade vid doser över 200 enheter/kg eller hos patienter med andra riskfaktorer för tromboemboliska händelser. Om tecken eller symptom på trombotiska och tromboemboliska händelser observeras ska infusionen avbrytas omedelbart och lämpliga diagnostiska och terapeutiska åtgärder sättas in.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 personer)
Överkänslighet, huvudvärk, yrsel, lågt blodtryck, hudutslag, positivt test för hepatit B-ytantikroppar.
Biverkningar med ingen känd frekvens (kan inte beräknas från tillgängliga data)
- Blodet och lymfsystemet: En allvarlig koagulationsrubbning (DIC), ökad titer av inhibitorer
- Immunsystemet: Anafylaktiska reaktioner, nässelutslag över hela kroppen (urtikaria)
- Centrala och perifera nervsystemet: Domningar i armar och ben (hypoestesi), onormal eller nedsatt känsel (parestesi), stroke (trombotisk stroke, embolisk stroke), sömnighet (sömnlöshet), förändrad smakupplevelse (dysgeusi)
- Hjärtat: Hjärtinfarkt (myokardiell infarkt), snabba hjärtslag (takykardi)
- Blodkärl: Blodproppsbildning som spolas in i kärlen (tromboemboliska händelser, venös och arteriell trombos), ökat blodtryck (hypertoni), rodnad
- Andningsvägar, bröstkorg och mediastinum: Obstruktion i lungartären (lungemboli), sammandragningar i luftvägarna (bronkospasm), väsningar, hosta, andnöd (dyspné)
- Magtarmkanalen: Kräkningar, diarré, buksmärta, sjukdomskänsla (illamående)
- Hud och subkutan vävnad: Domningar i ansiktet, svullnad i ansikte, tunga och läppar (angioödem), nässelutslag över hela kroppen (urtikaria), klåda (pruritus)
- Allmänna symtom och/eller symtom vid administreringsstället: Smärta vid injektionsstället, allmän sjukdomskänsla, värmekänsla, frossa, feber, bröstsmärta, obehag i bröstet
- Undersökningar och provtagningar: Blodtrycksfall, förhöjda nivåer av fibrin-D-dimer i blodet
En snabb intravenös infusion kan ge stickande värk och domningar i ansikte, armar och ben samt blodtrycksfall.
Hjärtinfarkter har observerats efter administrering av doser över den dagliga maxdosen och/eller vid långvarig användning och/eller vid närvaro av riskfaktorer för tromboemboli.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras vid högst 25°C Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Används före utgångsdatum som anges på etiketten och kartongen. Utgångsdatumet är den sista dagen i angiven månad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Pulver
- Den aktiva substansen i varje injektionsflaska är faktor VIII inhibitor bypassing activity.
- 1 ml innehåller 100 enheter faktor VIII inhibitor bypassing activity.
Feiba 100 E/ml finns i tre olika förpackningsstorlekar:
- Förpackningen med 500 enheter Feiba innehåller 500 enheter faktor VIII inhibitor bypassing activity i 200–600 mg humant plasmaprotein.
- Förpackningen med 1 000 enheter Feiba innehåller 1 000 enheter faktor VIII inhibitor bypassing activity i 400–1 200 mg humant plasmaprotein.
- Förpackningen med 2 500 enheter Feiba innehåller 2 500 enheter faktor VIII inhibitor bypassing activity i 1 000–3 000 mg humant plasmaprotein.
Feiba innehåller också faktor II, IX och X, huvudsakligen i icke-aktiverad form, samt aktiverad faktor VII. Faktor VIII-koagulationsantigen (FVIII C:Ag) samt faktorerna i kallikreinkinin-systemet (ett metaboliskt samverkanssystem) är endast närvarande i spårbara mängder, om över huvud taget.
- Övriga innehållsämnen är natriumklorid och natriumcitrat.
Spädningsvätska
- Vatten för injektionsvätskor
Läkemedlets utseende och förpackningsstorlekar
Produkten presenteras i form av ett frystorkat pulver eller ett sprött fast ämne med vit till benvit eller blekgrön färg. Den bruksfärdiga lösningens pH-värde är mellan 6,5 och 7,3.
Pulvret och spädningsvätskan tillhandahålls i injektionsflaskor av glas som är förslutna med gummiproppar.
Förpackningsstorlekar: 1 x 500 enheter
1 x 1 000 enheter
1 x 2 500 enheter
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Förpackningens innehåll:
- 1 injektionsflaska med 500 enheter/1 000 enheter/2 500 enheter Feiba pulver till infusionsvätska, lösning
- 1 injektionsflaska med 5 ml/10 ml/25 ml vatten för injektionsvätskor
- 1 BAXJECT II Hi-Flow för rekonstitution
- 1 engångsspruta
- 1 butterflynålset
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Baxalta Innovations GmbH
Industriestrasse 67
1220 Wien
Österrike
Tillverkare
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wien
Österrike
Lokal företrädare
Takeda Oy
PB 1406
00101 Helsingfors
Tel: 0800 774 051
Denna bipacksedel ändrades senast 23.09.2024
---------------------------------------------------------------------------------------------------------------------
Direktiv för experterna inom hälsovården
Behandling ska inledas och övervakas av en erfaren läkare vid behandling av koagulationssjukdomar.
Dosering
Behandlingens dos och längd beror på blödningssjukdomens allvarlighetsgrad, var och hur omfattande blödningen är, samt på patientens kliniska tillstånd.
Administreringsdosen och administreringsfrekvensen ska alltid styras av den kliniska effektiviteten i det enskilda fallet.
Generellt rekommenderas en dos på 50–100 enheter Feiba per kg kroppsvikt. En engångsdos på 100 enheter/kg kroppsvikt och en daglig dos på högst 200 enheter/kg kroppsvikt får inte överskridas såvida inte blödningens allvarlighetsgrad kräver och rättfärdigar användning av högre doser.
På grund av patientspecifika faktorer kan responsen på en bypassing substans variera och i en given blödningssituation kan patienter som svarar otillräckligt på ett medel svara väl på ett annat medel. Vid otillräcklig respons på en bypassing substans bör användning av ett annat medel övervägas.
Pediatrisk population
Erfarenheten på barn under 6 år är begränsad. Samma dosering som för vuxna ska anpassas efter barnets kliniska tillstånd.
1) Spontan blödning
Blödning i led, muskel och mjukdelsvävnad
Vid mindre till medelsvåra blödningar rekommenderas en dos om 50–75 enheter/kg kroppsvikt given med 12 timmars intervall. Behandlingen bör pågå tills tydliga tecken på klinisk förbättring ses, såsom minskad smärta, minskad svullnad eller ökad rörlighet i leden.
Vid större muskelblödningar och blödningar i mjukdelsvävnad, t.ex. retroperitoneala blödningar (blödningar i de organ som finns bakom bukhinnan), rekommenderas en dos på 100 enheter/kg kroppsvikt med 12 timmars intervall.
Blödning i slemhinna
En dos om 50 enheter/kg kroppsvikt att ges med 6 timmars intervall rekommenderas. Patienten ska kontrolleras noga (synlig blödning, upprepade mätningar av hematokrit). Om blödningen inte är under kontroll kan dosen höjas till 100 enheter/kg kroppsvikt under förutsättning att den maximala dagliga dosen ej överskrider 200 enheter/kg kroppsvikt.
Andra allvarliga blödningar
Vid allvarliga blödningar, som t.ex. CNS-blödningar, rekommenderas en dos på 100 enheter/kg kroppsvikt givna med 12 timmars intervall. I enstaka fall kan Feiba administreras med 6 timmars intervall till dess att en tydlig klinisk förbättring har uppnåtts. (Den maximala dagsdosen på 200 enheter/kg kroppsvikt får inte överskridas!)
2) Kirurgiska ingrepp
Vid kirurgiska ingrepp kan en initial dos på 100 enheter/kg kroppsvikt administreras preoperativt och en ytterligare dos på 50–100 enheter/kg kroppsvikt administreras efter 6–12 timmar. Som postoperativ underhållsdos kan 50–100 enheter/kg kroppsvikt administreras med 6–12 timmars intervall. Dosering, doseringsintervall och längden på peri- och postoperativ behandling vägleds av det kirurgiska ingreppet, patientens allmänna tillstånd samt den kliniska effekten i varje enskilt fall. (Den dagliga maxdosen på 200 enheter/kg kroppsvikt får inte överskridas!)
3) Blödningsprofylax för hemofili A-patienter med inhibitorer
- Blödningsprofylax för patienter med inhibitorer och med frekventa blödningar där immuntoleransterapi (ITT) har misslyckats eller inte anses lämpligt:
Feiba rekommenderas att ges i doser mellan 70 och 100 enheter/kg kroppsvikt varannan dag. Denna dos kan vid behov ökas upp till 100 enheter/kg kroppsvikt per dag. Dosen kan även gradvis sänkas om detta anses lämpligt.
- Blödningsprofylax för patienter med inhibitorer under immuntoleransterapi (ITT):
Feiba kan administreras efter faktor VIII-koncentratet i doser mellan 50 och 100 enheter/kg kroppsvikt två gånger om dagen tills faktor VIII-inhibitorer har sjunkit till under 2 B.E. *
*1 Bethesda-enhet definieras som den mängd inhibitorer som hämmar 50 % av faktor VIII-aktiviteten i färsk normal human plasma efter inkubation i två timmar vid 37 °C.
4) Användning av Feiba på särskilda patientgrupper
Feiba har också använts i kombination med faktor VIII-koncentrat för långtidsbehandling för att uppnå fullständig och permanent eliminering av faktor VIII-inhibitorer.
Övervakning
Vid otillräcklig respons på behandlingen med läkemedlet rekommenderas att antal trombocyter fastställs, då ett tillräckligt antal funktionellt intakta trombocyter anses vara nödvändigt för att produkten ska fungera.
På grund av den komplexa verkningsmekanismen går det inte att övervaka de aktiva substanserna direkt. Koagulationstester som heklblodskoagulationstid (WBCT), tromboelastogram (TEG, r-värde) och aPTT visar vanligen endast en mindre minskning och överensstämmer inte nödvändigtvis med klinisk förbättring. Därför har dessa tester mycket begränsat värde vid monitorering av behandling med Feiba.
Administreringssätt
Feiba ska administreras långsamt intravenöst. Feiba ska infunderas vid en infusionshastighet på 2 enheter/kg kroppsvikt per minut . Hos patienter som har tolererat infusionshastigheten på 2 enheter/kg kroppsvikt per minut väl kan infusionshastigheten vid efterföljande infusioner ökas upp till högst 10 enheter/kg kroppsvikt per minut.
Feiba ska rekonstitueras omedelbart före administreringen. Lösningen ska användas omedelbart (eftersom beredningen inte innehåller konserveringsmedel). Använd inte lösningar som är grumliga eller har fällningar. Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Övervakning av behandlingen
Engångsdoser på 100 enheter/kg kroppsvikt och dagliga doser på 200 enheter/kg kroppsvikt får inte överskridas. Patienter som får 100 enheter/kg kroppsvikt eller mer måste övervakas noga, särskilt vad gäller utveckling av DIC och/eller akut koronär ischemi samt symptom på andra trombotiska eller tromboemboliska händelser. Höga doser av Feiba ska endast administreras så länge som det strikt behövs – för att stoppa en blödning.
Om kliniskt signifikanta förändringar av blodtryck eller pulsfrekvens, andningssvårigheter, hosta eller bröstsmärta inträffar ska infusionen omedelbart avbrytas och lämpliga diagnostiska och terapeutiska åtgärder sättas in. Viktiga laboratorieparametrar för DIC är minskat fibrinogen, minskat antal trombocyter och/eller närvaro av fibrin-/fibrinogennedbrytningsprodukter (FDP). Andra parametrar för DIC är en tydligt förlängd trombintid, protrombintid eller aPTT. Hos patienter med hämmarhemofili eller med förvärvade inhibitorer av faktor VIII, IX och/eller XI förlängs aPTT av den underliggande sjukdomen.
Administrering av Feiba till patienter med inhibitorer kan leda till en initial anamnestisk stegring av hämmarnivåerna. Efter fortsatt administrering av Feiba kan inhibitorerna minska med tiden. Kliniska och publicerade data tyder på att Feibas effektivitet inte minskas.
Patienter med hämmarhemofili eller med förvärvade inhibitorer av koagulationsfaktorer som behandlas med Feiba kan ha ökad blödningstendens samt ökad risk för trombos samtidigt.
Laboratorieprover och klinisk effekt
In vitro-analyser för att kontrollera effekten, t.ex. aPTT, helblodskoagulationstid (WBCT) och tromboelastogram (TEG) överensstämmer inte nödvändigtvis med klinisk förbättring. Därför kan försök att normalisera dessa värden genom att öka dosen Feiba misslyckas och avråds starkt på grund av den potentiella risken att DIC förorsakas genom överdosering.
Betydelse av trombocytvärde
Vid otillräcklig eller nedsatt respons på behandling med Feiba rekommenderas att trombocytvärdet fastställs, eftersom ett tillräckligt antal intakta trombocyter bedöms nödvändigt för att Feiba ska ha full effekt.
Behandling av hemofili B-patienter med inhibitorer
Erfarenheten av hemofili B-patienter med faktor IX-inhibitorer är begränsad på grund av att sjukdomen är så sällsynt. Fem hemofili B-patienter med inhibitorer behandlades med Feiba under de kliniska prövningarna, antingen vid behov, som profylax eller inför kirurgiska ingrepp:
I en prospektiv, öppen, randomiserad klinisk studie med parallella grupper på hemofili A- eller B-patienter med höga nivåer av inhibitorer (090701, PROOF) randomiserades 36 patienter till antingen 12 månader ±14 dagar profylaktisk behandling eller behandling vid behov. De 17 patienterna i profylaxgrenen fick 85 ± 15 enheter/kg Feiba administrerat varannan dag och de 19 patienterna i vid behov-grenen behandlades individuellt enligt läkarens anvisningar. Två hemofili B-patienter med inhibitorer behandlades i vid behov-grenen och en hemofili B-patient behandlades i profylaxgrenen.
Median-ABR (annualiserad blödningsfrekvens) för alla typer av blödningsepisoder hos patienterna i profylaxgrenen (median-ABR = 7,9) var mindre än den för patienterna i vid behov-grenen (median-ABR = 28,7), vilket motsvarar 72,5 % minskning av median-ABR mellan behandlingsgrenarna.
I en annan slutförd prospektiv, icke interventionell övervakningsstudie av perioperativ användning av Feiba (PASS-INT-003, SURF) genomfördes sammanlagt 34 kirurgiska ingrepp på 23 patienter. De flesta patienterna (18) var patienter med medfödd hemofili A med inhibitorer, två var hemofili B-patienter med inhibitorer och tre var patienter med förvärvad hemofili A med inhibitorer. Varaktigheten på Feiba-exponeringen varierade mellan 1 och 28 dagar med ett medelvärde på 9 dagar och ett medianvärde på 8 dagar. Den genomsnittliga ackumulerade dosen var 88,347 enheter och mediandosen var 59 000 enheter. För hemofili B-patienter med inhibitorer var den längsta exponeringen för Feiba 21 dagar och given maxdos var 7 324 enheter.
Dessutom finns 48 patienter rapporterade i litteraturen där Feiba har använts för behandling och prevention av blödningsepisoder hos hemofili B med faktor IX-inhibitorer (34 hemofili B-patienter med inhibitorer behandlades vid behov, sex hemofili B-patienter med inhibitorer behandlades förebyggande och åtta hemofili B-patienter med inhibitorer behandlades i samband med kirurgiska ingrepp).
Toleransen och säkerheten för Feiba, som rekonstituerats i normal eller 50 % reducerad volym och vid snabbare infusionshastigheter hos hemofilipatienter med inhibitorer undersöktes i en prospektiv, öppen och randomiserad överkorsningsstudie (091501). Trettiotre patienter behandlades och tjugoåtta patienter slutförde studien. I studien rekonstituerades Feiba i 50 % reducerad volym (koncentration på 100 enheter/ml) och infunderades intravenöst vid infusionshastigheter på 2, 4 och 10 enheter/kg/min vid den rekommenderade dosen på 85 enheter/kg ± 15 enheter/kg för alla patienter. De primära effektmåtten var tolerans och säkerhet med 50 % reducerad volym (ökad koncentration) vid standard och ökade infusionshastigheter. Studien visade att både den högre koncentrationen (100 enheter/ml) och de högre infusionshastigheterna (4 och 10 enheter/kg/min) tolererades väl och att säkerhetsprofilen var jämförbar vid den rekommenderade dosen på 85 enheter/kg ± 15 enheter/kg. De patienter som fick 50 % reducerad volym (ökad koncentration) vid den vanliga infusionshastigheten på 2 enheter/kg/min uppvisade liknande frekvenser av behandlingsrelaterade oönskade händelser (TEAEs, Treatment Emergent Adverse Events) jämfört med de patienter som fick den vanliga volymen (koncentration på 50 enheter/ml) med samma infusionshastighet. Inga relaterade TEAEs rapporterades vid infusionshastigheten 4 enheter/kg/min. Bland de patienter som fick 50 % reducerad volym (100 enheter/ml) vid infusionshastigheten 10 enheter/kg/min förekom en relaterad, ej allvarlig TEAE. Dessutom hade de patienter som fick den 50 % reducerade volymen (ökad koncentration) vid de högre infusionshastigheterna 4 och 10 enheter/kg/min inga allvarliga TEAEs, inga överkänslighetsreaktioner, inga reaktioner på infusionsstället, inga trombotiska TEAEs och inga TEAEs som ledde till utsättning av läkemedlet eller avbrytande av studien. Överlag överensstämde de TEAEs som observerades i studien med den kända säkerhetsprofilen för Feiba hos patienter med hemofili med inhibitorer.
I en öppen, okontrollerad, icke-interventionell observationssäkerhetsstudie av Feiba efter godkännande för försäljning (PASS-EU-006) behandlades 75 patienter (genomsnittsålder 34,8 år, 70 män och 5 kvinnor), varav 73 hade hemofili A med inhibitorer och 2 hade hemofili B med inhibitorer, med Feiba. Av de 65 patienterna med medfödd hemofili hade 63 medfödd hemofili A och 2 hade medfödd hemofili B. Vid studiestart förskrevs 43 patienter Feiba som profylax och 32 förskrevs Feiba som behandling vid behov. Högre infusionshastigheter (> 2 enheter/kg/min) användes hos 6 barn i åldern 11 månader till 11 år och hos 5 ungdomar i åldern 13 till 16 år.
Av 320 infusioner med en tillgänglig infusionshastighet hos 7 barn och 6 ungdomar var uppdelningen följande: 129 infusioner (40,3 %) hos 2 patienter (båda barn) med infusionshastigheten > 10 enheter/kg/min, 26 infusioner (8,1 %) hos 7 patienter (4 barn; 3 ungdomar) med infusionshastigheten > 4 och ≤ 10 enheter/kg/min, 135 infusioner (42,2 %) hos 7 patienter (3 barn; 4 ungdomar) med infusionshastigheten > 2 och ≤ 4 enheter/kg/min, och 30 infusioner (9,4 %) hos 3 patienter (1 barn; 2 ungdomar) med infusionshastigheten ≤ 2 enheter/kg/min.
Det finns också enstaka rapporter om användning av Feiba för behandling av patienter med förvärvade inhibitorer av faktor IX, X, XI och XIII.
I sällsynta fall användes Feiba även på patienter med förekomst av von Willebrand-faktorhämmare.