Pakkausseloste
TEPADINA pulver och vätska till infusionsvätska, lösning 400 mg
Tilläggsinformation
TEPADINA 400 mg pulver och vätska till infusionsvätska, lösning
tiotepa
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor, vänd dig till läkare.
- Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad TEPADINA är och vad det används för
2. Vad du behöver veta innan du använder TEPADINA
3. Hur du använder TEPADINA
4. Eventuella biverkningar
5. Hur TEPADINA ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
TEPADINA innehåller den aktiva substansen tiotepa, som tillhör en grupp av läkemedel som kallas alkylerande medel.
TEPADINA används för att förbereda patienter för benmärgstransplantation. Det verkar genom att förstöra benmärgsceller. Detta gör det möjligt att transplantera nya benmärgsceller (hematopoetiska stamceller), som i sin tur gör det möjligt för kroppen att bilda friska blodkroppar.
TEPADINA kan användas av vuxna och barn och ungdomar.
Vad du behöver veta innan produkten används
Använd inte TEPADINA
- om du är allergisk mot tiotepa
- om du är gravid eller tror att du kan vara gravid
- om du ammar
- om du får vaccination mot gula febern, levande virala och bakteriella vacciner
Varningar och försiktighet
Du ska tala om för din läkare om du har
- lever- eller njurproblem
- hjärt- eller lungproblem
- krampanfall (epilepsi) eller har haft sådana tidigare (om dessa behandlas med fenytoin eller fosfenytoin).
Eftersom TEPADINA förstör benmärgsceller som ansvarar för tillverkning av blodkroppar kommer du regelbundet lämna blodprover under behandling för kontroll av antalet blodkroppar.
För att förhindra och behandla infektioner kommer du att få läkemedel mot infektioner.
TEPADINA kan framkalla en annan typ av cancer i framtiden. Din läkare kommer att diskutera denna risk med dig.
Andra läkemedel och TEPADINA
Tala om för din läkare om du tar eller nyligen har tagit andra läkemedel, även receptfria sådana.
Graviditet, amning och fertilitet
Du måste tala om för din läkare om du är gravid eller tror att du kan vara gravid innan du får TEPADINA. Du får inte använda TEPADINA under graviditet.
Både kvinnor och män som använder TEPADINA måste använda effektiva preventivmetoder under behandling. Män ska inte avla barn under behandlingen med TEPADINA och ett år efter avslutad behandling.
Det är okänt om detta läkemedel utsöndras i bröstmjölk. Som en försiktighetsåtgärd får kvinnor inte amma under behandling med TEPADINA.
TEPADINA kan försämra fruktsamheten hos män och kvinnor. Manliga patienter bör söka råd om att spara sperma innan behandling påbörjas.
Körförmåga och användning av maskiner
Det är sannolikt att vissa biverkningar av tiotepa såsom yrsel, huvudvärk och dimsyn kan påverka förmågan att framföra fordon och använda maskiner. Om du får någon biverkning ska du inte köra eller använda maskiner.
TEPADINA innehåller natrium
Detta läkemedel innehåller 1 418 mg (61,6 mmol) natrium (huvudingrediensen i koksalt/bordssalt) i varje påse. Detta motsvarar 70,9 % av högsta rekommenderat dagligt intag av natrium för vuxna.
Hur produkten används
Din läkare kommer att beräkna dosen efter din kroppsyta eller vikt och din sjukdom.
Hur TEPADINA ges
TEPADINA ges av kvalificerad hälso- och sjukvårdspersonal som en intravenös infusion (dropp i en ven) efter spädning av injektionsvätskan. Varje infusion pågår i 2–4 timmar.
Administreringsfrekvens
Du kommer att få dina infusioner var 12:e eller 24:e timme. Behandlingen kan pågå i upp till 5 dagar. Hur ofta infusionerna ges och hur lång behandlingen är beror på din sjukdom.
Eventuella biverkningar
Liksom alla läkemedel kan TEPADINA orsaka biverkningar men alla användare behöver inte få dem.
De allvarligaste biverkningarna av behandling med TEPADINA eller av transplantationen kan omfatta
- minskat antal cirkulerande blodkroppar (avsedd effekt av läkemedlet för att förbereda dig för din transplantationsinfusion)
- infektion
- rubbning av leverns funktion inklusive blockering av en ven i levern
- transplantatet angriper din kropp (transplantat-mot-värd-reaktion)
- andningskomplikationer.
Din läkare kommer att regelbundet kontrollera dina blodvärden och leverenzymer för att upptäcka och behandla dessa biverkningar.
Biverkningar av TEPADINA kan förekomma i vissa frekvenser, som definieras enligt följande:
Mycket vanliga biverkningar (kan förekomma hos fler än 1 av 10 användare)
- ökad infektionskänslighet
- blodförgiftning (inflammatoriskt tillstånd i hela kroppen; sepsis)
- minskat antal vita blodkroppar, blodplättar och röda blodkroppar (anemi)
- de transplanterade cellerna angriper din kropp (transplantat-mot-värd-reaktion)
- yrsel, huvudvärk, dimsyn
- okontrollerade skakningar i kroppen (krampanfall)
- en känsla av myrkrypningar, stickningar eller domningar (parestesi)
- partiell förlust av rörelseförmågan
- hjärtstillestånd
- illamående, kräkningar, diarré
- inflammation i munslemhinnan (mukosit)
- irriterad mage, matstrupe, tarm
- inflammation i tjocktarmen
- anorexi, minskad aptit
- hög blodsockernivå
- hudutslag, klåda, fjällning av huden
- förändrad hudfärg (ska inte förväxlas med gulsot – se nedan)
- hudrodnad (erytem)
- håravfall
- rygg- och buksmärtor, smärtor
- muskel- och ledsmärtor
- onormal elektrisk aktivitet i hjärtat (arytmi)
- inflammation i lungvävnande
- förstorad lever
- förändrad organfunktion
- blockering av en ven i levern (venös ocklusiv leversjukdom, VOD)
- gulfärgning av hud och ögon (gulsot)
- försämrad hörsel
- tilltäppning av lymfkärl
- högt blodtryck
- förhöjda nivåer av lever-, njur- och matspjälkningsenzymer
- onormala mängder av elektrolyter i blodet
- viktökning
- feber, allmän svaghet, frossbrytningar
- blödningar
- näsblödningar
- allmän svullnad på grund av vätskeansamling (ödem)
- smärta eller inflammation på injektionsstället
- ögoninfektion (konjunktivit)
- minskat spermieantal
- blödningar från slidan
- uteblivna menstruationer (amenorré)
- minnesförlust
- försenad viktökning och längdtillväxt
- rubbning av urinblåsans funktion
- för låg produktion av testosteron
- otillräcklig produktion av sköldkörtelhormon
- otillräcklig aktivitet hos hypofysen
- förvirringstillstånd
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 användare)
- oro, förvirring
- onormal utbuktning av en av artärerna i hjärnan (intrakraniell aneurysm)
- förhöjd kreatininnivå
- allergiska reaktioner
- blodpropp (tilltäppning av ett blodkärl; emboli)
- rubbningar i hjärtrytmen
- bristande funktion hos hjärtat
- bristande funktion hos hjärtkärlsystemet
- syrebrist
- vätskeansamling i lungorna (lungödem)
- lungblödningar
- andningsstillestånd
- blod i urinen (hematuri) och måttlig försämring av njurfunktionen
- inflammation i urinblåsan
- obehag vid urinering och minskad urinmängd (dysuri och oliguri)
- ökad mängd kvävekomponenter i blodbanan (ökad BUN)
- grå starr (katarakt)
- bristande funktion hos levern
- hjärnblödning
- hosta
- förstoppning och magbesvär
- tilltäppning av tarmen
- perforering av magsäcken
- förändrad muskelspänning
- kraftigt minskad koordination av muskelrörelser
- blåmärken på grund av lågt antal blodplättar
- klimakteriesymtom
- cancer
- onormal hjärnfunktion
- manlig och kvinnlig ofruktsamhet
Mindre vanliga biverkningar (kan förekomma hos upp till 1 av 100 användare)
- hudinflammation och fjällning av huden (erytroderm psoriasis)
- delirium, nervositet, hallucinationer, agitation
- sår i mage/tarm
- inflammation i hjärtats muskelvävnad (myokardit)
- hjärtsjukdom (kardiomyopati)
Ingen känd frekvens (frekvensen kan inte beräknas från tillgängliga data)
- förhöjt blodtryck i artärerna (blodkärl) i lungorna (pulmonell arteriell hypertension)
- allvarlig hudskada (t.ex. allvarliga lesioner, större blåsor etc.) som potentiellt omfattar hela kroppsytan vilket kan vara livshotande
- skada på en del av hjärnan (den så kallade vita hjärnsubstansen) som till och med kan vara livshotande (leukoencefalopati).
Rapportering av biverkningar
Om du får biverkningar, kontakta din läkare eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen, etiketten på aluminiumomslag och påse efter UTG.DAT. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras och transporteras kallt (2 °C–8 °C).
Får ej frysas.
Förvara påsen i aluminiumomslaget för att skydda det mot aktivering.
Efter aktivering och beredning av påsen är lösningen stabil upp till 48 timmar när den förvaras vid 2 °C–8 °C och upp till 6 timmar vid förvaring vid 25 °C.
Ur mikrobiologisk synvinkel bör produkten användas omedelbart.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är tiotepa. En påse innehåller 400 mg tiotepa. Efter beredning med vätskan innehåller varje ml lösning 1 mg tiotepa
- De andra innehållsämnen är natriumklorid och vatten för injektionsvätskor (se avsnitt Vad du behöver veta innan produkten används “TEPADINA innehåller natrium”).
Läkemedlets utseende och förpackningsstorlekar
TEPADINA levereras i en dubbelkammarpåse som innehåller 400 mg tiotepa och 400 ml natriumklorid 9 mg/ml (0,9 %) lösning för injektion.
Efter beredning innehåller påsen en klar och färglös lösning för infusion.
Varje påse är förpackad i ett aluminumomslag.
Varje kartong innehåller 1 påse.
Innehavare av godkännande för försäljning och tillverkare
ADIENNE S.r.l. S.U.
Via Galileo Galilei, 19
20867 Caponago (MB) Italien
Tel. +39-02 40700445
adienne@adienne.com
För ytterligare upplysningar om detta läkemedel, kontakta ombudet för innehavaren av godkännandet för försäljning:
Suomi/Finland
Accord Healthcare Oy
Puh/Tel: + 358 10 231 4180
Denna bipacksedel ändrades senast: 06/2024
Övriga informationskällor
Ytterligare information om detta läkemedel finns tillgänglig på Europeiska läkemedelsmyndighetens hemsida http://www.ema.europa.eu
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för sjukvårdspersonal:
BEREDNINGSANVISNING
TEPADINA 400 mg pulver och vätska till infusionsvätska, lösning
tiotepa
Läs denna anvisning före beredning och administrering av TEPADINA.
1. BESKRIVNING
En påse innehåller 400 mg tiotepa.
Efter beredning med vätskan innehåller varje ml lösning 1 mg of tiotepa.
TEPADINA måste beredas före administrering.
2. DOSERING OCH ADMINISTRERINGSSÄTT
Beräkning av dosen TEPADINA
TEPADINA administreras i olika doser i kombination med andra kemoterapeutika till patienter före konventionell hematopoetisk stamcellstransplantation (HSCT) vid hematologiska sjukdomar eller solida tumörer.
Doseringen av TEPADINA delas in i vuxna och barn efter typen av HSCT (autolog eller allogen) och sjukdom.
Om nödvändigt måste dosjustering av TEPADINA göras enligt specifik metod.
Om den beräknade dosen som behövs är större än 400 mg men mindre än en multipel av det, ska användaren tillföra de nödvändiga milligrammen från TEPADINA-injektionsflaskor genom att använda en därför avsedd anslutning (luer-anslutning) i TEPADINA 400 mg (steg 5 i bruksanvisningen i bipacksedeln).
Om den beräknade dosen som behövs är mindre än 400 mg, ska användaren avlägsna de onödiga mg av den fullt beredda 1 mg/ml lösningen eller ställa in en infusionspump med mängden läkemedel som ska administreras i ml.
Dosering hos vuxna
AUTOLOG HSCT
Hematologiska sjukdomar
Rekommenderad dos vid hematologiska sjukdomar varierar mellan 125 mg/m2/dag (3,38 mg/kg/dag) och 300 mg/m2/dag (8,10 mg/kg/dag) som en enda daglig infusion, och administreras från 2 till 4 dagar i följd före autolog HSCT, beroende på kombination med andra kemoterapeutika. Den totala maximala kumulativa dosen på 900 mg/m2 (24,32 mg/kg) får inte överskridas under konditioneringsbehandlingen.
LYMFOM
Rekommenderad dos ligger mellan 125 mg/m2/dag (3,38 mg/kg/dag) och 300 mg/m2/dag (8,10 mg/kg/dag) som en enda daglig infusion, som administreras från 2 upp till 4 dagar i följd före autolog HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 900 mg/m2 (24,32 mg/kg) under hela konditioneringsbehandlingen.
LYMFOM I CENTRALA NERVSYSTEMET (CNS)
Rekommenderad dos är 185 mg/m2/dag (5 mg/kg/dag) som en enda daglig infusion, som administreras i 2 dagar i följd före autolog HSCT, utan att överskrida den totala maximala kumulativa dosen på 370 mg/m2 (10 mg/kg) under hela konditioneringsbehandlingen.
MULTIPELT MYELOM
Rekommenderad dos ligger mellan 150 mg/m2/dag (4,05 mg/kg/dag) och 250 mg/m2/dag (6,76 mg/kg/dag) som en enda daglig infusion, som administreras i 3 dagar i följd före autolog HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 750 mg/m2 (20,27 mg/kg) under hela konditioneringsbehandlingen.
Solida tumörer
Rekommenderad dos vid solida tumörer ligger mellan 120 mg/m2/dag (3,24 mg/kg/dag) och 250 mg/m2/dag (6,76 mg/kg/dag) uppdelat på en eller två dagliga infusioner, som administreras från 2 upp till 5 dagar i följd före autolog HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 800 mg/m2 (21,62 mg/kg) under hela konditioneringsbehandlingen.
BRÖSTCANCER
Rekommenderad dos ligger mellan 120 mg/m2/dag (3,24 mg/kg/dag) och 250 mg/m2/dag (6,76 mg/kg/dag) som en enda daglig infusion, som administreras från 3 upp till 5 dagar i följd före autolog HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 800 mg/m2 (21,62 mg/kg) under hela konditioneringsbehandlingen.
CNS-TUMÖRER
Rekommenderad dos ligger mellan 125 mg/m2/dag (3,38 mg/kg/dag) och 250 mg/m2/dag (6,76 mg/kg/dag) uppdelat på en eller två dagliga infusioner, som administreras från 3 upp till 4 dagar i följd före autolog HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 750 mg/m2 (20,27 mg/kg) under hela konditioneringsbehandlingen.
OVARIALCANCER
Rekommenderad dos är 250 mg/m2/dag (6,76 mg/kg/dag) som en enda daglig infusion, som administreras i 2 dagar i följd före autolog HSCT, utan att överskrida den totala maximala kumulativa dosen på 500 mg/m2 (13,51 mg/kg) under hela konditioneringsbehandlingen.
KÖNSCELLSTUMÖRER
Rekommenderad dos ligger mellan 150 mg/m2/dag (4,05 mg/kg/dag) och 250 mg/m2/dag (6,76 mg/kg/dag) som en enda daglig infusion, som administreras i 3 dagar i följd före autolog HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 750 mg/m2 (20,27 mg/kg) under hela konditioneringsbehandlingen.
ALLOGEN HSCT
Hematologiska sjukdomar
Rekommenderad dos vid hematologiska sjukdomar ligger mellan 185 mg/m2/dag (5 mg/kg/dag) och 481 mg/m2/dag (13 mg/kg/dag) uppdelat på en eller två dagliga infusioner, som administreras från 1 upp till 3 dagar i följd före allogen HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 555 mg/m2 (15 mg/kg) under hela konditioneringsbehandlingen.
LYMFOM
Rekommenderad dos vid lymfom är 370 mg/m2/dag (10 mg/kg/dag) uppdelat på två dagliga infusioner före allogen HSCT, utan att överskrida den totala maximala kumulativa dosen på 370 mg/m2 (10 mg/kg) under hela konditioneringsbehandlingen.
MULTIPELT MYELOM
Rekommenderad dos är 185 mg/m2/dag (5 mg/kg/dag) som en enda daglig infusion före allogen HSCT, utan att överskrida den totala maximala kumulativa dosen på 185 mg/m2 (5 mg/kg) under hela konditioneringsbehandlingen.
LEUKEMI
Rekommenderad dos ligger mellan 185 mg/m2/dag (5 mg/kg/dag) och 481 mg/m2/dag (13 mg/kg/dag) uppdelat på en eller två dagliga infusioner, som administreras från 1 upp till 2 dagar i följd före allogen HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 555 mg/m2 (15 mg/kg) under hela konditioneringsbehandlingen.
TALASSEMI
Rekommenderad dos är 370 mg/m2/dag (10 mg/kg/dag) uppdelat på två dagliga infusioner, som administreras före allogen HSCT, utan att överskrida den totala maximala kumulativa dosen på 370 mg/m2 (10 mg/kg) under hela konditioneringsbehandlingen.
Dosering hos pediatriska patienter
AUTOLOG HSCT
Solida tumörer
Rekommenderad dos vid solida tumörer ligger mellan 150 mg/m2/dag (6 mg/kg/dag) och 350 mg/m2/dag (14 mg/kg/dag) som en enda daglig infusion, som administreras från 2 upp till 3 dagar i följd före autolog HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 1 050 mg/m2 (42 mg/kg) under hela konditioneringsbehandlingen.
CNS-TUMÖRER
Rekommenderad dos ligger mellan 250 mg/m2/dag (10 mg/kg/dag) och 350 mg/m2/dag (14 mg/kg/dag) som en enda daglig infusion, som administreras i 3 dagar i följd före autolog HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 1 050 mg/m2 (42 mg/kg) under hela konditioneringsbehandlingen.
ALLOGEN HSCT
Hematologiska sjukdomar
Rekommenderad dos vid hematologiska sjukdomar ligger mellan 125 mg/m2/dag (5 mg/kg/dag) och 250 mg/m2/dag (10 mg/kg/dag) uppdelat på en eller två dagliga infusioner, som administreras från 1 upp till 3 dagar i följd före allogen HSCT beroende på kombinationen med andra kemoterapeutika, utan att överskrida den totala maximala kumulativa dosen på 375 mg/m2 (15 mg/kg) under hela konditioneringsbehandlingen.
LEUKEMI
Rekommenderad dos är 250 mg/m2/dag (10 mg/kg/dag) uppdelat på två dagliga infusioner, som administreras före allogen HSCT, utan att överskrida den totala maximala kumulativa dosen på 250 mg/m2 (10 mg/kg) under hela konditioneringsbehandlingen.
TALASSEMI
Rekommenderad dos ligger mellan 200 mg/m2/dag (8 mg/kg/dag) och 250 mg/m2/dag (10 mg/kg/dag) uppdelat på två dagliga infusioner, som administreras före allogen HSCT, utan att överskrida den totala maximala kumulativa dosen på 250 mg/m2 (10 mg/kg) under hela konditioneringsbehandlingen.
REFRAKTÄR CYTOPENI
Rekommenderad dos är 125 mg/m2/dag (5 mg/kg/dag) som en enda daglig infusion, som administreras i 3 dagar i följd före allogen HSCT, utan att överskrida den totala maximala kumulativa dosen på 375 mg/m2 (15 mg/kg) under hela konditioneringsbehandlingen.
GENETISKA SJUKDOMAR
Rekommenderad dos är 125 mg/m2/dag (5 mg/kg/dag) som en enda daglig infusion, som administreras i 2 dagar i följd före allogen HSCT, utan att överskrida den totala maximala kumulativa dosen på 250 mg/m2 (10 mg/kg) under hela konditioneringsbehandlingen.
SICKLECELLANEMI
Rekommenderad dos är 250 mg/m2/dag (10 mg/kg/dag) uppdelat på två dagliga infusioner, som administreras före allogen HSCT, utan att överskrida den totala maximala kumulativa dosen på 250 mg/m2 (10 mg/kg) under hela konditioneringsbehandlingen.
Aktivering av påsen och beredning
TEPADINA 400 mg måste beredas med 400 ml natriumklorid 9 mg/ml (0,9 %) lösning. Den slutliga beredda lösningen erhålls efter att den avrivbara förslutningen bryts och påsens innehåll (pulver och vätska) blandas tills pulvret har fullständigt upplösts.
Efter beredning med vätska innehåller varje ml lösning 1 mg tiotepa.
Endast färglösa lösningar utan några partiklar får användas.
Använd inte detta läkemedel om du upptäcker några synliga tecken på försämring.
Administrering
Infusionslösningen med TEPADINA ska inspekteras visuellt för kontroll av partiklar före administrering. Lösningar som innehåller utfällning ska kasseras.
Infusionslösningen måste administreras till patienterna med hjälp av ett infusionsaggregat som är utrustat med ett 0,2 µm ”in‑line”-filter. Filtreringen förändrar inte verkningsförmågan.
TEPADINA ska administreras med aseptisk teknik som en infusion under 2–4 timmar i rumstemperatur (cirka 25 °C) och normala ljusförhållanden.
Före och efter varje infusion ska kvarkatetern spolas med ungefär 5 ml natriumklorid 9 mg/ml (0,9 procent) lösning för injektionsvätskor.
3. SÄRSKILDA ANVISNINGAR FÖR DESTRUKTION OCH ÖVRIG HANTERING
Allmänt
Metoder för rätt hantering och kassering av cancerläkemedel ska beaktas. Alla överföringsförfaranden kräver att aseptiska tekniker noggrant följs, helst användning av en säkerhetshuv med laminärt luftflöde.
Liksom när det gäller andra cytotoxiska substanser, måste försiktighet iakttas vid hantering och beredning av TEPADINA-lösningar för att undvika oavsiktlig kontakt med hud eller slemhinnor. Lokala reaktioner associerade med oavsiktlig exponering för tiotepa kan förekomma. Användning av handskar rekommenderas vid beredning av injektionsvätskan. Om lösning innehållande tiotepa oavsiktligt kommer i kontakt med huden, måste huden omedelbart tvättas noggrant med tvål och vatten. Om tiotepa oavsiktligt kommer i kontakt med slemhinnor, måste de spolas med rikligt med vatten.
Destruktion
TEPADINA är enbart avsett för engångsbruk.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
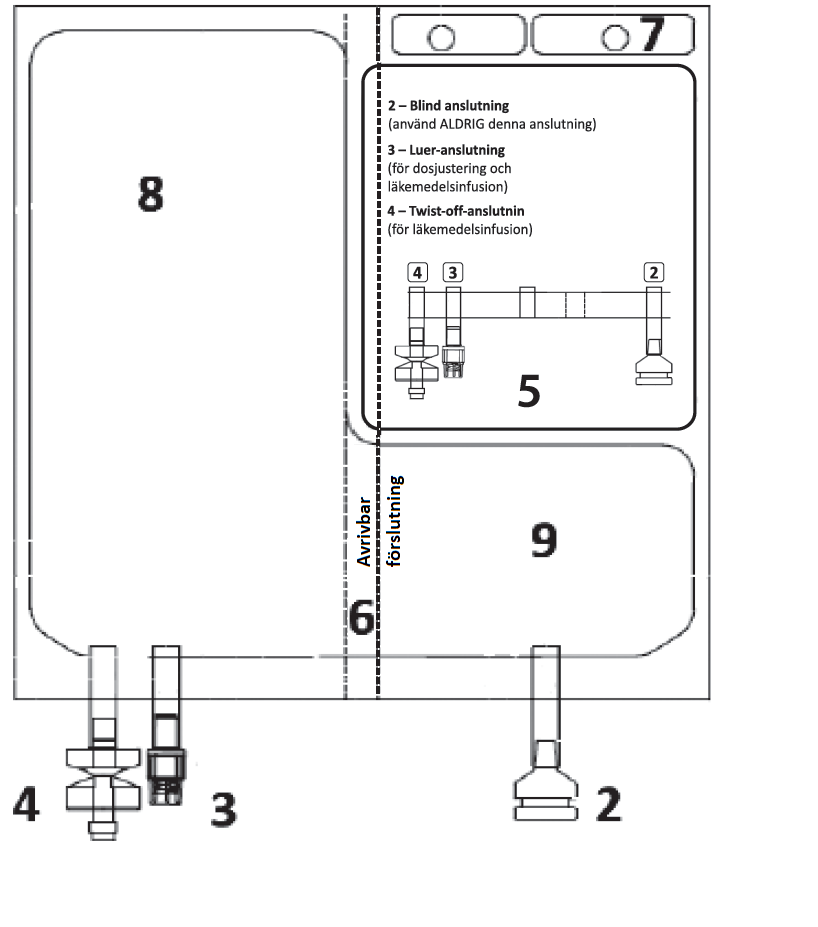
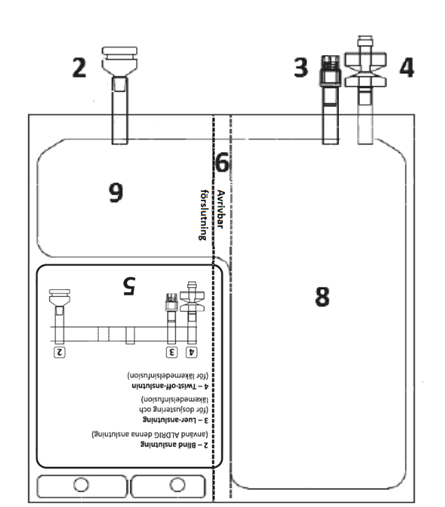
Figur A 1 – Hack i den yttre påsen
| Figur B 2 – Blind anslutning (använd ALDRIG denna anslutning) 3 – Luer-anslutning 4 – Twist-off-anslutning 5 – Etikettområde 6 – Avrivbar förslutning (måste brytas för att aktivera) 7 – Hål (för att hänga påsen) 8 – Vätskekammare 9 – Pulverkammare
|
| 1 – TA BORT DEN YTTRE PÅSEN | |||
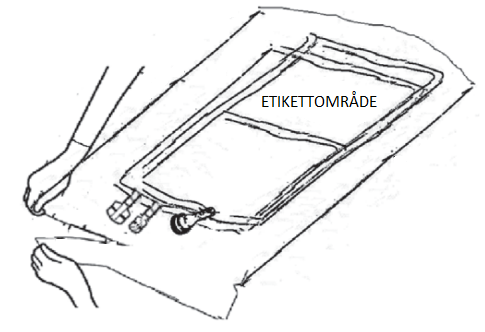
a) Placera påsen på en ren, stabil yta innan du öppnar den. b) Riv av vid hacket på den yttre påsen som finns nära anslutningarna (Figur A – punkt 1). c) Riv upp de korta sidorna för att komma åt den inre påsen enligt Figur C.
Figur C
| d) Ta ut den flexibla dubbelkammarpåsen ur den sekundära aluminiumförpackningen och vik upp påsen Figur D.
Figur D
| ||
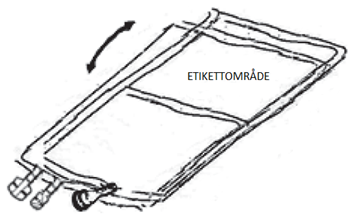
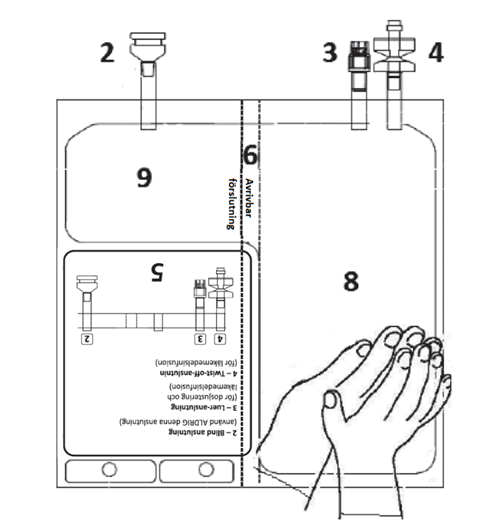
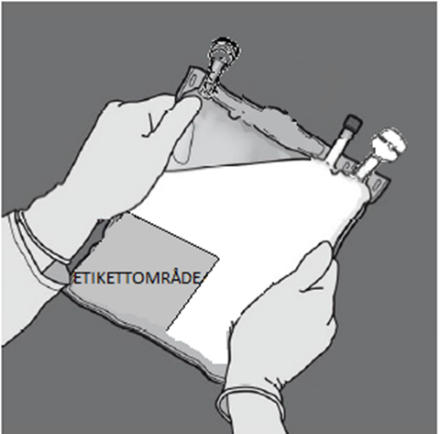
| 2 – GRANSKA PÅSEN FÖRE AKTIVERING. | 3 – AKTIVERA PÅSEN | ||
Placera påsen på en ren, stabil yta med textsidan upp och anslutningarna pekande bort från dig, enligt Figur E. Kontrollera att det inte finns vätska eller produktläckage från anslutningarna 2, 3, 4 och från kamrarna 8, 9. Kontrollera att avrivbara förslutningen 6 är intakt och kontrollera att det inte finns vätska i kammare 9.
Figur E
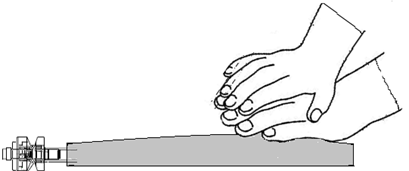
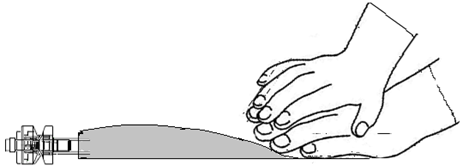
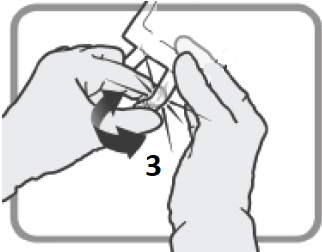
| Lägg den ena handen över den andra på den lägre delen av kammare 8 (enligt Figur F). Tryck stadigt för att utöva ett jämnt tryck tills den avrivbara förslutningen 6 är fullständigt aktiverad (det kan ta upp till 5 sekunder av konstant tryck för att bryta den avrivbara förseglingen 6).
Figur F
| ||
| PÅSEN FÖRE AKTIVERING | PÅSEN EFTER AKTIVERING | ||
Figur G
| Figur H
| ||
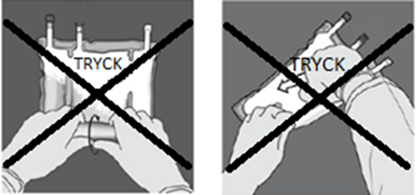
| Kläm eller tryck INTE kraftigt. | Figur I
| ||
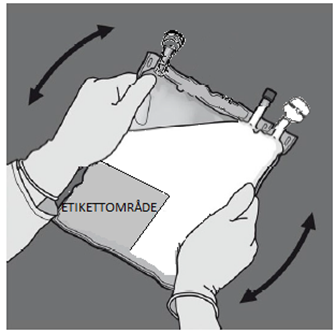
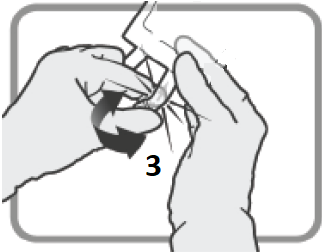
| 4 – GRANSKA PÅSEN FÖR ATT BEKRÄFTA AKTIVERING. | |||
Kontrollera att den avrivbara förslutningen 6 nu är fullständigt aktiverad. Kammare 8 och 9 har gått samman. Figur J
| Blanda försiktigt tills produkten ar fullständigt upplöst. Figur K
| ||
| 5 – DOSJUSTERING – Se avsnitt. 2 “Dosering och administreringssätt” och 3 “Särskilda anvisningar för destruktion och övrig hantering” | |||
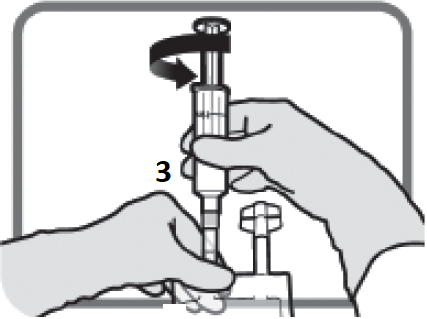
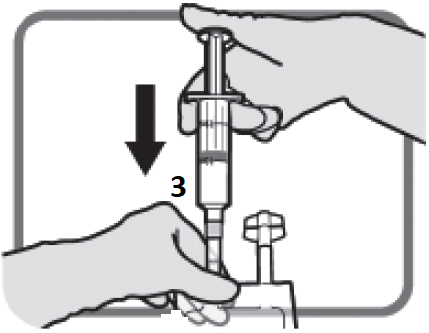
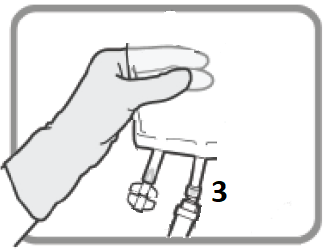
Identifiera Luer-anslutning 3 om korrigerande dos är nödvändig. Avlägsna plastlocket från Luer-anslutningen.
Figur L | Skruva på luer-lock-enheten enligt Figur M. Använd inte olämpliga icke-Luer-lock-enheter på port 3.
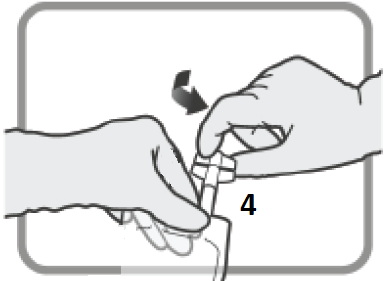
Figur M Se till att anslutningen är ordentligt på plats och spänn. | Utför dosjustering enligt avsnitt 2 och 3.
Figur N Skruva bort enheten då du är klar. Sätt plastlocket på Luer-anslutning 3 innan du går vidare till infusion. | |
| 6 – ANLUTNING - Infusionssatsen kan vara ansluten till påsen via antingen luer-anslutningen eller spikanslutningen. | |
ALTERNATIV A – SPIKANSLUTNING Identifiera twist-off-anslutning 4 om spikinfusionssats. Vrid av plastlocket innan du för in spiken.
Figur O För in spikanslutningen.
Figur P | ALTERNATIV B– LUER-ANSLUTNING Välj Luer-lockanslutning 3 om Luer-anslutningsinfusionssats. Ta bort plastlocket från Luer-anslutning 3 innan du ansluter Luer-anslutningen.
Figur Q För in Luer-anslutningen.
Figur R Se till att anslutningarna är ordentligt på plats och spänn. |
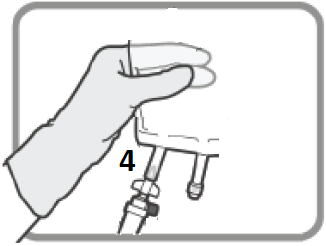
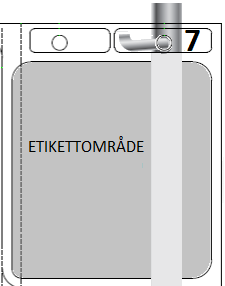
| 7. HÄNG PÅSEN | |
| Häng påsen från hålet 7. |
Figur S
|