Pakkausseloste
TEPADINA infuusiokuiva-aine ja liuotin, liuosta varten 400 mg
TEPADINA 400 mg infuusiokuiva-aine ja liuotin, liuosta varten
tiotepa
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, käänny lääkärin puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä TEPADINA on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät TEPADINAa
3. Miten TEPADINAa käytetään
4. Mahdolliset haittavaikutukset
5. TEPADINAn säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
TEPADINAn vaikuttava aine on tiotepa, joka kuuluu alkyloivat aineet -nimisiin lääkkeisiin.
TEPADINAa käytetään valmisteluhoitona luuydinsiirtoa odottaville potilaille. Se vaikuttaa tuhoamalla luuydinsoluja. Tämä mahdollistaa uusien luuydinsolujen (hematopoieettisten kantasolujen) siirtämisen, minkä ansiosta elimistö voi alkaa tuottaa terveitä verisoluja.
TEPADINAa voidaan käyttää sekä aikuis- että lapsipotilaille ja nuorille.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä TEPADINAa
- jos olet allerginen tiotepalle,
- jos olet tai epäilet olevasi raskaana,
- jos imetät,
- jos sinulle annetaan keltakuume-, bakteeri- tai eläviä viruksia sisältäviä rokotteita.
Varoitukset ja varotoimet
Kerro lääkärillesi, jos sinulla on jokin seuraavista:
- maksa- tai munuaisongelmia,
- sydän- tai keuhko-ongelmia,
- kouristuksia/kohtauksia (epilepsia) tai sinulla on joskus ollut niitä (jos hoitoon on käytetty fenytoiinia tai fosfenytoiinia).
Koska TEPADINA tuhoaa luuydinsoluja jotka aikaansaavat verisolujen muodostumisen, on hoidon aikana käytävä säännöllisesti verikokeissa verenkuvan seuraamiseksi.
Infektioiden ehkäisemiseksi ja hoitamiseksi saat myös infektiolääkkeitä.
TEPADINA voi aiheuttaa jonkin toisen syövän tulevaisuudessa. Lääkäri keskustelee kanssasi tästä riskistä.
Muut lääkevalmisteet ja TEPADINA
Kerro lääkärille, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai epäilet olevasi raskaana tai jos imetät, kerro siitä lääkärille ennen TEPADINA-hoidon aloittamista. Et saa käyttää TEPADINAa raskauden aikana.
TEPADINA-hoitoa saavien naisten ja miesten on käytettävä tehokasta raskaudenehkäisyä hoidon aikana. Miehet eivät saa siittää lasta TEPADINA-hoidon aikana eivätkä vuoteen hoidon päättymisen jälkeen.
Ei tiedetä, erittyykö tämä lääkevalmiste ihmisen rintamaitoon. Varotoimenpiteenä naiset eivät saa imettää TEPADINA-hoidon aikana.
TEPADINA voi heikentää miesten ja naisten hedelmällisyyttä. Miespotilaiden tulisi harkita siemennesteen talteenottoa ja jäädyttämistä ennen hoidon aloittamista.
Ajaminen ja koneiden käyttö
Todennäköisesti tiotepan tietyt haittavaikutukset, kuten huimaus, päänsärky ja näön hämärtyminen, voivat vaikuttaa ajamiseen ja koneiden käyttöön. Jos sinulla on näitä haittavaikutuksia, älä aja äläkä käytä koneita.
TEPADINA sisältää natriumia.
Tämä lääkevalmiste sisältää 1 418 mg (61,6 mmol) natriumia (ruokasuolan toinen ainesosa) per pussi. Tämä vastaa 70,9% a suositellusta natriumin enimmäisvuorokausiannoksesta aikuisille.
Miten valmistetta käytetään
Lääkäri laskee sinulle oikean annoksen kehosi pinta-alan tai painon ja sairautesi mukaan.
Miten TEPADINAa käytetään
TEPADINAn antamisesta vastaa koulutettu hoitoalan ammattilainen. TEPADINA annetaan laskimonsisäisenä infuusiona (tiputuksena suoneen) injektiopullossa olevan lääkeaineen laimentamisen jälkeen. Infuusio kestää 2–4 tuntia.
Antotiheys
Infuusiot annetaan sinulle 12 tai 24 tunnin välein. Hoito voi kestää 5 päivää. Antotiheys ja hoidon kesto määräytyvät sairautesi mukaan.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, TEPADINA voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Vakavimmat haittavaikutukset TEPADINA-hoidosta tai solusiirrosta voivat olla
- verenkierrossa olevien verisolujen määrän väheneminen (lääkevalmisteen toivottu vaikutus, jonka tehtävänä on valmistella elimistöäsi solusiirtoinfuusioon)
- infektio
- maksan toimintahäiriöt, mukaan luettuna maksalaskimon tukos
- solusiirteen hyökkäys elimistöäsi vastaan (käänteishyljintäsairaus)
- hengitysteiden komplikaatiot.
Lääkäri seuraa verisolu- ja maksaentsyymiarvojasi säännöllisesti, jotta nämä haittavaikutukset voidaan havaita ja hoitaa mahdollisimman varhain.
TEPADINAn haittavaikutusten esiintymisen yleisyys vaihtelee. Esiintymisen yleisyys määritetään seuraavasti:
Hyvin yleiset haittavaikutukset (saattaa esiintyä useammalla kuin 1 käyttäjällä 10 ihmisestä)
- lisääntynyt infektioalttius
- koko kehon tulehdustila (sepsis)
- valkosolujen, verihiutaleiden ja punasolujen määrän väheneminen (anemia)
- solusiirteen hyökkäys elimistöäsi vastaan (käänteishyljintäsairaus)
- heitehuimaus, päänsärky, sumentunut näkö
- elimistön hallitsematon tärinä (kouristus)
- kihelmöinnin, pistelyn tai puutumisen tunne (tuntoharhat)
- liikuntakyvyn osittainen häviäminen
- sydänpysähdys
- pahoinvointi, oksentelu, ripuli
- suun limakalvojen tulehdus (limakalvotulehdus)
- ärtynyt maha, ruokatorvi, suoli
- koolonin tulehdus
- anoreksia, ruokahalun heikentyminen
- korkea verensokeri
- ihottuma, kutina, hilseily
- ihonvärin muutokset (ei saa sekoittaa keltatautiin, katso jäljempänä)
- ihon punoitus (eryteema)
- hiustenlähtö
- selän ja vatsan alueen kipu, kipu
- lihas- ja nivelkipu
- sydämen sähköisen toiminnan epänormaalius (rytmihäiriöt)
- keuhkokudoksen tulehdus
- maksan suurentuminen
- elinten toiminnan muuttuminen
- maksalaskimon tukos (veno-occlusive disease, VOD)
- ihon ja silmien keltaisuus (keltatauti)
- kuulon heikkeneminen
- imuteiden tukkeutuminen
- korkea verenpaine
- kohonneet maksa-, munuais- ja ruoansulatusentsyymiarvot
- epänormaali veren elektrolyyttipitoisuus
- painonnousu
- kuume, yleinen heikkous, vilunväristykset
- verenvuoto
- nenäverenvuoto
- yleinen turvotus nesteen kerääntymisen vuoksi (edeema)
- kipu tai tulehdus infuusioneulan pistoskohdassa
- silmätulehdus (sidekalvotulehdus)
- siittiöiden määrän väheneminen
- emätinverenvuoto
- kuukautisten poisjäänti (amenorrea)
- muistinmenetys
- painon kehityksen ja pituuskasvun viivästyminen
- virtsarakon toimintahäiriöt
- testosteronin vajaatuotanto
- kilpirauhashormonin vajaatuotanto
- aivolisäkkeen vajaatoiminta
- sekavuus
Yleiset haittavaikutukset (saattaa esiintyä 1 käyttäjällä 10 ihmisestä)
- ahdistuneisuus, sekavuus
- aivovaltimon epänormaali pullistuminen ulospäin (kallonsisäinen valtimonpullistuma)
- kohonnut kreatiniinipitoisuus
- allergiset reaktiot
- verisuonitukos (veritulppa)
- sydämen rytmihäiriöt
- sydämen vajaatoiminta
- sydän- ja verenkiertoelimistön vajaatoiminta
- hapenpuutos
- nesteen kerääntyminen keuhkoihin (keuhkopöhö)
- keuhkoverenvuoto
- hengityspysähdys
- verivirtsaisuus (hematuria) ja keskivaikea munuaisten vajaatoiminta
- virtsarakon tulehdus
- kivulias tai vaikeutunut virtsaaminen, virtsamäärän väheneminen (dysuria ja oliguria)
- typpiyhdistepitoisuuden nousu verenkierrossa
- kaihi
- maksan vajaatoiminta
- aivoverenvuoto
- yskä
- ummetus ja vatsavaivat
- suolistotukos
- mahalaukun puhkeama
- lihasjännityksen muutokset
- lihasten liikekoordinaation vaikea puutos
- verihiutaleiden vähyydestä johtuvat mustelmat
- vaihdevuosioireet
- syöpä (toissijaiset syövät)
- epänormaali aivotoiminta
- miehen ja naisen hedelmättömyys
Melko harvinaiset haittavaikutukset (saattaa esiintyä 1 käyttäjällä 100 ihmisestä)
- ihon tulehdukset ja kuoriutuminen (erytroderminen psoriaasi)
- sekavuus, hermostuneisuus, aistiharhat, levottomuus
- mahalaukun tai suolen haavauma
- sydämen lihaskudoksen tulehdus (sydänlihastulehdus)
- epänormaali sydämen tila (sydänlihassairaus)
Tuntematon (koska saatavissa oleva tieto ei riitä yleisyyden arviointiin)
- keuhkovaltimoiden (verisuonten) kohonnut verenpaine (keuhkovaltimoiden verenpainetauti)
- vaikeat ihovauriot (esim. vaikeat leesiot, vesikellot jne.), joita saattaa ilmetä koko kehon alueella ja jotka saattavat olla jopa hengenvaarallisia
- vauriot aivojen tiettyyn osaan (niin sanottuun valkeaan aineeseen), jotka saattavat olla jopa hengenvaarallisia (leukoenkefalopatia).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai hoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkaukseen tai alumiinipakkauksen ja pussin etikettiin merkityn viimeisen käyttöpäivän (Käyt.viim.) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä ja kuljeta kylmässä (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alumiinikääreessä estääksesi aktivoitumisen.
Pussin aktivaation ja valmiiksi sekoittamisen jälkeen tuote säilyy vakaana enintään 48 tuntia, jos se säilytetään 2 °C – 8 °C:n lämpötilassa, tai enintään 6 tuntia, jos se säilytetään 25 °C:n lämpötilassa. Mikrobiologiselta kannalta lääkevalmiste pitää käyttää välittömästi.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä TEPADINA sisältää
Vaikuttava aine on tiotepa.
Yksi pussi sisältää 400 mg tiotepaa.
Käyttövalmiiksi sekoittamisen jälkeen yksi millilitra liuosta sisältää 1 mg tiotepaa.
- Muut ainesosat ovat natriumkloridi ja injektionesteisiin käytettävä vesi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä “TEPADINA sisältää natriumia”).
Lääkevalmisteen kuvaus ja pakkauskoko
TEPADINA on kaksilokeroinen pussi, joka sisältää 400 mg tiotepaa ja 400 ml 0,9 % (9 mg/ml) natriumkloridiliuosta injektiota varten
Käyttövalmiiksi sekoittamisen jälkeen pussi sisältää kirkasta ja väritöntä infuusionestettä.
Jokainen pussi on pakattu alumiinikääreeseen.
Pakkauksessa on 1 pussi.
Myyntiluvan haltija ja valmistaja
ADIENNE S.r.l. S.U.
Via Galileo Galilei, 19
20867 Caponago (MB) Italia
Tel: +39 02 40700445
adienne@adienne.com
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
Accord Healthcare Oy
Puh/Tel: + 358 10 231 4180
Tämä pakkausseloste on tarkistettu viimeksi 06/2024
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston kotisivuilta http://www.ema.europa.eu/.
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
VALMISTUSOHJE
TEPADINA 400 mg infuusiokuiva-aine ja liuotin, liuosta varten
Tiotepa
Lue nämä ohjeet ennen TEPADINAn käyttövalmiiksi sekoittamista ja antamista.
1. ESITTELY
1 pussi sisältää 400 mg tiotepaa.
Käyttövalmiiksi sekoittamisen jälkeen yksi millilitra liuosta sisältää 1 mg tiotepaa.
TEPADINA täytyy sekoittaa käyttövalmiiksi ennen käyttöä.
2. ANNOSTUS JA ANTOTAPA
TEPADINA-annoksen laskeminen
TEPADINAa käytetään erisuuruisina annoksina yhdessä muiden kemoterapia-aineiden kanssa ennen tavanomaista hematopoieettista kantasolusiirtoa (HPCT-hoito) potilailla, joilla on jokin verisairaus tai kiinteitä kasvaimia.
TEPADINAn annostus aikuisilla ja pediatrisilla potilailla määritetään HPCT:n tyypin (autologinen tai allogeeninen) ja sairauden mukaan.
Tarvittaessa TEPADINAn annoksen sovittaminen pitää tehdä erityisen menetelmän mukaisesti.
Jos laskettu annos on yli 400 mg, mutta vähemmän kuin sen kerroin, käyttäjän täytyy lisätä tarvittava mg-määrä TEPIDINA-injektiopullosta käyttäen siihen tarkoitettua TEPADINA 400 mg -pakkauksen porttia (luer-portti) (kohta Valmisteen säilyttäminen pakkausselosteen käyttöohjeissa).
Jos laskettu annos on vähemmän kuin 400 mg, käyttäjän täytyy poistaa tarpeeton mg-määrä valmistetusta 1 mg/ml liuoksesta tai säätää infuusiopumppuun annettavaksi tarkoitettu määrä millilitroina.
Annostus aikuisilla
AUTOLOGINEN HPCT
Verisairaudet
Suositusannos verisairauksissa vaihtelee 125 mg:sta/m2/päivä (3,38 mg/kg/päivä) 300 mg:aan/m2/päivä (8,10 mg/kg/päivä) päivittäisenä kertainfuusiona, joka annetaan 2–4 peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 900 mg/m2 (24,32 mg/kg).
LYMFOOMA
Suositusannos vaihtelee 125 mg:sta/m2/päivä (3,38 mg/kg/päivä) 300 mg:aan/m2/päivä (8,10 mg/kg/päivä) päivittäisenä kertainfuusiona, joka annetaan 2–4 peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 900 mg/m2 (24,32 mg/kg).
KESKUSHERMOSTOLYMFOOMA
Suositusannos on 185 mg/m2/päivä (5 mg/kg/päivä) päivittäisenä kertainfuusiona, joka annetaan kahtena peräkkäisenä päivänä ennen autologista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 370 mg/m2 (10 mg/kg).
MULTIPPELI MYELOOMA
Suositusannos vaihtelee 150 mg:sta/m2/päivä (4,05 mg/kg/päivä) 250 mg:aan/m2/päivä (6,76 mg/kg/päivä) päivittäisenä kertainfuusiona, joka annetaan kolmena peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 750 mg/m2 (20,27 mg/kg).
Kiinteät kasvaimet
Suositusannos kiinteiden kasvainten hoidossa vaihtelee 120 mg:sta/m2/päivä (3,24 mg/kg/päivä) 250 mg:aan/m2/päivä (6,76 mg/kg/päivä) jaettuna kerran tai kahdesti päivässä annettavaan infuusioon, joka annetaan 2–5 peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 800 mg/m2 (21,62 mg/kg).
RINTASYÖPÄ
Suositusannos vaihtelee 120 mg:sta/m2/päivä (3,24 mg/kg/päivä) 250 mg:aan/m2/päivä (6,76 mg/kg/päivä) päivittäisenä kertainfuusiona, joka annetaan 3–5 peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 800 mg/m2 (21,62 mg/kg).
KESKUSHERMOSTOKASVAIMET
Suositusannos vaihtelee 125 mg:sta/m2/päivä (3,38 mg/kg/päivä) 250 mg:aan/m2/päivä (6,76 mg/kg/päivä) jaettuna kerran tai kahdesti päivässä annettavaan infuusioon, joka annetaan 3–4 peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 750 mg/m2 (20,27 mg/kg).
MUNASARJASYÖPÄ
Suositusannos on 250 mg/m2/päivä (6,76 mg/kg/päivä) päivittäisenä kertainfuusiona, joka annetaan kahtena peräkkäisenä päivänä ennen autologista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 500 mg/m2 (13,51 mg/kg).
ITUSOLUKASVAIMET
Suositusannos vaihtelee 150 mg:sta/m2/päivä (4,05 mg/kg/päivä) 250 mg:aan/m2/päivä (6,76 mg/kg/päivä) yhtenä päivittäisenä infuusiona, joka annetaan kolmena peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 750 mg/m2 (20,27 mg/kg).
ALLOGEENINEN HPCT
Verisairaudet
Suositusannos verisairauksissa vaihtelee 185 mg:sta/m2/päivä (5 mg/kg/päivä) 481 mg:aan/m2/päivä (13 mg/kg/päivä) jaettuna kerran tai kahdesti päivässä annettavaan infuusioon, joka annetaan 1–3 peräkkäisenä päivänä ennen allogeenista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 555 mg/m2 (15 mg/kg).
LYMFOOMA
Suositusannos lymfooman hoidossa on 370 mg/m2/päivä (10 mg/kg/päivä) jaettuna kahteen päivittäiseen infuusioon ennen allogeenista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 370 mg/m2 (10 mg/kg).
MULTIPPELI MYELOOMA
Suositusannos on 185 mg/m2/päivä (5 mg/kg/päivä) yhtenä kertainfuusiona ennen allogeenista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 185 mg/m2 (5 mg/kg).
LEUKEMIA
Suositusannos vaihtelee 185 mg:sta/m2/päivä (5 mg/kg/päivä) 481 mg:aan/m2/päivä (13 mg/kg/päivä) jaettuna kerran tai kahdesti päivässä annettavaan infuusioon, joka annetaan 1–2 peräkkäisenä päivänä ennen allogeenista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 555 mg/m2 (15 mg/kg).
TALASSEMIA
Suositusannos on 370 mg/m2/päivä (10 mg/kg/päivä) jaettuna kahteen päivittäiseen infuusioon ennen allogeenista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 370 mg/m2 (10 mg/kg).
Annostus pediatrisilla potilailla
AUTOLOGINEN HPCT
Kiinteät kasvaimet
Suositusannos kiinteiden kasvainten hoidossa vaihtelee 150 mg:sta/m2/päivä (6 mg/kg/päivä) 350 mg:aan/m2/päivä (14 mg/kg/päivä) yhtenä päivittäisenä infuusiona, joka annetaan 2–3 peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 1 050 mg/m2 (42 mg/kg).
KESKUSHERMOSTOKASVAIMET
Suositusannos vaihtelee 250 mg:sta/m2/päivä (10 mg/kg/päivä) 350 mg:aan/m2/päivä (14 mg/kg/päivä) päivittäisenä kertainfuusiona, joka annetaan kolmena peräkkäisenä päivänä ennen autologista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 1 050 mg/m2 (42 mg/kg).
ALLOGEENINEN HPCT
Verisairaudet
Suositusannos verisairauksissa vaihtelee 125 mg:sta/m2/päivä (5 mg/kg/päivä) 250 mg:aan/m2/päivä (10 mg/kg/päivä) jaettuna kerran tai kahdesti päivässä annettavaan infuusioon, joka annetaan 1–3 peräkkäisenä päivänä ennen allogeenista HPCT-hoitoa sen mukaan, mitä muita kemoterapia-aineita hoitoon kuuluu. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 375 mg/m2 (15 mg/kg).
LEUKEMIA
Suositusannos on 250 mg/m2/päivä (10 mg/kg/päivä) jaettuna kahteen päivittäiseen infuusioon ennen allogeenista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 250 mg/m2 (10 mg/kg).
TALASSEMIA
Suositusannos vaihtelee 200 mg:sta/m2/päivä (8 mg/kg/päivä) 250 mg:aan/m2/päivä (10 mg/kg/päivä) jaettuna kahteen päivittäiseen infuusioon ennen allogeenista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 250 mg/m2 (10 mg/kg).
HOITOON VASTAAMATON SYTOPENIA
Suositusannos on 125 mg/m2/päivä (5 mg/kg/päivä) yhtenä päivittäisenä infuusiona, joka annetaan kolmena peräkkäisenä päivänä ennen allogeenista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 375 mg/m2 (15 mg/kg).
PERINNÖLLISET SAIRAUDET
Suositusannos on 125 mg/m2/päivä (5 mg/kg/päivä) yhtenä päivittäisenä infuusiona, joka annetaan kahtena peräkkäisenä päivänä ennen allogeenista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 250 mg/m2 (10 mg/kg).
SIRPPISOLUANEMIA
Suositusannos on 250 mg/m2/päivä (10 mg/kg/päivä) jaettuna kahteen päivittäiseen infuusioon ennen allogeenista HPCT-hoitoa. Koko valmisteluhoitojakson aikana ei saa ylittää suurinta sallittua kumulatiivista annosta, joka on 250 mg/m2 (10 mg/kg).
Pussin aktivoiminen ja käyttövalmiiksi saattaminen
TEPADINA 400 mg sekoitetaan 400 ml:aan 0,9 % (9 mg/ml) natriumkloridi-injektionestettä. Käyttövalmis liuos saadaan aikaan rikkomalla kaksilokeroisen pussin irrotettava sinetti ja sekoittamalla sisällöt (jauhe ja liuotin) kunnes jauhe on täysin liuennut
Käyttövalmiiksi saattamisen jälkeen yksi millilitra liuosta sisältää 1 mg tiotepaa.
Vain väritöntä liuosta, jossa ei näy hiukkasia, saa käyttää.
Älä käytä tätä lääkettä, jos havaitset mitään merkkejä vaurioitumisesta.
Annostelu
TEPADINA-infuusioliuos tulee tarkistaa silmämääräisesti ennen käyttöä. Nesteet, joissa on sakkaa, on hävitettävä.
Infuusioneste on annettava potilaalle käyttämällä infuusiovälineitä, joihin kuuluu 0,2 µm:n letkunsisäinen suodatin. Suodatus ei heikennä nesteen vaikutusta.
TEPADINA on annettava aseptisesti 2–4 tuntia kestävänä infuusiona huoneenlämmössä (n. 25 °C) ja normaaleissa valaistusolosuhteissa.
Ennen jokaista infuusiota ja sen jälkeen kestokatetri on huuhdeltava noin viidellä millilitralla 0,9-prosenttista natriumkloridi-injektionestettä (9 mg/ml).
3. ERITYISET VAROTOIMET HÄVITTÄMISELLE JA MUUT KÄSITTELYOHJEET
Yleistä
Syöpälääkkeiden käsittelyyn ja hävittämiseen liittyviä toimintaohjeita on noudatettava. Kaikissa siirtomenettelyissä on ehdottomasti noudatettava aseptista tekniikkaa ja mieluiten käytettävä pystysuoralla virtauksella varustettua laminaarivirtauskaappia.
Muiden syöpälääkkeiden tavoin myös TEPADINA-liuosten käsittelyssä ja valmistamisessa on noudatettava varovaisuutta, jotta valmiste ei joudu vahingossa kosketuksiin ihon tai limakalvojen kanssa. Tiotepalle vahingossa altistumisesta saattaa seurata paikallisia reaktioita. Sen vuoksi suojakäsineiden käyttö on suositeltavaa infuusioliuosta valmistettaessa. Jos tiotepaliuosta joutuu vahingossa iholle, iho on pestävä välittömästi perusteellisesti saippualla ja vedellä. Jos tiotepaa joutuu vahingossa kosketuksiin limakalvojen kanssa, ne on huuhdeltava välittömästi vedellä.
Hävittäminen
TEPADINA-liuos on kertakäyttöistä.
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
|
|
Kuva A
1 – Suojapussin lovi
|
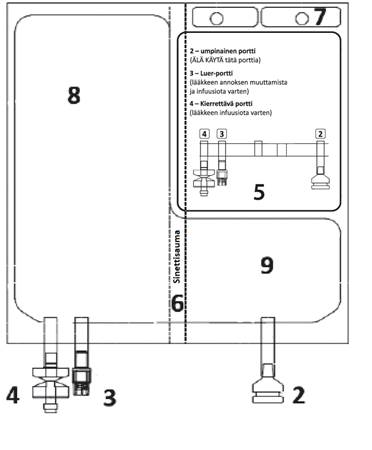
Kuva B
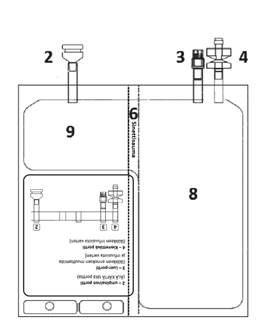
2 – Umpinainen portti (ÄLÄ KÄYTÄ tätä porttia) 3 – Luer-portti 4 – Kierrettävä portti 5 – Etikettialue 6 – Sinettisauma (murrettava aktivaatiota varten) 7 – Aukko (pussin ripustamista varten) 8 – Liuotinlokero 9 – Kuiva-ainelokero
|
| 1 – POISTA SUOJAPUSSI | |
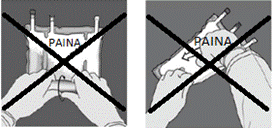
a) Aseta pussi puhtaalle, tasaiselle alustalle ennen avaamista. b) Repäise suojapussin porttien lähellä olevasta lovesta (Kuva A – kohta. 1). c) Revi lyhyet sivut saadaksesi sisemmän pussin esiin. Kuva C.
Kuva C
|
d) Poista pehmeä kaksilokeroinen pussi alumiinikääreestä ja avaa pussi kuten näytetään kuvassa D.
|
| 2 – TUTKI PUSSI ENNEN AKTIVAATIOTA. | 3 – AKTIVOI PUSSI |
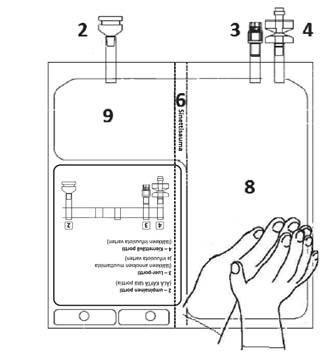
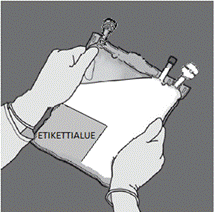
Aseta pussi puhtaalle, tasaiselle pinnalle tekstipuoli ylöspäin ja portit poispäin itsestäsi, kuten kuvassa E. Tarkista, että yhteysporteista 2, 3, 4 tai lokeroista 8, 9 ei ole vuotanut nestettä tai kuiva-ainetta. Tarkista että sinettisauma 6 on ehjä eikä lokerossa 9 ole nestettä.
Kuva E
|
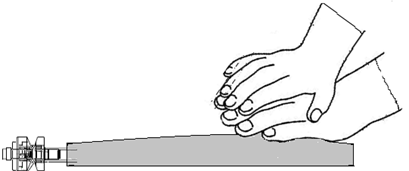
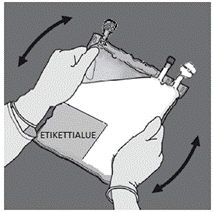
Pane kätesi päällekkäin lokeron 8 alaosan päälle (kuten kuvassa F). Paina tasaisesti lisäten ja ylläpitäen painetta, kunnes sinettisauma 6 on kokonaan auki (sauman 6 aukeamiseen voi kulua 5 sekuntia).
Kuva F
|
| PUSSI ENNEN AKTIVAATIOTA | PUSSI AKTIVAATION JÄLKEEN | |||||
Kuva G
|
Kuva H
|
|||||
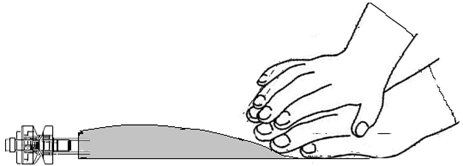
ÄLÄ purista tai paina liian kovaa.
|
Kuva I
|
|||||
| 4 – TUTKI PUSSI VARMISTAAKSESI AKTIVAATION. | ||||||
Tarkista että saumasinetti 6 on täysin aktivoitu ja lokerot 8 ja 9 ovat yhtyneet.
Kuva J
|
Sekoita varovasti kunnes kuiva-aine on täysin liuennut.
Kuva K
|
|||||
| 5. – ANNOSMUUTOKSET – katso kohdat 2. “Annostus ja antotapa” ja 3. “Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet ” | ||||||
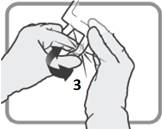
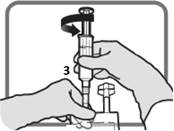
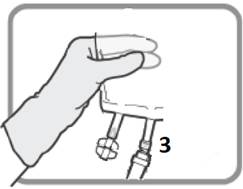
Tunnista Luer-portti 3 , jos annosta on muutettava. Poista Luer-portin muovikorkki.
Kuva L |
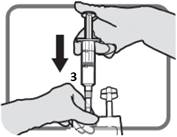
Kiinnitä luer-porttiin sopiva laite kuten kuvassa M. Älä käytä muita kuin Luer-porttiin sopivia välineitä porttiin 3.
Kuva M Varmista, että liitos on kohdallaan ja kiristä. |
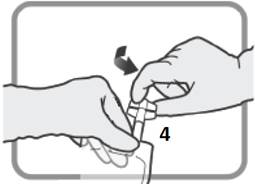
Sovita annos kohtien 2 ja 3 ohjeiden mukaisesti.
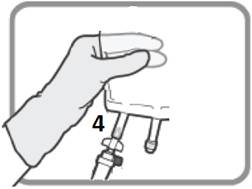
Kuva N Irrota laite käytön jälkeen. Aseta korkki Luer-portti 3:een ennen infuusion jatkamista. |
||||
6– YHDISTÄMINEN – Infuusiosetti voidaan yhdistää pussiin joko Luer- tai piikkiyhdistäjällä.
|
||||||
VAIHTOEHTO A – PIIKKIYHDISTÄJÄ Tunnista kierrettävä portti 4 piikki-infuusiosettiä varten. Kierrä irti muovikorkki ennen piikki-yhdistäjän laittoa.
Kuva O Aseta piikkiyhdistäjä.
Kuva P |
VAIHTOEHTO B– LUER-YHDISTÄJÄ Valitse Luer-portti 3 Luer-yhdistäjää käyttävää infuusiosettiä varten. Poista muovikorkki Luer-portista 3 ennen Luer-yhdistäjän laittoa.
Kuva Q Aseta Luer-yhdistäjä.
Kuva R Varmista, että liitos on täysin kohdallaan ja kiristä.
|
|||||
| 7– RIPUSTA PUSSI | ||||||
Ripusta pussi aukosta 7.
|
Kuva S
|
|||||