Pakkausseloste
PAMORELIN pulver och vätska till injektionsvätska, depotsuspension 3,75 mg
Tilläggsinformation
triptorelin
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Pamorelin 3,75 mg är och vad det används för
2. Vad du behöver veta innan du använder Pamorelin 3,75 mg
3. Hur du använder Pamorelin 3,75 mg
4. Eventuella biverkningar
5. Hur Pamorelin 3,75 mg ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Pamorelin 3,75 mg innehåller triptorelin som liknar ett hormon som kallas gonadotropinfrisättande hormon (GnRH-liknande ämne). Det är en långverkande formulering som är konstruerad så att den långsamt frisätter 3,75 mg triptorelin under en månad (4 veckor). Det verkar genom att sänka nivåerna av det manliga könshormonet (testosteron) och det kvinnliga könshormonet (östrogen) i kroppen.
Prostatacancer
Pamorelin 3,75 mg används för att behandla lokal avancerad hormonberoende prostatacancer och hormonberoende prostatacancer som har spridit sig till andra delar av kroppen (metastaserande cancer). Det används även för behandling av högrisk lokaliserad och lokal avancerad hormonberoende prostatacancer i kombination med strålbehandling.
Bröstcancer
Ett sätt att behandla hormonberoende bröstcancer är att minska östrogennivåerna i kroppen. Pamorelin 3,75 mg används för att behandla hormonberoende bröstcancer i tidigt stadium hos kvinnor som inte har genomgått klimakteriet och som har fått cellgiftsbehandling.
Pamorelin 3,75 mg används i kombination med hormonläkemedel. Du kommer att uppmanas att ta:
- ett läkemedel som kallas tamoxifen som du får om du löper stor risk för att få tillbaka cancern.
eller
- en aromatashämmare. Du kommer att behöva behandlas med Pamorelin 3,75 mg minst sex till åtta veckor innan du börjar ta aromatashämmaren.
Kom ihåg att läsa bipacksedeln för alla läkemedel som du tar medan du behandlas med Pamorelin 3,75 mg.
Vad du behöver veta innan produkten används
Använd inte Pamorelin 3,75 mg
- om du är allergisk mot triptorelinembonat, gonadotropinfrisättande hormon (GnRH), andra GnRH-liknande ämnen eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du är gravid eller ammar.
Varningar och försiktighet
Alla som behandlas med Pamorelin 3,75 mg
Tala med läkare eller apotekspersonal innan du tar Pamorelin 3,75 mg.
- Om du har diabetes. Din läkare kommer att kontrollera dina blodsockernivåer under behandlingen.
- Om du har hjärt- eller kärlbesvär (t.ex. högt blodtryck). Din läkare kommer att mäta ditt blodtryck under behandlingen.
- Om du har hjärtkärlsjukdom inklusive hjärtrytmrubbningar (arytmi), eller om du tar medicin mot detta. Risken för att drabbas av hjärtrytmrubbningar kan vara förhöjd när man använder Pamorelin 3,75 mg.
- Om du blir nedstämd/deprimerad. Depression, som kan vara allvarlig, har rapporterats hos patienter som tar Pamorelin 3,75 mg. Din läkare kan komma att vilja övervaka din depression under behandlingen.
- Om du använder läkemedel som hämmar blodets förmåga att levra sig, eftersom det kan uppstå blåmärken på injektionsstället.
- Hos vuxna kan Pamorelin 3,75 mg orsaka förtunning av benet (benskörhet), med ökad risk för benfrakturer. Du bör därför berätta för din läkare om du har några av nedanstående riskfaktorer eftersom han/hon kan ge dig bisfosfonat (läkemedel som används för att behandla skört ben) för att behandla benförlust. Riskfaktorer kan inkludera:
- Om du eller någon i din nära familj har tunnare skelett.
- Om du dricker stora mängder alkohol och/eller röker mycket.
- Om du tar läkemedel under lång tid som kan orsaka förtunning av skelett, till exempel läkemedel mot epilepsi eller steroider (som hydrokortison eller prednisolon).
- Om du har förstorad hypofys (godartad tumör) som du inte var medveten om, kan detta upptäckas under behandlingen med Pamorelin 3,75 mg. Symtomen är plötslig huvudvärk, kräkningar, problem med synen och ögonförlamning.
- Om du får kramper, informera omedelbart din läkare. Det har förekommit rapporter om kramper hos patienter som får triptorelin eller liknande läkemedel. Dessa inträffade hos patienter med eller utan historia av epilepsi.
Tala med din läkare om du känner oro kring något av det som nämns ovan.
Män
- I början av behandlingen ökar testosteronnivåerna i din kropp tillfälligt. Detta kan förvärra dina symtom av cancersjukdomen. Kontakta din läkare om detta inträffar. Läkaren kan ge dig ett läkemedel (en antiandrogen) som kan förhindra att dina symtom förvärras.
- Under de första behandlingsveckorna kan du (som vid behandling med andra GnRH-liknande ämnen) få symtom som orsakas av benmärgshoptryckning (t.ex. smärta, domning eller svaghet i benen) eller blockering av urinvägarna. Kontakta omedelbart läkare om du får något av dessa symtom. Läkaren kommer att göra en bedömning och ge dig lämplig behandling för dessa tillstånd.
- Om du har genomgått kirurgisk kastration ger triptorelin ingen ytterligare minskning av testosteronkoncentrationen och bör därför inte användas.
- Om du ska genomgå diagnostiska test av hypofys- eller könskörtelfunktionen, kan resultaten vara missvisande om du behandlas med Pamorelin 3,75 mg eller nyligen har avslutat behandling med Pamorelin 3,75 mg.
- Testosteronsänkande preparat kan orsaka förändringar i EKG associerade med hjärtrytmavvikelser (QT-förlängning).
Behandling med GnRH-analoger, inklusive Pamorelin, kan öka risken för anemi (definierat som en minskning av antalet röda blodkroppar).
Tala med din läkare om du känner oro kring något av det som nämns ovan.
Kvinnor
Under den första månaden av din behandling kan du få vaginala blödningar. Därefter upphör normalt dina menstruationer. Tala med din läkare om du får blödningar efter den första månaden av din behandling.
Din menstruation bör komma igång ungefär 2–3 månader efter din sista injektion. Du bör använda ett icke-hormonellt preventivmedel under den första behandlingsmånaden och efter den sista injektionen, eftersom p-piller eller andra hormonbaserade preventivmedel inte är tillräckligt för att förhindra graviditet.
Barn och ungdomar
Pamorelin 3,75 mg ska inte användas till nyfödda, småbarn, barn och ungdomar.
Andra läkemedel och Pamorelin 3,75 mg
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Pamorelin kan påverka vissa andra läkemedel som används för att behandla hjärtrytmrubbningar (t.ex. kinidin, prokainamid, amiodaron och sotalol) eller kan öka risken för hjärtrytmrubbningar när det används tillsammans med andra läkemedel (t.ex. metadon (används mot smärta och vid behandling av drogberoende), moxifloxacin (ett antibiotikum), antipsykotika (används mot allvarlig psykisk sjukdom).
Graviditet, amning och fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Pamorelin 3,75 mg får inte användas vid graviditet eller amning.
Ta inte Pamorelin 3,75 mg om du planerar att bli gravid.
Körförmåga och användning av maskiner
Även om Pamorelin 3,75 mg används enligt ordination kan biverkningar uppkomma i sådan omfattning att förmågan att framföra fordon eller använda maskiner försämras, särskilt i kombination med alkohol. Du kan känna dig yr, trött eller få problem med synen t.ex. dimsyn. Dessa är möjliga biverkningar av behandlingen eller på grund av den underliggande sjukdomen. Om du upplever någon av dessa biverkningar, bör du inte framföra fordon eller använda maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med läkare eller apotekspersonal om du är osäker.
Pamorelin 3,75 mg innehåller natrium, men mindre än 1 mmol (23 mg) natrium per injektionsflaska. Detta läkemedel är i det närmaste natriumfritt och kan tas av personer som ordinerats saltfattig kost.
Hur produkten används
Pamorelin 3,75 mg ges under läkares överinseende.
Prostatacancer
Behandling av prostatacancer med Pamorelin 3,75 mg kräver långvarig behandling.
Vid högrisk lokaliserad och lokal avancerad hormonberoende prostatacancer i kombination med strålbehandling är rekommenderad behandlingstid 2–3 år.
Vanlig dos av Pamorelin 3,75 mg är 1 injektionsflaska, injicerat under huden eller i en muskel en gång per månad (fyra veckor).
Läkaren kan komma att ta blodprov för att kontrollera effekten av behandlingen.
Om du upplever att effekten av Pamorelin 3,75 mg är för stark eller för svag, vänd dig till läkare eller apotekspersonal.
Om du har ytterligare frågor om detta läkemedel kontakta läkare eller apotekspersonal.
Bröstcancer
Den rekommenderade dosen av Pamorelin 3,75 mg är en injektion i muskeln en gång per månad (fyra veckor). Behandlingen kan pågå i upp till 5 år.
Pamorelin 3,75 mg används tillsammans med ett läkemedel som kallas tamoxifen eller med en aromatashämmare. Om du behöver ta en aromatashämmare, kommer du att behöva behandlas med Pamorelin 3,75 mg minst sex till åtta veckor innan du börjar ta aromatashämmaren. Du kommer att få minst 2 injektioner av Pamorelin 3,75 mg (med ett intervall på 4 veckor mellan injektionerna) innan du börjar ta aromatashämmaren.
Om du använt för stor mängd av Pamorelin 3,75 mg
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 0800 147 111) för bedömning av risken samt rådgivning.
Om du slutar att använda Pamorelin 3,75 mg
Sluta inte att använda Pamorelin 3,75 mg utan att först tala med läkare. Detta är särskilt viktigt om du får Pamorelin 3,75 mg i kombination med en aromatashämmare för behandling av bröstcancer. Om behandlingen avslutas kan det leda till att östrogennivåerna ökar. Läkaren kommer att övervaka dina östrogennivåer under behandling med Pamorelin 3,75 mg.
Om du slutar att använda Pamorelin 3,75 mg måste du även avsluta behandlingen med aromatashämmaren inom en månad efter din sista dos av Pamorelin 3,75 mg.
Om du har ytterligare frågor om detta läkemedel kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Uppsök omedelbart läkare om du får något av följande symtom:
Svårigheter att svälja eller andningsproblem, svullnad av läppar, ansikte, hals eller tunga, eller nässelutslag. Dessa kan vara tecken på en svår allergisk reaktion eller angioödem, vilket har rapporterats i sällsynta fall (kan förekomma hos upp till 1 av 1000 användare).
Män
Som observerats vid behandling med andra GnRH-agonister eller efter kirurgisk kastration, hade de vanligast förekommande biverkningarna vid triptorelinbehandling att göra med förväntade farmakologiska effekter. Dessa effekter innefattar värmevallningar och minskad sexuell lust.
Ökat antal lymfocyter har rapporterats hos patienter under pågående behandling med GnRH-liknande ämnen.
Med undantag för allergiska reaktioner och reaktioner vid injektionsstället är alla biverkningar relaterade till förändringar i testosteronnivåer.
Efter subkutan injektion (under huden) med andra triptorelinpreparat har tryckkänslig vätskeansamling på injektionsstället rapporterats i mindre vanliga fall.
Mycket vanliga: kan förekomma hos fler än 1 av 10 användare
- värmevallningar
- kraftlöshet
- ökad svettning
- ryggsmärta
- myrkrypningar i benen
- minskad sexuell lust
- impotens
Vanliga: kan förekomma hos upp till 1 av 10 användare
- illamående, muntorrhet
- smärta, blåmärke, rodnad och svullnad på injektionsstället, muskel- och skelettsmärta, smärta i armar och ben, ödem (vätskeansamling i kroppens vävnader), smärta i nedre delen av magen, högt blodtryck
- allergisk reaktion
- viktökning
- yrsel, huvudvärk
- förlust av sexuell lust, depression, humörsvängningar
Mindre vanliga: kan förekomma hos upp till 1 av 100 användare
- ökad mängd blodplättar
- medvetenhet om hjärtslag
- öronringningar, svindel, dimsyn
- magsmärtor, förstoppning, diarré, kräkningar
- dåsighet, svåra skakningar som är förknippade med svettningar och feber, sömnighet, smärta
- påverkan på blodbilden (inklusive förhöjda leverfunktionsvärden), förhöjt blodtryck
- viktminskning
- aptitlöshet, ökad aptit, gikt (svår smärta och svullnad i leder, vanligtvis i stortån), diabetes, ökad halt av fetter i blodet
- ledsmärta, muskelkramper, muskelsvaghet, muskelsmärta, svullnad och ömhet, skelettsmärta
- stickningar eller domningar
- sömnlöshet, irritabilitet
- bröstförstoring hos män, smärta i brösten, minskad storlek på testiklarna, smärta i testiklarna
- andningssvårigheter
- akne, håravfall, klåda, hudutslag, hudrodnad, nässelutslag
- stiga upp på natten för att urinera, urineringssvårigheter
- näsblödning
Sällsynta: kan förekomma hos upp till 1 av 1000 användare
- röda eller lila missfärgningar på huden
- onormal känselförnimmelse i ögat, dimsyn eller synrubbningar
- utspänd buk, gasbesvär, smakförändringar
- bröstsmärta
- svårighet att stå
- influensaliknande symtom, feber
- inflammation i näsan/halsen
- förhöjd kroppstemperatur
- stela leder, ledsvullnad, stelhet i muskler och skelett, artros
- minnesförlust
- förvirring, minskad aktivitet, upprymdhet
- andnöd i liggande ställning
- blåsor
- lågt blodtryck
Ingen känd frekvens: kan inte beräknas från tillgängliga data
- förändringar (QT-förlängning) i EKG (elektrokardiogram)
- allmän obehagskänsla
- ångest
- urininkontinens
- hos patienter med hypofystumör: ökad risk för blödning i hypofysområdet
- anemi (minskning av antalet röda blodkroppar).
Din läkare avgör vilka åtgärder som ska vidtas.
Kvinnor
Flera av biverkningarna orsakas av förändringar i kroppens östrogennivå.
Mycket vanliga: kan förekomma hos fler än 1 av 10 användare
- sömnsvårigheter, humörsvängningar
- huvudvärk
- värmevallningar
- kraftlöshet
- ökad svettning, akne, fet hud
- minskad sexuell lust, bröstsjukdomar, smärta under eller efter samlag, genital blödning, ovariellt hyperstimulationssyndrom, förstorade äggstockar, bäckensmärta, vaginal torrhet.
Vanliga: kan förekomma hos upp till 1 av 10 användare
- illamående, smärta eller obehag i buken
- muskelkramper, smärta i lederna, smärta i armar och ben
- smärta i brösten
- smärta, blåmärke, rodnad och svullnad vid injektionsstället
- svullnad i vrister, fötter eller fingrar
- allergisk reaktion
- viktökning
- depression, nervositet
- yrsel.
Mindre vanliga: kan förekomma hos upp till 1 av 100 användare
- hjärtklappning
- känsla av att omgivningen rör sig (vertigo)
- torra ögon, dimsyn
- utspänd buk, kräkningar, muntorrhet, gasbesvär, munsår
- viktminskning
- minskad aptit, ansamling av vätska i kroppen
- ryggsmärta, muskelsmärta
- förändrad smakuppfattning, nedsatt känsel, tillfällig medvetandeförlust, minnesförlust, koncentrationssvårigheter, myrkrypningar, stickningar eller domningar, ofrivilliga muskelrörelser
- humörförändringar, ångest, förvirring gällande tid och plats
- blödning efter samlag, framfall, oregelbunden menstruation, menstruationssmärtor och rikliga menstruationer, små cystor (svullnader) på äggstockarna som kan orsaka smärta, flytningar
- andningssvårigheter, näsblod
- håravfall, ökad kroppsbehåring
- torr hud, sköra naglar, klåda, hudutslag.
Ingen känd frekvens: kan inte beräknas från tillgängliga data
Feber, kramper, allmän olustkänsla, förhöjt blodtryck, allvarlig allergisk reaktion som orsakar andningssvårigheter, yrsel eller svullnad i ansikte eller hals, förändrade blodvärden (inklusive förhöjda leverfunktionsvärden), muskelsvaghet, förvirring, utebliven menstruation, plötlig uppkomst av upphöjda utslag på grund av svullnad i hud och slemhinnor, onormal känsla i ögonen och/eller synförändringar, diarré, ökad risk för blödning i hypofysområdet hos patienter med hypofystumör.
Biverkningar vid användning för behandling av bröstcancer i kombination med antingen tamoxifen eller, en aromatashämmare
Följande biverkningar har observerats när Pamorelin 3,75 mg används för bröstcancer i kombination med antingen tamoxifen eller en aromatashämmare:
Mycket vanliga: kan förekomma hos fler än 1 av 10 användare
- illamående
- stark trötthet
- led- och muskelsmärta
- benskörhet
- värmevallningar
- ökad svettning, sömnsvårigheter
- depression
- minskad sexuell lust, vaginal torrhet, smärta under eller efter samlag
- urininkontinens
- ökat blodtryck.
Vanliga: kan förekomma hos upp till 1 av 10 användare
- diabetes
- högt blodsocker (hyperglykemi)
- smärta, blåmärke, rodnad och svullnad vid injektionsstället
- allergisk reaktion
- benfrakturer
- blodpropp i ett blodkärl.
Mindre vanliga: kan förekomma hos upp till 1 av 100 användare
- blödning i hjärnan
- brist på blodtillförsel till hjärnan eller hjärtat.
Sällsynta biverkningar: kan förekomma hos upp till 1 av 1000 användare):
- förändring i EKG (QT-förlängning).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och på etiketterna efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Färdigblandad suspension ska användas omedelbart.
Förvaras vid högst 25 °C.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är triptorelin.
En injektionsflaska innehåller triptorelinembonat motsvarande 3,75 mg triptorelin.
Efter utspädning i 2 ml spädningsvätska innehåller 1 ml färdigblandad suspension 1,875 mg triptorelin. - Övriga innehållsämnen är:
Pulver: poly (d,l-laktid-koglykolid), mannitol, karmellosnatrium, polysorbat 80.
Spädningsvätska: vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Detta läkemedel är ett pulver och vätska till injektionsvätska, depotsuspension. Pulvret är ett vitt till benvitt pulver och spädningsvätskan är en klar lösning.
Pamorelin 3,75 mg är tillgänglig i förpackningar innehållande
- 1 injektionsflaska, 1 ampull och 1 blister innehållande 1 injektionsspruta och 2 injektionsnålar, samt i förpackningar innehållande
- 3 injektionsflaskor, 3 ampuller och 3 blister innehållande 1 injektionsspruta och 2 injektionsnålar.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Institut Produits Synthèse (IPSEN) AB
Kista Science Tower
Färögatan 33
SE-164 51 Kista
Sverige
Tillverkare
IPSEN PHARMA BIOTECH
Parc d'Activités du Plateau de Signes
Chemin départemental N° 402
F-83870 Signes
Frankrike
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
Österrike och Tyskland: Pamorelin LA 3,75 mg
Danmark, Finland, Nederländerna, Norge: Pamorelin 3,75 mg
Denna bipacksedel ändrades senast den 15.01.2025
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal (se avsnitt Hur produkten används):
| 1 – FÖRBEREDELSE AV PATIENT FÖRE BEREDNING | |
| Förbered patienten genom att desinficera injektionsstället. Detta behöver förberedas först, eftersom läkemedlet ska injiceras omedelbart efter beredning. | |
| 2 – BEREDNING AV INJEKTIONEN | |
Förpackningen innehåller två nålar:
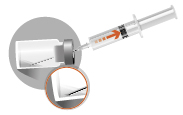
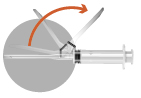
Förekomst av bubblor ovanpå det frystorkade pulvret är normalt. Följande steg måste utföras i en kontinuerlig följd. | |
2a
| 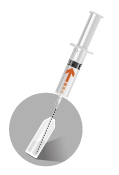 |
2b
| 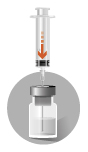 |
2c
|  |
2d
|
|
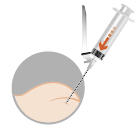
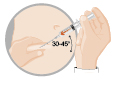
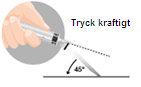
| 3 – INTRAMUSKULÄR OCH SUBKUTAN INJEKTION | |
| intramuskulärt eller subkutant (endast för män)
|
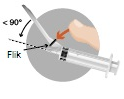
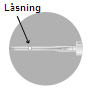
| 4 – EFTER ANVÄNDNINGEN | |
Säkerhetsanordningen kan aktiveras på två olika sätt.
|
Metod A
Metod B
|