Pakkausseloste
JEVTANA koncentrat och vätska till infusionsvätska, lösning 60 mg
Tilläggsinformation
cabazitaxel
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Om du får biverkningar tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad JEVTANA är och vad det används för
- Vad du behöver veta innan du får JEVTANA
- Hur du använder JEVTANA
- Eventuella biverkningar
- Hur JEVTANA ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Ditt läkemedel heter JEVTANA. Den aktiva substansen är cabazitaxel. Det hör till en grupp läkemedel som kallas ”taxaner” som används vid cancerbehandling.
JEVTANA används vid behandling av prostatacancer som har fortskridit efter du har erhållit annan kemoterapi. Det verkar genom att hämma celltillväxten och celldelningen.
Som en del av din behandling kommer du också att ta kortikosteroider (prednison eller prednisolon) via munnen varje dag. Be din läkare informera dig om denna medicin också.
Vad du behöver veta innan produkten används
Använd inte JEVTANA
- om du är allergisk (överkänslig) mot cabazitaxel, mot andra taxaner, polysorbat 80 eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om antalet vita blodceller är för lågt (neutrofiler lägre än eller lika med 1500/mm3),
- om du har en kraftigt nedsatt leverfunktion,
- om du nyligen har fått eller ska till att få vaccin mot gula febern.
Du ska inte använda JEVTANA om något av detta gäller för dig. Om du är osäker, tala med din läkare innan behandling med JEVTANA.
Varningar och försiktighet
Innan varje behandling med JEVTANA kommer du att göra blodtester för att kontrollera att du har tillräckligt med blodceller och tillräcklig lever- och njurfunktion för att erhålla JEVTANA.
Informera omedelbart din läkare om:
- du har feber. Under behandlingen med JEVTANA är det troligt att dina vita blodceller reduceras. Din läkare kommer att övervaka ditt blodvärde och allmäntillstånd efter tecken på infektioner. Läkaren kan ge dig andra mediciner för att bibehålla dina blodvärden. Personer med låga blodvärden kan utveckla livshotande infektioner. Det tidigaste tecknet på infektion kan vara feber, kontakta därför omedelbart läkare om du får feber.
- du har eller har haft några allergier. Allvarliga allergiska reaktioner kan inträffa under behandling med JEVTANA.
- du har allvarlig eller långvarig diarré, mår illa eller kräks. Vart och ett av dessa tillstånd kan orsaka allvarlig uttorkning. Din läkare kan behöva ge dig vård.
- du har en känsla av domningar, stickningar, brännande eller minskad känsel i dina händer och fötter.
- du har problem med blödningar från tarmen eller ändrad färg på din avföring eller magsmärta. Om blödningen eller smärtan är allvarlig, kommer din läkare att avsluta din behandling med JEVTANA. Detta för att JEVTANA kan öka risken för blödning eller att utveckla hål i tarmväggen.
- du har njurproblem.
- du har gulfärgning av huden och ögonen, mörkt urin, svårt illamående eller kräkningar, eftersom det kan vara tecken eller symtom på leverproblem.
- du erfar en signifikant ökning eller minskning i volymen av daglig urin.
- du har blod i urinen.
Om något av detta inträffar för dig, informera omedelbart din läkare. Läkaren kanske minskar dosen av JEVTANA eller avslutar behandlingen.
Användning av andra läkemedel och JEVTANA
Tala om för läkare, sjuksköterska eller apotekspersonal om du tar eller nyligen har tagit andra läkemedel, även receptfria sådana. Detta för att vissa läkemedel kan påverka effekten av JEVTANA eller så kan JEVTANA påverka hur dessa läkemedel fungerar. Dessa mediciner är:
- ketokonazol, rifampicin (mot infektioner);
- karbamazepin, fenobarbital eller fenytoin (mot kramper);
- Johannesört (Hypericum perforatum) (örtmedicin mot depression och andra tillstånd);
- statiner (såsom simvastatin, lovastatin, atorvastatin, rosuvastatin eller pravastatin) (sänker halten av kolesterol i blodet);
- valsartan (mot högt blodtryck);
- repaglinid (vid diabetes).
Rådgör med din läkare innan du tar någon vaccination när du behandlas med JEVTANA.
Graviditet, amning och fertilitet
JEVTANA är inte avsett för användning till kvinnor.
Använd kondom under samlag om din partner är eller kan bli gravid. JEVTANA kan finnas i sperman och kan påverka fostret. Du kommer att ges råd om att inte göra någon gravid under och upp till 4 månader efter behandlingen och att söka rådgivning om bevarande av sperma före behandling eftersom JEVTANA kan påverka den manliga fertiliteten.
Körförmåga och användning av maskiner
Du kan känna dig trött eller yr när du tar detta läkemedel. Om det händer, kör inte bil och använd inte verktyg eller maskiner förrän du känner dig bättre.
JEVTANA innehåller etanol (alkohol)
Detta läkemedel innehåller 573 mg alkohol (etanol) i varje flaska med spädningsvätska vilket motsvarar mindre än 11 ml öl eller 5 ml vin. Den lilla mängd alkohol som detta läkemedel innehåller kommer inte ge någon märkbar effekt. Om du är alkoholberoende, har leversjukdom eller epilepsi ska du tala med läkare eller apotekspersonal innan du tar detta läkemedel.
JEVTANA innehåller polysorbat 80 (E 433)
Detta läkemedel innehåller 1,56 g polysorbat 80 i varje 60 mg injektionsflaska med koncentrat vilket motsvarar 1,04 g/ml. Polysorbater kan orsaka allergiska reaktioner. Tala om för din läkare om du har några kända allergier. Polysorbater kan påverka ditt hjärta och din blodcirkulation (t.ex. oregelbundna eller onormala hjärtslag eller lågt blodtryck).
Hur produkten används
Användarinstruktioner
Läkemedel mot allergi kommer att ges till dig av en läkare eller sjuksköterska innan du får JEVTANA för att minska risken för allergiska reaktioner.
- JEVTANA kommer att ges till dig av en läkare eller sjuksköterska.
- JEVTANA måste beredas (spädas) innan det ges. Praktisk information angående hantering och administrering av JEVTANA för läkare, sjuksköterskor och farmaceuter följer med denna bipacksedel.
- JEVTANA ges via dropp (infusion) i en av dina vener (intravenöst) i ungefär en timme på sjukhuset.
- Som en del av din behandling kommer du också att ta kortisonläkemedel (prednison eller prednisolon) via munnen varje dag.
Hur mycket och hur ofta
- Dosen bestäms av din kroppsyta. Din läkare kommer att beräkna din kroppsyta i kvadratmeter (m2) och kommer sedan att bestämma vilken dos du ska ha.
- Du kommer vanligtvis att få en infusion var tredje vecka.
Om du har ytterligare frågor om detta läkemedel kontakta läkare, sjuksköterska eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem. Din läkare kommer att diskutera dessa med dig och kommer att förklara möjliga risker och fördelar med din behandling.
Kontakta omedelbart en läkare om du märker någon av följande biverkningar:
- feber (hög temperatur). Detta är vanligt (kan inträffa hos upp till 1 av 10 personer).
- kraftig förlust av kroppsvätskor (uttorkning). Detta är vanligt (kan inträffa hos upp till 1 av 10 personer). Detta kan inträffa om du har en allvarlig eller långvarig diarré eller feber eller om du varit illamående (haft kräkningar).
- allvarlig magsmärta eller ihållande magsmärta som inte försvinner. Detta kan inträffa om du har ett hål i magsäcken, matstrupen eller tarmen (gastrointestinal perforation). Detta kan leda till döden.
Om något av ovanstående gäller för dig kontakta omedelbart din läkare.
Övriga biverkningar omfattar:
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare):
- minskning i antal röda blodkroppar (anemi) eller vita blodkroppar (vilka är viktiga för att bekämpa infektioner)
- minskning av antalet blodplättar (vilket kan ge ökad blödningsrisk)
- aptitlöshet (anorexi)
- orolig mage inklusive illamående, kräkningar, diarré eller förstoppning
- ryggsmärta
- blod i urinen
- trötthet, svaghet eller brist på energi
Vanliga (kan förekomma hos upp till 1 av 10 användare):
- smakförändring
- andfåddhet
- hosta
- magsmärta
- tillfälligt håravfall (efter avslutad behandling bör normal hårväxt i de flesta fall återkomma)
- ledvärk
- urinvägsinfektion
- brist på vita blodkroppar associerat med feber och infektion
- domningskänsla eller stickningar, brännande eller minskad känsel i händer och fötter
- yrsel
- huvudvärk
- ökat eller minskat blodtryck
- obehagskänsla i magen, halsbränna eller rapningar
- magsmärta
- hemorrojder
- muskelspasmer
- smärtsam eller frekvent urinering
- urininkontinens
- njursjukdom eller problem
- sår i mun eller på läppar
- infektioner eller risk för infektioner
- högt blodsocker
- sömnlöshet
- mental förvirring
- ångest
- domningskänsla eller smärta i händer och fötter
- balansproblem
- snabb eller oregelbunden hjärtrytm
- blodpropp i ben eller lunga
- blossande hud
- smärta i mun eller hals
- ändtarmsblödning
- muskelbesvär, molande värk, svaghetskänsla eller smärta
- svullnad av fötter eller ben
- frossa
- nagelsjukdom (förändring av naglarnas färg; naglar kan lossna)
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare):
- lågt blodkalium
- öronringning
- värmekänsla i huden
- hudrodnad
- inflammation i urinblåsan som kan uppstå när den utsatts för strålbehandling (cystit på grund av ”radiation recall fenomen”)
Har rapporterats (förekommer hos ett okänt antal användare):
- interstitiell lungsjukdom (lunginflammation med hosta och andningssvårigheter).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvaras utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på ytterkartongen och på inneretiketten på injektionsflaskorna efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 30°C. Förvaras i skydd mot kyla.
Information om förvaring och användningstid efter spädning av JEVTANA beskrivs i avsnittet ”Praktisk information för hälso- och sjukvårdspersonal för förberedelse, administration och hantering av Jevtana”.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
JEVTANA innehåller
Den aktiva substansen är cabazitaxel. En ml koncentrat innehåller 40 mg cabazitaxel. En injektionsflaska av koncentratet innehåller 60 mg cabazitaxel.
Övriga innehållsämnen är polysorbat 80 och citronsyra i koncentratet och etanol 96% och vatten för injektionsvätskor i spädningsvätskan (se avsnitt Vad du behöver veta innan produkten används ”JEVTANA innehåller alkohol”).
Observera: Både JEVTANA 60 mg/1,5 ml injektionsflaska med koncentrat (fyllnadsvolym: 73,2 mg cabazitaxel/1,83 ml) och injektionsflaskan med spädningsvätska (fyllnadsvolym: 5,67 ml) innehåller en överfyllnad för att kompensera för vätskeförluster under beredning. Denna överfyllnad försäkrar att man efter spädning med HELA innehållet av den medföljande spädningsvätskan, erhåller en lösning som innehåller 10 mg/ml cabazitaxel.
Läkemedlets utseende och förpackningsstorlekar
JEVTANA är ett koncentrat och spädningsvätska till infusionsvätska, lösning (sterilt koncentrat).
Koncentratet är en klar, gul till brungul oljig lösning.
Spädningsvätskan är en klar och genomskinlig lösning.
En förpackning med JEVTANA innehåller:
- En genomskinlig injektionsflaska av glas för engångsbruk med en grå gummipropp förseglad med en aluminiumförslutning täckt med en ljusgrön «flip-off»-kapsyl av plast, innehållande 1,5 ml (nominell volym) koncentrat.
- En genomskinlig injektionsflaska av glas för engångsbruk med en grå gummipropp förseglad med en guldfärgad aluminiumförslutning täckt med en genomskinlig «flip-off»-kapsyl av plast, innehållande 4,5 ml (nominell volym) spädningsvätska.
Innehavare av godkännande för försäljning
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly
Frankrike
Tillverkare
Sanofi-Aventis Deutschland GmbH
Industriepark Höchst
65926 Frankfurt am Main
Tyskland
För ytterligare upplysningar om detta läkemedel, kontakta ombudet för innehavaren av godkännandet för försäljning:
Sanofi Oy
Tel: +358 (0) 201 200 300
Denna bipacksedel ändrades senast 09/2025.
Övriga informationskällor
Information om detta läkemedel finns tillgänglig på Europeiska läkemedelsmyndighetens hemsida http:// www.ema.europa.eu
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
PRAKTISK INFORMATION FÖR HÄLSO- OCH SJUKVÅRDSPERSONAL FÖR FÖRBEREDELSE, ADMINISTRERING OCH HANTERING AV JEVTANA 60 mg KONCENTRAT OCH VÄTSKA TILL INFUSIONSVÄTSKA, LÖSNING.
Denna information kompletterar avsnitt Hur produkten används och Hur produkten ska förvaras för användaren.
Det är viktigt att du läser igenom hela denna text innan du påbörjar beredningen av infusionslösningen.
Blandbarhet
Detta läkemedel får inte blandas med andra läkemedel förutom de som används för spädning.
Hållbarhet och speciella förvaringsanvisningar
För förpackningen med JEVTANA 60 mg koncentrat och spädningsvätska
Förvaras vid högst 30°C.
Förvaras i skydd mot kyla.
Efter öppnandet:
Koncentratet och spädningsvätskan måste användas omedelbart. Om de inte används på en gång, är förvaringstid och förvaringsförhållanden användarens ansvar. Ur en mikrobiologisk synvinkel måste 2-stegs spädningsprocessen ske under kontrollerade och aseptiska förhållanden (se nedan ”Försiktighetsåtgärder vid förberedelse och administrering”).
Efter den första spädningen av JEVTANA 60 mg koncentrat med hela innehållet i injektionsflaskan med spädningsvätska, har kemisk-fysikalisk stabilitet visats under 1 timme i omgivande temperatur.
Efter slutlig spädning i infusionspåsen/flaskan
Kemisk-fysikalisk stabilitet för infusionslösningen har visats under 8 timmar i omgivande temperatur (15-30° C) inklusive 1 timmes infusionstid och under 48 timmars kylförvaring inklusive 1 timmes infusionstid.
Ur mikrobiologisk synvinkel ska infusionslösningen användas omedelbart. Om den inte används omedelbart är förvaringstid och förvaringsförhållanden användarens ansvar och ska under normala förhållanden inte vara längre än 24 timmar vid 2-8° C, såvida beredning inte gjorts under kontrollerade och validerade aseptiska förhållanden.
Försiktighetsåtgärder vid förberedelse och administrering
Som för alla antineoplastiska ämnen ska försiktighet iakttas vid hantering och beredning av JEVTANA lösningar. Man ska tänka på användningen av säkerhetsutrustning, skyddsåtgärder för personalen (t.ex. handskar) och beredningsanvisningar.
Om JEVTANA under något steg av hanteringen skulle komma i kontakt med huden, tvätta omedelbart och noggrant med tvål och vatten. Om det kommer i kontakt med slemhinnor, skölj omedelbart och noggrant med rikliga mängder vatten.
JEVTANA ska endast beredas och administreras av personal som är utbildad för att hantera cytotoxiska ämnen. Gravid personal ska inte hantera detta läkemedel.
Späd alltid ut koncentratet till infusionslösning med hela mängden medföljande spädningsvätska innan det tillsätts till en infusionslösning.
Beredning
Läs HELA detta avsnitt noga innan blandning och spädning. JEVTANA behöver TVÅ spädningar innan administrering. Följ beredningsanvisningarna bifogade nedan.
Observera: Både JEVTANA 60 mg/1,5 ml injektionsflaska med koncentrat (fyllnadsvolym 73,2 mg cabazitaxel/1,83 ml) och injektionsflaskan med spädningsvätska (fyllnadsvolym: 5,67 ml) innehåller en överfyllnad för att kompensera för vätskeförluster under beredning. Denna överfyllnad försäkrar att man efter spädning med HELA innehållet av den medföljande spädningsvätskan erhåller en lösning som innehåller 10 mg/ml cabazitaxel.
Följande spädningsprocess i två steg måste utföras på ett aseptiskt sätt för beredningen av infusionsvätska, lösning.
Steg 1: Den första spädningen av koncentrat till infusionsvätska, lösning med den medföljande spädningsvätskan.
Steg 1.1 Inspektera injektionsflaskan med koncentrat och den medföljande spädningsvätskan. | 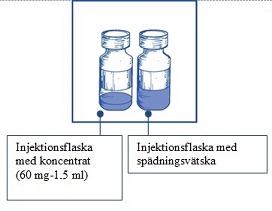 |
Steg 1.2 Använd en spruta med en nål fastsatt och dra aseptiskt upp hela innehållet av den medföljande spädningsvätskan | 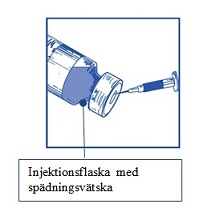 |
Steg 1.3 Injicera hela innehållet i motsvarande injektionsflaska med koncentrat. För att begränsa skumbildning så mycket som möjligt när man injicerar spädningsvätskan, rikta nålen mot insidan av väggen och injicera långsamt. När den är beredd innehåller den färdiga lösningen cabazitaxel 10 mg/ml. | 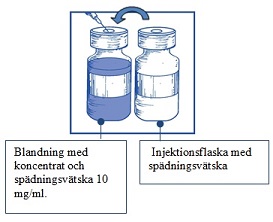 |
Steg 1.4 Ta bort sprutan och nålen och blanda försiktigt manuellt genom att vända flaskan upprepade gånger tills man får | 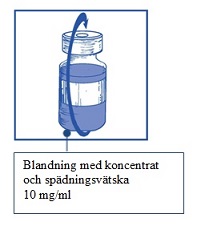 |
Steg 1.5 Låt lösningen stå i ungefär 5 minuter och kontrollera sedan att lösningen är klar och homogen. | 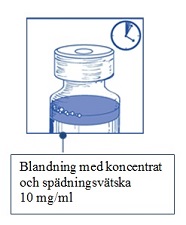 |
Detta resulterar i en lösning med koncentrat och spädningsvätska innehållande 10 mg/ml med cabazitaxel (med åtminstone 6 ml användbar volym). Den andra spädningen bör göras omedelbart (inom 1 timme) såsom beskrivs i Steg 2.
Mer än en injektionsflaska med lösningen innehållande koncentrat och spädningsvätska kan behövas för att ge den förskrivna dosen.
Steg 2: Den andra (finala) spädningen till infusionsvätska, lösning
Steg 2.1 Dra aseptiskt upp den mängd som behövs av den blandade lösningen med koncentrat och spädningsvätska Eftersom skum kan finnas kvar på injektionsflaskans vägg efter beredningen enligt Steg 1 så är det att föredra att hålla sprutnålen i mitten när man drar upp innehållet. | 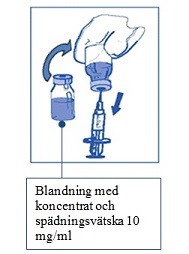 |
Steg 2.2 Injicera lösningen i en steril PVC-fri behållare med antingen 5 % glukoslösning eller natriumklorid 9 mg/ml (0,9 %) infusionsvätska, lösning. Koncentrationen av infusionslösningen | 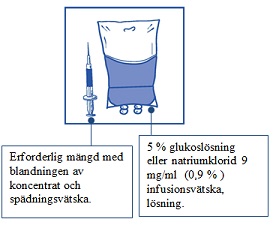 |
Steg 2.3 Tag bort sprutan och blanda innehållet i infusionspåsen eller flaskan manuellt genom en roterande rörelse. |  |
Steg 2.4 Som med alla parenterala produkter ska den färdiga infusionslösningen inspekteras visuellt innan användning. | 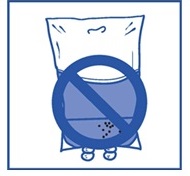 |
Infusionslösningen bör användas omedelbart. Förvaringstiden kan under vissa förhållanden vara längre, se avsnitt Hållbarhet och speciella förvaringsanvisningar ovan.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Administrering
JEVTANA administreras som en 1 timmes infusion.
Ett filter med 0,22 mikrometer nominell porstorlek (också refereras till som 0,2 mikrometer) rekommenderas under administrering.
Använd inte infusionsbehållare av PVC eller infusionsset med polyuretan för beredning och administering av infusionslösningen.