Pakkausseloste
HAVRIX injektioneste, suspensio, esitäytetty ruisku 1440 ELISA U/ml
Hepatiitti A -rokote (inaktivoitu, adsorboitu)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin saat/lapsesi saa tätä rokotetta, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä rokote on määrätty vain sinulle/lapsellesi eikä sitä pidä antaa muiden käyttöön.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tämä pakkausseloste on tarkoitettu henkilölle, joka saa rokotteen, mutta koska rokotetta voidaan antaa lapsille ja nuorille, myös vanhemmat voivat lukea selosteen lapsensa puolesta.
Tässä pakkausselosteessa kerrotaan
- Mitä Havrix 720 on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin saat Havrix 720 -rokotteen
- Miten Havrix 720 -valmistetta käytetään
- Mahdolliset haittavaikutukset
- Havrix 720 -rokotteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mihin Havrix 720 -valmistetta käytetään
Havrix 720 on rokote, jota käytetään suojaamaan 1–15-vuotiaita lapsia ja nuoria hepatiitti A-viruksen aiheuttamaa tautia vastaan.
Havrix 720 -rokotetta voidaan tarvittaessa antaa myös 16–18-vuotiaille nuorille.
Mikä hepatiitti A on
- Hepatiitti A on hepatiitti A -viruksen aiheuttama maksasairaus.
- Hepatiitti A -virus voi tarttua ihmisestä toiseen tai saastuneen veden, ruoan tai juoman välityksellä.
- Hepatiitti A:n oireet vaihtelevat lievistä vaikeisiin, ja niitä voivat olla kuume, huonovointisuus, ruokahaluttomuus, ripuli, pahoinvointi, vatsavaivat, virtsan tummuus sekä silmien ja ihon keltaisuus. Useimmat toipuvat täysin, mutta joskus sairaus voi olla vaikea ja vaatia sairaalahoitoa, ja joissain harvinaisissa tapauksissa se voi johtaa akuuttiin maksan vajaatoimintaan.
Miten Havrix 720 toimii
- Havrix 720 -rokote auttaa elimistöä suojautumaan itse (vasta-aineilla) viruksia vastaan. Vasta-aineet suojaavat taudilta.
- Kuten muutkaan rokotteet, Havrix 720 ei välttämättä anna täydellistä suojaa kaikille rokotetuille.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä ota Havrix 720 -rokotetta
- jos olet allerginen vaikuttavalle aineelle, tämän rokotteen jollekin muulle apuaineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa), neomysiinille tai formaldehydille
- jos olet aiemmin saanut allergisen reaktion mistä tahansa hepatiitti A -rokotteesta.
Allergisen reaktion merkkejä voivat olla kutiava ihottuma, hengenahdistus ja kasvojen tai kielen turvotus.
Havrix 720 -rokotetta ei saa antaa, jos jokin yllä mainituista pätee. Jos et ole varma, keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin saat Havrix 720 -rokotteen.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin saat Havrix 720 -rokotteen:
- jos sinulla on vaikea infektio, johon liittyy korkea kuume. Rokote voidaan antaa, kun olet toipunut. Lievä infektio, kuten nuha, ei yleensä ole este rokottamiselle, mutta keskustele ensin lääkärin kanssa.
- jos sinulla on sairauden ja/tai hoitojen aiheuttama alentunut vastustuskyky. Lääkäri tarkistaa, tarvitsetko useampia pistoksia.
- jos sinulla on verenvuotohäiriö tai mustelmataipumusta.
Pyörtymistä voi esiintyä ennen minkä tahansa pistoksen antoa tai sen jälkeen. Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos olet pyörtynyt aikaisemmin pistoksen yhteydessä.
Muut lääkevalmisteet ja Havrix 720
Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita rokotteita tai lääkkeitä.
Havrix 720 -rokote voidaan antaa samanaikaisesti tiettyjen muiden rokotteiden ja immunoglobuliinien kanssa. Rokotteet on annettava eri pistoskohtiin.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä, apteekkihenkilökunnalta tai sairaanhoitajalta neuvoa ennen kuin saat Havrix 720 ‑rokotteen.
Ajaminen ja koneiden käyttö
Havrix 720 -rokote ei vaikuta ajokykyyn ja koneiden käyttökykyyn.
Havrix 720 sisältää fenyylialaniinia, polysorbaatti 20:ta, natriumia ja kaliumia
Tämä rokote sisältää 0,083 mg fenyylialaniinia per annos.
Fenyylialaniini voi olla haitallista, jos sinulla on fenyyliketonuria (PKU), harvinainen perinnöllinen sairaus, jossa kertyy fenyylialaniinia, koska elimistö ei kykene poistamaan sitä kunnolla.
Tämä rokote sisältää 0,025 mg polysorbaatti 20:ta per annos. Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla on allergioita, kerro asiasta lääkärille.
Tämä rokote sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Tämä rokote sisältää kaliumia alle 1 mmol (39 mg) per annos, eli sen voidaan sanoa olevan ”kaliumiton”.
Miten valmistetta käytetään
Miten rokote annetaan
- Lääkäri tai sairaanhoitaja antaa Havrix 720 -rokotteen pistoksena lihakseen. Se annetaan lapsille ja nuorille yleensä olkavarteen.
- Pienille lapsille rokote voidaan antaa reisilihakseen.
- Havrix 720 -rokote voidaan poikkeustilanteissa antaa ihon alle henkilöille, joilla on trombosytopenia (verihiutaleiden vähäisyys) tai vakava verenvuotohäiriö.
Miten paljon rokotetta annetaan
- Saat yhden Havrix 720 -rokoteannoksen (0,5 ml suspensiota) lääkärin tai sairaanhoitajan kanssa sovittuna päivänä.
- Toinen annos (tehoste) suositellaan annettavaksi 6–12 kuukauden kuluttua ensimmäisestä annoksesta, mutta se voidaan antaa enintään viiden vuoden jälkeen ensimmäisestä annoksesta. Tehosteen tarkoitus on varmistaa pitkäaikainen rokotesuoja.
Jos saat enemmän Havrix 720 -valmistetta kuin sinun pitäisi
Yliannostus on hyvin epätodennäköinen, koska rokote on yksittäisenä annoksena injektiopullossa tai ruiskussa ja lääkäri tai sairaanhoitaja antaa sen. Muutamia vahingossa annettuja tapauksia on raportoitu, ja raportoidut haittavaikutukset olivat samanlaisia kuin tavanomaisen rokoteannon yhteydessä raportoidut haittavaikutukset (lueteltu kohdassa Mahdolliset haittavaikutukset).
Jos unohdat Havrix 720 -annoksen
Ota yhteys lääkäriin, hän päättää, tarvitsetko rokoteannoksen ja milloin se on annettava.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin rokote voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Vakavat haittavaikutukset
Kerro lääkärille välittömästi, jos havaitset mitään seuraavista vakavista haittavaikutuksista – saatat tarvita kiireellistä hoitoa:
- allergiset reaktiot – merkkejä voivat olla paikalliset tai laajalle levinneet ihottumat, jotka voivat olla kutisevia tai rakkulaisia, silmien ja kasvojen turvotus, hengitys- tai nielemisvaikeudet, verenpaineen äkillinen lasku ja tajuttomuus.
Reaktiot saattavat ilmetä ennen vastaanotolta poistumista.
Kerro lääkärille välittömästi, jos havaitset mitään yllä mainituista vakavista haittavaikutuksista.
Haittavaikutukset, joita esiintyi kliinisissä tutkimuksissa Havrix 720 -valmisteen käytön yhteydessä:
Hyvin yleiset (voi esiintyä yli 1 rokoteannoksella kymmenestä):
- ärtyneisyys
- pistoskohdan kipu ja punoitus.
Yleiset (voi esiintyä enintään 1 rokoteannoksella kymmenestä):
- ruokahaluttomuus
- päänsärky
- uneliaisuus
- pahoinvointi
- yleinen huonovointisuus
- kuume 37,5 °C tai enemmän
- pistoskohdan turvotus.
Melko harvinaiset (voi esiintyä enintään 1 rokoteannoksella sadasta):
- nenän tukkoisuus tai vuotaminen
- oksentelu
- ripuli
- ihottuma
- pistoskohdan kovettuma.
Haittavaikutukset, joita on esiintynyt Havrix 720 -rokotteen markkinoille tulon jälkeen:
- kouristuskohtaukset
- verisuonten tulehdus, joka johtaa niiden ahtautumiseen tai tukkeutumiseen (vaskuliitti)
- vakava allerginen reaktio, joka aiheuttaa kasvojen, kielen tai nielun turvotusta, joka saattaa aiheuttaa nielemis- tai hengitysvaikeuksia
- nokkosihottuma, punaiset, usein kutisevat läiskät, joita ilmaantuu ensin raajoihin ja joskus myös kasvoihin tai vartaloon
- nivelkipu.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville. Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 – 8 °C). Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Havrix 720 sisältää
Vaikuttava aine on hepatiitti A -virus (inaktivoitu) adsorboituna alumiinihydroksidiin. Jokainen 0,5 ml annos rokotetta sisältää 720 ELISA yksikköä hepatiitti A -virusta.
Apuaineet: aminohappoja injektiota varten (sis. fenyylialaniinia), dinatriumfosfaatti, kaliumdivetyfosfaatti, polysorbaatti 20 (E432), natriumkloridi, kaliumkloridi ja injektionesteisiin käytettävä vesi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Suspensio injektiota varten.
Havrix 720 on samea injektioneste. Havrix 720 on saatavilla yksittäisissä esitäytetyissä ruiskuissa neuloilla tai ilman. Pakkauskoot 1, 5, 10 ja 25.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija ja valmistaja
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja.
GlaxoSmithKline Oy
Porkkalankatu 20 A
00180 Helsinki
Puh. +358 10 30 30 30
Tällä lääkkeellä on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa seuraavilla kauppanimillä:
| Alankomaat | Havrix Junior |
| Belgia, Kypros, Luxemburg | Havrix Junior 720 |
| Bulgaria | HAVRIX 720 suspension for injection (Junior monodose) Хаврикс 720 инжекционна суспензия (доза за деца) |
| Espanja | Havrix 720 Junior suspensión inyectable en jeringa precargada |
| Irlanti | Havrix Junior Monodose |
| Islanti, Norja, Suomi, Tanska | Havrix |
| Italia, Kreikka | HAVRIX |
| Itävalta | Havrix (Hepatitis A-Impfstoff) Junior 720 EI.U/0,5 ml |
| Latvia | Havrix 720 ELISA vienības/0,5 ml suspensija injekcijām |
| Liettua | Havrix 720 ELISA vienetų/0,5 ml injekcinė suspensija |
| Malta | Havrix Junior Monodose Vaccine |
| Portugali | Havrix 720 Júnior |
| Puola | HAVRIX 720 JUNIOR |
| Ranska | HAVRIX NOURRISSONS ET ENFANTS 720 U/0,5 ml |
| Romania | HAVRIX JUNIOR 720 VACCIN HEPATITIC A |
| Saksa | Havrix 720 Kinder |
| Slovakia | HAVRIX 720 Junior monodose |
| Slovenia | HAVRIX 720 PAEDIATRIC |
| Tsekki | Havrix Junior monodose |
| Unkari | Havrix 720 Junior |
| Ruotsi | Havrix 720 ELISA U |
| Viro | Havrix, 720 ELISA ühikut/ml süstesuspensioon |
Tämä pakkausseloste on tarkistettu viimeksi 08.04.2025
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Lääkealan turvallisuus- ja kehittämiskeskuksen verkkosivuilla http://www.fimea.fi
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
Havrix 720 on samea nestemäinen suspensio. Varastoitaessa saattaa muodostua hienojakoinen valkoinen sakka ja kirkas väritön supernatantti.
Ennen antamista rokote tulee tarkastaa silmämääräisesti vierashiukkasten ja/tai fysikaalisten muutosten varalta. Ennen Havrix 720 -rokotteen käyttöä injektiopulloa/ruiskua on ravistettava hyvin, jolloin saadaan heikosti opalisoiva valkoinen suspensio. Jos ulkonäkö poikkeaa tästä, rokote on hylättävä.
Esitäytetyn ruiskun käyttöohje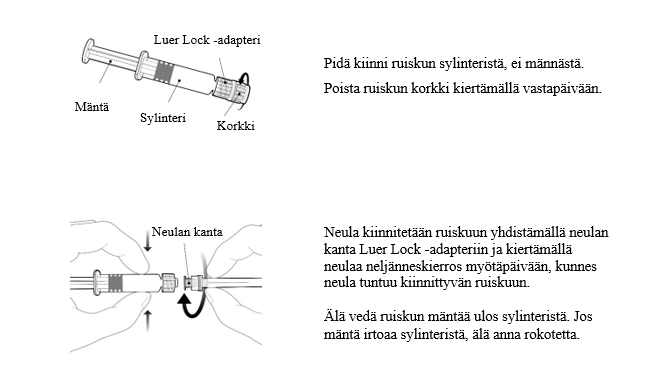
Hävitys:
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.