Pakkausseloste
POLIVY pulver till koncentrat till infusionsvätska, lösning 30 mg, 140 mg
Tilläggsinformation
Polivy 30 mg pulver till koncentrat till infusionsvätska, lösning
Polivy 140 mg pulver till koncentrat till infusionsvätska, lösning
polatuzumab vedotin
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller sjuksköterska.
- Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Polivy är och vad det används för
2. Vad du behöver veta innan du använder Polivy
3. Hur du använder Polivy
4. Eventuella biverkningar
5. Hur Polivy ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Polivy är
Polivy är ett cancerläkemedel som innehåller det aktiva ämnet polatuzumab vedotin.
Det används alltid tillsammans med andra cancerläkemedel – se nedan ”Vilka andra läkemedel ges Polivy tillsammans med”.
Vad används Polivy för
Polivy används för att behandla "diffust storcelligt B-cellslymfom" som aldrig har behandlats förut.
Polivy används också för att behandla ”diffust storcelligt B-cellslymfom” som har kommit tillbaka eller som inte blivit bättre:
- efter minst en tidigare behandling,
- och när du inte kan få en stamcellstransplantation.
”Diffust storcelligt B-cellslymfom” är en cancerform som kommer från ”B-lymfocyter” som även kallas B-celler. Dessa är en typ av blodceller.
Hur fungerar Polivy?
Polivy innehåller en så kallad monoklonal antikropp och en substans som kan döda cancerceller som kallas ”MMAE”.
- Den ”monoklonala antikroppsdelen” av läkemedlet fastnar på ett mål på B-cellerna.
- Då det fastnat på B-cellerna frigörs läkemedlet ”MMAE” in i B-cellerna och dödar dem.
Vilka andra läkemedel ges Polivy tillsammans med
Polivy ges i kombination med andra cancerläkemedel:
- rituximab, cyklofosfamid, doxorubicin och prednison för ”diffust storcelligt B-cellslymfom” som aldrig har behandlats förut.
- rituximab och bendamustin för ”diffust storcelligt B-cellslymfom” som har kommit tillbaka eller som inte blivit bättre efter minst en tidigare behandling – och när du inte kan få en stamcellstransplantation.
Vad du behöver veta innan produkten används
Använd inte Polivy
- om du är allergisk mot polatuzumab vedotin eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du för närvarande har en aktiv svår infektion.
Om det ovanstående gäller dig får du inte behandlas med Polivy. Om du är osäker, kontakta din läkare eller sjuksköterska innan du får Polivy.
Varningar och försiktighet
Tala med läkare eller sjuksköterska innan du använder Polivy om något av följande gäller dig (eller om du är osäker):
- du har eller haft kognitiva- eller neurologiska problem som:
- minnesproblem
- svårighet att röra dig eller förnimmelser i kroppen som stickningar, brännande känsla, smärta eller obehag även vid lätt beröring
- synproblem
- du har eller haft leverproblem
- du tror att du har en infektion eller har haft långvariga eller upprepade infektioner såsom herpes (se "Infektioner" i avsnitt Eventuella biverkningar)
- du ska vaccineras eller du vet att du kanske snart behöver en vaccination.
Om något av ovanstående gäller för dig (eller om du är osäker), tala med din läkare eller sjuksköterska innan du får Polivy.
Var uppmärksam på följande biverkningar
Polivy kan orsaka allvarliga biverkningar som du omedelbart behöver berätta om för din läkare eller sjuksköterska. Dessa inkluderar:
Myelosuppression
Myelosuppression är ett tillstånd där produktionen av blodceller minskar, vilket leder till färre antal röda blodkroppar, vita blodkroppar och blodplättar. Din läkare kommer att ta blodprov för att kontrollera antalet blodkroppar.
Tala omedelbart om för din läkare eller sjuksköterska om du:
- får frossa eller skälvningar
- har feber
- har huvudvärk
- känner dig trött
- känner dig yr
- är blek
- får en ovanlig blödning, blåmärken under huden, blöder längre än vanligt efter blodprovstagning eller blöder från tandköttet.
Perifer neuropati
Tala omedelbart om för din läkare eller sjuksköterska om du har problem med förändrad känsel i huden, särskilt i händer eller fötter, till exempel:
- domningar
- stickningar
- en brännande känsla
- smärta
- obehag eller svaghet
- svårt att gå.
Om du hade några av dessa symtom före behandlingen med Polivy, kontakta din läkare omedelbart om du märker några förändringar i symtomen.
Om du har symtom på perifer neuropati kan din läkare sänka din dos.
Infektioner
Tecken och symtom på infektioner varierar mellan olika individer. Tala omedelbart om för din läkare eller sjuksköterska om du utvecklar symtom på infektion som:
- feber
- hosta
- bröstsmärta
- trötthet
- smärtsamt utslag
- ont i halsen
- brännande smärta när du kissar
- känner dig svag eller allmänt dålig.
Progressiv multifokal leukoencefalopati (PML)
PML är en mycket sällsynt och livshotande infektion i hjärnan, som har inträffat hos en patient behandlad med Polivy tillsammans med bendamustin och ett annat läkemedel som kallas obinutuzumab.
Tala omedelbart om för din läkare eller sjuksköterska om du får:
- minnesförlust
- talsvårigheter
- svårt att gå
- synproblem.
Om du hade några av dessa symtom före behandlingen med Polivy, kontakta din läkare omedelbart om du märker några förändringar i symtomen. Du kan behöva medicinsk behandling.
Tumörlyssyndrom
Vissa människor kan utveckla onormala nivåer av vissa ämnen (som kalium och urinsyra) i blodet orsakat av den snabba nedbrytning av cancerceller under behandlingen. Detta kallas tumörlyssyndrom. Din läkare eller sjuksköterska kommer att ta blodprov för att kontrollera risk för detta tillstånd.
Infusionsrelaterade reaktioner
Infusionsrelaterade reaktioner, allergiska eller anafylaktiska (mer allvarliga allergiska) reaktioner kan uppstå. Din läkare eller sjuksköterska kommer att observera om du får några biverkningar under infusionen samt under 30 till 90 minuter efter avslutad infusion. Om du får någon allvarlig reaktion kan din läkare eventuellt avbryta behandlingen med Polivy.
Leverskada
Detta läkemedel kan orsaka inflammation eller skada cellerna i levern som påverkar leverns normala funktion. Skadade leverceller kan läcka större mängder av vissa ämnen (leverenzymer och bilirubin) till blodomloppet, vilket kan upptäckas med blodprov.
I de flesta fall får du inga symtom men tala omedelbart om för din läkare eller sjuksköterska om du får:
- gulfärgning av hud och av ögonvitorna (gulsot).
Din läkare kommer att ta blodprov för att kontrollera leverfunktionen före och regelbundet under behandlingen.
Barn och ungdomar
Detta läkemedel ska inte användas till barn eller ungdomar under 18 år. Det beror på att det inte finns någon information om dess användning i denna åldersgrupp.
Andra läkemedel och Polivy
Andra läkemedel och vacciner
Tala om för läkare eller sjuksköterska om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Detta gäller även läkemedel utan recept och växtbaserade läkemedel.
Tala också om för läkaren eller sjuksköterskan om du är inbokad för vaccination eller du vet att du kan behöva vaccineras inom nära framtid.
Preventivmedel (kvinnor och män)
Om du är en kvinna i fertil ålder måste du använda effektivt preventivmedel under behandlingen och i 9 månader efter den sista dosen av Polivy.
Män måste använda preventivmedel under behandlingen och i 6 månader efter den sista dosen av Polivy.
Graviditet
Det är viktigt att berätta för din läkare före och under behandlingen om du är gravid, tror du kan vara gravid eller planerar att bli gravid. Detta beror på att Polivy kan påverka ditt barns hälsa.
Använd inte detta läkemedel om du är gravid, om inte du och din läkare anser att det är nödvändigt och fördelen för dig överväger den möjliga risken för det ofödda barnet.
Amning
Amma inte när du får Polivy – och i minst 3 månader efter sista dosen, eftersom små mängder av Polivy kan passera över till din bröstmjölk.
Fertilitet
Män som ska behandlas med detta läkemedel ska rådas att ta spermaprov för förvaring innan behandlingen inleds.
Körförmåga och användning av maskiner
Polivy har liten inverkan på din förmåga att köra, cykla, använda verktyg eller maskiner.
- Om du får infusionsrelaterade reaktioner eller nervskador, eller om du känner dig trött, svag eller yr (se avsnitt Eventuella biverkningar), ska du inte köra bil, cykla eller använda verktyg eller maskiner förrän reaktionen försvunnit.
Se avsnitt Eventuella biverkningar för mer information om biverkningar.
Polivy innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Polivy innehåller polysorbat
Polivy 30 mg innehåller 1,8 mg polysorbat 20 per injektionsflaska. Polivy 140 mg innehåller 8,4 mg polysorbat 20 per injektionsflaska. Detta motsvarar 1,2 mg/ml efter beredning. Polysorbater kan orsaka allergiska reaktioner. Tala om för din läkare om du har några kända allergier.
Hur produkten används
Polivy ges under överinseende av läkare som har erfarenhet av att ge dessa behandlingar.
Det ges i en ven som infusion (dropp) under 90 minuter.
Hur mycket Polivy ges
Dosen av detta läkemedel beror på din kroppsvikt.
- Den vanliga startdosen är 1,8 mg per kg av din kroppsvikt.
- Om du har perifer neuropati kan din läkare sänka din dos.
Hur ofta ges Polivy?
- Varje cykel varar i 21 dagar.
- Du kommer att ges 6 behandlingscykler av Polivy i kombination med andra läkemedel.
Vilka andra läkemedel ges Polivy tillsammans med?
- rituximab, cyklofosfamid, doxorubicin och prednison för ”diffust storcelligt B-cellslymfom” som aldrig har behandlats förut.
- rituximab och bendamustin för ”diffust storcelligt B-cellslymfom” som har kommit tillbaka eller som inte blivit bättre efter minst en tidigare behandling – och när du inte kan få en stamcellstransplantation.
Om du har glömt en dos av Polivy
- Om du missat en inbokad tid, boka genast en ny tid.
- För att behandlingen ska få full effekt är det väldigt viktigt att inte missa en dos.
Om du slutar att använda Polivy
Avsluta inte behandlingen med Polivy om du inte har diskuterat det med din läkare. Avslutande av behandling kan leda till att din sjukdom förvärras.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Följande biverkningar har rapporterats med detta läkemedel:
Allvarliga biverkningar
Tala om för läkare eller sjuksköterska om du märker några av följande allvarliga biverkningar - du kan behöva akut medicinsk behandling. Det kan vara nya symtom eller förändring av dina nuvarande symtom.
- infusionsrelaterade reaktioner – läkaren kommer att kontrollera dig för dessa under 30‑90 minuter efter infusionen
- feber och frossa
- hudutslag/nässelfeber
- allvarliga infektioner
- lunginflammation (pneumoni)
- herpesinfektion
- virusinfektion
- övre luftvägsinfektion
- hudinfektion
- urinvägsinfektion
- ovanlig blödning och blåmärken under huden
- minnesförlust, talsvårigheter, svårigheter att gå eller problem med synen
- gulfärgad hud eller ögonvitor
- andfåddhet och svårt att andas.
Andra biverkningar
Tala om för din läkare eller sjuksköterska om du upplever någon av följande biverkningar:
Mycket vanliga: kan påverka fler än 1 av 10 personer
- lunginflammation (pneumoni)
- rinnsnuva, nysningar, halsont och hosta (övre luftvägsinfektion)
- domningar, stickningar, sveda, smärta, obehag eller svaghet och/eller svårt att gå (perifer neuropati)
- feber
- hosta
- kräkningar
- diarré eller förstoppning
- ömhet eller inflammation i munnen och/eller tarmen (mukosit)
- illamående
- buksmärtor (ont i magen)
- trötthet
- aptitlöshet
- viktminskning
- infusionsrelaterade reaktioner
- vanlig förkylning
- håravfall
- förändrade resultat i blodprover
- låga nivåer av alla typer av vita blodkroppar (tillsammans)
- låga nivåer av neutrofiler (en typ av vita blodkroppar) med eller utan feber
- låg nivå av blodplättar (en typ av blodkropp som hjälper blodet att koagulera)
- låga nivåer av röda blodkroppar (anemi)
- låg nivå av kalium i blodet (hypokalemi).
Vanliga: kan påverka upp till 1 av 10 personer
- svår infektion (sepsis)
- urinvägsinfektion
- virusinfektioner
- herpesinfektion
- hudinfektion
- lunginflammation
- andfåddhet och svårt att andas
- yrsel
- vätskeretention som orsakar svullnad i nedre delen av benen eller i händerna (perifert ödem)
- hög nivå av transaminaser i blodet
- ledsmärta
- klåda
- frossa
- hudutslag
- torr hud
- muskelsmärta
- förändrade resultat i blodprover
- minskat antal av alla blodkroppar (pancytopeni)
- låga nivåer av lymfocyter (en typ av vita blodkroppar)
- låg nivå av fosfat i blodet (hypofosfatemi)
- låg nivå av kalcium i blodet (hypokalcemi)
- låg nivå av albumin i blodet (hypoalbuminemi)
- hög nivå av enzymet lipas i blodet.
Mindre vanliga biverkningar: kan påverka upp till 1 av 100 personer
- dimsyn.
Tala omedelbart om för läkare eller sjuksköterska om du märker någon av biverkningarna listade ovan.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Finland
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Sverige
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
Hur produkten ska förvaras
Polivy kommer att lagras av sjukvårdspersonal på sjukhuset eller kliniken. Förvaringsbetingelserna och hantering är enligt följande:
- Förvara detta läkemedel utom syn- och räckhåll för barn.
- Används före utgångsdatum som anges på kartongen efter Utg. dat. och på injektionsflaskan efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
- Förvaras i kylskåp (2°C – 8°C).
- Får ej frysas.
- Förvara injektionsflaskan i ytterförpackningen. Ljuskänsligt.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är polatuzumab vedotin.
- Polivy 30 mg: Varje injektionsflaska innehåller 30 milligram (mg) polatuzumab vedotin.
- Polivy 140 mg: Varje injektionsflaska innehåller 140 milligram (mg) polatuzumab vedotin.
- Efter beredning innehåller varje milliliter (ml) 20 mg polatuzumab vedotin.
- Övriga innehållsämnen är: bärnstenssyra, natriumhydroxid, sackaros, polysorbat 20. Se avsnitt Vad du behöver veta innan produkten används ”Polivy innehåller natrium och polysorbat”.
Läkemedlets utseende och förpackningsstorlekar
Polivy pulver till koncentrat till infusionsvätska, lösning är ett vitt till något gråvitt pulver (pulverkaka) i en injektionsflaska av glas.
Varje förpackning med Polivy består av en injektionsflaska.
Innehavare av godkännande för försäljning
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Tyskland
Tillverkare
Roche Registration AG
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Tyskland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
België/Belgique/Belgien, Luxembourg/Luxemburg N.V. Roche S.A. België/Belgique/Belgien Tél/Tel: +32 (0) 2 525 82 11 | Latvija Roche Latvija SIA Tel: +371 - 6 7039831 |
България Рош България ЕООД Тел: +359 2 474 5444 | Lietuva UAB “Roche Lietuva” Tel: +370 5 2546799 |
Česká republika Roche s. r. o. Tel: +420 - 2 20382111 | Magyarország Roche (Magyarország) Kft. Tel: +36 – 1 279 4500 |
Danmark Roche Pharmaceuticals A/S Tlf.: +45 - 36 39 99 99 | Nederland Roche Nederland B.V. Tel: +31 (0) 348 438050 |
Deutschland Roche Pharma AG Tel: +49 (0) 7624 140 | Norge Roche Norge AS Tlf: +47 ‑ 22 78 90 00 |
Eesti Roche Eesti OÜ Tel: + 372 - 6 177 380 | Österreich Roche Austria GmbH Tel: +43 (0) 1 27739 |
Ελλάδα, Kύπρος Roche (Hellas) A.E. Τηλ: +30 210 61 66 100 | Polska Roche Polska Sp.z o.o. Tel: +48 ‑ 22 345 18 88 |
España Roche Farma S.A. Tel: +34 - 91 324 81 00 | Portugal Roche Farmacêutica Química, Lda Tel: +351 ‑ 21 425 70 00 |
Frankrike Roche Tél: +33 (0)1 47 61 40 00 | România Roche România S.R.L. Tel: +40 21 206 47 01 |
Hrvatska Roche d.o.o. Tel: + 385 1 4722 333 | Slovenija Roche farmacevtska družba d.o.o. Tel: +386 ‑ 1 360 26 00 |
Irland, Malta Roche Products (Ireland) Ltd. Ireland/L-Irlanda Tel: +353 (0) 1 469 0700 | Slovenská republika Roche Slovensko, s.r.o. Tel: +421 ‑ 2 52638201 |
Ísland Roche Pharmaceuticals A/S c/o Icepharma hf Sími: +354 540 8000 | Suomi/Finland Roche Oy Puh/Tel: +358 (0) 10 554 500 |
Italia Roche S.p.A. Tel: +39 - 039 2471 | Sverige Roche AB Tel: +46 (0) 8 726 1200 |
Denna bipacksedel ändrades senast 10/2025
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Anvisningar om korrekt hantering och destruktion av cancerläkemedel ska beaktas.
Instruktioner för beredning
- Polivy 30 mg: Använd en steril spruta, injicera långsamt 1,8 ml sterilt vatten för injektion i 30 mg Polivy-injektionsflaskan för att erhålla en singeldos-lösning innehållande 20 mg/ml polatuzumab vedotin. Rikta vätskan mot flaskans vägg och inte direkt på den frystorkade pulverkakan.
- Polivy 140 mg: Använd en steril spruta, injicera långsamt 7,2 ml sterilt vatten för injektion i 140 mg Polivy-injektionsflaskan för att erhålla en singeldos-lösning innehållande 20 mg/ml polatuzumab vedotin. Rikta vätskan mot flaskans vägg och inte direkt på den frystorkade pulverkakan.
- Snurra injektionsflaskan försiktigt tills pulvret är upplöst. Skaka inte.
- Inspektera den beredda lösningen med avseende på missfärgningar och partiklar. Den beredda lösningen ska vara färglös till lätt brunaktig, klar till lätt opaliserande och fri från synliga partiklar. Använd inte den beredda lösningen om den är missfärgad, grumlig eller innehåller synliga partiklar.
Instruktioner för spädning
1. Polivy måste spädas till en slutlig koncentration av 0,72-2,7 mg/ml i en intravenös infusionspåse med en minsta volym på 50 ml innehållande 9 mg/ml natriumklorid injektionslösning, 4,5 mg/ml natriumklorid injektionslösning eller 5% glukos.
2. Bestäm volymen av 20 mg/ml beredd lösning som behövs baserat på den dos som krävs (se nedan):
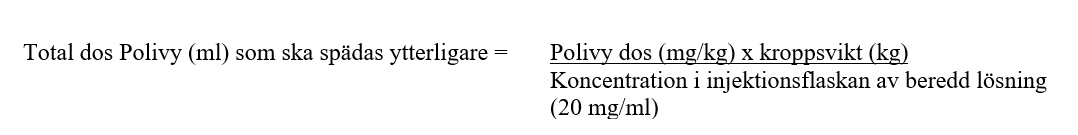
3. Dra ut den önskade volymen beredd lösning från injektionsflaskan med Polivy med en steril spruta och späd i den intravenösa infusionspåsen. Kasta oanvänd lösning som finns kvar i injektionsflaskan.
4. Blanda försiktigt den intravenösa infusionspåsen genom att vända den långsamt. Får ej skakas.
5. Inspektera den intravenösa infusionspåsen med avseende på partiklar och kassera vid partikelförekomst.
Beredd lösning:
Ur mikrobiologisk synvinkel ska den beredda lösningen användas omedelbart. Om lösningen inte används omedelbart är det den som administrerar som är ansvarig för (in-use) förvaringstider och förhållanden före förbrukning och det är normalt inte längre än 24 timmar i kylskåp (2 °C‑8 °C), såvida inte beredning skett under kontrollerade och validerade aseptiska förhållanden. Kemisk och fysikalisk (in-use) stabilitet i den beredda lösningen har visats i upp till 72 timmar i kylskåp (2 °C‑8 °C) och upp till 24 timmar vid rumstemperatur (9 °C‑25 °C).
Utspädd lösning:
Ur mikrobiologisk synvinkel ska den färdiga infusionslösningen användas omedelbart. Om lösningen inte används omedelbart är det den som administrerar som är ansvarig för (in-use) förvaringstider och förhållanden före förbrukning och det är normalt inte längre än 24 timmar i kylskåp (2 °C‑8 °C), såvida inte spädning skett under kontrollerade och validerade aseptiska förhållanden. Kemisk och fysikalisk stabilitet av den färdiga infusionslösningen har påvisats under de tidsperioder som anges i tabell 1. Den beredda lösningen måste kastas om förvaringstiden överstiger gränserna som anges i tabell 1.
Tabell 1 Hållbarhetstider för vilka kemisk och fysisk stabilitet hos den färdiga infusionslösningen har påvisats
| Spädningsmedel som använts för att bereda infusionsvätska | Infusionsvätska lagringsförhållanden1 |
| Natriumklorid 9 mg/ml (0,9%) | Upp till 72 timmar i kylskåp (2 °C‑8 °C) eller upp till 4 timmar vid rumstemperatur (9 °C‑25 °C) |
| Natriumklorid 4,5 mg/ml (0,45%) | Upp till 72 timmar i kylskåp (2 °C‑8 °C) eller upp till 8 timmar vid rumstemperatur (9 °C‑25 °C) |
| 5% Glukos | Upp till 72 timmar i kylskåp (2 °C‑8 °C) eller upp till 8 timmar vid rumstemperatur (9 °C‑25 °C) |
| 1 För att säkerställa produktstabilitet ska inte angiven lagringstid överskridas. | |