Pakkausseloste
POLIVY kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 30 mg, 140 mg
Polivy 30 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
Polivy 140 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
polatutsumabi-vedotiini
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai sairaanhoitajan puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Polivy on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Polivy-valmistetta
3. Miten Polivy-valmistetta annetaan
4. Mahdolliset haittavaikutukset
5. Polivy-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Polivy on?
Polivy on syöpälääke, joka sisältää vaikuttavana aineena polatutsumabi-vedotiinia.
Sitä käytetään aina yhdessä muiden syöpälääkkeiden kanssa – ks. jäljempänä Minkä muiden lääkkeiden kanssa Polivy-valmistetta annetaan.
Mihin Polivy-valmistetta käytetään
Polivy-valmistetta annetaan diffuusiksi suurisoluiseksi B-solulymfoomaksi kutsutun sairauden hoitoon, kun sairauteen ei ole aiemmin annettu hoitoa.
Polivy-valmistetta annetaan diffuusiksi suurisoluiseksi B-solulymfoomaksi kutsutun sairauden hoitoon myös, kun sairaus on uusiutunut tai se ei ole parantunut
- vähintään yhden aiemman hoidon jälkeen ja
- kun sinulle ei voida tehdä kantasolusiirtoa.
Diffuusi suurisoluinen B-solulymfooma on syöpä, joka saa alkunsa B-lymfosyyteistä (kutsutaan myös B-soluiksi). B-lymfosyytit ovat eräänlaisia verisoluja.
Miten Polivy vaikuttaa
Polivy sisältää ainetta, jota kutsutaan nimellä monoklonaalinen vasta-aine, sekä ainetta, joka on nimeltään MMAE eli monometyyliauristatiini E ja joka voi tuhota syövän.
- Lääkkeen monoklonaalinen vasta-aineosa sitoutuu B-soluissa olevaan kohteeseen.
- B-soluun sitoutunut lääkeaine vapauttaa MMAE:ta B-soluihin ja tuhoaa niitä.
Minkä muiden lääkkeiden kanssa Polivy-valmistetta annetaan
Polivy annetaan yhdistelmänä muiden syöpälääkkeiden kanssa:
- rituksimabin, syklofosfamidin, doksorubisiinin ja prednisonin kanssa aiemmin hoitamattoman diffuusin suurisoluisen B-solulymfooman hoitoon
- rituksimabin ja bendamustiinin kanssa uusiutuneen tai hoitoon vastaamattoman diffuusin suurisoluisen B‑solulymfooman hoitoon vähintään yhden aiemman hoidon jälkeen ja jos sinulle ei voida tehdä kantasolusiirtoa.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Sinulle ei saa antaa Polivy-valmistetta
- jos olet allerginen polatutsumabi-vedotiinille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on parhaillaan jokin aktiivinen vaikea-asteinen infektio.
Jos edellä mainitut koskevat sinua, sinulle ei saa antaa Polivy-valmistetta. Jos olet epävarma, käänny lääkärin tai sairaanhoitajan puoleen ennen kuin sinulle annetaan Polivy-valmistetta.
Varoitukset ja varotoimet
Jos jokin seuraavista koskee sinua (tai et ole siitä varma), keskustele lääkärin tai sairaanhoitajan kanssa ennen kuin sinulle annetaan Polivy-valmistetta:
- jos sinulla on joskus ollut aivojen tai hermoston häiriöitä, kuten
- muistihäiriöitä
- liikkumisvaikeuksia tai aistimuksia kehossa, kuten pistelyä ja kihelmöintiä, polttavaa tunnetta, kipua ja epämiellyttäviä tuntemuksia jopa vähäisestä kosketuksesta
- näköhäiriöitä
- jos sinulla on joskus ollut maksan toimintahäiriöitä
- jos epäilet, että sinulla on jokin infektio tai sinulla on ollut pitkään kestäviä tai toistuvia infektioita, kuten herpestä (ks. Infektiot kohdassa Mahdolliset haittavaikutukset)
- jos olet saamassa rokotuksen tai jos sinulle suunnitellaan rokotuksen antamista lähiaikoina.
Jos jokin edellä mainituista koskee sinua (tai et ole siitä varma), käänny lääkärin tai sairaanhoitajan puoleen ennen kuin sinulle annetaan Polivy-valmistetta.
Tarkkaile seuraavia haittavaikutuksia
Polivy voi aiheuttaa joitakin vakavia haittavaikutuksia, joista on heti kerrottava lääkärille tai sairaanhoitajalle. Tällaisia ovat:
Luuydinlama
Luuydinlama on häiriötila, jossa normaalien verisolujen tuotanto vähenee, minkä seurauksena veren punasolujen, veren valkosolujen ja verihiutaleiden määrä vähenee. Lääkäri ottaa verikokeita verisolujen määrän tarkistamiseksi.
Kerro lääkärille tai sairaanhoitajalle heti
- jos sinulle ilmaantuu vilunväreitä tai vilunpuistatuksia
- jos sinulla on kuumetta
- jos sinulla on päänsärkyä
- jos olet väsynyt
- jos sinulla on huimausta
- jos olet kalpea
- jos sinulla on epätavallista verenvuotoa, mustelmia ihon alla, verenvuoto kestää verikokeen ottamisen jälkeen tavanomaista pidempään tai verenvuotoa ikenistä.
Perifeerinen neuropatia
Kerro heti lääkärille tai sairaanhoitajalle, jos sinulla on oireita, joihin liittyy muutoksia ihon tuntoherkkyydessä, etenkin käsissä tai jalkaterissä, kuten
- tunnottomuutta
- kihelmöintiä
- polttavaa tunnetta
- kipua
- epämukavuuden tunnetta tai heikotusta
- kävelyvaikeuksia.
Jos sinulla on ollut tällaisia oireita ennen Polivy-hoitoa, kerro heti lääkärille, jos nämä oireet muuttuvat.
Jos sinulla on perifeerisen neuropatian oireita, lääkäri voi pienentää annostasi.
Infektiot
Infektioiden oireet ja löydökset ovat yksilöllisiä, joten kerro lääkärille tai sairaanhoitajalle heti, jos sinulle kehittyy infektion oireita, kuten
- kuumetta
- yskää
- kipua rintakehässä
- väsymystä
- kivuliasta ihottumaa
- kurkkukipua
- kirvelyä virtsaamisen yhteydessä
- heikotuksen tunnetta tai yleistä sairaudentunnetta.
Progressiivinen multifokaalinen leukoenkefalopatia (eli PML)
Progressiivinen multifokaalinen leukoenkefalopatia on hyvin harvinainen ja hengenvaarallinen aivoinfektio, jota on havaittu yhdellä potilaalla, joka sai Polivy-hoitoa yhdessä bendamustiinin ja toisen, obinututsumabi-nimisen lääkkeen kanssa.
Kerro lääkärille tai sairaanhoitajalle heti, jos sinulla on
- muistamattomuutta
- puhevaikeuksia
- kävelyvaikeuksia
- näköhäiriöitä.
Jos sinulla on ollut tällaisia oireita ennen Polivy-hoitoa, kerro heti lääkärille, jos nämä oireet muuttuvat. Saatat tarvita lääkärinhoitoa.
Tuumorilyysioireyhtymä
Joillekin henkilöille voi kehittyä joidenkin veren kemiallisten aineiden (kuten kaliumin ja virtsahapon) pitoisuuksien poikkeavuuksia, mikä johtuu syöpäsolujen nopeasta hajoamisesta hoidon aikana. Tätä kutsutaan tuumorilyysioireyhtymäksi. Lääkäri, apteekkihenkilökunta tai sairaanhoitaja ottaa verikokeita tuumorilyysioireyhtymän toteamiseksi.
Infuusioon liittyvät reaktiot
Infuusioreaktioita, allergisia tai anafylaktisia (vaikeampiasteisia allergisia) reaktioita voi esiintyä. Lääkäri tai sairaanhoitaja tarkkailee haittavaikutuksia infuusion aikana ja 30–90 minuutin ajan infuusion jälkeen. Jos sinulle ilmaantuu vakava reaktio, lääkäri saattaa lopettaa Polivy-hoidon.
Maksavaurio
Tämä lääke voi aiheuttaa maksasolutulehduksen tai maksasoluvaurion, joka vaikuttaa maksan normaaliin toimintaan. Vaurioituneista maksasoluista voi vapautua runsaasti tiettyjä aineita (maksaentsyymejä ja bilirubiinia) verenkiertoon, ja nämä aineet voidaan havaita verikokeista.
Tämä on useimmiten oireetonta, mutta kerro heti lääkärille tai sairaanhoitajalle, jos sinulle ilmaantuu
- ihon tai silmänvalkuaisten muuttumista keltaiseksi (ikterus).
Lääkäri ottaa verikokeita maksan toiminnan tutkimiseksi ennen hoitoa ja säännöllisesti hoidon aikana.
Lapset ja nuoret
Tätä lääkettä ei pidä käyttää lasten tai alle 18-vuotiaiden nuorten hoitoon, koska sen käytöstä näille ikäryhmille ei ole tietoja.
Muut lääkevalmisteet ja Polivy
Muut lääkevalmisteet ja rokotteet
Kerro lääkärille tai sairaanhoitajalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä. Tämä koskee myös ilman lääkemääräystä saatavia lääkkeitä ja rohdosvalmisteita.
Kerro lääkärille tai sairaanhoitajalle myös, jos sinun on tarkoitus saada jokin rokotus tai jos tiedät, että lähiaikoina tarvitset rokotuksen.
Ehkäisy (naiset ja miehet)
Jos olet nainen, joka voi tulla raskaaksi, sinun on käytettävä tehokasta ehkäisyä hoidon aikana ja 9 kuukauden ajan viimeisen Polivy-annoksen jälkeen.
Miesten on käytettävä ehkäisyä hoidon aikana ja 6 kuukauden ajan viimeisen Polivy-annoksen jälkeen.
Raskaus
On tärkeää, että kerrot lääkärille ennen hoitoa ja hoidon aikana, jos olet raskaana, epäilet olevasi raskaana tai suunnittelet lapsen hankkimista. Tämä on tärkeää siksi, että Polivy voi vaikuttaa vauvan terveyteen.
Et saa käyttää tätä lääkettä, jos olet raskaana, paitsi jos sinä ja lääkäri yhdessä katsotte, että hyödyt sinulle ovat sikiölle aiheutuvia mahdollisia riskejä suuremmat.
Imetys
Älä imetä Polivy-hoidon aikana äläkä vähintään 3 kuukauteen viimeisen annoksen jälkeen, koska pieni määrä Polivy-valmistetta voi erittyä rintamaitoon.
Hedelmällisyys
Miehiä kehotetaan hakeutumaan siittiöiden talteenottoon ja säilytykseen ennen hoitoa tällä lääkkeellä.
Ajaminen ja koneiden käyttö
Polivy-valmisteella on vähäinen vaikutus ajokykyyn ja kykyyn pyöräillä sekä työkalujen tai koneiden käyttökykyyn. Jos sinulle tulee infuusion liittyviä reaktioita tai hermovaurio tai jos sinulla on väsymystä, heikotusta tai huimausta (ks. kohta Mahdolliset haittavaikutukset), älä aja, pyöräile äläkä käytä mitään työkaluja tai koneita ennen kuin reaktio häviää.
Lisätietoja haittavaikutuksista, ks. kohta Mahdolliset haittavaikutukset.
Polivy sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Polivy sisältää polysorbaattia
Polivy 30 mg sisältää 1,8 mg polysorbaattia 20 per injektiopullo. Polivy 140 mg sisältää 8,4 mg polysorbaattia 20 per injektiopullo, mikä vastaa 1,2 mg/ml. Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla on allergioita, kerro asiasta lääkärille.
Miten valmistetta käytetään
Polivy annetaan sellaisen lääkärin valvonnassa, jolla kokemusta tällaisten hoitojen antamisesta.
Polivy annetaan 90 minuutin kestoisena tiputuksena laskimoon.
Miten paljon Polivy-valmistetta annetaan
Tämän lääkkeen annos perustuu painoosi.
- Tavanomainen aloitusannos on 1,8 mg painokiloa kohden.
- Jos sinulla on perifeerinen neuropatia, lääkäri saattaa pienentää annostasi.
Miten usein Polivy-valmistetta annetaan?
- Yksi hoitosykli kestää 21 päivää.
- Sinulle annetaan kuusi Polivy-hoitosykliä yhdistelmänä muiden lääkkeiden kanssa.
Minkä muiden lääkkeiden kanssa Polivy annetaan?
- rituksimabin, syklofosfamidin, doksorubisiinin ja prednisonin kanssa aiemmin hoitamattoman diffuusin suurisoluisen B-solulymfooman hoitoon tai
- rituksimabin ja bendamustiinin kanssa uusiutuneen tai hoitoon vastaamattoman diffuusin suurisoluisen B-solulymfooman hoitoon vähintään yhden aiemman hoidon jälkeen – ja jos sinulle ei voida tehdä kantasolusiirtoa.
Jos Polivy-annos jää saamatta
Jos unohdat hoitokäynnin, sovi heti uusi käynti. On hyvin tärkeää, ettei yksikään annos jää saamatta, jotta hoito mahdollisimman hyvin.
Jos lopetat Polivy-hoidon
Älä lopeta Polivy-hoitoa keskustelematta siitä ensin lääkärin kanssa, sillä vointisi voi huonontua hoidon lopettamisen seurauksena.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Tämän lääkkeen käytössä on raportoitu seuraavia haittavaikutuksia:
Vakavat haittavaikutukset
Kerro heti lääkärille tai sairaanhoitajalle, jos huomaat jonkin seuraavista vakavista haittavaikutuksista, sillä saatat tarvita kiireellistä lääkärinhoitoa. Kyse saattaa olla uusista oireista tai muutoksista nykyisiin oireisiin.
- infuusioon liittyvät reaktiot – lääkäri tutkii sinulta nämä 30–90 minuutin kuluttua hoidosta
- kuume ja vilunväreet
- ihottuma/nokkosihottuma
- vaikea-asteiset infektiot
- keuhkokuume (keuhkoinfektio)
- herpesinfektio
- virusinfektiot
- ylähengitysteiden infektio
- ihoinfektio
- virtsatieinfektio
- epätavallinen verenvuoto tai mustelmat ihon alla
- muistamattomuus, puhevaikeudet, kävelyvaikeudet tai näkövaikeudet
- ihon tai silmänvalkuaisten muuttuminen keltaisiksi
- hengästyneisyys ja hengitysvaikeudet.
Muita haittavaikutuksia
Kerro lääkärille tai sairaanhoitajalle, jos huomaat jonkin seuraavista haittavaikutuksista:
Hyvin yleiset (saattavat esiintyä useammalla kuin 1 potilaalla kymmenestä)
- keuhkokuume (keuhkoinfektio)
- nenän vuotaminen, aivastelu, kurkkukipu ja yskä (ylähengitysteiden infektio)
- tunnottomuus, kihelmöinti, polttava tuntemus, kipu, epämiellyttävät tuntemukset tai heikotus ja/tai kävelyvaikeudet (perifeerinen neuropatia)
- kuume
- yskä
- oksentelu
- ripuli tai ummetus
- suun ja/tai suoliston arkuus tai tulehdus (mukosiitti)
- pahoinvointi
- vatsakipu
- väsymyksen tunne
- ruokahaluttomuus
- painon lasku
- infuusioon liittyvät reaktiot
- nuhakuume
- hiustenlähtö
- muutokset verikokeissa:
- kaikkien veren valkosolutyyppien (yhteensä) vähyys
- neutrofiilien (eräänlaisia veren valkosoluja) vähyys, johon liittyy tai ei liity kuumetta
- verihiutaleiden (eräänlaisia verisoluja, jotka auttavat verta hyytymään) vähyys
- veren punasolujen vähyys (anemia)
- pieni veren kaliumpitoisuus (hypokalemia).
Yleiset (saattavat esiintyä enintään 1 potilaalla kymmenestä)
- vaikea-asteinen infektio (sepsis)
- virtsatieinfektio
- virusinfektiot
- herpesinfektio
- ihoinfektiot
- keuhkojen tulehdus
- hengästyneisyys ja hengitysvaikeudet
- heitehuimaus
- nesteen kertyminen, mistä aiheutuu säärten tai käsien turpoamista (perifeerinen edeema)
- suuri veren transaminaasipitoisuus
- nivelkipu
- kutina
- vilunväreet
- ihottuma
- kuiva iho
- lihaskipu
- muutokset verikokeissa:
- kaikkien verisolujen vähentynyt määrä (pansytopenia)
- lymfosyyttien (eräänlaisia veren valkosoluja) vähyys
- pieni veren fosfaattipitoisuus (hypofosfatemia)
- pieni veren kalsiumpitoisuus (hypokalsemia)
- pieni veren albumiinipitoisuus (hypoalbuminemia)
- suuri veren lipaasientsyymipitoisuus.
Melko harvinaiset (saattavat esiintyä enintään 1 potilaalla sadasta)
- näön sumeneminen.
Kerro heti lääkärille tai sairaanhoitajalle, jos huomaat jonkin edellä mainituista haittavaikutuksista.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Terveydenhoidon ammattilaiset säilyttävät Polivy-valmisteen sairaalassa tai klinikalla. Säilytysohjeet ovat
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä kotelossa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
- Säilytä jääkaapissa (2 °C – 8 °C).
- Ei saa jäätyä.
- Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Polivy sisältää
- Vaikuttava aine on polatutsumabi-vedotiini.
- Polivy 30 mg: Yksi injektiopullo sisältää 30 milligrammaa (mg) polatutsumabi-vedotiinia.
- Polivy 140 mg: Yksi injektiopullo sisältää 140 milligrammaa (mg) polatutsumabi-vedotiinia.
- Käyttökuntoon saatettuna yksi millilitra (ml) sisältää 20 mg polatutsumabi-vedotiinia.
- Muut aineet ovat meripihkahappo, natriumhydroksidi, sakkaroosi, polysorbaatti 20. Katso kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Polivy sisältää natriumia ja polysorbaattia”.
Lääkevalmisteen kuvaus ja pakkauskoko
Polivy kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos, on valkoinen tai harmahtavan valkoinen kuiva-ainekakku lasisessa injektiopullossa.
Yksi Polivy-pakkaus sisältää yhden injektiopullon.
Myyntiluvan haltija
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Saksa
Valmistaja
Roche Pharma AG
Emil‑Barell‑Strasse 1
79639 Grenzach‑Wyhlen
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
België/Belgique/Belgien, Luxembourg/Luxemburg N.V. Roche S.A. België/Belgique/Belgien Tél/Tel: +32 (0) 2 525 82 11 | Latvija Roche Latvija SIA Tel: +371 - 6 7039831 |
България Рош България ЕООД Тел: +359 2 474 5444 | Lietuva UAB “Roche Lietuva” Tel: +370 5 2546799 |
Česká republika Roche s. r. o. Tel: +420 ‑ 2 20382111 | Magyarország Roche (Magyarország) Kft. Tel: +36 ‑ 1 279 4500 |
Danmark Roche Pharmaceuticals A/S Tlf.: +45 ‑ 36 39 99 99 | Nederland Roche Nederland B.V. Tel: +31 (0) 348 438050 |
Deutschland Roche Pharma AG Tel: +49 (0) 7624 140 | Norge Roche Norge AS Tlf: +47 ‑ 22 78 90 00 |
Eesti Roche Eesti OÜ Tel: + 372 ‑ 6 177 380 | Österreich Roche Austria GmbH Tel: +43 (0) 1 27739 |
Ελλάδα, Kύπρος Roche (Hellas) A.E. Ελλάδα Τηλ: +30 210 61 66 100 | Polska Roche Polska Sp.z o.o. Tel: +48 ‑ 22 345 18 88 |
España Roche Farma S.A. Tel: +34 ‑ 91 324 81 00 | Portugal Roche Farmacêutica Química, Lda Tel: +351 ‑ 21 425 70 00 |
France Roche Tél: +33 (0) 1 47 61 40 00 | România Roche România S.R.L. Tel: +40 21 206 47 01 |
Hrvatska Roche d.o.o. Tel: +385 1 4722 333 | Slovenija Roche farmacevtska družba d.o.o. Tel: +386 ‑ 1 360 26 00 |
Ireland, Malta Roche Products (Ireland) Ltd. Ireland/L-Irlanda Tel: +353 (0) 1 469 0700 | Slovenská republika Roche Slovensko, s.r.o. Tel: +421 ‑ 2 52638201 |
Ísland Roche Pharmaceuticals A/S c/o Icepharma hf Sími: +354 540 8000 | Suomi/Finland Roche Oy Puh/Tel: +358 (0) 10 554 500 |
Italia Roche S.p.A. Tel: +39 ‑ 039 2471 | Sverige Roche AB Tel: +46 (0) 8 726 1200 |
Tämä pakkausseloste on tarkistettu viimeksi 10/2025
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
Toimenpiteet syöpälääkkeiden asianmukaisesta käsittelystä ja hävittämisestä on huomioitava.
Ohjeet kuiva-aineen liuottamiseen eli välikonsentraatin valmistamiseen
- Polivy 30 mg: Käytä steriiliä ruiskua, ja injisoi hitaasti 1,8 ml steriiliä injektionesteisiin käytettävää vettä 30 mg Polivy-valmistetta sisältävään injektiopulloon, jolloin saadaan kerta-annos 20 mg/ml polatutsumabi-vedotiinia sisältävää liuosta. Kohdista nestesuihku injektiopullon seinään eikä suoraan kylmäkuivattuun kuiva-ainekakkuun.
- Polivy 140 mg: Käytä steriiliä ruiskua, ja injisoi hitaasti 7,2 ml steriiliä injektionesteisiin käytettävää vettä 140 mg Polivy-valmistetta sisältävään injektiopulloon, jolloin saadaan kerta-annos 20 mg/ml polatutsumabi-vedotiinia sisältävää liuosta. Kohdista nestesuihku injektiopullon seinään eikä suoraan kylmäkuivattuun kuiva-ainekakkuun.
- Pyörittele injektiopulloa varovasti, kunnes kuiva-aine on liuennut täysin. Ei saa ravistaa.
- Tarkista, ettei välikonsentraatti ole värjäytynyttä eikä siinä ole hiukkasia. Välikonsentraatti on väritöntä tai hieman ruskeaa, kirkasta tai hieman opalisoivaa, eikä siinä saa olla näkyviä hiukkasia. Jos välikonsentraatti on värjäytynyttä tai sameaa tai jos siinä on näkyviä hiukkasia, älä käytä liuosta.
Laimennusohjeet
1. Polivy on laimennettava lopulliseen pitoisuuteen 0,72–2,7 mg/ml infuusiopussiin, jonka tilavuus on vähintään 50 ml ja joka sisältää 9 mg/ml natriumkloridiliuosta, 4,5 mg/ml natriumkloridiliuosta tai 5-prosenttista glukoosiliuosta.
2. Laske tarvittava välikonsentraatin liuostilavuus (20 mg/ml) tarvittavan annoksen perusteella (ks. jäljempänä):
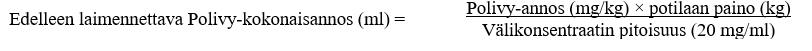
3. Vedä injektiopullosta steriiliin ruiskuun tarvittava tilavuus Polivy-välikonsentraattia ja laimenna se infuusiopussiin. Hävitä injektiopulloon käyttämättä jäävä valmiste.
4. Sekoita varovasti kääntelemällä infuusiopussia hitaasti. Ei saa ravistaa.
5. Tarkista, ettei infuusiopussissa ole hiukkasia. Hävitä, jos havaitset hiukkasia.
Liuotettu kuiva-aine eli välikonsentraatti
Välikonsentraatti pitää mikrobiologiselta kannalta käyttää heti. Jos välikonsentraattia ei käytetä heti, käytönaikaiset säilytysajat ja ‑olosuhteet ovat käyttäjän vastuulla eivätkä saisi tavallisesti ylittää 24 tuntia jääkaapissa (2 °C – 8 °C), paitsi jos kuiva-aine on liuotettu kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa. Välikonsentraatin käytönaikaiseksi kemialliseksi ja fysikaaliseksi säilyvyydeksi on osoitettu enintään 72 tuntia jääkaapissa (2 °C – 8 °C) ja enintään 24 tuntia huoneenlämpötilassa (9 °C – 25 °C).
Laimennettu liuos
Laimennettu infuusioliuos pitää mikrobiologiselta kannalta käyttää heti. Jos liuosta ei käytetä heti, käytönaikaiset säilytysajat ja ‑olosuhteet ovat käyttäjän vastuulla eivätkä saisi tavallisesti ylittää 24 tuntia jääkaapissa (2 °C – 8 °C), paitsi jos liuos on laimennettu kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa. Käyttövalmiiksi laimennetun liuoksen kemialliset ja fysikaaliset säilyvyysajat esitetään taulukossa 1. Jos säilytysaika ylittää taulukossa 1 mainitut rajat, hävitä laimennettu Polivy-liuos.
Taulukko 1 Käyttövalmiiksi laimennetun infuusioliuoksen osoitetut kemialliset ja fysikaaliset säilyvyysajat
| Infuusioliuoksen valmistamiseen käytettävä liuotin | Infuusioliuoksen säilytysolosuhteet1 |
| 9 mg/ml (0,9 %) natriumkloridiliuos | Enintään 72 tuntia jääkaapissa (2 °C – 8 °C) tai enintään 4 tuntia huoneenlämmössä (9 °C – 25 °C) |
| 4,5 mg/ml (0,45 %) natriumkloridiliuos | Enintään 72 tuntia jääkaapissa (2 °C – 8 °C) tai enintään 8 tuntia huoneenlämmössä (9 °C – 25 °C) |
| 5 % glukoosiliuos | Enintään 72 tuntia jääkaapissa (2 °C – 8 °C) tai enintään 8 tuntia huoneenlämmössä (9 °C – 25 °C) |
| 1 Valmisteen säilyvyyden varmistamiseksi mainittuja säilytysaikoja ei saa ylittää. | |