Pakkausseloste
PREVICOX purutabletti 57 mg, 227 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Previcox 57 mg purutabletit koiralle
Previcox 227 mg purutabletit koiralle
VAIKUTTAVAT JA MUUT AINEET
Yksi purutabletti sisältää:
Vaikuttava aine:
Firokoksibi 57 mg
tai
Firokoksibi 227 mg
Ruskeat, pyöreät, kuperat purutabletit, joissa on toisella puolella ristikkäisjakouurre.
Purutabletti voidaan jakaa kahteen tai neljään yhtä suureen osaan.
KÄYTTÖAIHEET
Koirien nivelrikkoon liittyvän kivun ja tulehdusreaktion lievittäminen.
Koirien pehmytkudoskirurgiaan, ortopediaan ja hammaskirurgiaan liittyvän toimenpiteen jälkeisen kivun ja tulehdusreaktion lievittäminen.
VASTA-AIHEET
Ei saa käyttää tiineille eikä imettäville nartuille.
Valmistetta ei saa käyttää alle 10-viikkoisille eikä alle 3 kg painaville eläimille.
Valmistetta ei saa käyttää eläimille, joilla on ruuansulatuskanavan verenvuoto, häiriöitä verenkuvassa tai verenvuotohäiriö.
Valmistetta ei saa käyttää samanaikaisesti kortikosteroidien eikä muiden tulehduskipulääkkeiden (NSAID) kanssa.
HAITTAVAIKUTUKSET
Melko harvinainen 1–10 eläintä 1 000 hoidetusta eläimestä):
Oksentelu1 ja ripuli1.
Harvinainen (1–10 eläintä 10 000 hoidetusta eläimestä):
Hermostolliset häiriöt.
Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina):
Maksa- ja munuaishäiriöt.
1 Yleensä ohimeneviä ja korjautuvia, kun hoito lopetetaan.
Jos haittavaikutuksia kuten oksentelua, toistuvaa ripulia, ulosteen piiloverisyyttä, äkillistä painon laskua, ruokahaluttomuutta, uupumista, munuais- tai maksa-arvojen poikkeamia ilmenee, valmisteen käyttö on lopetettava ja eläinlääkäriä on konsultoitava. Valmisteen käytön yhteydessä voi esiintyä vakavia haittavaikutuksia, kuten muidenkin tulehduskipulääkkeiden käytön yhteydessä. Hyvin harvoissa tapauksissa haittavaikutukset voivat olla jopa kuolemaan johtavia.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle tai myyntiluvan haltijan paikalliselle edustajalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta: {kansallisen järjestelmän yksityiskohdat}.
KOHDE-ELÄINLAJI
Koira
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
5 mg/kg kerran vuorokaudessa.
Leikkauksen jälkeisen kivun ja tulehdusreaktion lievittämiseen hoito voidaan aloittaa noin 2 tuntia ennen leikkausta ja hoitoa voidaan jatkaa enintään 3 vuorokauden ajan tarpeen mukaan. Ortopedisen leikkauksen jälkeen ja saavutetusta hoitovasteesta riippuen hoitoa voidaan jatkaa vielä kolmen ensimmäisen päivän jälkeen hoitavan lääkärin arvion perusteella.
Annetaan suun kautta alla olevan taulukon mukaisesti.
| Paino (kg) |
Purutablettien määrä tablettikoon mukaan |
mg/kg vaihteluväli |
|
| 57 mg |
227 mg |
||
| 3,0 – 5,5 |
0,5 |
5,2 – 9,5 |
|
| 5,6 – 7,5 |
0,75 |
5,7 – 7,6 |
|
| 7,6 – 10 |
1 |
0,25 |
5,7 – 7,5 |
| 10,1 – 13 |
1,25 |
5,5 – 7,1 |
|
| 13,1 – 16 |
1,5 |
5,3 – 6,5 |
|
| 16,1 – 18,5 |
1,75 |
5,4 – 6,2 |
|
| 18,6 – 22,5 |
0,5 |
5,0 – 6,1 |
|
| 22,6 – 34 |
0,75 |
5,0 – 7,5 |
|
| 34,1 – 45 |
1 |
5,0 – 6,7 |
|
| 45,1 – 56 |
1,25 |
5,1 – 6,3 |
|
| 56,1 – 68 |
1,5 |
5,0 – 6,1 |
|
| 68,1 – 79 |
1,75 |
5,0 – 5,8 |
|
| 79,1 – 90 |
2 |
5,0 – 5,7 |
|
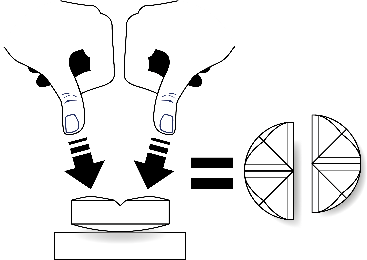
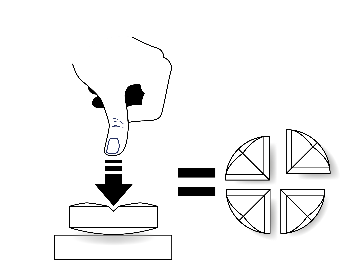
Tarkkaa annostelua varten tabletit voidaan jakaa kahteen tai neljään yhtä suureen osaan.
| |
|
|
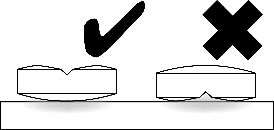
| Aseta tabletti tasaiselle alustalle, jakouurteellinen puoli ylöspäin ja kupera (pyöristetty) puoli alaspäin. |
Jakaminen kahteen yhtä suureen osaan: paina peukaloilla tabletin molemmilta puolilta. |
Jakaminen neljään yhtä suureen osaan: paina peukalolla tabletin keskeltä. |
ANNOSTUSOHJEET
Tabletit voidaan antaa ruuan kanssa tai ilman ruokaa. Annossuositusta ei saa ylittää.
Hoidon kesto määräytyy havaitun vasteen mukaan. Koska kenttätutkimusten kesto oli pisimmillään 90 vuorokautta, pitkäaikaisen hoidon tarpeellisuutta on harkittava tarkoin, ja eläinlääkärin on seurattava eläintä säännöllisesti.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Älä säilytä yli 30 °C.
Säilytä alkuperäispakkauksessa.
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu ulkopakkauksessa merkinnän Exp. jälkeen.
Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
Jaetut tabletit voidaan säilyttää enintään kuukauden ajan alkuperäispakkauksessa.
ERITYISVAROITUKSET
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Valmisteen käyttöön voi liittyä suurempi riski, jos sitä käytetään erittäin nuorille eläimille tai eläimille, joilla epäillään tai on todettu munuaisen, sydämen tai maksan vajaatoiminta. Jos käyttö tällaisissa tapauksissa on välttämätöntä, eläimet vaativat huolellista eläinlääkärin seurantaa. Tämän vuoksi suositellaan soveltuvien laboratoriokokeiden ottamista ennen hoidon aloittamista, jotta voidaan havaita subkliiniset (oireettomat) munuais- tai maksahäiriöt, jotka voivat altistaa haittavaikutuksille.
Vältä valmisteen käyttämistä kuivuneille, pienestä veritilavuudesta tai alhaisesta verenpaineesta kärsivillä eläimillä, koska tähän liittyy suurentunut munuaistoksisuuden riski. Valmisteen samanaikaista käyttöä mahdollisesti munuaistoksisten lääkkeiden kanssa on vältettävä.
Tätä valmistetta saa käyttää vain tarkassa eläinlääkärin seurannassa, jos eläimellä on ruuansulatuselimistön verenvuodon vaara tai jos tiedetään eläin sietää tulehduskipulääkkeitä huonosti. Hoito on lopetettava, jos seuraavia oireita havaitaan: toistuvaa ripulia, oksentelua, ulosteen piiloverisyyttä, äkillistä painon laskua, ruokahaluttomuutta, uupumista, munuais- tai maksa-arvojen poikkeamia.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Pese kädet valmisteen käytön jälkeen.
Jos vahingossa nielet valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Jaetut tabletit tulee laittaa takaisin alkuperäispakkaukseen.
Tiineys ja laktaatio:
Ei saa käyttää tiineille eikä imettäville nartuille.
Kaniineille tehdyt laboratoriokokeet ovat osoittaneet, että annoksilla, jotka ovat suunnilleen samat kuin koiralle suositeltu hoitoannos, ilmenee emossa ja sikiössä toksisia vaikutuksia.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Aiempi hoito muilla tulehdusta lievittävillä valmisteilla voi lisätä tai pahentaa haittavaikutuksia, joten ennen eläinlääkkeen aloittamista on pidettävä vähintään 24 tunnin tauko tällaisten lääkkeiden käyttämisen jälkeen. Hoidottoman ajanjakson pituuden arvioimisessa on kuitenkin otettava huomioon aiemmin käytettyjen valmisteiden farmakokineettiset ominaisuudet.
Eläinlääkettä ei saa antaa yhdessä muiden tulehduskipulääkkeiden eikä glukokortikosteroidien kanssa. Kortikosteroidit voivat pahentaa ruuansulatuskanavan haavaumia eläimissä, joille on annettu tulehduskipulääkkeitä.
Samanaikainen hoito lääkkeillä, jotka vaikuttavat munuaisten virtsaneritykseen, esim. diureeteilla tai angiotensiinikonvertaasin (ACE) estäjillä, edellyttää kliinistä seurantaa. Valmisteen samanaikaista käyttöä mahdollisesti munuaistoksisten lääkkeiden kanssa on vältettävä, koska tämä voi lisätä munuaistoksisuuden vaaraa. Koska anesteetit voivat vaikuttaa munuaisperfuusioon, parenteraalista nestehoitoa on harkittava leikkauksen aikana vähentämään mahdollisia munuaishaittoja, kun tulehduskipulääkkeitä (NSAID) käytetään perioperatiivisesti.
Samanaikainen, muiden voimakkaasti proteiineihin sitoutuvien lääkkeiden käyttö voi syrjäyttää firokoksibin ja johtaa näin toksisiin vaikutuksiin.
Yliannostus:
Koirilla, jotka hoidon alussa olivat kymmenen viikon ikäisiä, havaittiin seuraavat toksisuuden oireet, kun annos oli vähintään 25 mg/kg/vrk (viisinkertainen suositusannos) kolmen kuukauden ajan: painon lasku, huono ruokahalu, maksamuutokset (lipidin kertyminen), aivomuutokset (vakuolisaatiota), muutokset pohjukaissuolessa (haavaumia) ja kuolema. Kun annos oli vähintään 15 mg/kg/vrk (kolminkertainen suositusannos) kuuden kuukauden ajan, todettiin samanlaiset kliiniset löydökset, tosin lievempinä ja harvemmin eikä pohjukaissuolihaavaumia havaittu.
Näissä kohde-eläintä koskevissa turvallisuustutkimuksissa kliiniset toksisuuden oireet korjautuivat joillakin koirilla, kun hoito lopetettiin.
Koirissa, jotka hoidon alussa olivat seitsemän kuukauden ikäisiä, havaittiin ruoansulatuskanavan haittavaikutuksia, eli oksentelua, kun annos oli vähintään 25 mg/kg/vrk (viisinkertainen suositusannos) kuuden kuukauden ajan.
Yliannostustutkimuksia ei ole tehty 14 kuukautta vanhemmille koirille.
Jos yliannostuksen kliinisiä oireita havaitaan, hoito on keskeytettävä.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi tai apteekista.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
20.10.2023
MUUT TIEDOT
Vaikutustapa:
Firokoksibi on steroideihin kuulumaton, tulehdusta hillitsevä lääke (tulehduskipulääke, NSAID), joka estää selektiivisesti syklo-oksygenaasi-2 (COX-2) ‑ välitteisen prostaglandiinisynteesin. Tämän isoentsyymin on arveltu tuottavan pääasiassa juuri kipua, tulehdusreaktiota ja kuumetta aiheuttavia prostanoidivälittäjäaineita. Koiran kokoverestä tehdyissä in vitro ‑tutkimuksissa on osoitettu, että firokoksibi on noin 380 kertaa selektiivisempi COX-2:lle kuin COX-1:lle.
Purutableteissa on jakouurre tarkan annostelun helpottamiseksi. Lisäksi tableteissa on karamellin ja savun makua, jotta tablettien antaminen koirille olisi helpompaa.
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija:
Boehringer Ingelheim Vetmedica GmbH
55216 Ingelheim/Rhein
Saksa
Erän vapauttamisesta vastaava valmistaja:
Boehringer Ingelheim Animal Health France SCS,
4 Chemin du Calquet, 31000 Toulouse,
Ranska
Paikalliset edustajat ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
Suomi/Finland Vetcare Oy PL/PB 99 24101 Salo
Puh/Tel: + 358 201443360