Pakkausseloste
ELIGARD pulver och vätska till injektionsvätska, lösning 45 mg
Tilläggsinformation
ELIGARD 45 mg
pulver och vätska till injektionsvätska, lösning
leuprorelinacetat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Eligard är och vad det används för
- Vad du behöver veta innan du använder Eligard
- Hur du använder Eligard
- Eventuella biverkningar
- Hur Eligard ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Det aktiva innehållsämnet i Eligard tillhör läkemedelsgruppen gonadotropinfrisättande hormoner. Dessa läkemedel används för att hämma produktionen av vissa könshormoner (testosteron).
Eligard används för behandling av metastatisk hormonberoende prostatacancer hos vuxna män samt för behandling av icke-metastatisk hormonberoende prostatacancer av högrisktyp i kombination med strålbehandling.
Vad du behöver veta innan produkten används
Använd inte Eligard:
- Om du är kvinna eller barn
- Om du är överkänslig (allergisk) mot det aktiva innehållsämnet leuprorelinacetat, mot ämnen som har en verkan som är jämförbar med det naturligt förekommande hormonet gonadotropin eller något av de övriga innehållsämnena i Eligard (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- Om dina testiklar har opererats bort, eftersom Eligard inte har någon effekt i dessa fall.
- Om du har Eligard som enda behandling och du får tryck på ryggmärgen eller en tumör i ryggmärgen. I dessa fall måste Eligard kompletteras med andra läkemedel vid behandling av prostatacancer.
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Eligard
- Om du har något av följande: Hjärtkärlsjukdom inklusive hjärtrytmrubbningar (arytmi) eller om du tar medicin mot detta. Risken för att drabbas av hjärtrytmrubbningar kan vara förhöjd när man använder Eligard.
- Om du har urineringsbesvär. Du bör kontrolleras oftare under de första veckorna av behandlingen.
- Om tryck på ryggmärgen uppstår eller om du får svårt att urinera. När andra läkemedel som verkar på snarlikt sätt som Eligard har tagits samtidigt, finns det rapporter om svåra fall av tryck på ryggmärgen och avsmalning av urinledare mellan njure och urinblåsa, vilket kan bidra till förlamningssymtom. Uppstår dessa komplikationer, måste standardbehandling sättas in.
- Om du inom två veckor efter påbörjad behandling med Eligard får plötslig huvudvärk, kräkningar, förändrat sinnestillstånd och ibland hjärtkollaps, kontakta läkare eller sjukvårdspersonal. Det är sällsynta fall av vad som kallas hypofys-slaganfall, som har setts hos andra läkemedel med liknande verkan som Eligard.
- Om du har diabetes mellitus (förhöjt blodsocker). Du bör kontrolleras regelbundet under behandlingen.
- Behandling med Eligard kan öka risken för benbrott p g a benskörhet.
- Depression har rapporterats hos patienter som tar Eligard. Informera din läkare om du blir nedstämd/deprimerad under tiden du tar Eligard.
- Hjärt-kärlsjukdomar har rapporterats hos patienter som tar läkemedel som liknar Eligard. Det är okänt om det är relaterat till dessa läkemedel. Informera din läkare om du utvecklar symtom eller tecken på hjärt-kärlsjukdom under tiden du tar Eligard.
- Det har rapporterats kramper hos patienter efter administrering av Eligard. Om du tar Eligard och utvecklar kramper, informera din läkare.
- Om du får svår eller återkommande huvudvärk, problem med synen och ringningar eller susningar i öronen, ska du omedelbart kontakta läkare.
- har fettlever (ett tillstånd med överdriven fettinlagring i levern)
Allvarliga hudutslag inklusive Stevens-Johnsons syndrom, Toxic Epidermal Necrolysis (SJS/TEN) har rapporterats i samband med leuprorelin. Sluta använda leuprorelin och sök omedelbart läkare om du märker något av symtomen relaterade till dessa allvarliga hudreaktioner som beskrivs i avsnitt Eventuella biverkningar.
Komplikationer då behandlingen påbörjas
Under de första behandlingsveckorna ökar vanligtvis nivåerna av testosteron i blodet tillfälligt. Detta kan leda till tillfälligt förvärrade sjukdomsrelaterade symtom och även uppkomsten av nya symtom som inte upplevts tidigare. Symtom som speciellt kan uppstå är skelettsmärtor, urineringsbesvär, tryck på benmärgen och blod i urinen. Dessa symtom försvinner vanligtvis vid fortsatt behandling. Försvinner inte symtomen ska du kontakta din läkare.
Om Eligard inte har effekt
Vissa patienter har tumörer som inte är mottagliga för sänkta testosteronnivåer. Tala om för din läkare om du har känslan av att Eligard inte har tillräcklig effekt.
Andra läkemedel och Eligard
Eligard kan påverka vissa andra läkemedel som används för att behandla hjärtrytmrubbningar (t.ex. kinidin, prokainamid, amiodaron och sotalol) eller kan öka risken för hjärtrytmrubbningar när det används tillsammans med andra läkemedel (t.ex. metadon (används mot smärta och vid behandling av drogberoende), moxifloxacin (ett antibiotikum), antipsykotika (används mot allvarlig psykisk sjukdom)).
Tala om för läkare eller apotekspersonal om du använder eller nyligen har använt andra läkemedel, även receptfria sådana.
Graviditet och amning
Eligard är inte avsedd för kvinnor.
Körförmåga och användning av maskiner
Trötthet, yrsel och synstörningar är möjliga biverkningar vid behandling med Eligard eller kan vara en följd av sjukdomen. Om du besväras av dessa biverkningar, var försiktig då du kör eller använder maskiner.
Hur produkten används
Dosering
Använd alltid Eligard enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Om inte din läkare har förskrivit annat ges Eligard 45 mg en gång var sjätte månad.
Den injicerade lösningen bildar en depå med aktiv substans under huden från vilken en kontinuerlig frisättning av den aktiva substansen leuprorelinacetat sker under en period av sex månader.
Ytterligare tester
Eligardbehandlingen ska kontrolleras av din läkare genom att mäta specifika kliniska värden och genom att mäta nivåerna i blodet av s.k. prostataspecifikt antigen (PSA).
Administreringssätt
Eligard bör endast ges av din läkare eller en sjuksköterska som även färdigställer läkemedlet.
Efter beredning ska Eligard ges som en subkutan injektion (injektion strax under huden). Intraarteriell- (i en artär) eller intravenös (i en ven) injektion ska noga undvikas. Som vid andra subkutana injektioner ska injektionsstället varieras med tiden.
Om du använt för stor mängd Eligard
Eftersom injektionen vanligtvis administreras av din läkare eller lämpligt utbildad vårdpersonal, förväntas inte någon överdosering.
Om en större mängd än avsett ändå administreras, övervakar läkaren dig speciellt och ger dig ytterligare behandling efter behov.
Om du har glömt att använda Eligard
Fråga din läkare om du tror att din injektion har blivit bortglömd.
Om du slutar att använda Eligard
I regel krävs långvarig behandling med Eligard vid prostatacancer. Därför ska inte behandlingen avslutas även om det sker en förbättring av symtomen eller de försvinner helt.
Avslutas behandlingen med Eligard för tidigt kan en försämring av sjukdomsrelaterade symtom uppstå.
Du ska inte avbryta behandlingen för tidigt utan att dessförinnan ha kontaktat din läkare.
Om du har ytterligare frågor om detta läkemedel kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan Eligard orsaka biverkningar, men alla användare behöver inte få dem.
Biverkningar som har upplevts vid behandling med Eligard är främst orsakade av de specifika effekter den aktiva substansen leuprorelinacetat har, som höjning och sänkning av vissa hormoner. De vanligaste beskrivna biverkningarna är värmevallningar (ca 58 % av patienterna), illamående, sjukdomskänsla och trötthet samt övergående lokal irritation vid injektionsstället.
Biverkningar vid insättning
Under de första behandlingsveckorna med Eligard kan sjukdomsrelaterade symtom öka, därför att det vanligtvis är en övergående ökning av nivåerna av testosteron i blodet i början av behandlingen. Din läkare kan därför vilja ge dig en lämplig anti-androgen (en substans som hämmar testosteronets effekt) vid behandlingens början för att minska eventuella biverkningar (se även avsnitt Vad du behöver veta innan produkten används. Vad du behöver veta innan du använder Eligard, Komplikationer då behandlingen påbörjas).
Lokala biverkningar
De lokala biverkningar som beskrivits efter injektion med Eligard är typiskt de som ofta ses i samband med liknande subkutant injicerade läkemedel (läkemedel som injiceras strax under huden). Lätt brännande känsla strax efter injicering är mycket vanligt. Stickningar och smärta på injektionsstället efter injicering är vanliga, likaså blåmärken och rodnad av huden. Förhårdnad vävnad och sår är ovanliga.
De lokala biverkningarna efter en subkutan injektion är lindriga och beskrivs som övergående. Biverkningarna uppträder inte mellan injektionerna.
Mycket vanliga biverkningar (kan förekomma hos fler än 1 av 10 användare)
- Värmevallningar
- Spontana blödningar i hud och slemhinnor, rodnad
- Trötthet, reaktioner på injektionsstället (se även Lokala biverkningar ovan)
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 användare)
- Inflammation i näsa-hals (förkylningssymtom)
- Illamående, sjukdomskänsla, diarré, mag- och tarminflammation (gastroenterit/kolit)
- Klåda, nattliga svettningar
- Ledvärk
- Oregelbundna urinträngningar (även på natten), svårt att påbörja urinering, smärta vid urinering, minskad urinmängd
- Ömma bröst, svullna bröst, förminskade testiklar (förtvining), testikelsmärta, infertilitet, erektionsproblem, minskad penisstorlek
- Stelhet (perioder med överdrivna skakningar och hög feber), svaghet
- Förlängd blödningstid, förändrade blodvärden, lågt antal röda blodkroppar
Mindre vanliga biverkningar (kan förekomma hos upp till 1 av 100 användare)
- Urinvägsinfektioner, lokala hudinfektioner
- Försämring av diabetes
- Onormala drömmar, depression, minskad sexlust
- Yrsel, huvudvärk, förändrad känslighet för beröring, sömnlöshet, påverkan på smak- och luktsinnet
- Högt blodtryck, lågt blodtryck
- Andnöd
- Förstoppning, muntorrhet, matsmältningsbesvär, kräkningar
- Klibbighet, ökad svettning
- Ryggsmärta, muskelkramper
- Blod i urinen
- Blåskramp, får gå oftare än vanligt till toaletten, oförmåga att urinera
- Förstoring av manlig bröstvävnad, impotens
- Sömnighet, smärta, feber
- Viktökning
- Balansrubbning, svindel
- Muskelförtvining/förlust av muskelvävnad efter långvarig användning
Sällsynta biverkningar (kan förekomma hos upp till 1 av 1 000 användare)
- Onormala ofrivilliga rörelser
- Plötsligt förlorat medvetande, svimning
- Gaser i magen, rapning
- Håravfall, hudutslag
- Bröstsmärtor
- Sår vid injektionsstället
Mycket sällsynta biverkningar (kan förekomma hos upp till 1 av 10 000 användare)
- Vävnadsdöd vid injektionsstället
Har rapporterats (förekommer hos okänt antal användare)
- Förändringar (QT-förlängning) i EKG (elektrokardiogram)
- Inflammation i lungorna, lungsjukdom
- Idiopatisk intrakraniell hypertension (ökat tryck inuti skallen, runt hjärnan som kännetecknas av huvudvärk, dubbelseende och andra problem med synen samt ringningar eller susningar i ena eller båda öronen)
Rödaktiga icke-upphöjda, målliknande eller cirkulära fläckar på bålen, ofta med centrala blåsor, flagnande hud, sår i mun, svalg, näsa, könsorgan och ögon. Dessa allvarliga hudutslag kan föregås av feber och influensaliknande symtom (Stevens-Johnsons syndrom/Toxic Epidermal Necrolysis)
Hudrodnad och kliande utslag (giftigt hudutslag)
En hudreaktion som orsakar röda fläckar eller prickar på huden, som kan se ut som ett mål eller "bulls-eye" med en mörkröd mitt omgiven av blekare röda ringar (Erythema Multiforme)
Övriga biverkningar
Övriga biverkningar som har beskrivits i litteraturen i samband med leuprorelin, den aktiva substansen i Eligard, är ödem (ansamling av vätska, som leder till svullna händer och fötter), lungemboli (ger symtom som andnöd, svårt att andas och bröstsmärta), hjärtklappning, svaghet i muskler, frossa, hudutslag, försämrat minne och försämrad syn. Ökade tecken på minskad benvävnad (benskörhet) kan förväntas efter långvarig behandling med Eligard. På grund av benskörhet ökar risken för frakturer.
Allvarliga allergiska reaktioner, som orsakar andningssvårigheter eller yrsel, har rapporterats i sällsynta fall efter administration med läkemedel i samma läkemedelsklass som Eligard.
Kramper har rapporterats efter administration av läkemedel i samma läkemedelsklass som Eligard.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55 00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaring
Förvaras i kylskåp (2 °C – 8 °C).
Förvaras i originalförpackningen. Fuktkänsligt.
Produkten ska uppnå rumstemperatur före injektion. Ta ut ur kylen cirka 30 minuter före användning. När produkten har tagits ur kylen kan den förvaras i originalförpackningen vid rumstemperatur i upp till 4 veckor (under 25 °C).
När någon av brickförpackningarna har öppnats måste produkten beredas omedelbart. Efter beredning ska produkten användas omedelbart. Endast för engångsbruk.
Instruktion för kassering av oanvända eller utgångna förpackningar av Eligard
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är leuprorelinacetat.
En förfylld spruta (spruta B) innehåller 45 mg leuprorelinacetat.
- Övriga innehållsämnen är DL-laktid-glukolid-sampolymer (85:15) och N-metylpyrrolidon i en förfylld spruta med vätska till injektionsvätska, lösning (spruta A).
Läkemedlets utseende och förpackningsstorlekar
Eligard är pulver och vätska till injektionsvätska, lösning.
Eligard 45 mg tillhandahålls i följande förpackningar:
- En formpressad brickförpackning och en 18 gauge steril nål i en pappkartong. Brickan innehåller en torkmedelspåse och ett förkopplat sprutsystem bestående av:
- spruta A fylld med lösningsmedel
- spruta B fylld med pulver
- konnektor med låsknapp för spruta A och B.
- Multiförpackning innehållande satser om 2 förkopplade sprutsystem.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Matteo Civitali 1
20148 Milano
Italien
Tillverkare
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Matteo Civitali 1
20148 Milano
Italien
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Recordati AB, Sverige
Tel: +46 8 545 80 230
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
Österrike: Eligard Depot 45 mg
Belgien: Depo-Eligard 45 mg
Bulgarien: Eligard 45 mg
Cypern: Eligard
Tjeckien: Eligard
Danmark: Eligard
Estland: Eligard
Finland: Eligard
Frankrike: Eligard 45 mg
Tyskland: Eligard 45 mg
Ungern: Eligard 45 mg
Island: Eligard
Irland: Eligard 45 mg
Italien: Eligard
Lettland: Eligard 45 mg
Litauen: Eligard 45 mg
Luxemburg: Depo-Eligard 45 mg
Nederländerna: Eligard 45 mg
Norge: Eligard
Polen: Eligard 45 mg
Portugal: Eligard 45 mg
Rumänien: Eligard 45 mg
Slovakien: Eligard 45 mg
Slovenien: Eligard 45 mg
Spanien: Eligard Semestral 45 mg
Sverige: Eligard
Denna bipacksedel ändrades senast 11.10.2024
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Låt produkten få rumstemperatur genom att ta den ut ur kylen cirka 30 minuter före användning. Förbered först patienten för injektionen. Förbered därefter produkten enligt instruktionerna nedan. Om produkten inte bereds på rätt sätt, bör den inte administreras då utebliven klinisk effekt kan uppstå vid felaktig beredning av produkten.
Steg 1
Öppna brickan på en ren yta genom att riva av folien från hörnen för att ta ut innehållet. Kassera torkmedelspåsen. Ta bort det förkopplade sprutsystemet (figur 1.1) från brickan. Öppna förpackningen med säkerhetskanylen (figur 1.2) genom att dra av pappersfliken. Notera: spruta A och spruta B ska ännu inte placeras mot varandra.

Steg 2
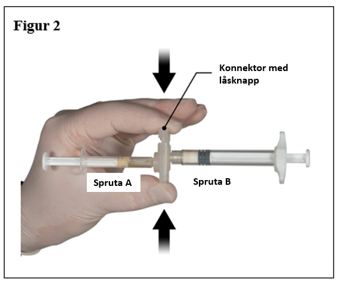
Ta tag i låsknappen på konnektorn med ditt finger och tumme och tryck (figur 2) tills du hör ett klickljud. De två sprutorna kommer vara mot varandra. Ingen speciell montering av sprutststemet krävs för att aktivera konnektorn. Böj inte sprutsystemet (observera att detta kan orsaka läckage eftersom du delvis kan skruva isär sprutorna).
Steg 3
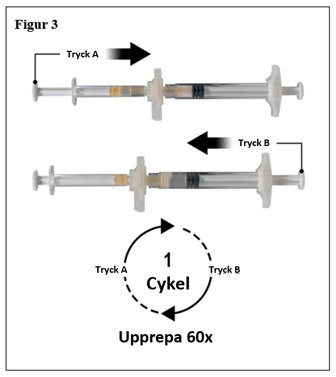
Håll, sprutorna i en horisontell position, överför vätskeinnehållet från spruta A till leuprorelinacetat pulvret i spruta B. Blanda produkten noga i 60 cykler genom att försiktigt trycka innehållet i båda sprutorna fram och tillbaka mellan båda sprutorna (en cykel är ett tryck på kolven för spruta A och ett tryck på kolven för spruta B) i ett horisontellt läge för att erhålla en homogen, viskös lösning (figur 3). Böj inte sprutsystemet (observera att detta kan orsaka läckage eftersom du delvis kan skruva isär sprutorna).
Den viskösa lösningen kommer att ha en färg från färglös till vit till svagt gul (vilket kan innefatta nyanser av vitt till svagt gult) när den har blandats ordentligt.
Viktigt: Efter blandning, fortsätt omedelbart med nästa steg eftersom produkten blir mer trögflytande med tiden. Kylförvara inte den blandade produkten.
Observera: Produkten måste blandas enligt beskrivningen; skakning KOMMER INTE att ge en fullgod blandning av produkten.
Steg 4
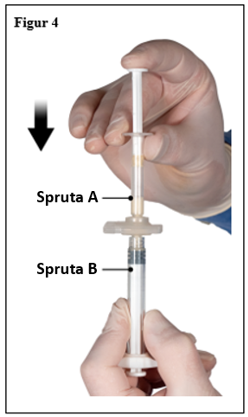
Efter att ha blandat, håll sprutorna lodrätt med spruta B underst. Sprutorna ska vara säkert ihopkopplade. Dra ner all blandad produkt i spruta B (kort, bred spruta) genom att trycka ner kolven i spruta A och lätt dra tillbaks kolven i spruta B (figur 4).
Steg 5
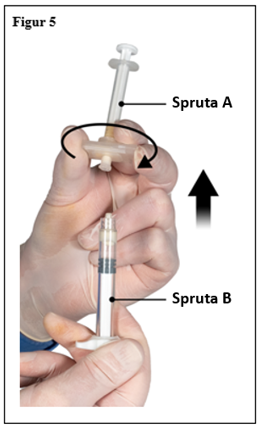
Medan kolven på spruta A hålls fortsatt nedtryckt, håll konnektorn och skruva loss den från spruta B. Spruta A kommer fortsätta vara ansluten till konnektorn (figur 5). Se till att ingen produkt läcker ut eftersom kanylen i sådana fall inte kommer att fästa säkert när den sätts på.
Observera: en stor eller några små luftbubblor kan finnas kvar i beredningen - detta är acceptabelt. Tryck inte ut luftbubblorna från spruta B i detta skede eftersom produkt kan förloras!
Steg 6
- Håll spruta B upprätt och håll tillbaka den vita kolven så att produkten inte rinner ut.
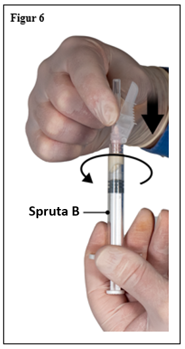
- Fäst säkerhetskanylen på spruta B genom att hålla i sprutan och vrida kanylen försiktigt medurs cirka trekvarts varv tills kanylen sitter fast (figur 6).
Skruva inte för hårt eftersom detta kan orsaka sprickor i kanylfattningen och därmed resultera i att produkten läcker ut under injektion. Säkerhetsskyddet kan skadas om nålen skruvas på med för mycket kraft.
Om kanylfattningen skulle spricka, verka skadad eller läcka ska produkten inte användas. Den skadade kanylen ska inte bytas ut och produkten ska inte injiceras. Hela produkten ska kasseras på ett säkert sätt.
Om det uppstår skador på kanylfattningen ska en ny produkt användas.
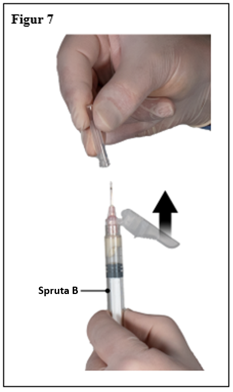
Steg 7
Dra säkerhetshöljet ifrån kanylen och dra av kanylens skydd omedelbart före administrering (figur 7).
Viktigt: Aktivera inte säkerhetskanylens mekanism före administrering. Om kanylfattningen verkar vara skadad, eller läcka, ska produkten INTE användas. Den skadade kanylen ska INTE ersättas och produkten ska INTE injiceras. Vid skada på kanylfattningen, använd ett annat ELIGARD kit.
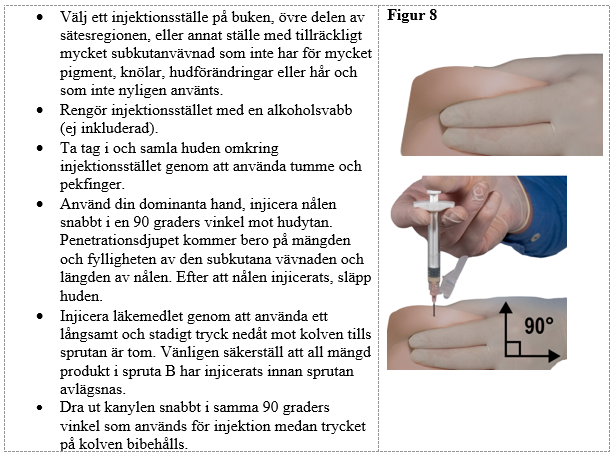
Steg 8
Tryck ut alla stora luftbubblor från spruta B före administrering. Administrera produkten subkutant och håll samtidigt säkerhetshöljet ifrån kanylen.
Administreringssätt:
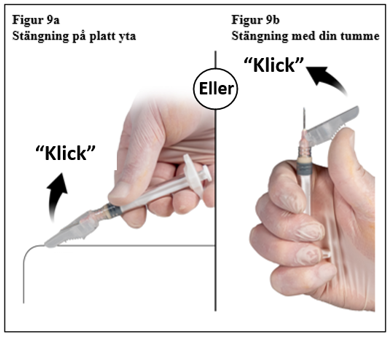
Steg 9
Efter injektion lås kanylens hölje genom att använda någon av metoderna för aktivering nedan.
1. Stängning mot en plan yta
Tryck säkerhetshöljet med spaken nedåt mot en plan yta (figur 9a) för att täcka kanylen och låsa höljet.
Säkerställ det låsta läget genom ett hörbart och distinkt ”klick”. Låst position kommer att fullständigt täcka nålspetsen.
2. Stängning med tummen
Placera tummen på säkerhetshöljet (figur 9b), täck nålspetsen och lås höljet.
Säkerställ det låsta läget genom ett hörbart och distinkt ”klick”. Låst läge kommer att fullständigt täcka nålspetsen.
Då säkerhetshöljet är låst, kassera genast kanylen och sprutan i en godkänd avfallsbehållare.