Pakkausseloste
ADVATE injektiokuiva-aine ja liuotin, liuosta varten 250 IU, 1000 IU, 1500 IU
ADVATE 250 IU/2 ml ‑injektiokuiva‑aine ja liuotin, liuosta varten
ADVATE 500 IU/2 ml ‑injektiokuiva‑aine ja liuotin, liuosta varten
ADVATE 1 000 IU/2 ml ‑injektiokuiva‑aine ja liuotin, liuosta varten
ADVATE 1 500 IU/2 ml ‑injektiokuiva‑aine ja liuotin, liuosta varten
oktokogi alfa (ihmisen yhdistelmä‑DNA‑tekniikalla valmistettu hyytymistekijä VIII)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä ADVATE on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät ADVATE‑valmistetta
3. Miten ADVATE‑valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. ADVATE‑valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
ADVATE‑valmisteen vaikuttava aine on oktokogi alfa, ihmisen hyytymistekijä VIII, joka valmistetaan yhdistelmä‑DNA‑tekniikalla. Tekijä VIII on välttämätön veren hyytymiseen ja verenvuodon pysäyttämiseen. Hemofilia A ‑potilailla (synnynnäinen tekijä VIII:n puutos) tekijä VIII puuttuu tai se ei toimi oikein.
ADVATE‑valmistetta käytetään hoitamaan ja estämään verenvuotoa kaikissa ikäryhmissä, kun potilaalla on hemofilia A (perinnöllinen verenvuotohäiriö, joka aiheutuu tekijä VIII:n puutoksesta).
ADVATE valmistetaan siten, että missään vaiheessa valmistusprosessia ei ole käytetty lainkaan ihmisestä tai eläimistä peräisin olevaa proteiinia
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä ADVATE‑valmistetta
- jos olet allerginen oktokogi alfalle tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos olet allerginen hiiren tai hamsterin proteiinille.
Epävarmoissa tapauksissa on kysyttävä lääkärin neuvoa.
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen ADVATE-valmisteen käyttämistä. Kerro lääkärille, jos sinua on aikaisemmin hoidettu tekijä VIII ‑valmisteilla, erityisesti jos sinulle on kehittynyt inhibiittoreita, koska tällöin on suurempi riski, että niitä kehittyy uudelleen. Inhibiittorit ovat tekijä VIII:n vasta‑aineita, jotka heikentävät ADVATE‑valmisteen tehoa estää tai hallita verenvuotoja. Vasta‑aineiden kehittyminen on tunnettu komplikaatio hemofilia A ‑potilaiden hoidossa. Kerro lääkärille heti, jos verenvuoto ei ole hallittavissa ADVATE‑valmisteella.
ADVATE‑valmisteen käyttöön sisältyy pieni anafylaktisen reaktion vaara (vaikea, äkkinäinen allerginen reaktio). Tällaisen reaktion ensimmäisiä oireita ovat mm. ihottuma, nokkosihottuma, näppylät, kutina, huulien ja kielen turvotus, hengitysvaikeudet, vinkuva hengitys, hengenahdistus, yleinen pahanolon tunne ja huimaus. Oireet voivat olla anafylaktisen sokin ensimmäisiä merkkejä, ja niitä voivat lisäksi olla paha huimaus, tajuttomuus ja erittäin pahat hengitysvaikeudet.
Jos oireita ilmaantuu, lopeta heti injektio ja ota yhteys lääkäriin. Vaikeat oireet, kuten hengenahdistus ja pyörtymisen tunne, vaativat nopeaa ensiapua.
Jos sinulla on katetri (keskuslaskimokatetri), jonka kautta tämä lääke voidaan antaa verenkiertoon, sinulla voi olla riski saada katetriin liittyviä infektioita tai veritulppia.
Jos sinulla on sydänsairaus, kerro siitä lääkärillesi, koska sinulla on suurentunut riski saada veren hyytymiseen (koagulaatioon) liittyviä jälkiseurauksia.
Potilaat, joille kehittyy tekijä VIII -inhibiittoreita
Inhibiittorien (vasta-aineiden) muodostuminen on tunnettu komplikaatio, joka voi kehittyä minkä tahansa tekijä VIII ‑lääkkeen käytön aikana. Etenkin suurina pitoisuuksina esiintyessään nämä inhibiittorit estävät hoitoa vaikuttamasta oikein, ja sinua tai lastasi seurataan huolellisesti inhibiittorien kehittymisen varalta. Kerro lääkärille heti, jos verenvuotosi tai lapsesi verenvuoto ei ole hallittavissa ADVATE-valmisteella.
Lapset ja nuoret
Luetellut varoitukset ja varotoimet koskevat sekä aikuisia että lapsia (iältään 0–18-vuotiaita).
Muut lääkevalmisteet ja ADVATE
Kerro lääkärille, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
ADVATE‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
ADVATE sisältää natriumia
Tämä lääkevalmiste sisältää 10 mg natriumia (ruokasuolan toinen ainesosa) per injektiopullo. Tämä vastaa 0,5 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
ADVATE sisältää polysorbaatti 80:aa
Tämä lääkevalmiste sisältää 0,5 mg polysorbaatti 80:aa per injektiopullo, joka vastaa 0,25 mg:aa/ml. Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla/lapsellasi on allergioita, kerro asiasta lääkärille.
ADVATE‑valmisteen antaminen väärin
Valmisteen antamista väärin (injektio valtimoon tai laskimon ulkopuolelle) on vältettävä, koska se voi aiheuttaa lieviä, lyhytkestoisia reaktioita antopaikassa, kuten mustelmia ja punoitusta.
Miten valmistetta käytetään
Lääkäri, jolla on kokemusta hemofilia A ‑sairauden hoidosta, aloittaa hoidon ADVATE‑valmisteella.
Lääkäri laskee ADVATE-valmisteen annoksen (kansainvälisinä yksikköinä IU) potilaan tilan, painon ja sen mukaan käytetäänkö valmistetta verenvuodon ennaltaehkäisyyn vai hoitoon. Antoväli määrätään ADVATE-valmisteen yksilöllisen tehon mukaan. Yleensä korvaushoito ADVATE-valmisteella kestää loppuelämän.
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Verenvuodon ennaltaehkäisy
Tavallinen annos oktokogi alfaa on 20 – 40 IU painokiloa kohden, ja se annetaan 2–3 vuorokauden välein. Joissain tapauksissa tiheämmät antovälit tai suuremmat annokset voivat olla tarpeen erityisesti nuorille potilaille.
Verenvuodon hoito
Oktokogi alfan annos lasketaan potilaan painon ja halutun tekijä VIII lisäyksen mukaan. Tarvittava tekijä VIII:n määrä riippuu siitä, kuinka vaikea verenvuoto on ja sen sijainnista.
Annos (IU) = paino (kg) x haluttu tekijä VIII lisäys (%) x 0,5
Jos ADVATE‑valmisteen teho tuntuu riittämättömältä, asiasta on ilmoitettava lääkärille.
Lääkäri tekee tarvittavia laboratoriokokeita varmistaakseen, että potilaan tekijä VIII taso on riittävä. Tämä on erityisen tärkeää silloin, kun potilaalle tehdään suuri leikkaus.
Käyttö lapsille ja nuorille
Verenvuodon hoidossa lasten annos ei poikkea aikuisten annoksesta. Alle 6-vuotiaiden lasten verenvuodon ehkäisyssä on suositeltavaa käyttää annosta 20–50 IU/painokilo 3–4 kertaa viikossa. ADVATE‑valmisteen antaminen lapsille (laskimoon) ei eroa aikuisille antamisesta. Keskuslaskimokatetri voi olla tarpeen, jotta toistuva tekijä VIII ‑valmisteiden anto on mahdollista.
Koska 2 ml:lla laimennetun ADVATE‑valmisteen injektiomäärä pienenee, aikaa reagoida injektionaikaisiin yliherkkyysreaktioihin on aiempaa vähemmän. Siten on noudatettava varovaisuutta annettaessa 2 ml:lla laimennettua ADVATE‑valmistetta injektiona, erityisesti lasten kohdalla.
Kuinka ADVATE annetaan
Lääkäri tai sairaanhoitaja antaa ADVATE‑valmisteen yleensä laskimoon.
Potilas itse tai joku muu henkilö voi myös antaa ADVATE‑valmisteen injektiona, mutta vain asianmukaisen koulutuksen jälkeen. Yksityiskohtaiset ohjeet valmisteen antamiseen löytyvät tämän pakkausselosteen lopusta.
Jos käytät enemmän ADVATE‑valmistetta kuin sinun pitäisi
Käytä aina ADVATE-valmistetta lääkärin määräyksen mukaan. Tarkista lääkäriltäsi, mikäli olet epävarma. Jos otat ADVATE‑valmistetta enemmän kuin sinun pitäisi, kerro siitä lääkärillesi mahdollisimman pian.
Jos unohdat käyttää ADVATE‑valmistetta
Älä pistä kaksinkertaista annosta korvataksesi unohtamasi annoksen. Pistä seuraava annos suunnitellusti ja jatka valmisteen ottamista lääkärin ohjeiden mukaan.
Jos lopetat ADVATE‑valmisteen käytön
Älä lopeta ADVATE‑valmisteen käyttöä ilman lääkärin lupaa.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Jos vaikeita, äkillisiä allergisia (anafylaktisia) reaktioita ilmaantuu, pistäminen on lopetettava heti. Lääkäriin on otettava heti yhteyttä, jos potilas saa seuraavia aikaisia allergisen reaktion oireita:
- ihottuma, nokkosihottuma, näppylät, yleistynyt kutina
- huulten ja kielen turvotus
- hengitysvaikeuksia, vinkuva hengitys, hengenahdistus
- yleinen huono olo
- huimaus ja pyörtyminen
Vaikeat oireet, mukaan lukien hengitysvaikeudet ja (lähes) pyörtyminen, vaativat aina nopeaa ensiapua.
Lapsille, jotka eivät ole aiemmin saaneet tekijä VIII‑lääkkeitä, kehittyy hyvin yleisesti (useammalle kuin yhdelle henkilölle 10:stä) inhibiittoreita eli vasta-aineita (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä). Riski on kuitenkin melko harvinainen (esiintyy alle yhdellä henkilöllä 100:sta), jos potilas on saanut aiemmin tekijä VIII -hoitoa (yli 150 hoitopäivää). Tällöin lääkityksesi tai lapsesi lääkitys voi lakata vaikuttamasta oikein, ja sinulla tai lapsellasi voi esiintyä sitkeää verenvuotoa. Jos näin käy, lääkäriin on otettava heti yhteyttä.
Hyvin yleiset haittavaikutukset (voi esiintyä useammalla kuin yhdellä henkilöllä 10:stä)
Tekijä VIII -inhibiittorit (lapsilla, jotka eivät ole aiemmin saaneet tekijä VIII -lääkkeitä).
Yleiset haittavaikutukset (voi esiintyä enintään yhdellä henkilöllä 10:stä)
Päänsärky ja kuume.
Melko harvinaiset haittavaikutukset (voi esiintyä enintään yhdellä henkilöllä 100:sta)
Tekijä VIII -inhibiittorit (potilailla, jotka ovat aiemmin saaneet tekijä VIII -hoitoa (yli 150 hoitopäivää)), huimaus, flunssa, pyörtyminen, epänormaali syke, punaiset kutiavat paukamat iholla, epämukava tunne rinnassa, mustelma pistokohdassa, pistokohdan reaktio, kutina, lisääntynyt hikoilu, epätavallinen maku suussa, kuumat aallot, migreeni, muistihäiriöt, vilunväreet, ripuli, pahoinvointi, oksentelu, hengenahdistus, kurkun arkuus, mustelma, vapina, vähentynyt hyytymistekijä VIII:n pitoisuus, komplikaatiot tai mustelmat lääketieteellisen toimenpiteen jälkeen, epänormaali olo, imusuonitulehdus, ihon kalpeus, silmätulehdus, ihottumat, jalkaterien ja jalkojen turvotus, hematokriitin lasku, valkosolumäärän kasvu (monosyytit) ja ylävatsan ja rintakehän alaosan kivut.
Leikkauksiin liittyvät
katetriin liittyvät infektiot, vähentynyt punasolujen määrä veressä, raajojen ja nivelten turvotus, dreenauksen jälkeinen pitkittynyt verenvuoto, alentunut tekijä VIII:n pitoisuus ja leikkauksen jälkeinen hematooma.
Keskuslaskimokatetreihin liittyvät
katetriin liittyvät infektiot, systeeminen infektio ja paikallinen verihyytymä katetrin asetuspaikassa.
Haittavaikutukset, joiden esiintyvyys on tuntematon (esiintymistiheyttä ei voida arvioida saatavissa olevan tiedon perusteella)
mahdollisesti henkeä uhkaavat reaktiot (anafylaksi) ja muut allergiset reaktiot (yliherkkyys), yleisoireet (väsymys, energian puute)
Lapsilla esiintyvät muut haittavaikutukset
Lukuun ottamatta aiemmin hoitamattomilla lapsipotilailla esiintynyttä estäjien kehittymistä ja katetriin liittyviä komplikaatioita, ikäkohtaisia eroja haittavaikutuksissa ei havaittu kliinisissä tutkimuksissa.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä etiketissä ja pakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Kestoajan puitteissa valmisteen sisältävää läpipainopakkausta voidaan säilyttää huoneenlämmössä (alle 25 °C) yhtäjaksoisesti enintään 6 kuukautta. Tässä tapauksessa tämä lääke vanhenee tämän 6 kuukauden jakson lopussa tai läpipainopakkaukseen painettuna viimeisenä käyttöpäivänä sen mukaan, kumpi näistä ensin tuleekin. Merkitse pakkaukseen päivämäärä, jolloin valmiste on ollut 6 kuukautta säilytyksessä huoneenlämmössä. Valmistetta ei enää saa säilyttää jääkaapissa, sen jälkeen kun se siirretty huoneenlämpöön.
Säilytä valmisteen sisältävä läpipainopakkaus ulkopakkauksessa valolta suojattuna.
Vain kerta‑antoon. Hävitä käyttämättä jäänyt osuus asianmukaisesti.
Käytä heti sen jälkeen, kun valmiste on täysin liuennut.
Liuotettua valmistetta ei saa säilyttää jääkaapissa.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä ADVATE sisältää
- Vaikuttava aine on oktokogi alfa (yhdistelmä‑DNA‑tekniikalla valmistettu ihmisen hyytymistekijä VIII). Injektiokuiva‑ainepullossa on nimellisesti 250, 500, 1 000 tai 1 500 IU oktokogi alfaa.
- Apuaineet ovat mannitoli (E421), natriumkloridi, histidiini, trehaloosi, kalsiumkloridi (E509), trometamoli, polysorbaatti 80 (E433) ja glutationi (pelkistetty). Ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä, ”ADVATE sisältää natriumia” ja ”ADVATE sisältää polysorbaatti 80:aa”.
- Liuotinpullo sisältää 2 ml injektionesteisiin käytettävää vettä.
Lääkevalmisteen kuvaus ja pakkauskoko (‑koot)
ADVATE on valkoista tai luonnonvalkoista haurasta jauhetta.
Liuottamisen jälkeen liuos on kirkas ja väritön, eikä siinä ole hiukkasia.
Myyntiluvan haltija
Takeda Manufacturing Austria AG
Industriestraße 67
A‑1221 Wien
Itävalta
Valmistaja
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B‑7860 Lessines
Belgia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi
Takeda Oy
Puh/Tel: 0800 774 051
Tämä pakkausseloste on tarkistettu viimeksi 05/2025.
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta https://www.ema.europa.eu.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Valmisteen liuotus ja anto‑ohjeet
ADVATE‑valmistetta ei saa sekoittaa muihin lääkkeisiin tai liuottimiin.
On erittäin suositeltavaa kirjata muistiin valmisteen nimi ja eränumero aina, kun ADVATE-valmistetta annetaan.
Liuottaminen
- Älä käytä pakkauksessa ja etiketissä mainitun viimeisen käyttöpäivämäärän jälkeen.
- Älä käytä, jos läpipainopakkauksen kansi ei ole kunnolla suljettu.
- Älä säilytä liuotettua valmistetta jääkaapissa.
1. Jos valmistetta säilytetään vielä jääkaapissa, ota suljettu läpipainopakkaus (sisältää kuiva-aine- ja liuotinpullot esikoottuna liuottamiseen tarkoitetun järjestelmän kanssa) jääkaapista ja anna sen lämmetä huoneenlämpöiseksi (välille 15–25 °C).
2. Pese kätesi huolellisesti saippualla ja lämpimällä vedellä.
3. Avaa ADVATE-pakkaus poistamalla kansi. Poista BAXJECT III ‑järjestelmä läpipainopakkauksesta.
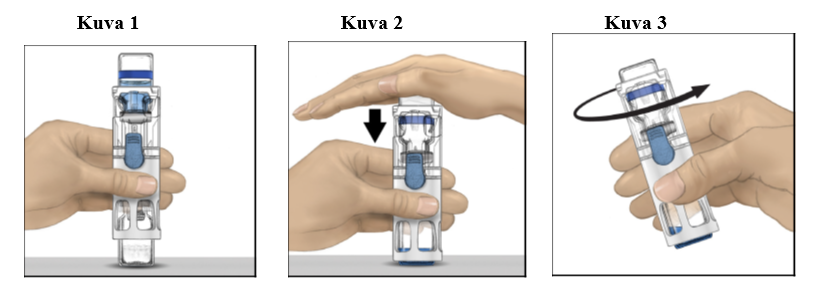
4. Aseta ADVATE tasaiselle pinnalle niin, että liuotinpullo on ylimpänä (kuva 1). Liuotinpullossa on sininen raita. Älä poista sinistä suojusta, ennen kuin myöhemmässä vaiheessa niin neuvotaan.
5. Pitele ADVATE-valmistetta toisella kädellä BAXJECT III ‑järjestelmässä ja paina liuotinpulloa tasaisesti alaspäin toisella kädellä, kunnes järjestelmä on painunut kokonaan kasaan ja liuotin virtaa ADVATE-injektiopulloon (kuva 2). Älä kallista järjestelmää, ennen kuin siirto on valmis.
6. Tarkista, että liuottimen siirto on valmis. Pyöritä varovasti, kunnes kaikki materiaali on liuennut (kuva 3). Varmista, että ADVATE-kuiva-aine on kokonaan liuennut. Muuten kaikki liuotettu liuos ei kulkeudu laitteen suodattimen läpi. Valmiste liukenee nopeasti (tavallisesti alle minuutissa). Liuottamisen jälkeen liuos on myös kirkasta ja väritöntä eikä siinä näy vieraita hiukkasia.
Injektion antaminen
Antamisen aikana on käytettävä aseptista tekniikkaa.
Valmisteen antamiseen tarvitaan ruisku, jossa on luer‑liitin.
Tärkeää huomata:
- Injektiota ei saa antaa, ellei lääkäri tai sairaanhoitaja ole antanut siihen asianmukaista koulutusta.
Ennen liuotetun valmisteen antoa on tarkastettava, ettei siinä ole hiukkasia tai värimuutoksia (liuoksen tulee olla kirkas ja väritön, eikä siinä saa olla vieraita hiukkasia).
Älä käytä liuotettua ADVATE‑valmistetta, jos liuos ei ole täysin kirkas tai kuiva‑aine ei ole kokonaan liuennut.
1. Poista BAXJECT III ‑järjestelmän sininen suojus. Älä päästä ilmaa ruiskuun. Kiinnitä ruisku BAXJECT III ‑järjestelmään.
2. Käännä järjestelmä ylösalaisin (injektiopullon, jossa liuotettu valmiste, oltava ylinnä). Vedä liuotettu valmiste ruiskuun vetämällä hitaasti ruiskun mäntää.
3. Irrota ruisku.
4. Kiinnitä perhosneula ruiskuun ja injektoi valmiste laskimoon. Liuos annetaan hitaasti sellaisella antonopeudella, mikä on potilaasta mukavaa, eikä antonopeus saa ylittää 10 ml minuutissa. (ks. kohta Mahdolliset haittavaikutukset. Mahdolliset haittavaikutukset.)
5. Hävitä käyttämätön liuos asianmukaisesti.
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
Hoito tarvittaessa
Taulukossa luetelluissa verenvuototapauksissa tekijä VIII:n aktiivisuus ei saa pudota alle annetun plasman aktiivisuustason (prosenttia normaalista tasosta tai IU/dl) vastaavana aikana. Alla oleva taulukko on ohjeellinen verenvuototapauksiin ja leikkauksiin.
Annos ja antoväli on yksittäistapauksessa muutettava valmisteen kliinisen vasteen mukaisesti. Tietyissä tapauksissa (esim. alhaisen titterin inhibiittorin esiintyessä) saattavat kaavan mukaan laskettuja annoksia suuremmat annokset olla tarpeen.
Taulukko 1. Ohjeelliset annokset verenvuototapauksissa ja leikkauksissa
Verenvuodon määrä/ kirurgisen toimenpiteen laatu | Tekijä VIII:n tarvittava määrä (% tai IU/dl) | Annosten väli (tunteja)/ hoidon kesto (vuorokausia) |
| Verenvuoto | ||
| Alkava nivelensisäinen vuoto, lihas‑ tai suuverenvuoto. | 20–40 | Toista injektiot 12–24 tunnin välein (8–24 tunnin välein alle 6‑vuotiailla potilailla) vähintään vuorokauden ajan, kunnes kivulias verenvuoto on loppunut tai parantunut. |
| Suurehko nivelensisäinen vuoto, lihasverenvuoto tai verenpurkauma. | 30–60 | Toista injektiot 12–24 tunnin välein (8–24 tunnin välein alle 6‑vuotiailla potilailla) vähintään 3–4 vuorokauden ajan, kunnes kipu on hävinnyt ja akuutisti hävinnyt liikuntakyky on palautunut. |
| Hengenvaaralliset verenvuodot. | 60–100 | Toista injektiot 8–24 tunnin välein (6–12 tunnin välein alle 6‑vuotiailla potilailla), kunnes kriittinen tilanne on ohi. |
| Kirurgia | ||
Pieni toimenpide mukaan lukien hampaan poistaminen. | 30–60 | Joka 24. tunti (12–24 tunnin välein alle 6‑vuotiailla potilailla) ainakin vuorokauden ajan, kunnes potilas paranee. |
| Suurehko leikkaus | 80–100 (ennen leikkausta ja sen jälkeen) | Toista injektiot 8–24 tunnin välein (6–24 tunnin välein alle 6‑vuotiailla potilailla), kunnes haavat ovat kunnolla parantuneet. Sen jälkeen hoitoa jatketaan vielä vähintään 7 päivää, jotta tekijä VIII:n aktiivisuus pysyy tasolla 30–60 % (IU/dl). |
Profylaksia
Vaikeaa hemofilia A:ta sairastavien potilaiden verenvuodon pitkäaikaisessa ennaltaehkäisyssä tavalliset tekijä VIII ‑annokset ovat 20–40 IU painokiloa kohden 2–3 vuorokauden välein.
Joissakin tapauksissa, etenkin nuoremmilla potilailla, lyhyemmät antovälit tai suuremmat annokset voivat olla tarpeen.
Pediatriset potilaat
Tarpeen mukaisen hoidon annostus pediatrisille potilaille (0–18-vuotiaille) ei poikkea aikuispotilaiden annostuksesta. Alle 6‑vuotiaille potilaille suositeltu tekijä VIII:n ennaltaehkäisevä annos on 20–50 IU painokiloa kohden 3–4 kertaa viikossa.