Pakkausseloste
GAMUNEX infusionsvätska, lösning 100 mg/ml
Tilläggsinformation
Gamunex 100 mg/ml infusionsvätska, lösning
humant, normalt immunglobulin (IVIg)
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Gamunex är och vad det används för
2. Vad du behöver veta innan du använder Gamunex
3. Hur du använder Gamunex
4. Eventuella biverkningar
5. Hur Gamunex ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Gamunex är
Gamunex innehåller humant, normalt immunglobulin (antikroppar) i form av högrenat protein som extraherats från human plasma (en substans i blodet från blodgivare). Läkemedlet tillhör läkemedelsgruppen intravenösa immunglobuliner. Dessa används för att behandla sådana tillstånd som innebär att kroppens försvarssystem mot sjukdomar inte fungerar som det ska.
Vad Gamunex används för
Behandling av vuxna, barn och ungdomar (0–18 år) som inte har tillräckligt med antikroppar (ersättningsbehandling) vid t.ex.:
- primära immunbristsyndrom (PID), en medfödd brist på antikroppar
- förvärvad immunbrist (SID) med allvarliga eller återkommande infektioner, ineffektiv antimikrobiell behandling och antingen konstaterad specifik antikroppsbrist eller IgG i serum på mindre än 4 g/l.
Behandling av känsliga vuxna, barn och ungdomar (0-18 år) som har utsatts för mässling eller som löper risk för att utsättas för mässling i framtiden och där vaccination mot mässling inte rekommenderas.
Behandling av vuxna, barn och ungdomar (0–18 år) med vissa autoimmuna sjukdomar (immunmodulering). Det finns fem grupper:
- Idiopatisk trombocytopen purpura (ITP), ett tillstånd då antalet blodplättar i blodomloppet är starkt reducerat. Blodplättar har en viktig roll i koagulationsprocessen och ett minskat antal kan orsaka oönskade blödningar och blåmärken. Läkemedlet används också till patienter med stor blödningsrisk eller före operation för att korrigera antalet blodplättar.
- Guillain-Barrés syndrom, då immunsystemet skadar nerverna och hindrar dem från att fungera som de ska
- Kawasakis sjukdom (i detta fall tillsammans med acetylsalicylsyrabehandling), en sjukdom hos barn då blodkärlen (artärer) i kroppen förstoras.
- Kronisk inflammatorisk demyeliniserande polyradiculoneuropati (CIDP), en sällsynt och fortskridande sjukdom som ger svaghet i armar och ben, domningar, smärta och trötthet
- Multifokal motorisk neuropati (MMN), en sällsynt sjukdom som orsakar långsamt fortskridande svaghet i armar och ben utan känselförlust.
Behandling av vuxna från 18 års ålder:
- Allvarliga, akuta exacerbationer (skov) av myasthenia gravis, en sjukdom som orsakar allvarlig muskelsvaghet som främst påverkar sväljförmågan, talet och andningen.
Humant, normalt immunglobulin som finns i Gamunex kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apotek eller annan hälsovårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Vad du behöver veta innan produkten används
Använd inte Gamunex
- om du är allergisk mot humana normala immunglobuliner eller mot något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar)
- om du inte har tillräckligt med immunglobuliner av typen IgA i blodet och har utvecklat antikroppar mot IgA.
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Gamunex.
Infusionsreaktioner och överkänslighet
Vissa biverkningar kan bero på infusionshastigheten. Den rekommenderade infusionshastigheten ska därför följas (se”Uppgifter avsedda för hälso- och sjukvårdspersonal” i slutet av denna bipacksedel).
Vissa biverkningar kan förekomma oftare:
- vid hög infusionshastighet
- hos patienter som helt saknar gammaglobuliner eller har låga gammaglobulinnivåer (agammaglobulinemi eller hypogammaglobulinemi) med eller utan IgA-brist
- hos patienter som får humant normalt immunglobulin för första gången eller, i sällsynta fall när man byter immunglobulinpreparat eller efter ett långt behandlingsuppehåll.
Eventuella komplikationer kan ofta undvikas genom att säkerställa:
- att du inte är överkänslig mot humant immunglobulin genom att i början ge Gamunex genom långsam infusion.
- att du kontrolleras noggrant med avseende på eventuella symtom under hela infusionsperioden. Särskilt om du får humant immunglobulin för första gången, om du har bytt från ett annat immunglobulin eller om du inte har fått behandling på ett tag, ska du kontrolleras för eventuella biverkningar under den första infusionen och under en timme därefter.
Om biverkningar uppkommer ska infusionshastigheten sänkas eller infusionen avbrytas tills symtomen har försvunnit. Om symtomen kvarstår även efter att infusionen har avbrutits, ska lämplig behandling sättas in. I händelse av chockreaktion (anafylaktisk chock med kraftigt blodtrycksfall) ska behandling med läkemedlet omedelbart stoppas och medicinsk standardbehandling för chock ges.
Patienter med njurproblem och andra riskfaktorer
Fall av njurfunktionsstörningar och akut njursvikt har rapporterats i samband med tillförsel av intravenösa immunglobuliner. Du löper särskilt stor risk om du har vissa riskfaktorer såsom tidigare försämrad njurfunktion (njurinsufficiens), diabetes (diabetes mellitus) eller minskad blodvolym (hypovolemi). Andra omständigheter som anses vara riskfaktorer är om du är överviktig eller samtidigt behandlas med läkemedel som har skadliga effekter på njurarna och/eller om du är äldre än 65 år. Följande försiktighetsåtgärder ska du i alla fall vidta:
- Drick tillräckligt med vätska innan behandlingen påbörjas.
- Din läkare ska kontrollera urinmängden och mäta njurfunktionen.
- Använd inte samtidigt vissa läkemedel som ökar urinproduktionen (loopdiuretika).
Infusionshastigheten ska i ditt fall vara så långsam som möjligt och immunglobulinprodukten ska användas i lägsta möjliga koncentration. Om en njurfunktionsstörning uppstår, kommer din läkare att överväga att avbryta immunglobulinbehandlingen.
Hemolys (onormal nedbrytning av röda blodkroppar)
Det rapporteras ofta att immunglobuliner ökar risken för destruktion av röda blodkroppar (hemolys) hos både vuxna och barn. Om du fått höga doser av IVIg antingen en dag eller under flera dagar och har blodgrupp A, B eller AB och/eller har en underliggande inflammatorisk sjukdom, kan du löpa ökad risk för destruktion av röda blodkroppar (hemolys).
I rapporter efter godkännandet har det observerats att IVIg högdosindikationer hos barn, speciellt Kawasakis sjukdom, är förenade med en ökad frekvens rapporter om hemolytiska reaktioner jämfört med andra IVIg indikationer hos barn.
Uppsök läkare om du utvecklar blekhet, trötthet (svaghetskänsla), mörkfärgad urin, andnöd eller hjärtklappning (snabb hjärtfrekvens).
Enstaka fall av hemolysrelaterad njurinsufficiens/njursvikt med dödlig utgång har inträffat.
Information om säkerhet vad gäller infektioner
När läkemedel tillverkas av humant blod eller human plasma vidtas vissa åtgärder för att förhindra att infektioner överförs till patienter. Dessa omfattar:
- noggrant val av blod- och plasmagivare för att säkerställa att de som kan bära på infektioner utesluts
- test av varje donation och pool av plasma med avseende på tecken på virus/infektion
- inkludering av steg i tillverkningsprocessen som kan inaktivera eller avlägsna virus.
Trots dessa åtgärder kan risken för överföring av infektion inte helt uteslutas, när man använder läkemedel som framställts från humant blod eller human plasma. Detta gäller även alla okända eller nya virus och andra typer av infektioner.
Vidtagna åtgärder anses vara effektiva mot höljeförsedda virus såsom humant immunbristvirus (hiv), hepatit B-virus och hepatit C-virus. De vidtagna åtgärderna kan dock vara av begränsat värde mot icke höljeförsedda virus såsom hepatit A-virus och/eller parvovirus B19. Immunglobuliner har inte varit förknippade med hepatit A- eller parvovirus B19-infektioner, möjligen beroende på att antikropparna som finns i produkten skyddar mot infektion.
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per engångsdos (upp till högst 2 g/kg), d.v.s. är näst intill ”natriumfritt”.
Det rekommenderas starkt att varje gång du får en dos av detta läkemedel ska produktens namn och tillverkningssatsnummer noteras för att kunna spåra de använda produktsatserna.
Andra läkemedel och Gamunex
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Undvik att samtidigt använda läkemedel som ökar utsöndringen av vätska från kroppen (loopdiuretika) medan du behandlas med Gamunex.
Effekter på vacciner: Gamunex kan försämra effekten av vissa typer av vaccin (levande försvagade virusvacciner). När det gäller röda hund, påssjuka och vattkoppor ska det gå minst 3 månader efter att du fått detta läkemedel innan du vaccineras. När det gäller mässling är perioden upp till 1 år.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Körförmåga och användning av maskiner
Yrsel och andra reaktioner kan ibland förekomma och kan påverka förmågan att köra och använda maskiner. Om detta händer ska du vänta tills besvären försvunnit innan du kör något fordon eller använder maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbeten som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Hur produkten används
Gamunex injiceras i dina vener (intravenös administrering) av din läkare. Dosen beror på din sjukdom och kroppsvikt och beräknas av läkaren (se avsnittet avsett för sjukvårdspersonal sist i denna bipacksedel).
I början av infusionen injiceras Gamunex långsamt. Beroende på hur du mår kan läkaren sedan gradvis öka infusionshastigheten.
Om du slutar att använda Gamunex
Om behandling med detta läkemedel upphör, kan ditt kliniska tillstånd försämras. Tala med ansvarig läkare om du vill avsluta behandlingen med detta läkemedel i förtid.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
I sällsynta och enstaka fall har nedanstående biverkningar av immunglobulinläkemedel rapporterats. Sök omedelbart vård om du får någon av följande biverkningar under eller efter infusionen:
- Plötsligt blodtrycksfall och, i enstaka fall, anafylaktisk chock (tecken på detta är bland annat hudutslag, lågt blodtryck, snabba eller oregelbundna hjärtslag, väsande andning, hosta, nysningar och andningssvårigheter), även om du inte visat tecken på allergisk reaktion vid tidigare behandling.
- Fall av övergående icke-infektiös meningit (tecken på detta är huvudvärk, undvikande av eller intolerans mot ljus, nackstelhet).
- Fall av övergående minskning av antalet röda blodkroppar i blodet (reversibel hemolytisk anemi/hemolys).
- Fall av övergående reaktioner som drabbar huden.
- Ökat serumkreatinin (ett test som mäter njurfunktionen) och/eller akut njursvikt (tecken på detta är värk i ländryggen, trötthet, minskade urinmängder).
- Tromboemboliska reaktioner som hjärtinfarkt (åtstramande känsla runt bröstkorgen och snabba hjärtslag), stroke (muskelsvaghet i ansiktet, en arm eller ett ben, talsvårigheter eller svårt att förstå vad andra säger), propp i lungan (andfåddhet, bröstsmärtor och trötthet), djup ventrombos (smärta och svullnad i en arm eller ett ben).
- Fall av transfusionsrelaterad akut lungskada (TRALI) som leder till syrebrist, andningssvårigheter, snabb andning, blåaktig missfärgning av hud eller slemhinnor, feber och lågt blodtryck.
I kliniska prövningar med Gamunex har följande biverkningar observerats:
Följande biverkningar var vanliga (kan förekomma vid upp till 1 av 10 infusioner):
- huvudvärk
- feber.
Följande biverkningar var mindre vanliga (kan förekomma vid upp till 1 av 100 infusioner):
- yrsel
- nässelutslag (nässelfeber, rodnad, klåda)
- klåda
- hudutslag
- illamående
- kräkningar
- högt blodtryck
- svalginflammation
- hosta
- nästäppa
- pipande andning
- ledvärk
- ryggvärk
- influnsaliknande sjukdom
- trötthet
- köldfrossa
- kraftlöshet
- muskelvärk.
Följande biverkningar var sällsynta (kan förekomma vid upp till 1 av 1 000 infusioner):
- hemolytisk anemi (nedbrytning av röda blodkroppar)
- andnöd
- bihåleinflammation
- hudavflagning
- ångest
- minskat hemoglobinvärde
- matsmältningsproblem
- blåmärke
- rodnad
- skelettmuskelstelhet
- rodnad i handflatorna
- förlorad röst
- minskat antal vita blodkroppar
- dermatit (inflammation i huden) eller kontaktdermatit
- buksmärtor
- diarré
- lågt blodtryck
- nacksmärta
- smärtor i skelettmuskulaturen
- bröstsmärtor
- sjukdomskänsla
- reaktion på injektionsstället
- uretrit (urinrörsinflammation, som gör det smärtsamt och svårt att urinera)
- virusinfektion i övre luftvägarna (akut infektion av virus i näsa, bihålor och svalg)
- lymfocytos (ökat antal av en viss typ av vita blodkroppar)
- överkänslighet (allergisk reaktion)
- ljuskänslighet hos ögonen
- hypertensiv kris (akut blodtrycksökning)
- hyperemi (ökad mängd blod)
- hemoglobinuri (onormalt hög koncentration i urinen av protein som transporterar syre)
- förhöjt blodtryck
- förekomst av fritt hemoglobin (hemoglobin cirkulerar utanför röda blodkroppar)
- förhöjd sänka (ökad hastighet med vilken röda blodkroppar sjunker i ett provrör).
Vilka motåtgärder ska vidtas om biverkningar uppstår?
Om biverkningar uppstår ska infusionshastigheten sänkas eller infusionen avbrytas tills symtomen har försvunnit. Om symtomen kvarstår även efter att infusionen har avbrutits, ska lämplig behandling påbörjas.
I händelse av en svår överkänslighetsreaktion med blodtrycksfall och andnöd, och även en svår generaliserad allergisk reaktion (anafylaktisk chock), ska användningen av detta läkemedel omedelbart upphöra och lämpliga motåtgärder påbörjas.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Sverige:
Läkemedelsverket
Box 26
SE-751 03 Uppsala
webbplats: www.lakemedelsverket.se
Finland:
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och injektionsflaskan. Hållbarhetstiden är 3 år.
Förvaras i kylskåp (2 °C–8 °C). Får ej frysas. Förvara injektionsflaskan i ytterkartongen.
Läkemedlet kan förvaras i ytterkartongen under en engångsperiod på upp till 6 månader i rumstemperatur (högst 25 °C). I detta fall går läkemedlets hållbarhetstid ut efter 6 månader, oavsett ursprungligt utgångsdatum. Det nya utgångsdatumet måste noteras på ytterkartongen. Det nya utgångsdatumet får dock inte vara ett senare datum än det tryckta utgångsdatumet. Förvaring i kylskåp efter detta datum är inte möjlig.
När den enskilda injektionsflaskan har öppnats, måste innehållet användas omedelbart. Eventuella rester måste kasseras. Fortsatt förvaring, även i kylskåp, är inte tillåtet på grund av möjlig tillväxt av bakterier.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är humant normalt immunglobulin (IVIg). En ml av detta läkemedel innehåller 100 mg protein med ett IgG-innehåll på minst 98 % i vatten för injektionsvätskor.
En injektionsflaska à 10 ml innehåller: 1 g humant normalt immunglobulin
En injektionsflaska à 50 ml innehåller: 5 g humant normalt immunglobulin
En injektionsflaska à 100 ml innehåller: 10 g humant normalt immunglobulin
En injektionsflaska à 200 ml innehåller: 20 g humant normalt immunglobulin
En injektionsflaska à 400 ml innehåller: 40 g humant normalt immunglobulin
Fördelningen av IgG-subklasser är ungefär 62,8 % (IgG1), 29,7 % (IgG2), 4,8 % (IgG3), 2,7 % (IgG4).
Maximalt IgA-innehåll: 84 mikrogram/ml.
Övriga innehållsämnen är glycin och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Gamunex är en infusionsvätska, lösning. Lösningen är klar till lätt opaliserande och färglös eller svagt gul.
Gamunex finns i förpackningsstorlekar på 10 ml, 50 ml, 100 ml, 200 ml och 400 ml. Kartongen innehåller en injektionsflaska av glas med propp (av klorbutyl), en avdragbar hängetikett och en bipacksedel.
Innehavare av godkännande för försäljning
Grifols Deutschland GmbH
Colmarer Straße 22
60528 Frankfurt
Tyskland
Tfn: +49-69-660 593 100
Tillverkare
Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
08150 Barcelona
Spanien
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet och i Storbritannien (Nordirland) under namnen:
Belgien, Cypern, Irland, Luxemburg, Nederländerna, Polen, Portugal, Storbritannien (Nordirland), Tyskland, Österrike: Gamunex 10% 100 mg/ml
Danmark, Finland, Frankrike, Italien, Norge, Slovakien, Spanien, Sverige, Tjeckien, Ungern: Gamunex 100 mg/ml
Grekland: Gaminex 10% 100 mg/ml
Denna bipacksedel ändrades senast 24.10.2022
Direktiv för experterna inom hälsovården
Använd endast klara eller lätt opaliserande och färglösa eller ljusgula infusionslösningar som är fria från partiklar – skaka inte. Före infusion ska Gamunex värmas till rums- eller kroppstemperatur (eventuellt i ett vattenbad med en temperatur som inte är högre än 37 °C).
Injektionsflaskorna levereras med en hängetikett (bild 1). Efter isättning av infusionssetet (bild 2), vänd injektionsflaskan upp och ned och öglan på etiketten viks bakåt (bild 3). Tryck hårt med fingrarna för att skapa ett veck på vardera sidan av öglan där den sitter ihop med resten av etiketten (bild 4). Häng upp injektionsflaskan på infusionsstativet i den ögla som bildats (bild 5).
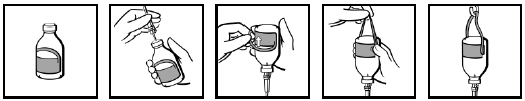
Bild 1 Bild 2 Bild 3 Bild 4 Bild 5
Dosering och administreringssätt
Dos och doseringsregim är beroende av indikationen.
Dosen kan behöva anpassas efter varje patient beroende på det kliniska svaret. Dos som baseras på kroppsvikt kan behöva justeras för under- eller överviktiga patienter. Följande dosregimer anges som riktlinjer.
Doseringsrekommendationerna sammanfattas i nedanstående tabell:
|
Indikation |
Dos |
Injektionsfrekvens |
||
|
Substitutionsbehandling |
||||
|
Primärt immunbristsyndrom |
Startdos: 0,4‑0,8 g/kg |
|||
|
Underhållsdos: 0,2‑0,8 g/kg |
var 3:e till var 4:e vecka |
|||
|
Sekundära immunbristtillstånd |
0,2‑0,4 g/kg |
var 3:e till var 4:e vecka |
||
| Mässlingsprofylax före/efter exponering: | ||||
| Post-exponeringsprofylax hos känsliga patienter | 0,4 g/kg | Så snart som möjligt och inom 6 dagar, som eventuellt kan upprepas en gång efter 2 veckor för att bibehålla serumnivån av mässlingsantikroppar > 240 mIU/ml | ||
| Post-exponeringsprofylax hos PID/SID- patienter | 0,4 g/kg | Utöver underhållsbehandling ges en extra dos inom 6 dagar efter exponering | ||
| Pre-exponeringsprofylax hos PID/SID- patienter | 0,53 g/kg | Om en patient får en underhållsdos på mindre än 0,53 g/kg var 3-4:e vecka, bör denna dos ökas en gång till minst 0,53 g/kg | ||
|
Immunmodulering |
||||
|
Primär immuntrombocytopeni |
0,8‑1 g/kg eller |
dag 1, kan upprepas en gång inom 3 dagar |
||
|
0,4 g/kg/dag |
i 2‑5 dagar |
|||
|
Guillain-Barrés syndrom |
0,4 g/kg/dag |
i 5 dagar |
||
|
Kawasakis sjukdom |
2 g/kg |
som engångsdos tillsammans med acetylsalicylsyra |
||
|
Kronisk inflammatorisk demyeliniserande polyradiculoneuropati (CIDP) |
Startdos: 2 g/kg |
i uppdelade doser fördelat över 2‑5 dagar |
||
|
Underhållsdos: 1 g/kg |
var 3:e vecka i uppdelade doser fördelat över 1‑2 dagar | |||
|
Multifokal motorisk neuropati (MMN)
|
Startdos: 2 g/kg |
i uppdelade doser fördelat över 2‑5 dagar i följd |
||
|
Underhållsdos: 1 g/kg eller |
var 2-4:e vecka
eller |
|||
|
2 g/kg |
var 4-8:e vecka i uppdelade doser fördelat över 2‑5 dagar | |||
| Allvarliga, akuta exacerbationer av myasthenia gravis | 2 g/kg |
administreras fördelat på 2 dagar i följd |
||
Administreringssätt
För intravenös användning.
Humant normalt immunglobulin ska ges som en intravenös infusion med en initial hastighet på 0,6‑1,2 ml/kg/timme under 30 minuter. Vid biverkning måste antingen administreringshastigheten minskas eller infusionen avbrytas. Om infusionen tolereras väl kan administreringshastigheten gradvis ökas till max. 4,8–8,4 ml/kg/timme.
Pediatrisk population
Dosering till barn och ungdomar (0–18 år) är inte annorlunda än till vuxna eftersom dosering för varje indikation ges enligt kroppsvikt och justeras utefter det kliniska utfallet för ovan nämnda tillstånd.
Gamunex får inte blandas med andra infusionsvätskor eller andra läkemedel. Om spädning är nödvändig före infusion, kan 50 mg/ml glukoslösning användas för detta ändamål. Blanda inte med koksaltlösning.
Gamunex och heparin får inte administreras samtidigt i samma infusionssystem.
Infusionsslangarna kan spolas med 50 mg/ml glukoslösning eller med natriumkloridlösning (9 mg/ml) och får inte spolas med heparin.
Heparin Lock genom vilka Gamunex administreras skall spolas med 50 mg/ml glukoslösning eller natriumkloridlösning (9 mg/ml) och får inte spolas med heparin.