Pakkausseloste
RINIVENT nässpray, lösning 21 mikrog/dos
Tilläggsinformation
Rinivent 21 mikrog/dos nässpray, lösning
ipratropiumbromid
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Rinivent är och vad det används för
2. Vad du behöver veta innan du använder Rinivent
3. Hur du använder Rinivent
4. Eventuella biverkningar
5. Hur Rinivent ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Rinivent minskar nässekretionen, speciellt när sekretionen är högre än normalt, t ex vid rinnsnuva.
Rinivent används för rinnsnuva vid allergisk eller icke allergisk inflammation i näsan (rinit).
Vad du behöver veta innan produkten används
Använd inte Rinivent
- om du är allergisk mot ipratropiumbromid, atropin eller mot något ämne besläktat med detta eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Rinivent bör användas med försiktighet vid prostataförstoring, förträngning i urinvägarna och trångvinkelglaukom.
Personer som har trångvinkelglaukom kan få ett förhöjt ögontryck om nässprayen kommer i ögonen. Detta ger följande symtom: ögonirritation och -smärta, synfenomen och röda, irriterade ögon. Sök ögonläkare omedelbart i sådana fall.
Undvik att spraya Rinivent i eller omkring ögonen. Skulle detta inträffa så skölj ögonen med kallt kranvatten under några minuter. Om sprayvätskan skulle komma i ögonen, kan ögats förmåga att ställa in sig på olika avstånd påverkas. Detta är ofarligt och övergående.
I sällsynta fall kan Rinivent orsaka överkänslighetsreaktioner, t ex nässelutslag , svullnad på tunga, läppar eller ansikte och anafylaktiska reaktioner.
Barn och undromar
Rinivent rekommenderas inte för barn och ungdomar under 18 år.
Andra läkemedel och Rinivent
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Graviditet, amning och fertilitet
Begränsad erfarenhet av användning under graviditet. Rådgör därför med läkare vid mer än tillfälligt bruk av Rinivent under graviditet.
Uppgift saknas om ipratropium passerar över i modersmjölk. Rådgör därför med läkare före regelbunden användning under amning.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Körförmåga och användning av maskiner
Inga studier har utförts.
Rinivent kan i någon mån påverka din förmåga att köra bil eller använda maskiner, eftersom yrsel eller ögonsymptom (till exempel svårighet att ställa in synen på olika avstånd eller dimsyn) kan förekomma som biverkning. Om du får sådana symptom, ska du inte köra bil eller använda maskiner förrän symptomen har upphört. Be din läkare om råd.
Rinivent innehåller bensalkoniumklorid
Detta läkemedel innehåller 17,5 mikrogram bensalkoniumklorid (konserveringsmedel) per spraydos. Bensalkoniumklorid kan orsaka irritation och svullnad inuti näsan särskilt vid längre tids användning.
Hur produkten används
Dosen bestäms av läkaren som anpassar den individuellt för dig.
Vanlig dos för vuxna är 2 sprayningar i vardera näsborren 2-3 gånger dagligen.
Rinivent skall lindra din rinnsnuva genom regelbunden användning. Det är därför viktigt att du använder Rinivent som din läkare har föreskrivit. Lite förbättring av rinnsnuvan märks vanligtvis redan efter någon dags användning, men full effekt uppnås först efter flera veckors behandling.
Bruksanvisning
Läs bruksanvisningen noggrant och följ anvisningarna.
- Tag av skyddslocket.
- Innan nässprayen används första gången, spraya flera gånger i luften tills en jämn dusch kommer från sprayflaskan (se bild.1).
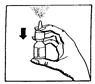
bild 1.
Vid fortsatt användning fungerar nässprayen omedelbart.
Snyt ur näsan före användning av nässprayen. - För in spetsen på sprayflaskan i näsborren och spraya en gång (se bild 2).
Upprepa i den andra näsborren. När sprayen är utlöst, andas sakta in genom näsan.
bild 2. - Sätt tillbaka skyddslocket efter användning av nässprayen.
Ta inga extra doser och sluta inte att använda Rinivent spray, utan att ta kontakt med läkaren.
Om nässprayen i misstag kommer i kontakt med ögonen, skölj då genast ögonen med ljummet vatten.
Rengöring: Rengör näsapplikatorn regelbundet. Ta bort plastlocket. Håll spetsen under rinnande varmt kranvatten under en minut och låt den torka. Sätt tillbaka locket.
Om du har tagit för stor mängd av Rinivent
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 09 471 977) för bedömning av risken samt rådgivning.
Om du har glömt att ta Rinivent
Ta inte dubbel dos för att kompensera för glömd dos.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Vanliga (hos fler än en av 100 patienter): huvudvärk, näsblod, torra nässlemhinnor, irritation i halsen, obekväm känsla i näsan
Mindre vanliga (hos färre än en av 100 patienter): kraftig allergisk reaktion (anafylaktisk reaktion), överkänslighet, yrsel, ögonsymptom (svårighet att ställa in synen på olika avstånd, trångvinkelglaukom, förhöjt ögontryck, ögonsmärta, pupilldilatation, dimsyn, synfenomen som ringar av ljus, blodutgjutning i bindehinnan, svullnad i hornhinnan), oregelbunden hjärtrytm, förmaksflimmer, ökad pulsfrekvens, torr hals, tryck över bröstet, i samband med hosta, pipande andning eller andnöd genast efter inhalationen, kramp i struphuvudet, svullnad i svalget, muntorrhet, illamående, funktionella störningar i mag-tarmkanalen, infektion i munnen, eksem, lokal svullnad i huden, urineringsbesvär
Sällsynta (hos färre än en av 1000 patienter): hjärtklappning, nässelutslag, klåda
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Får ej frysas. Förbrukningstiden för öppnad sprayflaska är 12 månader.
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum ”Utg.dat.” som anges på kartongen. Utgångsdatumet är den sista dagen i angiven månad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är ipratropiumbromid
- Övriga innehållsämnen är natriumklorid, bensalkoniumklorid 0,25 mg (konserveringsmedel), dinatriumedetat 0,5 mg (konserveringsmedel), klorvätesyra för justering av
pH till 4,7 och renat vatten till 1 ml.
Läkemedlets utseende och förpackningsstorlekar
Rinivent 21 mikrog/dos nässpray är förpackad i en brun, 15 ml:s pumpflaska av glas, varav man får cirka 180 doser.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning:
Opella Healthcare France SAS
157 avenue Charles de Gaulle
92200 Neuilly-sur-Seine
Frankrike
Lokal företrädare:
STADA Nordic ApS
PL 1310
00101 Helsingfors
Finland
Tillverkare:
Istituto De Angeli S.r.l., 50066 Reggello, Italien
Denna bipacksedel ändrades senast 15.07.2023