Pakkausseloste
VYDURA frystorkad tablett 75 mg
Tilläggsinformation
VYDURA 75 mg frystorkad tablett
rimegepant
Utökad övervakning
▼ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar du eventuellt får. Information om hur du rapporterar biverkningar finns i slutet av avsnitt Eventuella biverkningar.
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad VYDURA är och vad det används för
2. Vad du behöver veta innan du tar VYDURA
3. Hur du tar VYDURA
4. Eventuella biverkningar
5. Hur VYDURA ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
VYDURA innehåller den aktiva substansen rimegepant, som förhindrar aktiviteten hos ett ämne i kroppen som kallas kalcitoningenrelaterad peptid (CGRP). Personer med migrän kan ha förhöjda nivåer av CGRP. Rimegepant fäster på receptorn för CGRP och minskar därmed möjligheten för CGRP att också fästa på receptorn. Detta minskar CGRP:s aktivitet och får två effekter:
1) det kan avbryta ett pågående migränanfall
2) det kan minska antalet migränanfall om det tas i förebyggande syfte.
VYDURA används för att behandla och förebygga migränanfall hos vuxna.
Vad du behöver veta innan produkten används
Ta inte VYDURA
- om du är allergisk mot rimegepant eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du tar VYDURA om något av följande gäller dig:
- du har svåra leverproblem
- din njurfunktion är försämrad eller du står på dialys.
När du behandlas med VYDURA måste du sluta ta detta läkemedel och omedelbart informera läkaren
- om du får symtom på en allergisk reaktion, t.ex. andningsproblem eller kraftigt hudutslag. Dessa symtom kan visa sig flera dagar efter att du tagit läkemedlet.
Barn och ungdomar
VYDURA ska inte ges till barn och ungdomar under 18 års ålder eftersom det inte har studerats i denna åldersgrupp.
Andra läkemedel och VYDURA
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel. Anledningen är att vissa läkemedel kan påverka hur VYDURA verkar och VYDURA kan påverka hur andra läkemedel verkar.
Följande är exempel på läkemedel som ska undvikas när man behandlas med VYDURA:
- itrakonazol och klaritromycin (används mot svamp- eller bakterieinfektioner)
- ritonavir och efavirenz (används mot hiv-infektioner)
- bosentan (används mot högt blodtryck)
- johannesört ((traditionellt) växtbaserat läkemedel mot lätt nedstämdhet och lindrig oro)
- fenobarbital (används mot epilepsi)
- rifampicin (används mot tuberkulos)
- modafinil (används mot narkolepsi).
Ta inte VYDURA oftare än en gång varannan dag (var 48:e timme) om du också tar
- flukonazol eller erytromycin (används mot svamp- eller bakterieinfektioner)
- diltiazem, kinidin eller verapamil (används mot onormal hjärtrytm, bröstsmärtor (kärlkramp) eller högt blodtryck)
- ciklosporin (används för att förhindra organavstötning efter transplantation).
Graviditet och amning
Om du är gravid, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel Man bör undvika användning av VYDURA under graviditet eftersom läkemedlets effekter hos gravida kvinnor inte är känd.
Om du ammar eller planerar att amma, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel. Du och din läkare ska besluta om du ska använda VYDURA under amning.
Körförmåga och användning av maskiner
VYDURA förväntas inte påverka din förmåga att framföra fordon eller använda maskiner.
Hur produkten används
Ta alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Hur mycket du ska ta
För att förebygga migrän är den rekommenderade dosen en frystorkad tablett (75 mg rimegepant) varannan dag.
För behandling av ett migränanfall som redan har startat är den rekommenderade dosen en frystorkad tablett (75 mg rimegepant) vid behov, dock inte mer än en gång dagligen.
Högsta dagliga dos är en frystorkad tablett (75 mg rimegepant) per dag.
Hur du tar detta läkemedel
VYDURA är avsett för oral användning.
Den frystorkade tabletten kan tas med eller utan mat eller vatten.
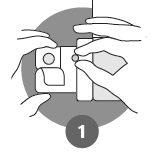
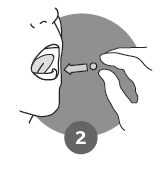
Anvisningar:
|
|
Händerna ska vara torra när du öppnar förpackningen. Dra av folien från ett blister och ta försiktigt upp den frystorkade tabletten. Tabletten ska inte tryckas ut genom folien. |
|
|
Lägg omedelbart tabletten under eller ovanpå tungan, där den löses upp. Vatten eller annan dryck behövs inte. Förvara inte den frystorkade tabletten utanför blisterkartan för framtida användning. |
Om du har tagit för stor mängd av VYDURA
Tala med läkare eller apotekspersonal eller bege dig till sjukhus omedelbart. Ta med läkemedelsförpackningen och denna bipacksedel.
Om du har glömt att ta VYDURA
Om du tar VYDURA för att förebygga migrän och du har glömt en dos, tar du bara nästa dos vid den vanliga tiden. Ta inte dubbel dos för att kompensera för en glömd dos.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Sluta använda VYDURA och kontakta läkare omedelbart om du får tecken på en allergisk reaktion, t.ex. kraftigt hudutslag eller andnöd. Allergiska reaktioner av VYDURA är mindre vanliga (kan förekomma hos upp till 1 av 100 användare).
En vanlig biverkning (kan förekomma hos upp till 1 av 10 användare) är illamående.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och blisterkartan efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 30 °C. Förvaras i originalblistret. Fuktkänsligt.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är rimegepant. Varje frystorkad tablett innehåller 75 mg rimegepant (som sulfat).
- Övriga innehållsämnen är: gelatin, mannitol, mintsmakämne och sukralos.
Läkemedlets utseende och förpackningsstorlekar
VYDURA 75 mg frystorkade tabletter är vita till benvita, runda och präglade med symbolen ![]() .
.
Förpackningsstorlekar:
- 2 x 1 frystorkade tabletter i perforerade endosblister.
- 8 x 1 frystorkade tabletter i perforerade endosblister.
- 16 x 1 frystorkade tabletter i perforerade endosblister.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelles
Belgien
Tillverkare
HiTech Health Limited
5-7 Main Street
Blackrock
Co. Dublin
A94 R5Y4
Irland
Millmount Healthcare Limited
Block-7, City North Business Campus
Stamullen
Co. Meath
K32 YD60
Irland
Pfizer Ireland Pharmaceuticals Unlimited Company
Little Connell
Newbridge
Co. Kildare
W12 HX57
Irland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Suomi/Finland
Pfizer Oy
Puh/Tel: +358 (0)9 430 040
Denna bipacksedel ändrades senast 04/2025.
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu.