Pakkausseloste
SANCUSO depotlaastari 3,1 mg/24 h
SANCUSO 3,1 mg/24 tuntia depotlaastari
granisetroni
Yleisiä ohjeita
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä SANCUSO on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät SANCUSOa
- Miten SANCUSOa käytetään
- Mahdolliset haittavaikutukset
- SANCUSOn säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
SANCUSOn vaikuttava aine on granisetroni, joka kuuluu oksentelun ja pahoinvoinnin hillitsemiseen tarkoitettujen lääkkeiden ryhmään.
SANCUSO on (ihoon kiinnitettävä) depotlaastari, jota käytetään ehkäisemään pahoinvointia ja oksentelua aikuisilla, jotka saavat solunsalpaajahoitoja 3–5 päivän ajan ja joilla on vaikeuksia niellä tabletteja (esim. suun tai nielun aristavuuden, kuivuuden tai tulehduksen vuoksi).
Keskustele lääkärisi kanssa, jos vointisi ei parane tai jos tunnet vointisi huonommaksi ensimmäisen solunsalpaajahoitopäivän jälkeen.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä SANCUSOa:
- jos olet allerginen granisetronille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos olet allerginen jollekin niistä pahoinvoinnin estolääkkeistä, joiden nimen loppuosa on “setroni”, esim. ondansetroni.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät tätä hoitoa, jos mikä tahansa seuraavista pätee kohdallasi:
- sinulle on kerrottu, että sinulla on sydänhäiriö tai -sairaus
- sinulla on mahakipua tai mahasi on turvoksissa
- sinulla on munuais- tai maksaongelmia (munuais- tai maksasairaus).
Tämä lääke ei ehkä toimi yhtä hyvin ja/tai se saattaa vaikuttaa ihoosi, jos ihosi altistuu suoralle auringon tai solariumin valolle. On tärkeätä, että toimit seuraavasti:
- kun käytät depotlaastaria, pidä se vaatetuksella peitettynä, jos olet auringonvalossa tai valohoitolampun lähellä, mukaan lukien solarium
- pidä ihon kohta, johon tämä lääke oli kiinnitetty, peitettynä vielä 10 päivän ajan sen jälkeen, kun depotlaastari on poistettu suojautuaksesi suoralta auringonvalolta.
Esimerkiksi uinnin, voimakkaan liikunnan tai saunassa tai porealtaassa käynnin kaltaisten toimintojen vaikutusta tähän lääkkeeseen ei tiedetä. Vältä näitä aktiviteetteja, kun käytät tätä depotlaastaria. Voit jatkaa suihkussa käyntiä ja normaalia peseytymistä depotlaastaria käyttäessäsi.
Ulkoista lämmönlähdettä, esim. kuumavesipulloja tai lämpöpakkauksia tulee välttää depotlaastarin kiinnityskohdan alueella.
Lapset ja nuoret
Tätä lääkettä eivät saa käyttää alle 18-vuotiaat lapset.
Muut lääkevalmisteet ja SANCUSO
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat joutua käyttämään muita lääkkeitä. SANCUSO voi vaikuttaa siihen, miten jotkut lääkkeet toimivat. Jotkut muut lääkkeet voivat myös vaikuttaa siihen miten SANCUSO toimii. Kerro lääkärillesi tai apteekkihenkilökunnalle erityisesti, jos käytät mitä tahansa seuraavista lääkkeistä:
- Parasetamoli, käytetään kivun hoitoon.
- Fenobarbitaali, käytetään epilepsian hoitoon.
- Ketokonatsoli, käytetään sieni-infektioiden hoitoon.
- Masennuksen ja/tai ahdistuksen hoitoon käytettävät SSRI-lääkkeet (selektiiviset serotoniinin takaisinoton estäjät), mukaan lukien fluoksetiini, paroksetiini, sertraliini, fluvoksamiini, sitalopraami, essitalopraami.
- Masennuksen ja/tai ahdistuksen hoitoon käytettävät SNRI-lääkkeet (serotoniinin ja noradrenaliinin takaisinoton estäjät), mukaan lukien venlafaksiini, duloksetiini.
- Buprenorfiini, opioidit tai muut serotonergiset lääkkeet.
Raskaus, imetys ja hedelmällisyys
Älä käytä tätä lääkettä jos olet raskaana ellei lääkärisi ole nimenomaan suositellut sen käyttöä.
Lopeta imettäminen käyttäessäsi depotlaastaria.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
SANCUSOlla ei ole mitään tai vain vähäistä vaikutusta ajokykyysi tai koneiden käyttökykyysi.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai sairaanhoitajalta, jos olet epävarma.
Suositeltu annos on yksi depotlaastari. Depotlaastarin sisältämä lääke läpäisee vähitellen ihon ja kulkeutuu kehoon, jonka vuoksi laastari kiinnitetään 1−2 päivää (24–48 tuntia) ennen solunsalpaajahoidon aloittamista.
Tätä lääkettä käytetään ihon läpi. Tämä lääke vapauttaa vaikuttavaa ainetta hitaasti ja jatkuvasti ihosi läpi suoraan verenkiertoosi depotlaastarin ollessa kiinnitettynä.
Muistettavaa depotlaastarin käytössä
- Älä pidä tai säilytä depotlaastaria suljetun pussin ulkopuolella.
- Älä leikkaa depotlaastaria pienempiin osiin.
- Käytä vain yhtä depotlaastaria kerrallaan.
- Kun poistat depotlaastarin, tarkista ihosi ja kerro lääkärillesi, jos havaitset vakavan ihoreaktion (jos ihosi on hyvin punainen tai kutiava tai jos havaitset mitä tahansa rakkuloita).
- Suora auringonvalo tai valohoitolampun valo saattaa vaikuttaa depotlaastariin. Kun käytät depotlaastaria, sinun tulee pitää se peitettynä, esim. vaatetuksen alla, jos on olemassa auringonvalolle tai valohoitolampun valolle altistumisen riski. Jatka kiinnityskohdan alueen peittämistä vielä 10 päivän ajan depotlaastarin irrottamisen jälkeen.
- Vesikontakti kylvyn tai suihkussa käynnin yhteydessä ei muuta SANCUSOn vaikutustapaa. Depotlaastari saattaa kuitenkin osittain irrota. Yritä välttää depotlaastarin pitkäkestoista käyttöä vedessä.
- Ei tiedetä miten aktiviteetit, esim. voimakas liikunta, sauna tai porealtaat, vaikuttavat depotlaastariin. Sinun tulee sen vuoksi välttää näitä toimintoja tämän depotlaastarin käytön aikana.
- Sinun tulee välttää ulkopuolista lämmönlähdettä (esim. kuumavesipulloja ja lämpöpakkauksia) depotlaastarin kiinnitysalueella.
Milloin depotlaastari kiinnitetään ja irrotetaan
Älä poista depotlaastaria pussista ennen kuin olet valmis käyttämään sitä. Kiinnitä depotlaastari vähintään 1 päivä (24 tuntia) ennen solunsalpaajahoitosi ajankohtaa. Depotlaastari voidaan kiinnittää korkeintaan 2 päivää (48 tuntia) ennen solunsalpaajahoitoa. Pidä depotlaastaria koko sen ajan kun saat solunsalpaajahoitoa. Depotlaastaria voidaan käyttää korkeintaan 7 vuorokauden ajan solunsalpaajahoitosi kestosta riippuen. Poista depotlaastari aikaisintaan 1 päivän (24 tunnin) kuluttua solunsalpaajahoitosi päättymisestä.
Mihin depotlaastari kiinnitetään
Aseta depotlaastari puhtaalle, kuivalle ja terveelle ihoalueelle olkavartesi ulkopintaan. Jos laastaria ei voi kiinnittää olkavarteesi, lääkärisi voi neuvoa laittamaan sen vatsasi päälle. Valitsemasi alue ei saa olla öljyinen, karvojenpoisto ei saa olla äskettäin tapahtunut, eikä iho-ongelmia saa olla, esim. iho ei saa olla vaurioitunut (haavoilla tai naarmuuntunut) eikä ärtynyt (punoitus tai ihottuma). Älä kiinnitä SANCUSOa ihoalueille, joita on hoidettu salvoilla, öljyillä, voiteilla, jauheilla tai muilla ihotuotteilla, jotka voivat estää depotlaastarin kunnollisen kiinnittymisen ihoosi.
Miten depotlaastari kiinnitetään
- Poista pussi rasiasta ja revi se auki käyttämällä siihen tarkoitettua viiltoa. Jokainen pussi sisältää yhden depotlaastarin, joka on pakattu tiiviiseen muovikelmuun.
- Ota depotlaastari pussista.
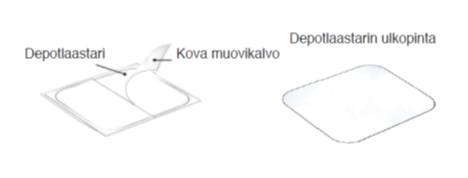
- Depotlaastarin kiinnityspuolta peittää kova kaksiosainen muovikalvo. Taivuta depotlaastaria keskeltä ja poista kovan muovikalvon toinen puoli. Varo depotlaastarin kiinnittymistä itseensä ja vältä koskettamasta depotlaastarin kiinnityspuolta.
- Samalla kuin pidät kiinni kovan muovikalvon toisesta puolikkaasta, kiinnitä depotlaastari olkavartesi ulkopuolen ihoon.
- Poista kovan muovikalvon toinen puolikas ja paina koko depotlaastaria sormin tiiviisti ja painele se paikoilleen. Paina tiukasti varmistaen että kontakti ihoon on tiivis, erityisesti reunoilta.
- Pese kätesi depotlaastarin kiinnityksen jälkeen.
- Pidä depotlaastari paikoillaan koko sen ajan kun saat solunsalpaajahoitoa.
- Älä käytä depotlaastaria poistamisen jälkeen, ks. alla olevia ohjeita depotlaastarin poistamisesta ja hävittämisestä (ks. kohta Valmisteen säilyttäminen).
Depotlaastarin poistamisen jälkeen
- Käytetyssä depotlaastarissa on jäljellä vielä vähän granisetronia ja laastari tulee hävittää välittömästi siten kuin on kuvattu kohdassa Valmisteen säilyttäminen.
- Depotlaastarin poistamisen jälkeen saatat vielä havaita tahmeaa materiaalia ihollasi. Pese alue varovasti saippualla ja vedellä. Alkoholi ja muut liuottavat nesteet kuten kynsilakan poistoaine saattavat aiheuttaa ihoärsytystä eikä niitä pidä käyttää.
- Pese kätesi.
- Saatat havaita lievää punoitusta iholla, josta depotlaastari on poistettu. Tämän punoituksen tulisi hävitä ajan mittaan. Jos se ei häviä, kerro siitä lääkärillesi.
Jos depotlaastari irtoaa
Jos depotlaastari alkaa irrota, sama depotlaastari voidaan kiinnittää samalle ihoalueelle. Käytä tarpeen mukaan sidoksia tai lääketeippiä depotlaastarin paikoillaan pysymiseksi. Jos depotlaastari katoaa tai vaurioituu, mene takaisin lääkäriin.
Jos käytät enemmän SANCUSOa kuin sinun pitäisi
Jos käytät enemmän SANCUSOa kuin sinun pitäisi, poista yksinkertaisesti ylimääräiset depotlaastarit ja ota yhteys lääkäriisi.
Jos unohdat käyttää SANCUSOa
On tärkeätä että käytät tätä lääkettä lääkärisi ohjeiden mukaisesti, jotta ehkäiset solunsalpaajahoitoasi seuraavaa huonovointisuutta tai oksentelua. Jos olet unohtanut kiinnittää depotlaastarisi oikeaan aikaan, kiinnitä se niin pian kuin muistat ja kerro siitä lääkärillesi mahdollisimman pian ennen solunsalpaajahoitoasi.
Jos lopetat SANCUSOn käyttämisen
On tärkeätä, että käytät tätä lääkettä koko solunsalpaajahoitosi ajan (enintään 7 päivää) pahoinvointisi tai solunsalpaajahoidon jälkeisen pahoinvoinnin ehkäisemiseksi. Keskustele lääkärin kanssa, jos haluat poistaa depotlaastarin ennen solunsalpaajahoitokuurisi päättymistä (enintään 7 päivää).
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Jos sinulle parhaillaan annetaan kohtalaisesti tai voimakkaasti pahoinvointia aiheuttavaa solunsalpaajahoitoa, saatat silti - voida pahoin -ehkäisevästä lääkehoidosta huolimatta, tämä lääke mukaan lukien.
Kerro lääkärille välittömästi, jos sinulle kehittyy ummetusta tai jos mahasi kipeytyy ja siinä on turvotusta. Ummetus on yleinen haittavaikutus ja sitä saattaa esiintyä korkeintaan yhdellä henkilöllä 10:stä.
Poista depotlaastari ja kerro lääkärillesi, jos havaitset:
- niin kutsutun serotoniinioireyhtymän merkkejä ja oireita, jotka voivat olla vakavia ja joissakin tapauksissa henkeä uhkaavia. Niitä saattavat olla verenpaineen muutokset (jotka saattavat aiheuttaa huimausta tai päänsärkyä), nopea sydämensyke, näön hämärtyminen (joka saattaa johtua silmän mustuaisen laajentumisesta), hikoilu, ulostustarpeen tihentyminen tai suolistoäänien lisääntyminen, vilunväristykset, vapina, lihasten nykiminen ja heijasteiden (refleksien) vilkastuminen. Myös kuumetta tai korkeaa kuumetta, kiihtyneisyyttä tai sekavuutta, lihasjäykkyyttä ja puheen nopeutumista saattaa esiintyä. Serotoniinioireyhtymän yleisyyttä ei tunneta (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
- vakavan ihoreaktion (jos ihosi on hyvin punainen, kutiava tai jos havaitset mitä tahansa rakkuloita). Kiinnityskohdassa esiintyvät ihoreaktiot, kuten ärsytys, kutina tai punoitus, ovat melko harvinaisia ja niitä saattaa esiintyä korkeintaan yhdellä henkilöllä 100:sta.
Muut mahdolliset haittavaikutukset:
Melko harvinaisia haittavaikutuksia ovat:
- päänsärky, pyörrytyksen tunne jopa paikallaan seistessä (vertigo)
- ruokahalun vähentyminen, painon lasku
- punastuminen (tai punoitus)
- oksentelu (pahoinvointi), yökkäily, suun kuivuminen
- nivelkipu
- nesteen kertymisen aiheuttama turvotus (ödeema)
- maksakokeiden tulosten muutoksia (jos sinulle tehdään verikokeita, kerro lääkärille tai sairaanhoitajalle, että sinulle on annettu SANCUSOa).
Harvinaisia haittavaikutuksia (saattaa esiintyä korkeintaan yhdellä henkilöllä 1 000:sta) ovat:
- epänormaalit lihasliikkeet (esim. vapina, lihasjäykkyys ja lihassupistukset).
Haittavaikutuksia, joiden yleisyyttä ei tiedetä (koska saatavissa oleva tieto ei riitä arviointiin):
- allergiset ihoreaktiot, joiden merkkejä saattavat olla punaiset, koholla olevat, kutiavat kuhmut.
Muita granisetronivalmisteisiin liittyviä mahdollisia haittavaikutuksia (joiden esiintymistiheys on tuntematon):
- Allergiset reaktiot, mukaan lukien urtikaria (kutiseva, punainen, koholla oleva ihottuma) ja anafylaksi (vakava allerginen reaktio, johon saattaa liittyä äkillistä hengityksen pihinää, hengitysvaikeuksia, silmäluomien, kasvojen tai huulten turvotusta, ihotumaa tai kutinaa)
- Univaikeudet/unihäiriöt
- Liiallinen uneliaisuus
- EKG:ssä (sydänfilmi) havaittava pitkittynyt QT-väli (sydämen lyöntinopeuden aiheuttamat - muutokset -sydänfilmissä joka on merkki sydämen rytmihäiriöstä)
- Ummetus
- Ripuli
- Energisyyden puute / heikkous / voimattomuus
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän (‘EXP’) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää. Säilytä alkuperäisessä pakkauksessa. Herkkä valolle.
Käytetyt depotlaastarit sisältävät vielä vaikuttavia aineita, jotka saattavat olla haitallisia muille. Taita käytetty depotlaastari keskeltä kiinnityspuoli sisäänpäin ja hävitä turvallisesti, pois lasten ulottuvilta. Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä SANCUSO sisältää
- Vaikuttava aine on granisetroni. Yksi 52 cm2 depotlaastari sisältää 34,3 mg granisetronia, josta
vapautuu 3,1 mg granisetronia 24 tunnissa.
- Muut aineet ovat:
- Depotlaastarin kiinnitysaine: akrylaattivinyyliasetaatti-kopolymeeri
- Taustakerros: polyesteri
- Kova muovikalvo: silikonisoitu polyesteri
Lääkevalmisteen kuvaus ja pakkauskoko
SANCUSO on ohut, läpinäkyvä, suorakaiteen muotoinen depotlaastari, jonka kulmat on pyöristetty, se on kiinnitetty kovaan muovikalvoon. Depotlaastari on pussin sisällä. Jokainen rasia sisältää yhden depotlaastarin.
Myyntiluvan haltija ja valmistaja
Myyntiluvan haltija
Grünenthal GmbH
Zieglerstraße 6
52078 Aachen
Saksa
Valmistaja
Pharbil Waltrop GmbH (a subsidiary of NextPharma)
Im Wirrigen 25
45731 Waltrop
Saksa
Tämä pakkausseloste on tarkistettu viimeksi 11/2024
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta http://www.ema.europa.eu/.