Pakkausseloste
GALAFOLD kapsel, hård 123 mg
Tilläggsinformation
Galafold 123 mg hårda kapslar
migalastat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor, vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Galafold är och vad det används för
- Vad du behöver veta innan du tar Galafold
- Hur du tar Galafold
- Eventuella biverkningar
- Hur Galafold ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Galafold innehåller den aktiva substansen migalastat.
Detta läkemedel används vid långtidsbehandling av Fabrys sjukdom hos vuxna och ungdomar som är 12 år eller äldre som har vissa genetiska mutationer (förändringar).
Fabrys sjukdom orsakas av en brist på eller ett felaktigt enzym som kallas alfa-galaktosidas A (α-Gal A). Beroende på typen av mutation (förändring) i genen som producerar α-Gal A, fungerar inte enzymet som det ska eller saknas fullständigt. Denna enzymdefekt leder till onormala inlagringar av en fettsubstans som kallas globotriaosylceramid (GL-3) i njurarna, hjärtat och andra organ, vilket orsakar symtomen på Fabrys sjukdom.
Detta läkemedel verkar genom att stabilisera enzymet som din kropp naturligt producerar, så att det på ett bättre sätt kan minska mängden GL-3 som har ansamlats i dina celler och vävnader.
Vad du behöver veta innan produkten används
Ta inte Galafold
- om du är allergisk mot migalastat eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
123 mg migalaslat kapslar ska inte ges till barn (över 12 år) som väger mindre än 45 kg.
Tala med läkare innan du tar Galafold om du just nu genomgår enzymersättningsbehandling.
Du ska inte ta Galafold om du också får enzymersättningsbehandling.
Medan du tar Galafold kommer din läkare var 6:e månad att övervaka ditt tillstånd och kontrollera om läkemedlet verkar. Om ditt tillstånd försämras kan läkaren utvärdera dig vidare eller avbryta din behandling med Galafold.
Tala med läkare innan du tar Galafold om du har kraftigt nedsatt njurfunktion eftersom Galafold inte rekommenderas till patienter med kraftig njurfunktionsförsämring (GFR mindre än 30 ml/min/1,73 m2).
Barn
Barn under 12 år
Detta läkemedel har inte studerats på barn under 12 år; därför har inte säkerhet och effekt fastställts för denna åldersgrupp.
Andra läkemedel och Galafold
Tala om för läkare, apotekspersonal eller sjuksköterska om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel. Detta gäller även receptfria läkemedel, inklusive kosttillskott och växtbaserade läkemedel.
Tala i synnerhet om för din läkare om du tar läkemedel eller kosttillskott som innehåller koffein då dessa kan inverka på Galafolds effekt om de tas under en fasteperiod.
Notera vilka läkemedel du tar. För en förteckning över dem och visa den för din läkare eller apotekspersonal varje gång du tar ett nytt läkemedel.
Graviditet, amning och fertilitet
Graviditet
Det finns mycket begränsad erfarenhet av användningen av detta läkemedel hos gravida kvinnor. Galafold rekommenderas inte under graviditet. Om du är gravid, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel.
Kvinnor i fertil ålder som använderGalafold ska använda en säker preventivmetod.
Amning
Om du ammar, ta inte detta läkemedel förrän du har talat med läkare, apotekspersonal eller sjuksköterska. Det är inte känt om detta läkemedel passerar över i bröstmjölken. Din läkare kommer att besluta om du måste sluta amma eller tillfälligt sluta ta ditt läkemedel efter att ha tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för modern.
Fertilitet hos män
Det är inte känt om detta läkemedel påverkar fertiliteten hos män. Effekterna av Galafold på fertiliteten hos människor har inte undersökts.
Fertilitet hos kvinnor
Det är inte känt om detta läkemedel påverkar fertiliteten hos kvinnor.
Om du planerar att skaffa barn, rådfråga läkare, apotekspersonal eller sjuksköterska.
Körförmåga och användning av maskiner
Det är osannolikt att detta läkemedel påverkar din förmåga att framföra fordon eller använda maskiner.
Hur produkten används
Ta alltid detta läkemedel enligt läkarens, apotekspersonalens eller sjuksköterskans anvisningar. Rådfråga läkare, apotekspersonal eller sjuksköterska om du är osäker.
Ta en kapsel en gång varannan dag vid samma tid på dagen. Ta inte Galafold två dagar i sträck.
Ät inte mat och drick inte koffein minst 2 timmar före och 2 timmar efter att du har tagit en dos. En fasteperiod på minst 4 timmar behövs för att läkemedlet ska tas upp fullständigt i din kropp.
Vatten (vanligt, smaksatt eller sötad), fruktjuicer utan fruktkött och koffeinfria kolsyrade drycker kan konsumeras under den fyra timmar långa fastan.
Svälj kapseln hel. Du får inte dela, krossa eller tugga kapseln.
|
Figur A |
Steg 1: Avlägsna förseglingen på locket. |
|
Figur B - Öppnad kartong |
Steg 2: Tryck och fortsätt hålla ner den lila fliken med din tumme på vänster sida av kartongen (se figur B) och fortsätt till steg 3. |
|
Figur C |
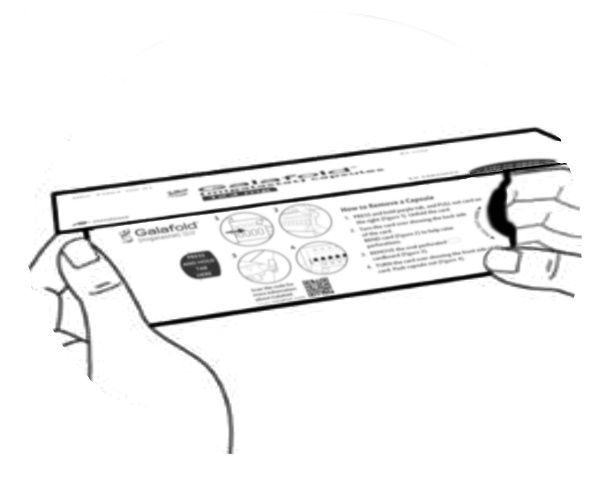
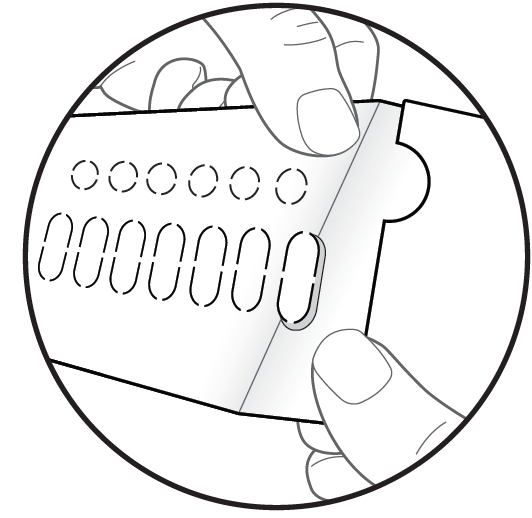
Steg 3: TA TAG i fliken på höger sida där det står ”DRA HÄR” och dra ut det vikta blisterkortet (se figur C). |
|
Figur D – Blisterkortets framsida |
Steg 4: Vik ut blisterkortet (se figur D). |
|
Ta en Galafold-kapsel:
|
|
|
Figur F – Blisterkortets framsida |
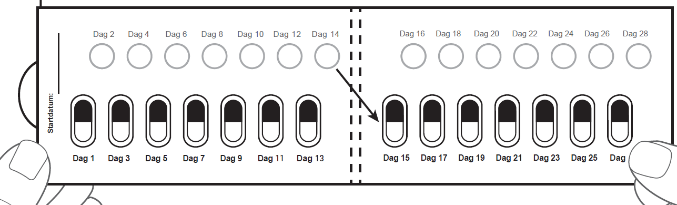
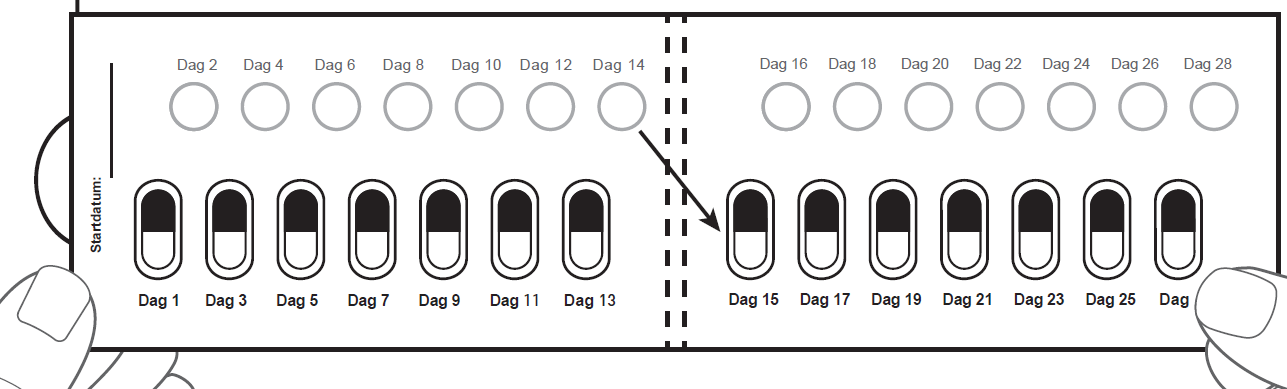
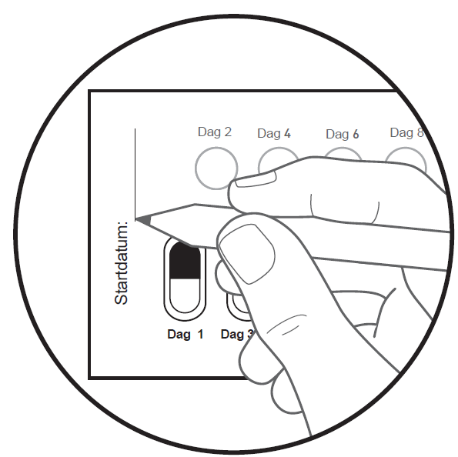
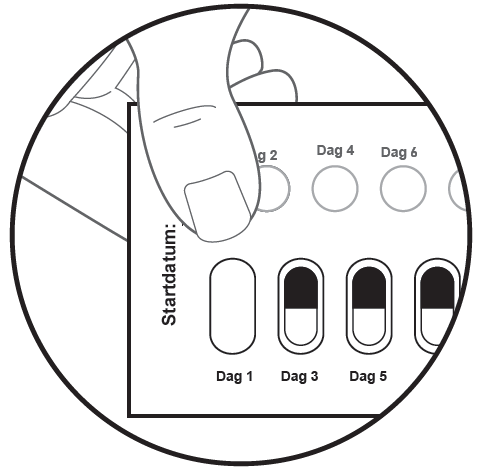
Steg 5: Skriv ner datumet på blisterkortet den första dagen du tar detta läkemedel från ett nytt blisterkort (se figur F). |
|
Figur G – Blisterkortets baksida |
Steg 6: VÄND PÅ kortet så att baksidan visas. |
|
Figur H – Blisterkortets baksida |
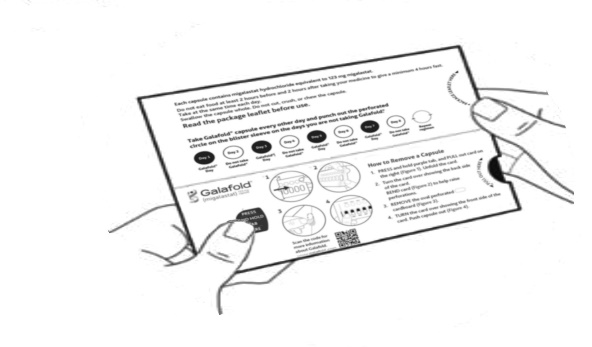
Steg 7: AVLÄGSNA kartongen med oval |
|
Figur I – Blisterkortets framsida |
Steg 8: VÄND PÅ kortet så att framsidan visas.
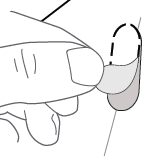
TRYCK ut kapseln (se figur I). |
|
Figur J – Blisterkortets framsida |
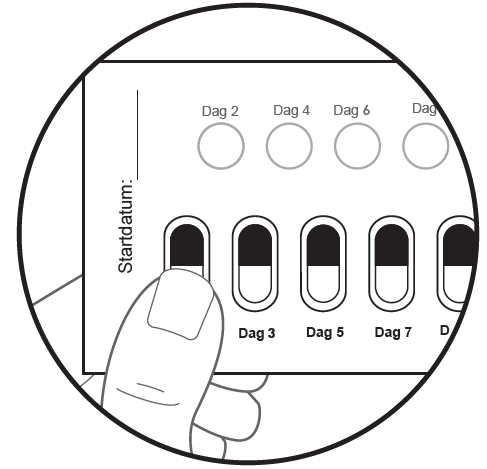
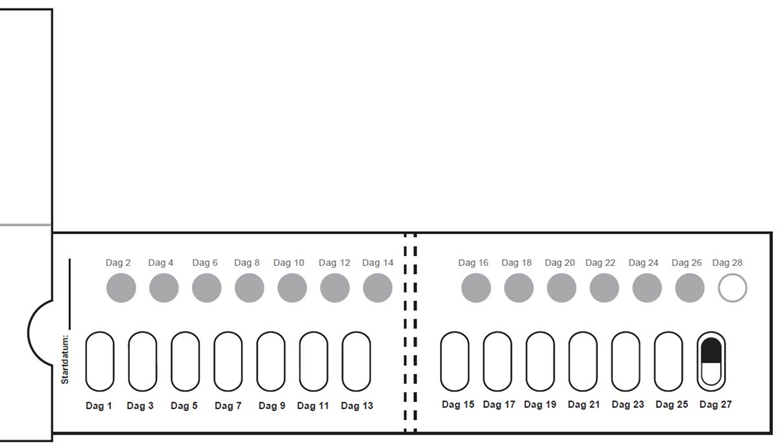
Steg 9: Tryck nästa dag ut den perforerade vita kartongcirkeln som är märkt Dag 2 på översta raden. |
|
Efter Dag 2 ska du fortsätta till Dag 3 på blisterkortet.
|
|
Om du har tagit för stor mängd av Galafold
Om du har tagit för många kapslar ska du sluta ta läkemedlet och kontakta läkare. Du kan få huvudvärk och känna dig yr.
Om du har glömt att ta Galafold
Om du har glömt att ta din kapsel vid den vanliga tiden men kommer ihåg den senare kan du ta kapseln endast om det inte gått längre tid än 12 timmar efter tidpunkten då kapseln skulle ha tagits. Om det har gått längre tid än 12 timmar, ska du fortsätta att ta Galafold den dag och tidpunkt som anges för nästa planerade dos enligt doseringsschemat. Ta inte två kapslar för att kompensera för glömd dos.
Om du slutar att ta Galafold
Sluta inte att ta detta läkemedel utan att först ha talat med din läkare.
Om du har ytterligare frågor om användningen av detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Mycket vanliga: kan förekomma hos fler än 1 av 10 personer
- Huvudvärk
Vanliga: kan förekomma hos upp till 1 av 10 personer
|
|
|
Mindre vanliga: kan påverka upp till 1 av 100 personer
Plötslig svullnad på huden eller slemhinna (t.ex. läpp, tunga, ögon osv) eller både och (angioödem)
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och blisterförpackningen efter ”EXP”. Utgångsdatumet är den sista dagen i angiven månad.
Inga särskilda temperaturanvisningar. Förvaras i originalförpackningen för att skydda produkten från fukt.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är migalastat. Varje kapsel innehåller migalastat-hydroklorid motsvarande 123 mg migalastat.
- Övriga innehållsämnen är:
Kapselinnehåll: Pregelatiniserad stärkelse (majs) och magnesiumstearat
Kapselskal: Gelatin, titandioxid (E171) och indigokarmin (E132)
Tryckfärg: Shellack, svart järnoxid och kaliumhydroxid
Läkemedlets utseende och förpackningsstorlekar
Opaka, blåa och vita hårda kapslar, märkta med ”A1001” i svart färg, storlek 2 hård kapsel (6,4 x 18,0 mm) innehållande vitt till ljusbrunt pulver.
Galafold finns i en blisterförpackning som innehåller 14 kapslar.
Innehavare av godkännande för försäljning
Amicus Therapeutics Europe Limited
Block 1, Blanchardstown Corporate Park
Ballycoolin Road
Blanchardstown, Dublin
D15 AKK1
Irland
Tfn: +353 (0) 1 588 0836
Fax: +353 (0) 1 588 6851
e-post: info@amicusrx.co.uk
Tillverkare
Almac Pharma Services (Ireland) Limited
Finnabair Industrial Estate
Dundalk, Co. Louth
A91 P9KD
Irland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel (om du inte kan nå Amicus-representanten via telefon, använd e-postadresserna som anges nedan):
| België/Belgique/Belgien Amicus Therapeutics Europe Limited Tél/Tel: (+32) 0800 89172 e-mail: MedInfo@amicusrx.com | Lietuva Amicus Therapeutics Europe Limited Tel: (+370) 8800 33167 El. paštas: MedInfo@amicusrx.com |
| България Amicus Therapeutics Europe Limited Teл.: (+359) 00800 111 3214 имейл: MedInfo@amicusrx.com | Luxembourg/Luxemburg Amicus Therapeutics Europe Limited Tél/Tel: (+352) 800 27003 e-mail: MedInfo@amicusrx.com |
| Česká republika Amicus Therapeutics Europe Limited Tel.: (+420) 800 142 207 e-mail: MedInfo@amicusrx.com | Magyarország Amicus Therapeutics Europe Limited Tel.: (+36) 06 800 21202 e-mail: MedInfo@amicusrx.com |
| Danmark Amicus Therapeutics Europe Limited Tlf.: (+45) 80 253 262 e-mail: MedInfo@amicusrx.com | Malta Amicus Therapeutics Europe Limited Tel: (+356) (800 62674 e-mail: MedInfo@amicusrx.com |
| Deutschland Amicus Therapeutics GmbH Tel.: (+49) 0800 000 2038 E-Mail: MedInfo@amicusrx.com | Nederland Amicus Therapeutics BV Tel: (+31) 0800 022 8399 e-mail: MedInfo@amicusrx.com |
| Eesti Amicus Therapeutics Europe Limited Tel: (+372) 800 0111 911 e-post: MedInfo@amicusrx.com | Norge Amicus Therapeutics Europe Limited Tlf: (+47) 800 13837 e-post: MedInfo@amicusrx.com |
| Ελλάδα Amicus Therapeutics Europe Limited Τηλ.: (+30) 00800 126 169 e-mail: MedInfo@amicusrx.com | Österreich Amicus Therapeutics Europe Limited Tel: (+43) 0800 909 639 E-Mail: MedInfo@amicusrx.com |
| España Amicus Therapeutics S.L.U. Tel: (+34) 900 941 616 e-mail: MedInfo@amicusrx.com | Polska Amicus Therapeutics Europe Limited Tel.: (+48) 0080 012 15475 e-mail: MedInfo@amicusrx.com |
| France Amicus Therapeutics SAS Tél: (+33) 0 800 906 788 e-mail: MedInfo@amicusrx.com | Portugal Amicus Therapeutics Europe Limited Tel: (+351) 800 812 531 e-mail: MedInfo@amicusrx.com |
| Hrvatska Amicus Therapeutics Europe Limited Tel: (+385) 0800 222 452 e-pošta: MedInfo@amicusrx.com | România Amicus Therapeutics Europe Limited Tel.: (+40) 800 476 561 e-mail: MedInfo@amicusrx.com |
| Irland Amicus Therapeutics Europe Limited Tel: (+353) 1800 936 230 e-mail: MedInfo@amicusrx.com | Slovenija Amicus Therapeutics Europe Limited Tel.: (+386) 0800 81794 e-pošta: MedInfo@amicusrx.com |
| Ísland Amicus Therapeutics Europe Limited Sími: (+354) 800 7634 Netfang: MedInfo@amicusrx.com | Slovenská republika Amicus Therapeutics Europe Limited Tel.: (+421) 0800 002 437 e-mail: MedInfo@amicusrx.com |
| Italia Amicus Therapeutics S.r.l. Tel: (+39) 800 795 572 e-mail: MedInfo@amicusrx.com | Suomi/Finland Amicus Therapeutics Europe Limited Puh/Tel: (+358) 0800 917 780 sähköposti/e-mail: MedInfo@amicusrx.com |
| Κύπρος Amicus Therapeutics Europe Limited Τηλ.: (+357) 800 97595 e-mail: MedInfo@amicusrx.com | Sverige Amicus Therapeutics Europe Limited Tfn: (+46) 020 795 493 e-post: MedInfo@amicusrx.com |
| Latvija Amicus Therapeutics Europe Limited Tel.: (+371) 800 05391 e-pasts: MedInfo@amicusrx.com |
Denna bipacksedel ändrades senast 22.08.2025
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu. Där finns också länkar till andra webbplatser rörande sällsynta sjukdomar och behandlingar.