Pakkausseloste
RIASTAP pulver till injektion/infusionvätska, lösning 1 g
Tilläggsinformation
Riastap 1 g
Pulver till injektions-/infusionsvätska, lösning
humant fibrinogen
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Riastap är och vad det används för
- Vad du behöver veta innan du använder Riastap
- Hur du använder Riastap
- Eventuella biverkningar
- Hur Riastap ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad är Riastap?
Riastap innehåller humant fibrinogen som är ett protein som är viktigt för att blodet ska levra sig (koagulera). Brist på fibrinogen gör så att blodet inte koagulerar så snabbt som det borde, vilket resulterar i en ökad tendens för blödningar. Genom att ersätta humant fibrinogen med Riastap kan man rätta till koaguleringsrubbningen.
Vad används Riastap för?
Riastap används för att behandla blödningar hos patienter som har en medfödd brist på fibrinogen (hypo- eller afibrinogenemi) med ökad blödningsrisk.
Vad du behöver veta innan produkten används
Följande avsnitt innehåller information som din läkare ska beakta innan du får Riastap.
Använd inte Riastap:
- om du är allergisk mot humant fibrinogen eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Informera din läkare om du är allergisk mot något läkemedel eller mot någon mat.
Varningar och försiktighet:
- om du har fått allergiska reaktioner av Riastap tidigare. Om din läkare råder dig bör du ta antihistaminer och kortikosteroider i förebyggande syfte.
- vid allergisk eller anafylaktisk reaktion (en allvarlig allergisk reaktion som medför stora svårigheter att andas eller yrsel). Användningen av Riastap ska genast avbrytas (det vill säga avbryta infusionen).
- eftersom det finns en ökad risk för blodproppar (trombos), framförallt:
- vid höga doser eller vid upprepad dosering
- om du har haft en hjärtattack (tidigare haft hjärtsjukdom eller hjärtinfarkt)
- om du har någon leversjukdom
- om du just genomgått en operation (postoperativ patient)
- om du snart kommer att opereras (preoperativ patient)
- hos nyfödda barn
- om du har större risk än normalt att drabbas av blodproppar (patienter med risk för tromboemboliskt fenomen eller disseminerad intravaskulär koagulering).
Din läkare kommer att noggrant överväga nyttan med behandling med Riastap jämfört med risken för ovanstående komplikationer.
Virussäkerhet
När läkemedel framställs ur humant blod eller plasma vidtas speciella åtgärder för att förhindra att infektioner överförs till patienter. Detta inkluderar:
- ett noggrant urval av blod- och plasmagivare för att säkerställa att personer med risk för att vara smittbärare utesluts, samt
- test av enskilda donationer och plasmapooler för tecken på virus/infektion.
Tillverkare av dessa produkter inkluderar dessutom steg i hanteringen av blod och plasma som kan inaktivera eller avskilja eventuella virus. Trots detta kan risken för överföring av infektion inte helt uteslutas när läkemedel framställda ur humant blod eller plasma ges. Detta gäller även okända eller nya virus och andra typer av infektioner.
De åtgärder som vidtas anses effektiva mot höljeförsedda virus såsom humant immunbristvirus (HIV som orsakar AIDS), hepatit B- och hepatit C-virus (inflammation i levern) och mot icke-höljeförsedda virus såsom hepatit A (inflammation i levern) och parvovirus B19.
Din läkare kan komma att föreslå vaccination mot hepatit A och B om du regelbundet/upprepat behandlas med humana plasmaderiverade preparat.
Det rekommenderas starkt att datum för administrering, batchnummer och injicerad volym registreras varje gång du får Riastap.
Andra läkemedel och Riastap
- Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
- Riastap ska inte blandas med andra läkemedel förutom de som nämns i avsnittet ”Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal” under ”Beredning”.
Graviditet och amning
- Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
- Riastap ska endast ges under graviditet och amning om din läkare bedömer att det behövs.
Körförmåga och användning av maskiner
Riastap har ingen eller försumbar påverkan på din körförmåga eller förmåga att använda maskiner.
Riastap innehåller natrium
Riastap innehåller upp till 164 mg natrium (7,1 mmol) per injektionsflaska vilket motsvarar 11,5 mg (0,5 mmol) natrium per kg kroppsvikt om den rekommenderade startdosen på 70 mg/kg kroppsvikt används. Detta bör beaktas om du ordinerats saltfattig kost.
Hur produkten används
Behandlingen ska påbörjas och övervakas av läkare med erfarenhet av den här typen av behandling.
Dosering
Mängden humant fibrinogen som du behöver och hur länge du ska behandlas beror på:
- hur svår din sjukdom är
- var blödningen uppstått och hur svår den är
- ditt allmänna tillstånd.
Om du har använt för stor mängd av Riastap
Din läkare bör regelbundet kontrollera din koaguleringsstatus under behandlingens gång. Vid eventuell överdosering förhöjs risken för att utveckla tromboemboliska komplikationer.
Om du använt mer Riastap än föreskrivet eller om ett barn av misstag har fått i sig av läkemedlet ska du kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 0800 147 111) för bedömning av risken samt rådgivning.
Administreringssätt
Om du har ytterligare frågor angående användningen av denna produkt, fråga din läkare eller apotekspersonal (se avsnitt ”Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal”).
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Kontakta din läkare omedelbart:
- om någon av biverkningarna uppstår
- om du märker några biverkningar som inte nämns i denna information.
Följande biverkning har observerats i mycket vanliga fall (kan förekomma hos fler än 1 av 10 användare):
- Förhöjd kroppstemperatur
Följande biverkning har observerats i mindre vanliga fall (kan förekomma hos upp till 1 av 100 användare):
- Plötslig allergisk reaktion (såsom rodnad av huden, hudutslag över hela kroppen, blodtrycksfall, andningssvårigheter).
Följande biverkning har observerats i vanliga fall (kan förekomma hos upp till 1 av 10 användare, incidenten var dock högre hos patienter som fått fibrinogen):
- Ökad risk för bildning av blodproppar (se avsnitt Vad du behöver veta innan produkten används ”Vad du behöver veta innan du använder Riastap”).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
- Förvara detta läkemedel utom syn- och räckhåll för barn.
- Används före utgångsdatum som anges på etiketten och kartongen.
- Förvaras vid högst 25 °C.
- Får ej frysas.
- Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
- Den färdigberedda lösningen bör användas omedelbart.
- Om den färdigberedda lösningen inte används omedelbart ska den förvaras i rumstemperatur (högst 25 °C) och lösningen måste användas inom 8 timmar.
- Den färdigberedda lösningen ska inte förvaras i kylskåp.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är:
Humant fibrinogen (1 g/injektionsflaska; efter beredning med 50 ml vatten för injektionsvätskor cirka 20 mg/ml).
Se avsnitt ”Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal” för ytterligare information.
Övriga innehållsämnen är:
Humant albumin, natriumklorid, L-argininhydroklorid, natriumcitrat, natriumhydroxid (för pH-justering).
Se sista paragrafen i avsnitt Vad du behöver veta innan produkten används. ”Riastap innehåller natrium”.
Läkemedlets utseende och förpackningsstorlekar
Riastap är ett vitt pulver.
Efter beredning med vatten för injektionsvätskor ska lösningen vara klar eller lätt opalescent, det vill säga lösningen kan glänsa när den hålls mot ljuset men den ska inte innehålla några synliga partiklar.
Förpackning
En förpackning med 1 g innehåller (figur 1):
1. En injektionsflaska som innehåller 1 g humant fibrinogen
2. Filter: Pall® sprutfilter
3. Uppdragningsspike: Mini-Spike® uppdragningsspike
 Figur 1
Figur 1
Innehavare av godkännande för försäljning och tillverkare:
CSL Behring GmbH, Emil-von-Behring-Strasse 76, 35041 Marburg, Tyskland
Ytterligare upplysningar om detta läkemedel kan erhållas av ombudet för innehavaren av godkännande för försäljning:
CSL Behring AB, Box 712, 182 17 Danderyd, Sverige
| Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen: | |
| Riastap 1 g powder for solution for injection/infusion | Storbritannien |
| Riastap 1 g, poudre pour solution injectable/perfusion | Frankrike |
| Riastap 1 g prašek za raztopino za injiciranje ali infundiranje | Slovenien |
| Riastap 1 g | Tyskland, Irland |
| Riastap | Belgien, Cypern, Danmark, Finland, Grekland, Island, Italien, Luxemburg, Malta, Norge, Polen, Slovakien, Spanien, Sverige |
Denna bipacksedel ändrades senast 29.10.2024
Direktiv för experterna inom hälsovården
Dosering
För att kunna beräkna den individuella dosen bör man fastställa den funktionella fibrinogennivån, medan mängden och administreringsfrekvensen bör bestämmas utifrån den individuella patienten genom regelbundna mätningar av fibrogennivåerna i plasma och kontinuerlig bevakning av patientens kliniska status, samt utifrån andra ersättningsbehandlingar som använts.
De normala fibrinogennivåerna i plasma ligger inom intervallet 1,5–4,5 g/l. Den kritiska fibrinogennivån i plasma, under vilken blödningar kan uppstå, är cirka 0,5–1,0 g/l. Vid behov av ett större kirurgiskt ingrepp är det av yttersta vikt att göra en exakt övervakning av ersättningsbehandlingen genom koagulationsprov.
Initial dos
Om patientens fibrinogennivå är okänd rekommenderas en intravenös dos om 70 mg per kg kroppsvikt.
Påföljande dos
Målnivån (1 g/l) för mindre händelser (t.ex. näsblod, blödning i muskeln eller riklig menstruation) ska vidhållas i åtminstone tre dagar. Målnivån (1,5 g/l) för större händelser (t.ex. huvudskador eller blödningar i hjärnan) ska vidhållas i sju dagar.
| Dos fibrinogen (mg/kg kroppsvikt) | = | [målnivå (g/l) – uppmätt nivå (g/l)] 0,017 (g/l per mg/kg kroppsvikt) |
Dos för nyfödda, spädbarn och barn
Begränsade data från kliniska studier för dosering av Riastap hos barn finns. Baserat på dessa studier, såväl som på långvarig klinisk erfarenhet med fibrinogenprodukter är dosrekommendationerna för behandling av barn desamma som för vuxna.
Administreringssätt
Allmänna instruktioner
- Beredning och uppdragning från injektionsflaskan måste utföras under aseptiska förhållanden.
- Den färdigberedda lösningen ska granskas visuellt med avseende på synliga partiklar och missfärgning före administrering.
- Lösningen ska vara nästan färglös till gulaktig, klar eller lätt opalescent med neutralt pH. Använd inte lösningar som är grumliga eller innehåller fällningar.
Beredning
- Utan att öppna injektionsflaskorna, värm både pulver och spädningsvätska till rums- eller kroppstemperatur (ej över 37 °C).
- Riastap ska beredas med vatten för injektionsvätskor (50 ml, ej inkluderad i förpackningen).
- Tvätta händerna eller använd handskar vid beredning av produkten.
- Ta bort kapsylen från Riastap-flaskan för att frigöra den centrala delen av injektionsproppen.
- Rengör ytan på gummiproppen med en antiseptisk lösning och låt torka.
- För över spädningsvätskan till injektionsflaskan med hjälp av ett lämpligt överföringsset. Se till att pulvret blir genomfuktat.
- Snurra försiktigt flaskan till dess att pulvret löst upp sig och lösningen är färdig för administrering. Undvik kraftiga skakningar eftersom det kan orsaka skumbildning. Vanligtvis löses pulvret upp inom cirka 5 minuter. Det bör inte ta längre än 15 minuter för pulvret att helt lösas upp.
- Öppna plastblistret innehållande uppdragningsspiken (Mini-Spike® uppdragningsspike), som tillhandahålls med Riastap (figur 2).
 Figur 2
Figur 2
- Ta den medföljande uppdragningsspiken och för in den i proppen på injektionsflaskan, med den färdigberedda produkten (figur 3).
 Figur 3
Figur 3
- När uppdragningsspiken har förts in i proppen, tas locket bort. Efter att locket är borttaget får inte den exponerade ytan vidröras.
- Öppna blistret med filtret (Pall® sprutfilter) som tillhandahålls med Riastap (figur 4).
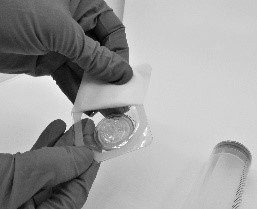 Figur 4
Figur 4
- Skruva fast sprutan på filtret (figur 5).
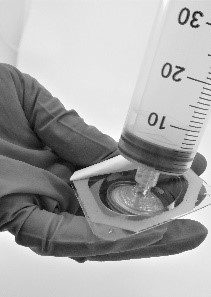 Figur 5
Figur 5
- Skruva fast sprutan med monterat filter på uppdragningsspiken (figur 6).
 Figur 6
Figur 6
- Dra upp den färdigberedda produkten i sprutan (figur 7).
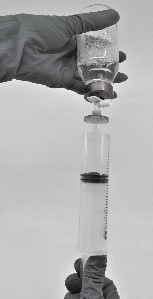 Figur 7
Figur 7
- När detta genomförts tas filtret, uppdragningsspiken och den tomma injektionsflaskan bort från sprutan, och kasseras enligt gällande anvisningar. Administreringen fortsätter därefter som vanligt.
- Färdigberedd lösning bör administreras omedelbart genom en separat injektions-/infusionsslang.
- Se till att inget blod kommer in i de fyllda injektionssprutorna.
Ej använt läkemedel och avfall skall hanteras enligt lokala riktlinjer.
Administrering
Ett standardset för infusion bör användas för intravenös administrering av den färdigberedda, rumstempererade lösningen. Den färdigberedda lösningen ska ges genom långsam injektion eller infusion med en hastighet som patienten upplever som behaglig. Injektions- eller infusionshastigheten bör inte överskrida cirka 5 ml per minut.