Pakkausseloste
RIASTAP injektio/infuusiokuiva-aine, liuosta varten 1 g
Riastap 1 g
Injektio-/infuusiokuiva-aine, liuosta varten
ihmisen fibrinogeeni
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Riastap on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Riastap-valmistetta
- Miten Riastap-valmistetta käytetään
- Mahdolliset haittavaikutukset
- Riastap-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Riastap on?
Riastap sisältää ihmisen fibrinogeenia, joka on veren hyytymisen kannalta tärkeä proteiini (valkuaisaine). Fibrinogeenin puutos tarkoittaa, ettei veri hyydy niin nopeasti kuin sen pitäisi, mistä seuraa suurentunut verenvuototaipumus. Ihmisen fibrinogeenin korvaushoito Riastap-valmisteella korjaa hyytymishäiriötä.
Mihin Riastap-valmistetta käytetään?
Riastap-valmistetta käytetään verenvuotojen hoitoon potilailla, joilla on synnynnäinen fibrinogeenipuutos (hypo- tai afibrinogenemia), johon liittyy vuototaipumus.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Seuraavat kohdat sisältävät tietoja, jotka lääkärin on otettava huomioon ennen kuin hän antaa sinulle Riastap-valmistetta.
Älä käytä Riastap-valmistetta:
- jos olet allerginen ihmisen fibrinogeenille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Kerro lääkärille, jos olet allerginen jollekin lääkkeelle tai ruoka-aineelle.
Varoitukset ja varotoimet:
- jos sinulla on aiemmin esiintynyt allergisia reaktioita Riastap-valmisteelle. Ota estohoitoon antihistamiinia ja kortisonia, jos lääkäri niin kehottaa.
- kun allergisia tai anafylaksian kaltaisia reaktioita (vakava allerginen reaktio, josta aiheutuu vaikeita hengitysvaikeuksia tai huimausta) ilmaantuu. Riastap-valmisteen antaminen on lopetettava heti (lopettamalla pistoksen antaminen).
- koska verisuoniin muodostuvien verihyytymien (veritulpan) vaara suurenee etenkin:
- jos käytät suuria tai toistuvia annoksia
- jos sinulla on ollut sydänkohtaus (sinulla on ollut sepelvaltimotauti tai sydäninfarkti)
- jos sinulla on maksasairaus
- jos sinulle on äskettäin tehty leikkaus (postoperatiiviset potilaat)
- jos olet pian menossa leikkaukseen (preoperatiiviset potilaat)
- vastasyntyneillä vauvoilla
- jos sinulle kehittyy tavanomaista todennäköisemmin veritulppia (potilaat, joilla on tromboembolisten tapahtumien tai DIC-oireyhtymän eli yleistyneen suonensisäisen hyytymisen vaara).
Lääkäri arvioi Riastap-hoidon hyödyt tarkoin näiden komplikaatioiden vaaraan nähden.
Virusturvallisuus
Kun lääkkeitä valmistetaan ihmisen verestä tai plasmasta, käytössä on menetelmiä, joilla estetään infektioiden siirtyminen potilaaseen. Tällaisia menetelmiä ovat:
- veren- ja plasmanluovuttajien tarkka valinta, millä varmistetaan, etteivät luovuttajat ole mahdollisia taudinkantajia ja
- virusten ja infektioiden seulominen jokaisesta luovutuserästä ja plasmapoolista.
Valmistajat ovat sisällyttäneet valmistusprosessiin myös virusten inaktivointi- tai poistomenetelmät. Varotoimista huolimatta infektioiden siirtymismahdollisuutta ei voida täydellisesti sulkea pois, kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkkeitä. Tämä koskee myös tuntemattomia ja uusia viruksia ja muita taudinaiheuttajia.
Käytettyjen menetelmien katsotaan olevan tehokkaita sellaisia vaipallisia viruksia vastaan kuin ihmisen immuunikatovirus (HIV eli AIDS-virus), hepatiitti B ja hepatiitti C (maksatulehdus) sekä sellaisia vaipattomia viruksia vastaan kuin hepatiitti A ‑virus (maksatulehdus) ja parvovirus B19.
Lääkäri saattaa suositella sinulle, että harkitset hepatiitti A- ja B -rokotuksen ottamista, jos saat ihmisen plasmasta valmistettuja valmisteita säännöllisesti/toistuvasti.
On erittäin suositeltavaa, että aina kun Riastap-valmistetta annetaan potilaalle, lääkäri kirjaa valmisteen antopäivän, eränumeron ja injisoidun tilavuuden potilastietoihin.
Muut lääkevalmisteet ja Riastap
- Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
- Riastap-valmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta kohdassa Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille / Käyttövalmiiksi saattaminen mainittuja valmisteita.
Raskaus ja imetys
- Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
- Riastap-valmistetta saa antaa raskauden ja imetyksen aikana vain, jos se on selvästi välttämätöntä.
Ajaminen ja koneiden käyttö
Riastap ei vaikuta ajokykyyn eikä kykyyn käyttää koneita.
Riastap sisältää natriumia
Riastap sisältää natriumia 164 mg (7,1 mmol) per injektiopullo. Tämä vastaa 11,5 mg:aa (0,5 mmol) natriumia painokiloa kohden (mg/kg), jos potilaalle suositeltu annos on 70 mg painokiloa kohden (mg/kg). Potilaiden, joilla on ruokavalion natriumrajoitus, tulee ottaa tämä huomioon.
Miten valmistetta käytetään
Hoito aloitetaan ja toteutetaan tämäntyyppisten sairauksien hoitoon perehtyneen lääkärin seurannassa.
Annostus
Tarvitsemasi ihmisen fibrinogeenimäärä ja hoidon kesto riippuvat seuraavista tekijöistä:
- sairautesi vaikeusasteesta
- verenvuotokohdasta ja verenvuodon voimakkuudesta
- kliinisestä tilastasi.
Jos käytät enemmän Riastap-valmistetta kuin sinun pitäisi
Lääkärin on seurattava hyytymisarvojasi säännöllisesti hoidon aikana. Jos saat yliannoksen, tromboembolisten komplikaatioiden kehittymisen vaara suurenee.
Jos olet ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 0800 147 111) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Antotapa
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen (ks. kohta Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille).
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Ota välittömästi yhteyttä lääkäriin:
- jos sinulle ilmaantuu jokin haittavaikutus
- jos havaitset sellaisia haittavaikutuksia, joita ei ole tässä pakkausselosteessa mainittu.
Seuraavaa haittavaikutusta on havaittu hyvin yleisesti (voi esiintyä yli 1 käyttäjällä 10:stä):
- ruumiinlämmön nousu
Seuraavaa haittavaikutusta on havaittu melko harvoin (voi esiintyä enintään 1 käyttäjällä 100:sta):
- äkillinen allerginen reaktio (kuten ihon punoitus, ihottumaa kaikkialla kehossa, verenpaineen lasku, hengitysvaikeudet).
Seuraavaa haittavaikutusta on havaittu yleisesti (voi esiintyä enintään 1 käyttäjällä 10:stä), joskin ilmaantuvuus oli suurempi potilailla, jotka eivät saaneet fibrinogeenia):
- suurentunut verihyytymien muodostumisen vaara (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä Mitä sinun on tiedettävä, ennen kuin käytät Riastap-valmistetta).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä ulkopakkauksessa ja etiketissä mainitun viimeisen käyttöpäivämäärän jälkeen.
- Säilytä alle 25°C.
- Ei saa jäätyä.
- Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
- Käyttövalmiiksi saatettu valmiste on käytettävä mieluiten heti.
- Jos käyttövalmiiksi saatettua valmistetta ei käytetä heti, sitä ei saa säilyttää pidempään kuin 8 tuntia huoneenlämmössä (enintään 25 °C).
- Käyttövalmiiksi saatettua valmistetta ei saa säilyttää jääkaapissa.
Pakkauksen sisältö ja muuta tietoa
Mitä Riastap sisältää
Vaikuttava aine on:
Ihmisen fibrinogeeni (1 g/injektiopullo, 50 ml:aan injektionesteisiin käytettävää vettä käyttövalmiiksi saatettu liuos noin 20 mg/ml).
Ks. lisätietoja kohdasta Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille.
Muut aineet ovat:
Ihmisen albumiini, natriumkloridi, L-arginiinihydrokloridi, natriumsitraatti, natriumhydroksidi (pH:n säätöön).
Ks. viimeinen kappale kohdasta Mitä sinun on tiedettävä ennen valmisteen käyttöä Riastap sisältää natriumia.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Riastap on valkoinen jauhe.
Kun valmiste on saatettu käyttövalmiiksi injektionesteisiin käytettävään veteen, käyttövalmiiksi saatetun liuoksen on oltava kirkasta tai hieman opaalinhohtoista eli se saattaa kimallella valoa vasten, mutta ei sisällä selkeitä hiukkasia.
Pakkaukset
1 g:n pakkaus (kuva 1)
1. Yksi injektiopullo, jossa 1 g ihmisen fibrinogeeniä
2. Suodatin: Pall®-ruiskusuodatin
3. Lääkkeenottokanyyli: Mini-Spike®-lääkkeenottokanyyli
 Kuva 1
Kuva 1
Myyntiluvan haltija ja valmistaja
CSL Behring GmbH, Emil-von-Behring-Strasse 76, 35041 Marburg, Saksa
Lisätietoa tästä valmisteesta antaa myyntiluvan haltijan edustaja:
CSL Behring AB, Box 712, 182 17 Danderyd, Ruotsi
| Tällä lääkevalmisteella on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa seuraavilla kauppanimillä: | |
| Riastap 1 g powder for solution for injection/infusion | Iso-Britannia |
| Riastap 1 g, poudre pour solution injectable/perfusion | Ranska |
| Riastap 1 g prašek za raztopino za injiciranje ali infundiranje | Slovenia |
| Riastap 1 g | Saksa, Irlanti |
| Riastap | Belgia, Kypros, Tanska, Suomi, Kreikka, Islanti, Italia, Luxemburg, Malta, Norja, Puola, Slovakia, Espanja, Ruotsi |
Tämä pakkausseloste on tarkistettu viimeksi 29.10.2024
Ohjeet terveydenhuollon ammattilaiselle
Annostus
(Toiminnallinen) fibrinogeenipitoisuus on määritettävä yksilöllisen annostuksen laskemiseksi ja annettava määrä ja antotiheys on määriteltävä kullekin potilaalle yksilöllisesti mittaamalla plasman fibrinogeenipitoisuus säännöllisesti ja seuraamalla jatkuvasti potilaan kliinistä tilaa ja hänen käyttämiään muita korvaushoitoja.
Plasman normaali fibrinogeenipitoisuus on 1,5–4,5 g/l. Plasman kriittinen fibrinogeenipitoisuus on 0,5–1,0 g/l, ja verenvuotoja saattaa esiintyä, jos pitoisuus on tätä pienempi. Suurten kirurgisten toimenpiteiden yhteydessä korvaushoidon tarkka seuranta hyytymiskokeiden avulla on välttämätöntä.
Aloitusannos
Jos potilaan fibrinogeenipitoisuutta ei tiedetä, suositeltu annos on 70 mg painokiloa kohden (mg/kg) laskimoon annettuna.
Seuraavat annokset
Tavoitepitoisuus (1 g/l) on säilytettävä vähäisempien tapahtumien (esim. nenäverenvuoto, lihaksensisäinen verenvuoto tai runsas kuukautisvuoto) yhteydessä vähintään kolmen päivän ajan. Tavoitepitoisuus (1,5 g/l) on säilytettävä suurempien tapahtumien (esim. pään vamma tai kallonsisäinen verenvuoto) yhteydessä vähintään seitsemän päivän ajan.
Fibrinogeeniannos (painon perusteella, mg/kg) | = | Tavoitepitoisuus (g/l) - mitattu pitoisuus (g/l) 0,017 (g/l per mg/kg ruumiinpainoa kohden) |
Vastasyntyneiden, pikkulasten ja lasten annostus
Kliinisistä tutkimuksista on saatu vähän tietoja Riastap-valmisteen annostuksesta lapsille. Näiden tutkimusten sekä fibrinogeenivalmisteista saadun pitkäaikaisen kliinisen kokemuksen perusteella annossuositukset lasten hoitoon ovat samat kuin aikuisille.
Antotapa
Yleiset ohjeet
- Valmiste on saatettava käyttövalmiiksi ja vedettävä ruiskuun aseptisissa olosuhteissa.
- Käyttövalmiiksi saatettu valmiste on tarkistettava silmämääräisesti ennen antoa, ettei siinä ole hiukkasia ja värimuutoksia havaittavissa.
- Liuoksen on oltava lähes väritöntä tai kellertävää, kirkasta tai hieman opaalinhohtoista, ja pH-arvoltaan neutraali. Älä käytä liuosta, jos se on sameaa tai siinä on saostumia.
Käyttövalmiiksi saattaminen
- Lämmitä sekä liuotin että kuiva-aine avaamattomissa injektiopulloissa huoneen- tai kehonlämpöiseksi (ei yli 37 ºC).
- Riastap on saatettava käyttövalmiiksi injektionesteisiin käytettävään veteen (50 ml, ei pakkauksessa mukana).
- Pese kädet ennen valmisteen käyttövalmiiksi sekoittamista tai käytä suojakäsineitä.
- Poista Riastap-injektiopullosta korkki, jotta saat tulpan keskiosan esille.
- Pyyhi tulpan pinta antiseptisella liuoksella ja anna sen kuivua.
- Siirrä liuotin injektiopulloon asianmukaisen siirtolaitteen avulla. Varmista, että liuotin kastelee kuiva-aineen kauttaaltaan.
- Pyörittele injektiopulloa, kunnes kuiva-aine on saatettu käyttövalmiiksi ja liuos on valmis annettavaksi. Vältä ravistamista, koska se aiheuttaa vaahdon muodostumista. Kuiva-aine liukenee yleensä noin 5 minuutissa, ja sen täydelliseen liukenemiseen ei pitäisi kulua pidempään kuin 15 minuuttia.
- Avaa Riastap-pakkauksen sisältämän lääkkeenottokanyylin (Mini-Spike®-lääkkeenottokanyyli) muovinen läpipainopakkaus (kuva 2).
 Kuva 2
Kuva 2
- Ota pakkauksen sisältämä lääkkeenottokanyyli, ja työnnä se käyttövalmiiksi sekoitetun valmisteen sisältävän injektiopullon tulppaan (kuva 3).
 Kuva 3
Kuva 3
- Kun lääkkeenottokanyyli on työnnetty tulppaan, poista korkki. Kun korkki on poistettu, älä kosketa esillä olevaan pintaan.
- Avaa Riastap-pakkauksen sisältämän suodattimen (Pall®-ruiskusuodatin) läpipainopakkaus (kuva 4).
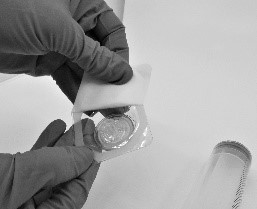 Kuva 4
Kuva 4
- Kierrä ruisku kiinni suodattimeen (kuva 5).
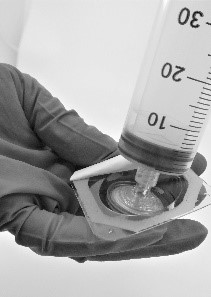 Kuva 5
Kuva 5
- Kierrä ruisku ja siihen kiinnitetty suodatin kiinni lääkkeenottokanyyliin (kuva 6).
 Kuva 6
Kuva 6
- Vedä käyttövalmiiksi saatettu valmiste ruiskuun (kuva 7).
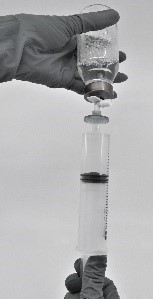 Kuva 7
Kuva 7
- Kun tämä on tehty, irrota ruiskusta suodatin, lääkkeenottokanyyli ja tyhjä injektiopullo, ja hävitä nämä asianmukaisesti. Jatka lääkkeenantoa tavanomaiseen tapaan.
- Käyttövalmiiksi saatettu valmiste on annettava heti erillisen injektio-/infuusioantolaitteen kautta.
- Varo, ettei valmisteen sisältävään ruiskuun pääse verta.
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Valmisteen anto
Käyttövalmiiksi saatettu huoneenlämpöinen liuos suositellaan annettavaksi tavanomaisen infuusiolaitteiston avulla laskimoon. Käyttövalmiiksi sekoitettu liuos annetaan injektiona tai infuusiona hitaasti nopeudella, joka tuntuu potilaasta miellyttävältä. Injektio- tai infuusionopeus saa olla enintään noin 5 ml minuutissa.