Pakkausseloste
RUCONEST pulver till injektionsvätska, lösning 2100 U
Tilläggsinformation
Ruconest 2100 enheter pulver till injektionsvätska, lösning
konestat alfa
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller
information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor, vänd dig till läkare.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Ruconest är och vad det används för
2. Vad du behöver veta innan du använder Ruconest
3. Hur du använder Ruconest
4. Eventuella biverkningar
5. Hur Ruconest ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Ruconest innehåller konestat alfa som aktiv substans. Konestat alfa är en rekombinant (ej framställt från blod) form av human C1-inhibitor (rhC1-INH).
Ruconest är avsett att användas av vuxna, ungdomar och barn (i åldern 2 år och äldre) med en sällsynt ärftlig blodsjukdom, hereditärt angioödem (HAE). HAE-patienter har brist på C1-inhibitorprotein i blodet. Detta kan leda till återkommande anfall med svullnad, magsmärta, andningssvårigheter och andra symtom.
Ruconest ges för att åtgärda bristen på C1-inhibitor och lindra symtomen vid akuta anfall av hereditärt angioödem (HAE).
Vad du behöver veta innan produkten används
Använd inte Ruconest
- om du är eller tror att du är allergisk mot kaniner
- om du är allergisk mot konestat alfa eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Tala med läkare innan du använder Ruconest.
Om du upplever allergiska reaktioner, t.ex. nässelutslag, hudutslag, klåda, yrsel, väsande andning, andningssvårigheter eller om tungan svullnar upp efter att du har fått Ruconest ska du söka vård akut så att dina allergiska symtom kan behandlas omedelbart.
Innan du påbörjar behandling med Ruconest är det viktigt att du berättar för din läkare om du har eller har haft problem med blodproppar (trombotiska händelser). Om så är fallet kommer du att övervakas noga.
Överkänslighetsreaktioner kan inte uteslutas och kan ha symtom som liknar anfall av angioödem.
Barn och ungdomar
Ruconest ska inte ges till barn under 2 år. Ruconest har inte studerats hos barn yngre än 5 år. Läkaren avgör om det är lämpligt att behandla ditt barn med Ruconest. Ytterligare övervakning av ditt barn för symtom på allergiska reaktioner under och efter administrering krävs.
Andra läkemedel och Ruconest
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Om du får tPA (tissue-type plasminogen activator) som akut behandling mot blodproppsbildning ska du inte samtidigt behandlas med Ruconest.
Graviditet och amning
Ruconest rekommenderas inte under graviditet och amning.
Om du planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel.
Körförmåga och användning av maskiner
Kör inte bil och använd inte verktyg eller maskiner om du känner dig yr eller har huvudvärk efter att ha fått Ruconest.
Ruconest innehåller natrium (19,5 mg per injektionsflaska)
Detta bör beaktas av patienter som ordinerats natriumfattig kost.
Hur produkten används
Behandling med Ruconest ska inledas av en läkare som är specialiserad på diagnos och behandling av hereditärt angioödem.
Ruconest ges direkt i en ven under ca 5 minuter av en läkare eller sjuksköterska. Dosen (upp till två injektionsflaskor) beräknas efter din vikt.
Oftast räcker en dos, men ytterligare en dos kan behövas. Din läkare kan besluta att en ytterligare dos ska administreras om dina symtom inte förbättrats efter 120 minuter (för vuxna och ungdomar) eller efter 60 minuter (för barn). Högst två doser ska ges inom 24 timmar.
Användaranvisningen beskrivs tydligt i läkarens information och är bifogade.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Om dina symtom förvärras och/eller om du får hudutslag, stickningar i huden eller svårt att andas eller om ansiktet eller tungan sväller upp ska du söka vård omedelbart. Dessa symtom kan tyda på att du har blivit allergisk mot Ruconest.
Ruconest kan orsaka vissa biverkningar:
Vanliga: kan förekomma hos upp till 1 av 10 användare
- Illamående
Mindre vanliga: kan förekomma hos upp till 1 av 100 användare
- Buksmärta, diarré
- Pirrande eller stickande känsla eller domningskänsla i munnen
- Huvudvärk, yrsel
- Minskad känsel i huden eller armar eller ben
- Halsirritation
- Nässelutslag
- Svullnad i öronen eller området runt öronen
- Allergisk chock
Har rapporterats: förekommer hos ett okänt antal användare
- Överkänslighetsreaktioner
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och på injektionsflaskans etikett efter EXP.
Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 25 ºC.
Förvaras i originalförpackningen. Ljuskänsligt.
Innan Ruconest kan ges måste det lösas i vatten för injektionsvätskor. Detta görs av sjukvårdspersonal.
Efter beredning av läkemedlet, bör det användas omedelbart.
Använd inte detta läkemedel om lösningen är missfärgad eller innehåller partiklar.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är konestat alfa. En injektionsflaska innehåller 2100 enheter konestat alfa, motsvarande 2100 enheter per 14 ml efter beredning, eller en koncentration av 150 enheter/ml.
Övriga innehållsämnen är sackaros, natriumcitrat (E331) och citronsyra.
Läkemedlets utseende och förpackningsstorlekar
Ruconest levereras i en injektionsflaska av glas som innehåller ett vitt till benvitt pulver till injektionsvätska, lösning. När pulvret har lösts i vatten för injektionsvätskor är lösningen klar och färglös.
Ruconest levereras i en kartong som innehåller en injektionsflaska med pulver.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning:
Pharming Group N.V.
Darwinweg 24
2333 CR Leiden
Nederländerna
Tillverkare:
Pharming Technologies B.V.
Darwinweg 24
2333 CR Leiden
Nederländerna
Denna bipacksedel ändrades senast 07/2023
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu/ .
Direktiv för experterna inom hälsovården
DOSERING OCH ADMINISTRERINGSSÄTT
Dosering
Kroppsvikt upp till 84 kg
- En intravenös injektion med 50 E/kg kroppsvikt.
Kroppsvikt 84 kg eller mer
- En intravenös injektion med 4200 E (två injektionsflaskor).
I de flesta fall räcker en dos av Ruconest för att behandla ett akut anfall av angioödem.
Vid otillräckligt kliniskt svar kan ytterligare en dos (50 E/kg kroppsvikt upp till 4200 E) administreras.
Högst två doser ska ges inom 24 timmar.
Dosberäkning
Bestäm patientens kroppsvikt.
Kroppsvikt upp till 84 kg
- För patienter med kroppsvikt upp till 84 kg beräknas den volym som ska administreras med nedanstående formel:
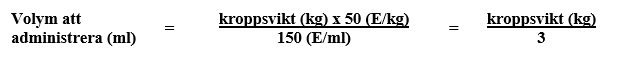
Kroppsvikt 84 kg eller mer
- För patienter med kroppsvikt 84 kg eller mer är den volym som ska administreras 28 ml, motsvarande 4200 E (2 injektionsflaskor).
Späd varje injektionsflaska med 14 ml vatten för injektionsvätskor (se avsnittet om beredning nedan).
Den färdigberedda lösningen i varje injektionsflaska innehåller 2100 E konestat alfa vid koncentrationen 150 E/ml.
Korrekt volym färdigberedd lösning ska administreras som en långsam intravenös injektion under ca 5 minuter.
SÄRSKILD FÖRSIKTIGHET VID DESTRUKTION OCH ANNAN HANTERING
Varje injektionsflaska med Ruconest är avsedd för engångsbruk.
Aseptisk teknik ska användas för beredning, sammanslagning och blandning av lösningarna.
Beredning
Varje injektionsflaska med Ruconest (2100 E) ska spädas med 14 ml vatten för injektionsvätskor. Vatten för injektionsvätskor ska tillsättas långsamt för att undvika kraftig inverkan på pulvret och sedan blandas varsamt för att minimera skumbildning i lösningen. Den färdigberedda lösningen i varje injektionsflaska innehåller 2100 E konestat alfa vid koncentrationen 150 E/ml. Lösningen är klar och färglös.
Den färdigberedda lösningen i varje injektionsflaska ska inspekteras visuellt. Inga partiklar och ingen missfärgning ska förekomma. Lösningar med partiklar eller missfärgning ska kasseras. När läkemedlet har spätts med vatten ska det användas omedelbart.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.