Pakkausseloste
TAKHZYRO injektionsvätska, lösning i förfylld spruta 150 mg
Tilläggsinformation
TAKHZYRO 150 mg injektionsvätska, lösning i förfylld spruta
lanadelumab
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du ger detta läkemedel till barnet. Den innehåller information som är viktig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till barnets läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt ditt barn eller åt ett barn i din vård. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dem hos ditt barn eller hos barnet du vårdar.
- Om barnet får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad TAKHZYRO är och vad det används för
2. Vad du behöver veta innan du ger TAKHZYRO
3. Hur du använder TAKHZYRO
4. Eventuella biverkningar
5. Hur TAKHZYRO ska förvaras
6. Förpackningens innehåll och övriga upplysningar
7. Bruksanvisning
Vad produkten är och vad den används för
TAKHZYRO innehåller den aktiva substansen lanadelumab.
Vad TAKHZYRO används för
TAKHZYRO 150 mg är ett läkemedel som används till patienter i åldern 2 år och äldre som väger mindre än 40 kg, för att förhindra angioödemanfall hos patienter med ärftligt angioödem (HAE).
Vad hereditärt angioödem (HAE) är
HAE är en ärftlig sjukdom. Vid denna sjukdom finns det inte tillräckligt av ett protein som kallas ”C1‑hämmare” i blodet, eller så fungerar inte C1-hämmaren på rätt sätt. Detta leder till för mycket plasmakallikrein, vilket i sin tur ger högre nivåer av bradykinin i blodet. För mycket bradykinin leder till symtom på HAE såsom svullnad och smärta på
- händer och fötter
- ansikte, ögonlock, läppar eller tunga
- struphuvudet (larynx), vilket kan göra det svårt att andas
- könsorganen.
Hur TAKHZYRO fungerar
TAKHZYRO är en typ av protein som blockerar aktiviteten hos plasmakallikrein. Detta bidrar till att minska mängden av bradykinin i blodet och förhindrar symtomen vid HAE.
Vad du behöver veta innan produkten används
Använd inte TAKHZYRO
Om ditt barn eller barnet du vårdar är allergisk mot lanadelumab eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
- Tala med barnets läkare, apotekspersonal eller sjuksköterska innan du ger TAKHZYRO.
- Om barnet får en allvarlig allergisk reaktion mot TAKHZYRO med symtom som utslag, åtstramning i bröstet, väsande andning eller snabba hjärtslag, ska du omedelbart tala om det för barnets läkare, apotekspersonal eller sjuksköterska.
Anteckna
Det rekommenderas starkt att du skriver ned läkemedlets namn och tillverkningssatsnummer varje gång ditt barn eller barnet du vårdar tar en dos av TAKHZYRO. På så sätt kan du hålla reda på vilka tillverkningssatser som använts.
Laboratorietester
Tala om för läkaren om barnet använder TAKHZYRO innan barnet genomgår laboratorietester för att mäta hur väl blodet koaguleras. Detta på grund av att TAKHZYRO i blodet kan störa vissa laboratorietester, vilket leder till felaktiga resultat.
Barn
TAKHZYRO rekommenderas inte för barn under 2 år. Detta beror på att läkemedlet inte har studerats i denna åldersgrupp.
Andra läkemedel och TAKHZYRO
Tala om för barnets läkare eller apotekspersonal om barnet tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
TAKHZYRO har ingen känd påverkan på andra läkemedel eller påverkas av andra läkemedel.
Graviditet och amning
Patienter som är gravida eller ammar eller tror sig vara gravid bör rådfråga patientens läkare eller apotekspersonal innan du börjar ge TAKHZYRO. Det finns begränsad information om säkerheten för TAKHZYRO vid användning under graviditet och amning. För säkerhets skull rekommenderas att man undviker användning av lanadelumab under graviditet och amning. Patientens läkare kommer att tillsammans med dig diskutera riskerna och fördelarna med att ta detta läkemedel.
Körförmåga och användning av maskiner
Detta läkemedel har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
TAKHZYRO innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per förfylld spruta, d.v.s. är näst intill ”natriumfritt”.
Hur produkten används
TAKHZYRO tillhandahålls i förfyllda sprutor för engångsbruk som bruksfärdig lösning. Behandlingen för ditt barn eller barnet som du vårdar kommer att påbörjas och hanteras under övervakning av en läkare som har erfarenhet av att behandla patienter med HAE.
Använd alltid detta läkemedel exakt enligt beskrivning i denna bipacksedel eller enligt anvisningar från barnets läkare, apotekspersonal eller sjuksköterska. Rådfråga läkare, apotekspersonal eller sjuksköterska om du är osäker eller om du har fler frågor om användningen av detta läkemedel.
Hur mycket TAKHZYRO du ska använda
Den rekommenderade dosen för barn i åldern 2 till yngre än 12 år baseras på kroppsvikt:
| Kroppsvikt (kg) | Rekommenderad startdos | Dosjustering |
| 10 till mindre än 20 kg | 150 mg lanadelumab var fjärde vecka | En dosökning till 150 mg lanadelumab var tredje vecka kan övervägas hos patienter med otillräcklig anfallskontroll |
| 20 till mindre än 40 kg | 150 mg lanadelumab varannan vecka | En dosminskning till 150 mg lanadelumab var fjärde vecka kan övervägas hos patienter som blir stabilt anfallsfria på behandlingen |
| 40 kg eller mer | 300 mg lanadelumab varannan vecka | En dosminskning till 300 mg lanadelumab var fjärde vecka kan övervägas hos patienter som blir stabilt anfallsfria på behandlingen |
- För patienter med en kroppsvikt på 20 till mindre än 40 kg som inte har haft något anfall under en lång period kan läkaren låta ditt barn eller barnet som du vårdar fortsätta med samma dos när han eller hon når 12 års ålder.
För vuxna och ungdomar i åldern 12 till yngre än 18 år med en kroppsvikt på mindre än 40 kg:
- Rekommenderad startdos är 300 mg lanadelumab varannan vecka. Om du inte har haft något anfall under en lång period kan din läkare ändra dosen till 300 mg lanadelumab var fjärde vecka, särskilt om du har låg kroppsvikt.
- En startdos på 150 mg lanadelumab varannan vecka kan också övervägas. Om du inte har haft något anfall under en lång period kan din läkare ändra dosen till 150 mg lanadelumab var fjärde vecka.
Hur TAKHZYRO injiceras
TAKHZYRO ska injiceras av sjukvårdspersonal eller vårdare. Vårdare måste noggrant läsa och följa instruktionerna i avsnitt 7, ”Bruksanvisning”.
- TAKHZYRO är avsett för injektion under huden (”subkutan injektion").
- Injektionen kan antingen ges av sjukvårdspersonal eller av en vårdare.
- Läkare, apotekspersonal eller sjuksköterska ska visa dig hur du förbereder och injicerar TAKHZYRO på rätt sätt innan du ger det för första gången. Ge det inte förrän du har utbildats i att injicera läkemedlet.
- För in nålen i fettvävnaden i magen (buken), låret eller överarmen.
- Injicera läkemedlet på ett nytt ställe varje gång.
- Varje förfylld spruta med TAKHZYRO ska endast användas en gång.
Om du har använt för stor mängd av TAKHZYRO
Tala om för läkaren om barnet har fått för stor mängd av TAKHZYRO eller om dosen har givits tidigare än vad läkaren ordinerat.
Om du har glömt att använda TAKHZYRO
Om du missar en dos av TAKHZYRO ska dosen injiceras så snart som möjligt. Nästa planerade dos kan behöva justeras baserat på den avsedda doseringsfrekvensen för att säkerställa
- att det går minst 10 dagar mellan doserna för patienter med doseringsregim varannan vecka
- att det går minst 17 dagar mellan doserna för patienter med doseringsregim var tredje vecka
- att det går minst 24 dagar mellan doserna för patienter med doseringsregim var fjärde vecka.
Om du är osäker på när du ska injicera TAKHZYRO efter en missad dos ska du fråga barnets läkare, apotekspersonal eller sjuksköterska.
Om du slutar att ge TAKHZYRO
Ett beslut om att sluta använda TAKHZYRO ska diskuteras med barnets läkare. Symtomen kan komma tillbaka om behandlingen avbryts.
Om du har ytterligare frågor om detta läkemedel, kontakta barnets läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Om barnet får en allvarlig allergisk reaktion av TAKHZYRO med symtom som utslag, åtstramning i bröstet, väsande andning eller snabba hjärtslag, ska du omedelbart tala om det för barnets läkare, apotekspersonal eller sjuksköterska.
Tala om för läkare, apotekspersonal eller sjuksköterska om du eller barnet observerar någon av följande biverkningar:
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare):
- Reaktioner där injektionen ges – symtom kan vara smärta, hudrodnad, blåmärke, obehag, svullnad, blödning, klåda, förhårdnad i huden, stickningar, värmekänsla och utslag.
Vanliga (kan förekomma hos upp till 1 av 10 användare):
- Allergiska reaktioner med t.ex. klåda, obehag och stickningar i tungan
- Yrsel, svimningskänsla
- Upphöjda hudutslag
- Muskelsmärta
- Blodvärden som visar på förändringar i levern
Rapportering av biverkningar
Om ditt barn eller barnet du vårdar får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
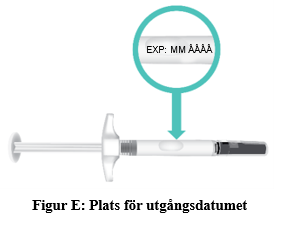
Används före utgångsdatum som anges på etiketten och på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
TAKHZYRO 150 mg injektionsvätska, lösning i förfylld spruta
Förvaras i kylskåp (2 °C‑8 °C). Får ej frysas. Förvara den förfyllda sprutan i ytterkartongen. Ljuskänsligt.
Förfyllda sprutor kan förvaras vid en temperatur lägre än 25 °C under en enda period på 14 dagar, men inte efter utgångsdatumet.
Ställ inte tillbaka TAKHZYRO i kylskåpet efter förvaring i rumstemperatur.
När en förfylld spruta i en multiförpackning tas ut ur kylskåpet, ställ tillbaka återstående förfyllda sprutor i kylskåpet till framtida användning vid behov.
Använd inte detta läkemedel om du ser t.ex. partiklar i den förfyllda sprutan eller ändrad färg på lösningen i den förfyllda sprutan.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är lanadelumab. Varje förfylld spruta (med 1 ml lösning) innehåller 150 mg lanadelumab.
- Övriga innehållsämnen är dinatriumfosfatdihydrat, citronsyramonohydrat, histidin, natriumklorid, polysorbat 80 och vatten för injektionsvätskor – se avsnitt Vad du behöver veta innan produkten används ”TAKHZYRO innehåller natrium”.
Läkemedlets utseende och förpackningsstorlekar
TAKHZYRO tillhandahålls som en klar, färglös till svagt gul injektionsvätska, lösning i en förfylld spruta.
TAKHZYRO finns som
- en engångsförpackning innehållande en förfylld 1 ml-spruta i en kartong
- en engångsförpackning innehållande två förfyllda 1 ml-sprutor i en kartong
- multiförpackning innehållande 3 kartonger, där varje kartong innehåller två förfyllda 1 ml‑sprutor.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublin 2
D02 HW68
Irland
Tillverkare
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublin 2
D02 HW68
Irland
Shire Pharmaceuticals Ireland Limited
Blocks 2 & 3 Miesian Plaza
50-58 Baggot Street Lower
Dublin 2
Irland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Finland
Takeda Oy
Puh/Tel: 0800 774 051
Denna bipacksedel ändrades senast 03/2024
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu . Där finns också länkar till andra webbplatser rörande sällsynta sjukdomar och behandlingar.
Direktiv för användaren
Se till att du läser, förstår och följer bruksanvisningen innan du injicerar TAKHZYRO. Kontakta din vårdgivare om du har några frågor.
Avsedd användning
Den förfyllda sprutan med TAKHZYRO är en bruksfärdig, nålbaserad injektionsenhet för engångsbruk med en fast dos (150 mg/1 ml), avsedd för subkutan administrering av läkemedlet av sjukvårdspersonal eller vårdare. Självadministrering rekommenderas inte hos pediatriska patienter (i åldern 2 till yngre än 12 år).
Förvaring av TAKHZYRO
- Förvara den förfyllda sprutan med TAKHZYRO i kylskåp vid 2 °C till 8 °C. Får ej frysas.
- En förfylld spruta som tagits ut ur kylskåpet ska förvaras under 25 °C och användas inom 14 dagar. Ställ inte tillbaka TAKHZYRO i kylskåpet efter förvaring i rumstemperatur.
- När en förfylld spruta i en multiförpackning tas ut ur kylskåpet, ställ tillbaka återstående förfyllda sprutor i kylskåpet till framtida användning vid behov.
- Förvara den förfyllda sprutan med TAKHZYRO i originalförpackningen. Ljuskänsligt.
- Kasta (kassera) den förfyllda sprutan med TAKHZYRO om den har förvarats utanför kylskåp, om den har varit fryst eller om den inte har förvarats skyddad från ljus i originalförpackningen.
- Skaka inte TAKHZYRO.
Förvara TAKHZYRO och alla läkemedel utom räckhåll för barn.
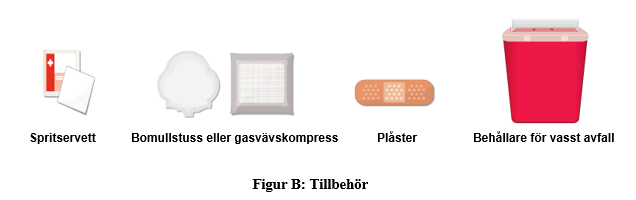
Den förfyllda TAKHZYRO-sprutans delar före användning (figur A).
| Steg 1: Förbered injektionen | |
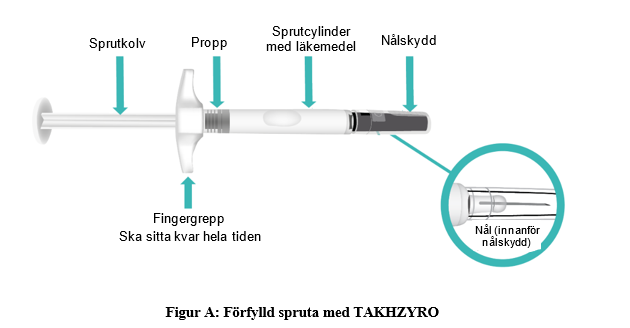
a. Ta fram en spritservett, bomullstuss eller gasvävskompress, plåster och en behållare för vasst avfall (figur B) och lägg dem på en ren, jämn arbetsyta som är väl upplyst. Dessa tillbehör ingår inte i TAKHZYRO-förpackningen.
| |
b. Ta ut den förfyllda sprutan med TAKHZYRO ur kylskåpet 15 minuter före injicering.
|
|
c. Öppna kartongen. Håll i sprutans cylinder och ta ut den förfyllda sprutan från brickan (figur C).
|  |
d. Tvätta händerna med tvål och vatten (figur D). Torka händerna helt.
|  |
e. Kontrollera utgångsdatumet (EXP) på sprutans cylinder (figur E).
|  |
f. Inspektera den förfyllda sprutan med TAKHZYRO och kontrollera att den inte har några skador. Läkemedlet i sprutans cylinder ska vara färglöst till svagt gult. (figur F).
Kontakta din vårdgivare om den förfyllda sprutan med TAKHZYRO inte kan användas. | 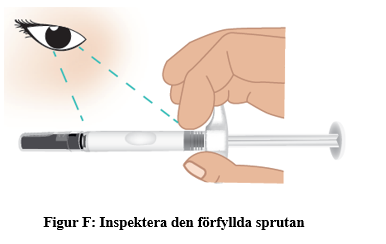 |
| Steg 2: Välj och förbered injektionsstället | |
a. TAKHZYRO ska injiceras av sjukvårdspersonal eller en vårdare på något av följande ställen (figur G):
Viktigt: Använd olika injektionsställen för att hålla huden frisk. Varje ny injektion ska ges minst 3 cm från det senaste injektionsstället. | 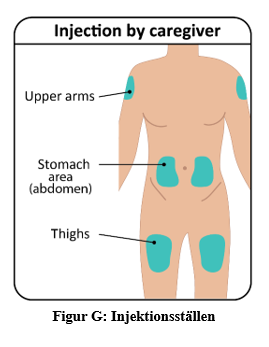 |
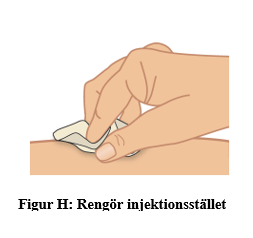
b. Rengör injektionsstället med en spritservett och låt huden torka helt (figur H).
|  |
c. Håll ett stadigt grepp på mitten av den förfyllda sprutan med TAKHZYRO med den ena handen och dra försiktigt nålskyddet rakt ut med den andra handen (figur I).
Det kan finnas luftbubblor, vilket är normalt. Försök inte ta bort luftbubblorna. | 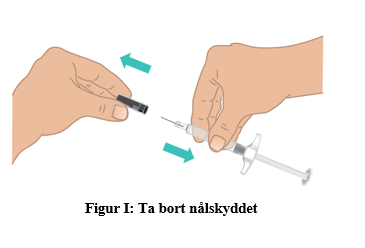 |
d. Släng nålskyddet i en avfallsbehållare eller i en behållare för vasst avfall.
| |
| Steg 3: Injicera TAKHZYRO | |
| a. Fatta tag i den förfyllda sprutan med TAKHZYRO med ena handen som en penna (figur J). Undvik att röra vid nålen eller trycka på kolven. |  |
b. Nyp försiktigt cirka 3 cm hud på det rengjorda injektionsstället med den andra handen. Fortsätt nypa huden tills injektionen är klar och nålen dragits bort (figur K). | 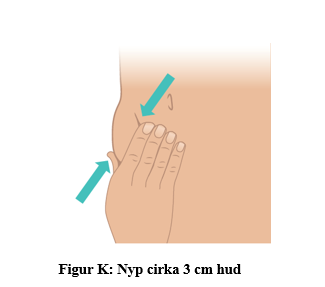 |
c. Tryck in nålen med en snabb, pilkastningsliknande rörelse i en 45 till 90 graders vinkel. Var noga med att hålla nålen på plats (figur L). Viktigt: Injicera direkt i fettlagret under huden (subkutan injektion). | 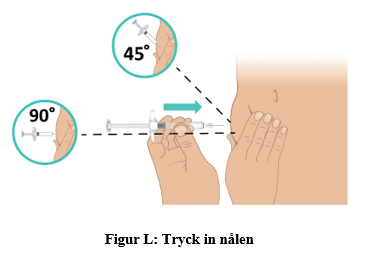 |
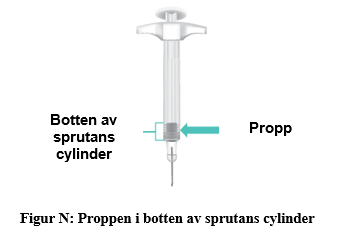
d. Tryck långsamt kolven hela vägen ner tills det tar stopp (figur M). Viktigt: Dra inte ut nålen förrän allt läkemedel har injicerats och sprutans cylinder är tom. När injektionen är klar kommer du se proppen i botten av sprutans cylinder (figur N). | 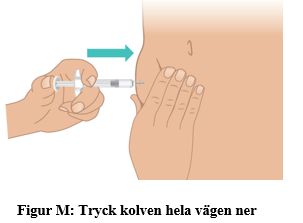 |
 | |
| e. Dra långsamt ut nålen medan du håller kvar sprutan i samma vinkel. Släpp sedan försiktigt huden. | |
f. Tryck en bomullstuss eller en gasvävskompress över injektionsstället om det behövs och håll kvar i 10 sekunder.
| |
| Steg 4: Kasta (kassera) den förfyllda sprutan med TAKHZYRO | |
a. Släng den förfyllda sprutan med TAKHZYRO i en behållare för vasst avfall direkt efter användningen (figur O).
|  |