Pakkausseloste
ACTILYSE pulver och vätska till injektions-/infusionsvätska, lösning 20 mg, 50 mg
Tilläggsinformation
10 mg, 20 mg och 50 mg
alteplas
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller sjuksköterska.
- Om du får biverkningar, tala med läkare eller sjuksköterska. Det gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Actilyse är och vad det används för
- Vad du behöver veta innan du får Actilyse
- Hur Actilyse ges
- Eventuella biverkningar
- Hur Actilyse ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Den aktiva substansen i Actilyse är alteplas. Den tillhör en grupp läkemedel som kallas trombolytiska medel. Dessa läkemedel verkar genom att lösa upp blodproppar som täpper igen kärlen.
Actilyse 10, 20 eller 50 mg används för behandling av tillstånd som orsakas av bildning av blodproppar i blodkärlen, inklusive:
- hjärtattack som orsakas av blodproppar i hjärtats artärer (akut hjärtinfarkt)
- blodproppar i lungornas artärer (akut massiv lungemboli)
- stroke orsakad av bildning av blodproppar i hjärnans artärer (akut ischemisk stroke).
Vad du behöver veta innan produkten används
Du skall inte behandlas med Actilyse
- om du är allergisk (överkänslig) mot alteplas eller mot något av de övriga innehållsämnena i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har eller nyligen haft en sjukdom som ökar risken för blödning, t ex:
- blödningssjukdom eller tendens till ökad blödning
- en svår eller farlig blödning i någon del av kroppen
- blödning i hjärnan eller skallen
- okontrollerat, mycket högt blodtryck
- bakterieinfektion eller inflammation i hjärtat eller inflammation i membranen omkring hjärtat
- inflammation i bukspottkörteln
- sår i mag-tarmkanalen
- åderbråck i matstrupen
- förändringar i blodkärlen, som bråck på artärer
- vissa tumörer
- svår leversjukdom
- om du tar blodförtunnande läkemedel (via munnen), om inte lämpliga tester visar att det inte finns någon kliniskt signifikant verkan av detta läkemedel
- om du någon gång har opererats i hjärnan eller ryggraden
- om du har genomgått en större operation eller fått en allvarlig skada under de senaste 3 månaderna
- om du nyligen genomgått en punktion av ett stort blodkärl
- om du fått hjärtmassage under de senaste 10 dagarna
- om du fött barn under de senaste 10 dagarna.
Din läkare kommer inte heller att använda Actilyse för behandling av hjärtinfarkt eller blodproppar i lungans artärer
- om du har eller någon gång haft en stroke orsakad av blödning i hjärnan
- om du har eller någon gång haft en stroke av oklara orsaker
- om du nyligen (under de senaste 6 månaderna) haft en stroke orsakad av blodproppar i hjärnans artärer. Detta avser inte den stroke du söker behandling för.
Dessutom kommer din läkare inte att använda Actilyse för behandling av stroke orsakad av en blodpropp i hjärnans artärer
- om symtomen på stroke började uppträda för mer än 4,5 timmar sedan eller om det kan ha varit möjligt att det gått mer än 4,5 timmar sedan starten eftersom du inte vet när de började
- om din stroke endast ger milda symtom
- om det finns tecken på blödning i hjärnan
- om du haft en stroke under de senaste 3 månaderna
- om dina symtom förbättras snabbt innan behandlingen med Actilyse påbörjas
- om du har en mycket svår stroke
- om du hade kramper när strokesymtomen började
- om din tromboplastintid (blodprov för att undersöka blodets levringsförmåga) är avvikande. Provet kan vara avvikande om du har fått heparin (ett läkemedel som förtunnar blodet) under de senaste 48 timmarna.
- om du är diabetiker och har haft stroke någon gång tidigare
- om du har mycket få blodplättar
- om du har mycket högt blodtryck (över 185/110) som bara kan minskas genom injektion av läkemedel
- om mängden socker (glukos) i blodet är mycket låg (under 2,8 mmol/l)
- om mängden socker (glukos) i blodet är mycket hög (över 22,2 mmol/l)
- om du är yngre än 16 år. (För ungdomar från 16 år eller äldre, se avsnitt ”Din läkare kommer att vara särskilt försiktig med Actilyse”.)
Din läkare kommer att vara särskilt försiktig med Actilyse
- om du har haft någon annan allergisk reaktion än en plötslig livshotande allergisk reaktion (svår överkänslighet) mot den aktiva substansen alteplas eller mot något av de övriga innehållsämnena i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har eller nyligen har haft något tillstånd som innebär ökad risk för blödning, såsom:
- smärre skador
- biopsi (vävnadsprovtagning)
- punktion av större blodkärl
- intramuskulär injektion
- extern hjärtmassage
- om du någon gång tidigare fått Actilyse
- om du är äldre än 65 år
- om du är äldre än 80 år kan du få ett sämre behandlingsresultat även om du behandlas med Actilyse. Nyttan med behandlingen överväger den möjliga risken även hos patienter som är över 80 år. Därför är enbart hög ålder inget hinder för behandling med Actilyse.
- om du är ungdom som är 16 år eller äldre kommer nyttan vägas noga mot den möjliga risken vid behandling av stroke (akut ischemisk stroke).
Andra läkemedel och Actilyse
Tala om för läkare eller apotekspersonal om du tar eller nyligen har tagit andra läkemedel, även receptfria sådana.
Det är särskilt viktigt att tala om för din läkare om du tar eller nyligen har tagit:
- något läkemedel som används för att förtunna blodet, t ex:
- acetylsalicylsyra
- warfarin
- kumarin
- heparin
- vissa läkemedel mot högt blodtryck (ACE-hämmare).
Graviditet, amning och fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare. Din läkare kommer att ge dig Actilyse endast om nyttan överväger den möjliga risken för ditt barn.
Hur produkten används
Actilyse förbereds och ges till dig av läkare eller annan sjukvårdspersonal. Det är inte meningen att du själv ska ta läkemedlet.
Actilyse ska ges så tidigt som möjligt efter första symtomet.
Actilyse kan användas för att behandla tre olika sjukdomar:
Hjärtattack (akut hjärtinfarkt)
Dosen du får beror på din kroppsvikt. Maximal dos av Actilyse är 100 mg, men om du väger mindre än 65 kg får du en lägre dos.
Actilyse kan ges på två olika sätt:
a) Tillförsel under 90 minuter, till patienter som behandlas inom 6 timmar efter första symtom. Detta innebär:
- först en injektion av en del av dosen i en ven
- därefter infusion av resten av dosen under de följande 90 minuterna.
b) Tillförsel under 3 timmar, till patienter som behandlas 6 - 12 timmar efter första symtom. Detta innebär:
- först en injektion av en del av dosen i en ven
- därefter infusion av resten av dosen under de följande 3 timmarna.
Dessutom kommer läkaren att ge dig ett annat läkemedel för att motverka bildning av blodproppar. Detta läkemedel kommer att ges så snart som möjligt efter att du börjat känna av bröstsmärtor.
Blodproppar i artärerna i lungorna (akut massiv lungemboli)
Dosen du får beror på din kroppsvikt. Maximal dos av Actilyse är 100 mg, men om du väger mindre än 65 kg får du en lägre dos.
Actilyse ges vanligen på följande sätt:
- först en injektion av en del av dosen i en ven
- därefter infusion av resten av dosen under de följande 2 timmarna.
Efter behandling med Actilyse, kommer din läkare att påbörja (eller återuppta) behandling med heparin (ett läkemedel som förtunnar blodet).
Stroke orsakat av blodproppar i en artär i hjärnan (akut ischemisk stroke)
Actilyse måste ges inom 4,5 timmar efter de första symtomen. Ju tidigare du får behandlingen, desto större är chansen att du ska få nytta av behandlingen och desto mindre risk att allvarliga biverkningar inträffar. Dosen du får är beroende av din kroppsvikt. Den maximala dosen av Actilyse är 90 mg, men den kan vara lägre om du väger mindre än 100 kg.
Actilyse ges på följande sätt:
- först en injektion av en del av dosen i en ven
- därefter infusion av resten av dosen under de följande 60 minuterna.
Du ska inte använda acetylsalicylsyra under de första 24 timmarna efter behandling med Actilyse mot stroke. Om det är nödvändigt kan din läkare ge dig en injektion med heparin.
Om du har ytterligare frågor om användningen av Actilyse, kontakta läkare eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Följande biverkningar har rapporterats av personer som fått Actilyse
Mycket vanliga (förekommer hos mer än 1 person av 10 som får läkemedlet)
- hjärtsvikt - det kan vara nödvändigt att avbryta behandlingen
- blödning i hjärnan efter behandling av stroke orsakad av blodpropp i en av hjärnans artärer (akut ischemisk stroke) – det kan vara nödvändigt att avbryta behandlingen.
- vätska i lungorna
- blödning vid det skadade blodkärlet (såsom blåmärken/hematom)
- lågt blodtryck
- kärlkramp.
Vanliga (förekommer hos mindre än en person av 10 som får läkemedlet)
- ytterligare en hjärtattack
- blödning i hjärnan efter behandling av hjärtattack – det kan vara nödvändigt att avbryta behandlingen
- hjärtstillestånd – det kan vara nödvändigt att avbryta behandlingen
- chock (mycket lågt blodtryck) pga hjärtsvikt – det kan vara nödvändigt att avbryta behandlingen
- blödning i halsen
- blödning i mage eller tarm, inklusive blodiga kräkningar eller blod i avföringen, blödning i tandköttet
- blödning i kroppsvävnader som orsakar lilaaktiga blåmärken
- blödning från urinvägarna eller könsorganen som kan medföra blod i urinen
- blödning eller blåmärken vid injektionsstället.
Mindre vanliga (förekommer hos mindre än 1 person av 100 som får läkemedlet)
- lungrelaterad blödning, såsom blodfärgat slem, eller blödning i luftvägarna - det kan vara nödvändigt att avbryta behandlingen
- näsblödning
- oregelbundna hjärtslag efter att blodtillförseln till hjärtat har återställts
- skador på hjärtklaffarna eller väggen som avdelar de två kamrarna i hjärtat – det kan vara nödvändigt att avbryta behandlingen
- plötslig blockad av en artär i lungorna (lungembolism), hjärnan och alla andra ställen i kroppen (systemisk embolism)
- blödning i öronen
- blodtryckssänkning.
Sällsynta (förekommer hos mindre än 1 person av 1 000 som får läkemedlet)
- blödning i hjärtsäcken som omringar hjärtat - det kan vara nödvändigt att avbryta behandlingen
- inre blödning i bakre delen av bålen - det kan vara nödvändigt att avbryta behandlingen
- bildning av blodproppar som kan transporteras till olika organ i kroppen. Symtomen beror på vilket organ som drabbas
- allergiska reaktioner, t ex nässelutslag och hudutslag, svårigheter att andas med svårighetsgrad upp till astma (bronkospasm), vätska under huden och slemhinnor (angioödem), lågt blodtryck eller chock - det kan vara nödvändigt att avbryta behandlingen
- blödning i ögonen
- illamående.
Mycket sällsynta (förekommer hos mindre än 1 person av 10 000 som får läkemedlet)
- allvarliga allergiska reaktioner (t ex livshotande anafylaxi) – det kan vara nödvändigt att avbryta behandlingen
- händelser som påverkar nervsystemet t ex:
- krampanfall
- problem att tala
- förvirring eller delirium (mycket svår förvirring)
- oro tillsammans med rastlöshet
- depression
- förändrat tänkande (psykos).
Dessa förändringar uppträder ofta i samband med en stroke orsakad av blodproppar eller blödning i hjärnan.
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
- blödning i inre organ, t ex blödning i levern – det kan vara nödvändigt att avbryta behandlingen
- bildning av kolesterolkristaller som lossnar och följer med blodet till andra organ. Symtomen beror på vilka organ som drabbas - det kan vara nödvändigt att avbryta behandlingen
- blödning som medför behov av blodtransfusion
- kräkningar
- feber.
Död eller permanent funktionsnedsättning kan följa efter blödning i hjärnan eller andra allvarliga blödningshändelser.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Normalt blir du inte ombedd att förvara Actilyse eftersom det kommer att ges till dig av din läkare.
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras vid högst 25 °C. Förvaras i originalförpackningen. Ljuskänsligt.
Används före utgångsdatum som anges på etiketten och kartongen. Utgångsdatumet är den sista dagen i angiven månad.
Rekonstituerad lösning
Den rekonstituerade lösningen har visats vara stabil under 24 timmar vid 2-8 °C och under 8 timmar vid 25°C.
Ur ett mikrobiologiskt perspektiv, bör lösningen användas omedelbart efter rekonstituering. Om lösningen inte används omedelbart, är förvaringstid och betingelser före användning användarens ansvar, och bör normalt inte överstiga 24 timmar vid 2-8 °C.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är alteplas. Varje injektionsflaska innehåller 10 mg (motsvarar 5 800 000 IE), 20 mg (motsvarar 11 600 000 IE) eller 50 mg (motsvarar 29 000 000 IE) alteplas. Alteplas tillverkas med rekombinant DNA-teknik med hjälp av en ovarialcellinje från kinesisk hamster. Övriga innehållsämnen är arginin, fosforsyra (för pH justering) och polysorbat 80.
- Spädningsvätskan är vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Actilyse är pulver och vätska till injektions-/infusionsvätska, lösning. En förpackning innehåller en injektionsflaska med pulver och en injektionsflaska med spädningsvätska.
Actilyse finns tillgängligt i följande förpackningsstorlekar:
- en injektionsflaska med 10 mg alteplaspulver och en injektionsflaska med 10 ml spädningsvätska
- en injektionsflaska med 20 mg alteplaspulver och en injektionsflaska med 20 ml spädningsvätska och en överföringskanyl
- en injektionsflaska med 50 mg alteplaspulver och en injektionsflaska med 50 ml spädningsvätska och en överföringskanyl
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
Boehringer Ingelheim International GmbH
Binger Strasse 173
55216 Ingelheim
Tyskland
Tillverkare
Boehringer Ingelheim Pharma GmbH & Co. KG
Birkendorfer Straβe 65
88397 Biberach/Riβ
Tyskland
Information lämnas av:
Boehringer Ingelheim Finland Ky
Märaholmsgatan 5
00180 Helsingfors
Tel: +358 10 310 2800
Denna bipacksedel ändrades senast 13.02.2024
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Injektionsflaskor med 2 mg alteplas är inte indicerade för användning vid akut hjärtinfarkt, akut massiv lungembolism eller akut ischemisk stroke (på grund av risk för kraftig underdosering). Endast injektionsflaskorna med 10 mg, 20 mg och 50 mg är indicerade för användning vid dessa indikationer.
Rekonstitution
För rekonstituering till en slutlig koncentration av 1 mg alteplas/ml ska hela volymen spädningsvätska som följer med förpackningen överföras till injektionsflaskan med Actilyse pulver. För detta ändamål bifogas en överföringskanyl i förpackningarna med 20 mg och 50 mg. Till förpackningen med 10 mg ska en spruta användas.
För rekonstituering till en slutlig koncentration av 2 mg alteplas/ml ska endast halva volymen spädningsvätska användas (som visat i nedanstående tabell). I dessa fall ska alltid spruta användas för att överföra den avsedda mängden spädningsvätska till injektionsflaskan med Actilyse pulver.
Under aseptiska förhållanden ska innehållet i en injektionsflaska Actilyse pulver (10 mg, 20 mg eller 50 mg) lösas upp i vatten för injektionsvätskor (spädningsvätska) enligt nedanstående tabell, för att erhålla en slutlig koncentration av 1 mg alteplas/ml eller 2 mg alteplas/ml:
| Actilyse pulver | 10 mg | 20 mg | 50 mg |
| (a) Volym sterilt vatten för injektionsvätskor som ska tillsättas pulvret |
10 ml |
20 ml |
50 ml |
| Slutlig koncentration: | 1 mg alteplas/ml | 1 mg alteplas/ml | 1 mg alteplas/ml |
| (b) Volym sterilt vatten för injektionsvätskor som ska tillsättas pulvret |
5 ml |
10 ml |
25 ml |
Slutlig koncentration:
| 2 mg alteplas/ml | 2 mg alteplas/ml | 2 mg alteplas/ml |
Den rekonstituerade lösningen skall sedan administreras intravenöst. Den rekonstituerade 1 mg/ml lösningen kan spädas ytterligare med steril natriumklorid 9 mg/ml (0,9 %) lösning för injektionsvätskor, till en lägsta koncentration på 0,2 mg/ml eftersom det inte kan uteslutas att den rekonstituerade lösningen blir grumlig. Ytterligare spädning av den färdigberedda 1 mg/ml lösningen, med sterilt vatten för injektionsvätskor eller med kolhydratlösningar för infusion, t ex glukos, rekommenderas inte på grund av ökad grumlighet i den rekonstituerade lösningen. Actilyse skall ej blandas med andra läkemedel i samma infusionslösning (detta gäller även heparin).
För förvaringsanvisningar, se avsnitt Hur produkten ska förvaras i denna bipacksedel.
Den rekonstituerade lösningen är endast avsedd för engångsbruk. Oanvänd lösning ska destrueras.
Instruktioner för rekonstituering av Actilyse
| 1 | Rekonstituera omedelbart före administrering. |  |
| 2 | Använd tummen för att ta bort skyddslocken från injektionsflaskorna innehållande Actilyse pulver och spädningsvätska. | 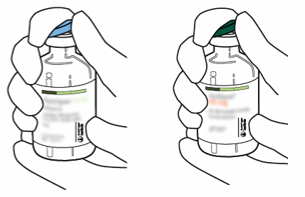 |
| 3 | Gör ren injektionsflaskornas gummiöverdelar med en spritkompress. | 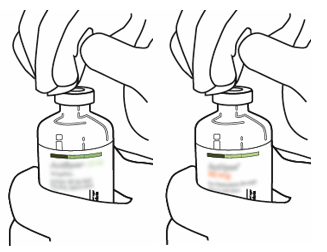 |
| 4 | Ta ut överföringskanylen*. Desinficera eller sterilisera inte överföringskanylen, den är redan steril. Ta av det ena skyddslocket. | 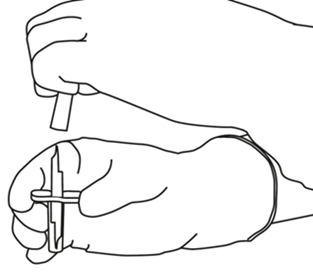 |
| 5 | Ställ injektionsflaskan med spädningsvätska upprätt på ett fast underlag. Punktera mitten av gummikorken, rakt uppifrån, med överföringskanylen. Tryck försiktigt men bestämt utan att vrida. | 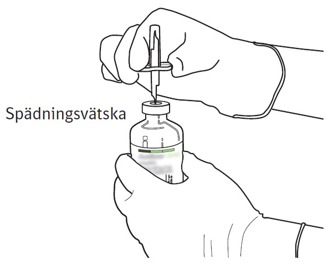 |
| 6 | Håll injektionsflaskan med spädningsvätska och överföringskanylen stadigt i ena handen genom att hålla i överföringskanylens mittdel.
Ta bort det andra skyddslocket från överföringskanylen. | 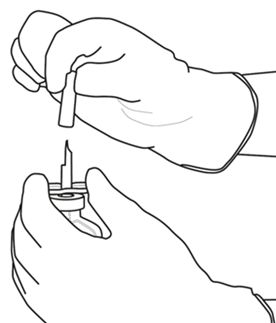 |
| 7 | Håll injektionsflaskan med spädningsvätska och överföringskanylen stadigt i ena handen genom att hålla i överföringskanylens mittdel.
Håll injektionsflaskan med Actilyse-pulver vertikalt ovanför överföringskanylen. Placera överföringskanylens spets i gummikorkens mitt.
Tryck ned injektionsflaskan med pulver på överföringskanylen rakt uppifrån. Punktera gummikorken försiktigt men bestämt utan att vrida. | 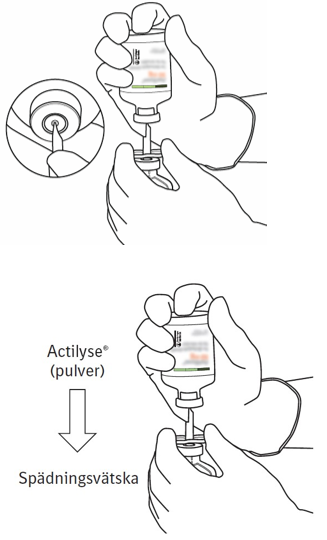 |
| 8 | Vänd de två injektionsflaskorna och låt all spädningsvätska rinna över till pulvret. | 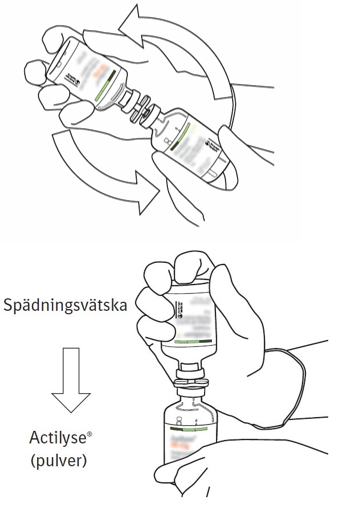 |
| 9 | Ta bort den nu tomma injektionsflaskan för spädningsvätskan tillsammans med överföringskanylen. De kan kasseras. | 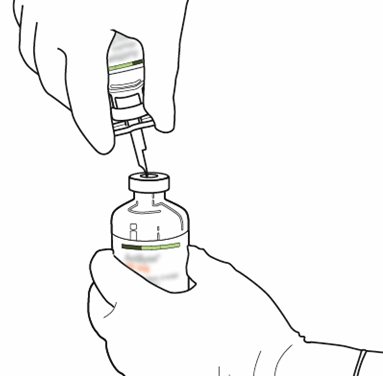 |
| 10 | Snurra injektionsflaskan med rekonstituerad Actilyse försiktigt för att lösa upp återstående pulver. Skaka inte injektionsflaskan eftersom det leder till skumbildning.
Om det finns luftbubblor: låt lösningen stå i några minuter för att bubblorna ska försvinna. | 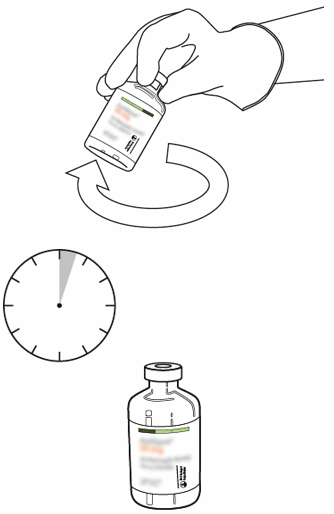 |
| 11 | Den rekonstituerade lösningen består av 1 mg/ml alteplas. Den ska vara klar och färglös till ljust gul och den ska vara fri från partiklar. | |
| 12 | Använd endast en nål och en spruta för att ta ut den mängd som behövs. För att undvika läckage ska sprutans nål inte sättas in på samma ställe som överföringskanylen satt. | 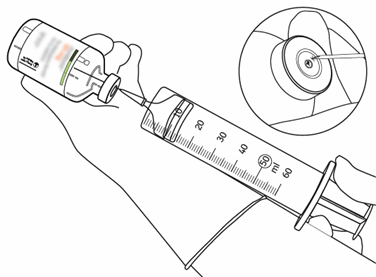 |
| 13 | Använd omedelbart. All oanvänd lösning ska kasseras. | |
(*om en överföringskanyl är inkluderad i förpackningen. Rekonstitueringen kan också göras med en spruta och nål.)
Dosering och administreringssätt
Akut hjärtinfarkt
Dosering
a) 90 minuters (accelererat) dosschema för patienter med akut hjärtinfarkt, där behandling kan påbörjas inom 6 timmar efter symtomdebut.
För patienter med en kroppsvikt ≥ 65 kg:
| Volym som ska ges beroende på koncentration av alteplas | ||
| 1 mg/ml | 2 mg/ml | |
| 15 mg som intravenös bolus, omedelbart följt av | 15 ml | 7,5 ml |
| 50 mg som intravenös infusion med konstant hastighet under de första 30 minuterna, omedelbart följt av | 50 ml | 25 ml |
| 35 mg som intravenös infusion med konstant hastighet under 60 minuter, till maximala totaldosen 100 mg | 35 ml | 17,5 ml |
För patienter med en kroppsvikt < 65 kg ska den totala dosen justeras enligt följande tabell:
| Volym som ska ges beroende på koncentration av alteplas | ||
| 1 mg/ml | 2 mg/ml | |
| 15 mg som intravenös bolusdos, omedelbart följt av | 15 ml | 7,5 ml |
| 0,75 mg/kg kroppsvikt som intravenös infusion med konstant hastighet under de första 30 minuterna, omedelbart följt av | 0,75 ml per kg kroppsvikt | 0,375 ml per kg kroppsvikt |
| 0,5 mg/kg kroppsvikt som intravenös infusion med konstant hastighet under 60 minuter | 0,5 ml per kg kroppsvikt | 0,25 ml per kg kroppsvikt |
b) 3 timmars doseringsschema för patienter med akut hjärtinfarkt där behandling kan påbörjas mellan 6 och 12 timmar efter symtomdebut.
För patienter med en kroppsvikt ≥ 65 kg:
| Volym som ska ges beroende på koncentration av alteplas | ||
| 1 mg/ml | 2 mg/ml | |
| 10 mg som intravenös bolusdos, omedelbart följt av | 10 ml | 5 ml |
| 50 mg som intravenös infusion med konstant hastighet under den första timmen, omedelbart följt av | 50 ml | 25 ml |
| 40 mg som intravenös infusion med konstant hastighet under 2 timmar till maximala totaldosen 100 mg | 40 ml | 20 ml |
Hos patienter med en kroppsvikt < 65 kg:
| Volym som ska ges beroende på koncentration av alteplas | ||
1 mg/ml
| 2 mg/ml | |
| 10 mg som intravenös bolus, omedelbart följt av | 10 ml
| 5 ml |
| en intravenös infusion med konstant hastighet under 3 timmar till en maximal total dos av 1,5 mg/kg kroppsvikt | 1,5 ml/ kg kroppsvikt | 0,75 ml/kg kroppsvikt |
Tilläggsbehandling: Tillägg med antitrombotisk behandling rekommenderas i enlighet med rådande internationella vägledningar för behandling av patienter med hjärtinfarkt med ST-höjning.
Administreringssätt
Den färdigberedda lösningen ska ges intravenöst och ska användas omedelbart.
Injektionsflaskorna med 2 mg alteplas är inte indicerade för att användas vid denna indikation.
Akut massiv lungemboli
Dosering
För patienter med en kroppsvikt ≥ 65 kg:
En total dos på 100 mg bör administreras inom 2 timmar. Mest erfarenhet finns med följande dosschema:
| Volym som ska ges beroende på koncentration av alteplas | ||
| 1 mg/ml | 2 mg/ml | |
| 10 mg som intravenös bolusdos under 1-2 minuter, omedelbart följt av | 10 ml | 5 ml |
| 90 mg som intravenös infusion med konstant hastighet under 2 timmar till maximal total dos av 100 mg | 90 ml | 45 ml |
Hos patienter med en kroppsvikt < 65 kg:
| Volym som ska ges beroende på koncentration av alteplas | ||
1 mg/ml
| 2 mg/ml | |
| 10 mg som intravenös bolus under 1-2 minuter, omedelbart följt av | 10 ml
| 5 ml |
| en intravenös infusion med konstant hastighet under 2 timmar till en maximal total dos av 1,5 mg/kg kroppsvikt | 1,5 ml/ kg kroppsvikt | 0,75 ml/kg kroppsvikt |
Tilläggsbehandling: Efter behandling med Actilyse bör behandling med heparin påbörjas (eller återupptas) när APTT-värdena är mindre än dubbla övre normalgränsen. Infusionen ska justeras så att ett APTT mellan 50-70 sekunder bibehålls (1,5- till 2,5-faldigt av referensvärdet).
Administreringssätt
Den färdigberedda lösningen ska ges intravenöst och ska användas omedelbart.
Injektionsflaskorna med 2 mg alteplas är inte indicerade för att användas vid denna indikation.
Akut ischemisk stroke
Behandling måste övervakas och följas upp av läkare med särskild utbildning och erfarenhet av neurovaskulär vård, se avsnitt 4.3 Kontraindikationer och 4.4 Varningar och försiktighet i SmPC.
| Behandling med Actilyse måste påbörjas så tidigt som möjligt inom 4,5 timmar efter symtomdebut (se SmPC avsnitt 4.4). För behandling som sätts in mer än 4,5 timmar efter symtomdebut är risk/nyttabalans negativ, varför behandling efter 4,5 timmar inte ska initieras (se avsnitt 5.1 i SmPC). |
Dosering
Rekommenderade totala dosen är 0,9 mg alteplas/kg kroppsvikt (maximal dos 90 mg) påbörjat med 10 % av totaldosen som en initial intravenös bolus, omedelbart följt av resten av den totala dosen som intravenös infusion under 60 minuter.
| DOSERINGSTABELL FÖR AKUT ISCHEMISK STROKE | |||
| Genom att använda standardkoncentrationen 1 mg/ml är volymen (ml) som ska administreras lika med den rekommenderade dosen i mg | |||
Vikt
(kg) | Total dos
(mg) | Bolusdos
(mg) | Infusionsdos*
(mg) |
| 40 | 36,0 | 3,6 | 32,4 |
| 42 | 37,8 | 3,8 | 34,0 |
| 44 | 39,6 | 4,0 | 35,6 |
| 46 | 41,4 | 4,1 | 37,3 |
| 48 | 43,2 | 4,3 | 38,9 |
| 50 | 45,0 | 4,5 | 40,5 |
| 52 | 46,8 | 4,7 | 42,1 |
| 54 | 48,6 | 4,9 | 43,7 |
| 56 | 50,4 | 5,0 | 45,4 |
| 58 | 52,2 | 5,2 | 47,0 |
| 60 | 54,0 | 5,4 | 48,6 |
| 62 | 55,8 | 5,6 | 50,2 |
| 64 | 57,6 | 5,8 | 51,8 |
| 66 | 59,4 | 5,9 | 53,5 |
| 68 | 61,2 | 6,1 | 55,1 |
| 70 | 63,0 | 6,3 | 56,7 |
| 72 | 64,8 | 6,5 | 58,3 |
| 74 | 66,6 | 6,7 | 59,9 |
| 76 | 68,4 | 6,8 | 61,6 |
| 78 | 70,2 | 7,0 | 63,2 |
| 80 | 72,0 | 7,2 | 64,8 |
| 82 | 73,8 | 7,4 | 66,4 |
| 84 | 75,6 | 7,6 | 68,0 |
| 86 | 77,4 | 7,7 | 69,7 |
| 88 | 79,2 | 7,9 | 71,3 |
| 90 | 81,0 | 8,1 | 72,9 |
| 92 | 82,8 | 8,3 | 74,5 |
| 94 | 84,6 | 8,5 | 76,1 |
| 96 | 86,4 | 8,6 | 77,8 |
| 98 | 88,2 | 8,8 | 79,4 |
| 100+ | 90,0 | 9,0 | 81,0 |
*given med koncentrationen 1 mg/ml under 60 min med konstant infusionshastighet.
Tilläggsbehandling: Säkerhet och effekt av denna behandling med samtidig administrering av heparin eller trombocytaggregationshämmare som acetylsalicylsyra inom de första 24 timmarna efter symtomdebut har inte studerats tillräckligt. Därför ska administrering av intravenöst heparin eller trombocytaggregationshämmare som acetylsalicylsyra undvikas under de första 24 timmarna efter behandling med Actilyse på grund av ökad risk för blödning. Om heparin krävs för andra indikationer (t ex prevention av djup ventrombos) skall dosen inte överstiga 10 000 IE per dag, administrerat subkutant.
Administreringssätt
Den färdigberedda lösningen ska ges intravenöst och ska användas omedelbart.
Injektionsflaskorna med 2 mg alteplas är inte indicerade för att användas vid denna indikation.
Pediatrisk population
Det finns begränsad erfarenhet av användning av Actilyse hos barn och ungdomar. Actilyse är kontraindicerat för behandling av akut ischemisk stroke hos barn och ungdomar under 16 år (se avsnitt 4.3 i SmPC). Dosen för ungdomar som är 16–17 år är samma som för vuxna (se avsnitt 4.4 i SmPC för rekommendationer om användning av bilddiagnostiska metoder innan behandling).
Ungdomar som är 16 år eller äldre ska behandlas enligt anvisningarna för den vuxna populationen efter att bilddiagnostik använts för att utesluta andra strokeliknande tillstånd och för att bekräfta arteriell ocklusion motsvarande de neurologiska symtomen.