Pakkausseloste
ACTILYSE injektio-/infuusiokuiva-aine ja liuotin, liuosta varten 20 mg, 50 mg
alteplaasi
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai sairaanhoitajan puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Actilyse on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Actilyse-valmistetta
- Miten Actilyse-valmiste annetaan
- Mahdolliset haittavaikutukset
- Actilyse-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Actilyse-valmisteen vaikuttava aine on alteplaasi. Se kuuluu trombolyyttisten lääkeaineiden ryhmään. Nämä lääkkeet vaikuttavat liuottamalla verisuoniin muodostuneita veritulppia.
Actilyse 10 mg, 20 mg ja 50 mg -valmisteita käytetään useiden sellaisten tilojen hoitoon, joiden syynä on verisuoniin muodostunut veritulppa. Tällaisia tiloja ovat mm.:
- sydänkohtaus (akuutti sydäninfarkti), joka johtuu sydämen sepelvaltimoiden veritulpista
- veritulpat keuhkovaltimoissa (akuutti massiivinen keuhkoembolia)
- aivohalvaukset, jotka johtuvat aivovaltimoiden veritulpista (akuutti iskeeminen aivohalvaus).
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Sinulle ei anneta Actilyse-valmistetta
- jos olet allerginen (yliherkkä) alteplaasille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on tai on äskettäin ollut jokin verenvuotoriskiä suurentava tila kuten:
- vuotohäiriö tai verenvuototaipumus
- vaikea tai vaarallinen verenvuoto jossain kehon osassa
- aivoverenvuoto tai kallonsisäinen verenvuoto
- kontrolloimaton, hyvin korkea verenpaine
- bakteeriperäinen sydänlihastulehdus tai sydänpussitulehdus
- haimatulehdus
- mahahaava tai haavainen suolistosairaus
- ruokatorven laskimonlaajentumat
- jokin verisuonten poikkeavuus, esimerkiksi valtimonpullistuma
- tietyntyyppinen kasvain
- vaikea maksasairaus
- jos käytät jotakin veren hyytymistä estävää lääkettä (suun kautta otettavaa antikoagulanttia), ellei asianmukaisin testein ole osoitettu, ettei näillä lääkkeillä ole kliinisesti merkittävää vaikutusta
- jos sinulle on joskus tehty aivo- tai selkärankaleikkaus
- jos sinulle on tehty suuri leikkaus tai olet saanut huomattavan vamman edeltävien 3 kuukauden aikana
- jos sinulle on äskettäin tehty punktio suureen verisuoneen
- jos olet saanut ulkoista sydänhierontaa edeltävien 10 päivän aikana
- jos olet synnyttänyt edeltävien 10 päivän aikana.
Lääkäri ei myöskään käytä Actilyse-valmistetta sydänkohtauksen eikä keuhkoveritulpan hoitoon
- jos sinulla on tai on aiemmin ollut aivoverenvuodon aiheuttama aivohalvaus
- jos sinulla on tai on ollut tuntemattomasta syystä johtunut aivohalvaus
- jos sinulla on äskettäin (edeltävien 6 kk aikana) ollut aivoveritulpan aiheuttama aivohalvaus (parhaillaan hoidettavaa aivoinfarktia lukuun ottamatta).
Lääkäri ei myöskään käytä Actilyse-valmistetta aivovaltimoiden veritulpan aiheuttaman aivohalvauksen hoitoon
- jos aivohalvauksen oireet alkoivat yli 4,5 tuntia sitten tai jos on mahdollista, että oireet alkoivat yli 4,5 tuntia sitten, koska niiden alkamisaikaa ei tiedetä
- jos aivohalvaus aiheuttaa vain hyvin lieviä oireita
- jos sinulla on aivoverenvuodon merkkejä
- jos sinulla on ollut aivohalvaus edeltävien 3 kuukauden aikana
- jos oireet korjautuvat nopeasti ennen Actilyse-hoitoa
- jos kyseessä on hyvin vaikea aivoinfarkti
- jos sinulla oli aivoinfarktin alkaessa kouristuksia
- jos tromboplastiiniaikasi (veren hyytymistä mittaava verikoearvo) on poikkeava. Tämä arvo voi olla poikkeava, jos olet saanut veren hyytymistä ehkäisevää hepariinia edeltävien 48 tunnin aikana.
- jos sairastat diabetesta ja sinulla on ollut aiemmin aivohalvaus
- jos verihiutaleiden määrä veressäsi on hyvin alhainen
- jos verenpaineesi on hyvin korkea (yli 185/110) ja saadaan hallintaan vain pistosmuotoisilla lääkkeillä
- jos verensokeriarvosi ovat hyvin alhaiset (alle 2,8 mmol/l)
- jos verensokeriarvosi ovat hyvin korkeat (yli 22,2 mmol/l)
- jos olet alle 16-vuotias. (16-vuotiaat tai sitä vanhemmat nuoret ks. kohta Lääkäri on erityisen varovainen Actilyse-hoitosi suhteen).
Lääkäri on erityisen varovainen Actilyse-hoitosi suhteen
- jos olet saanut minkä tahansa muun allergisen reaktion kuin äkillisen henkeä uhkaavan allergisen reaktion (vakavan yliherkkyysreaktion) vaikuttavasta aineesta alteplaasista tai jostain muusta tämän lääkkeen aineesta (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on tai on äskettäin ollut jokin muu verenvuotoriskiä suurentava tila, esim.
- olet saanut pienen vamman
- sinulta on otettu kudosnäyte (biopsia)
- sinulle on tehty jonkin suuren verisuonen punktio
- olet saanut injektion lihakseen
- olet saanut ulkoista sydänhierontaa
- jos olet saanut aiemmin Actilyse-hoitoa
- jos olet yli 65-vuotias
- jos olet yli 80-vuotias, hoitotuloksesi voi olla huonompi riippumatta siitä saatko Actilyse-hoitoa vai et. Kuitenkin Actilyse-hoidon hyöty on yli 80-vuotiaille potilaille suurempi kuin mahdollinen riski. Tämän takia ikä ei ole este Actilyse-hoidolle.
- jos olet 16-vuotias tai sitä vanhempi nuori, hoidon hyödyt ja riskit punnitaan tarkasti yksilökohtaisesti aivovaltimoiden veritulpan aiheuttaman aivohalvauksen hoidossa.
Muut lääkevalmiseet ja Actilyse
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt muita lääkkeitä, myös lääkkeitä, joita lääkäri ei ole määrännyt. On erityisen tärkeää, että kerrot lääkärille, jos käytät tai olet äskettäin käyttänyt jotakin seuraavista:
- veren hyytymistä ehkäisevät lääkkeet kuten:
- asetyylisalisyylihappo
- varfariini
- kumariini
- hepariini
- tietyt verenpainelääkkeet (ACE-estäjät).
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa. Lääkäri antaa sinulle Actilyse-hoitoa vain, jos sen mahdolliset hyödyt ylittävät sen mahdollisesti aiheuttamat riskit lapselle.
Miten valmistetta käytetään
Lääkäri tai muu hoitohenkilöstö laittaa Actilyse-valmisteen käyttökuntoon ja antaa sen sinulle. Sitä ei oteta itse.
Actilyse-hoito tulee aloittaa mahdollisimman pian oireiden alkamisen jälkeen.
Lääkettä voidaan käyttää kolmen eri tilan hoitoon:
Sydänkohtaus (akuutti sydäninfarkti)
Saamasi annos riippuu painostasi. Suurin Actilyse-annos on 100 mg, mutta jos painat alle 65 kg, saat pienemmän annoksen.
Lääke voidaan antaa kahdella eri tavalla:
a) Annostelu 90 minuutissa, jos hoito annetaan 6 tunnin kuluessa oireiden alkamisesta. Hoidon yhteydessä
- osa Actilyse-annoksesta annetaan aluksi injektiona laskimoon
- loput annoksesta annetaan infuusiona seuraavien 90 minuutin kuluessa.
b) Annostelu 3 tunnin kuluessa, jos hoito annetaan 6–12 tunnin kuluttua oireiden alkamisesta. Hoidon yhteydessä
- osa Actilyse-annoksesta annetaan aluksi injektiona laskimoon
- loput annoksesta annetaan infuusiona seuraavien 3 tunnin kuluessa.
Actilyse-valmisteen lisäksi lääkäri antaa sinulle myös toista veren hyytymistä ehkäisevää lääkettä. Se annetaan mahdollisimman pian sen jälkeen, kun alat tuntea rintakipua.
Veritulpat keuhkovaltimoissa (akuutti massiivinen keuhkoembolia)
Saamasi annos riippuu painostasi. Suurin Actilyse-annos on 100 mg, mutta jos painat alle 65 kg, saat pienemmän annoksen.
Lääke annetaan yleensä seuraavasti:
- osa annoksesta annetaan aluksi injektiona laskimoon
- loput annoksesta annetaan infuusiona seuraavien 2 tunnin kuluessa.
Actilyse-hoidon jälkeen lääkäri määrää sinulle veren hyytymistä estävää hepariinihoitoa (tai aloittaa sen uudelleen).
Aivovaltimon veritulpan aiheuttama aivohalvaus (akuutti iskeeminen aivohalvaus)
Actilyse tulee antaa 4,5 tunnin kuluessa oireiden alkamisesta. Mitä nopeammin saat Actilyse-valmistetta, sitä enemmän hyötyä saat hoidosta ja sitä epätodennäköisemmin saat haittavaikutuksia. Saamasi annos riippuu painostasi. Suurin Actilyse-annos on 90 mg, mutta jos painat alle 100 kg, saat pienemmän annoksen. Actilyse annetaan seuraavasti:
- osa annoksesta annetaan aluksi injektiona laskimoon
- loput annoksesta annetaan infuusiona seuraavien 60 minuutin kuluessa.
Et saa ottaa asetyylisalisyylihappoa ennen kuin aivohalvauksen Actilyse-hoidosta on kulunut 24 tuntia. Lääkäri antaa sinulle tarvittaessa hepariini-injektion.
Jos sinulla on kysymyksiä Actilyse-valmisteen käytöstä, käänny lääkärin tai terveydenhuollon ammattilaisen puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Actilyse-hoitoa saaneilla on esiintynyt seuraavia haittavaikutuksia:
Hyvin yleiset (yli 1 potilaalla kymmenestä)
- sydämen vajaatoiminta – hoidon lopettaminen voi olla välttämätöntä
- aivoverenvuoto, kun valmistetta on käytetty aivovaltimoiden veritulpan aiheuttaman aivohalvauksen hoitoon – hoidon lopettaminen voi olla välttämätöntä
- nesteen kertyminen keuhkoihin
- verenvuotoa vahingoittuneissa verisuonissa (kuten mustelma)
- alhainen verenpaine
- rintakipu (angina pectoris)
Yleiset (alle 1 potilaalla kymmenestä)
- uusi sydänkohtaus
- aivoverenvuoto, kun valmistetta on käytetty sydäninfarktin hoitoon – hoidon lopettaminen voi olla välttämätöntä
- sydänpysähdys – hoidon lopettaminen voi olla välttämätöntä
- sokki (hyvin alhainen verenpaine) sydämen toimintahäiriön vuoksi – hoidon lopettaminen voi olla välttämätöntä
- verenvuoto nielussa
- ruoansulatuskanavan verenvuoto, esim. verioksennukset tai veriset ulosteet, verenvuoto ikenistä
- mustelmanmuodostus, joka johtuu verenvuodosta kudoksiin
- virtsateiden tai sukuelinten verenvuoto, joka voi aiheuttaa verivirtsaisuutta
- verenvuoto tai mustelmanmuodostus pistoskohdassa
Melko harvinaiset (alle 1 potilaalla sadasta)
- keuhkoihin liittyvä verenvuoto, kuten veriyskökset tai hengitysteiden verenvuoto – hoidon lopettaminen voi olla välttämätöntä
- nenäverenvuoto
- epäsäännöllinen sydämen syke, kun sydämen verenkierto on palautunut
- sydänläppien vauriot tai sydämen kammioita erottavan väliseinän vauriot – hoidon lopettaminen voi olla välttämätöntä
- yhtäkkinen veritulppien muodostuminen keuhkoihin (keuhkoembolia), aivoihin (aivoembolia) tai kehon muihin osiin (systeeminen embolia)
- verenvuoto korvasta
- verenpaineen lasku
Harvinaiset (alle 1 potilaalla tuhannesta)
- verenvuoto sydänpussiin – hoidon lopettaminen voi olla välttämätöntä
- sisäinen verenvuoto vatsaontelon takaosaan, vatsakalvon taakse – hoidon lopettaminen voi olla välttämätöntä
- veritulppien muodostuminen ja kulkeutuminen muualle elimistöön. Oireet riippuvat siitä, mikä elin on kyseessä.
- allergiset reaktiot, esim. nokkosihottuma ja ihottuma, keuhkoputkien supistumisesta johtuvat hengitysvaikeudet, turvotus ihon tai limakalvojen alla (angioödeema), alhainen verenpaine tai sokki – hoidon lopettaminen voi olla välttämätöntä
- verenvuoto silmissä
- pahoinvointi
Hyvin harvinaiset (alle 1 potilaalla kymmenestätuhannesta)
- vakava allerginen reaktio (esim. henkeä uhkaava anafylaksia) – hoidon lopettaminen voi olla välttämätöntä
- hermosto-oireet, esim.
- kouristukset
- puheen häiriöt
- sekavuus tai delirium (erittäin vakava sekavuustila)
- ahdistuneisuus, johon liittyy levottomuutta
- masennus
- muuttunut ajattelu (psykoosi)
Näitä häiriöitä esiintyy usein veritulpan aiheuttaman aivoinfarktin tai aivoverenvuodon yhteydessä.
Tuntematon (saatavissa oleva tieto ei riitä esiintyvyyden arviointiin)
- sisäelinten verenvuoto, esim. maksan verenvuoto – hoidon lopettaminen voi olla välttämätöntä
- kolesterolikiteiden muodostuminen ja kulkeutuminen muualle elimistöön (kolesterolikiteiden aiheuttama embolisaatio). Oireet riippuvat siitä, mikä elin on kyseessä – hoidon lopettaminen voi olla välttämätöntä
- verensiirtoa vaativa verenvuoto
- oksentelu
- kehon lämpötilan nousu (kuume)
Verenvuoto aivoissa tai muut vakavat verenvuototapahtumat voivat johtaa kuolemaan tai pysyvään vammautumiseen.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Sinun ei normaalisti tarvitse säilyttää Actilyse-valmistetta, sillä lääkäri antaa sen sinulle.
Ei lasten ulottuville eikä näkyville.
Säilytä alle 25 °C. Säilytä alkuperäispakkauksessa. Herkkä valolle.
Älä käytä Actilyse-valmistetta injektiopullon etiketissä ja pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Käyttökuntoon saatettu liuos
Käyttökuntoon saatetun liuoksen on osoitettu säilyvän enimmillään 24 tunnin ajan 2–8 °C:ssa ja 8 tunnin ajan 25 °C:ssa.
Mikrobiologiselta kannalta valmiste pitää käyttää heti käyttökuntoon saattamisen jälkeen. Ellei sitä käytetä heti, käytönaikainen säilytysaika ja käyttöä edeltävät olosuhteet ovat käyttäjän vastuulla, ja aika ei yleensä ole yli 24 tuntia 2–8 °C:ssa.
Pakkauksen sisältö ja muuta tietoa
Mitä Actilyse sisältää
- Vaikuttava aine on alteplaasi. Yksi injektiopullo sisältää 10 mg (vastaten 5 800 000 KY), 20 mg (vastaten 11 600 000 KY) tai 50 mg (vastaten 29 000 000 KY) alteplaasia. Alteplaasi tuotetaan yhdistelmä-DNA-tekniikalla käyttäen kiinanhamsterin munasarjasolulinjaa. Muut aineet ovat arginiini, fosforihappo (pH:n säätämiseen) ja polysorbaatti 80.
- Liuotin on injektionesteisiin käytettävää vettä.
Actilyse-valmisteen kuvaus ja pakkauskoot
Actilyse on injektio-/infuusiokuiva-aine ja liuotin liuosta varten. Yksi pakkaus sisältää yhden kuiva-ainetta sisältävän injektiopullon ja yhden injektiopullon, joka sisältää liuotinta.
Actilyse-valmisteesta on saatavilla seuraavat pakkauskoot:
- yksi kuiva-ainetta sisältävä injektiopullo, jossa 10 mg alteplaasia, ja yksi injektiopullo, jossa 10 ml liuotinta.
- yksi kuiva-ainetta sisältävä injektiopullo, jossa 20 mg alteplaasia, yksi injektiopullo, jossa 20 ml liuotinta, ja yksi siirtokanyyli.
- yksi kuiva-ainetta sisältävä injektiopullo, jossa 50 mg alteplaasia, yksi injektiopullo, jossa 50 ml liuotinta, ja yksi siirtokanyyli.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
Boehringer Ingelheim International GmbH
Binger Strasse 173
55216 Ingelheim am Rhein
Saksa
Valmistaja
Boehringer Ingelheim Pharma GmbH & Co. KG
Birkendorfer Strasse 65
88397 Biberach/Riss
Saksa
Lisätietoja antaa:
Boehringer Ingelheim Finland Ky
Tammasaarenkatu 5
00180 Helsinki
Puh: +358 10 310 2800
Tämä pakkausseloste on hyväksytty viimeksi 13.02.2024
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
2 mg:n alteplaasivalmistetta ei ole tarkoitettu käyttöön akuutin sydäninfarktin, akuutin massiivisen keuhkoembolian tai akuutin iskeemisen aivohalvauksen hoitoon (suuresta aliannostuksen riskistä johtuen). Ainoastaan 10 mg, 20 mg tai 50 mg injektiopullot on tarkoitettu näihin käyttöaiheisiin.
Käyttökuntoon saattaminen
Haluttaessa käyttökuntoon saatettu liuos, jonka alteplaasipitoisuus on 1 mg/ml, koko liuotinmäärä siirretään Actilyse kuiva-ainepulloon. Tähän tarkoitukseen pitää käyttää siirtokanyylia, joka on mukana Actilyse 20 mg:n ja 50 mg:n pakkauksissa. Actilyse 10 mg:n injektiopulloissa käytetään ruiskua.
Haluttaessa käyttökuntoon saatettu liuos, jonka alteplaasipitoisuus on 2 mg/ml, vain puolet liuotinmäärästä käytetään (alla olevan taulukon mukaisesti). Näissä tapauksissa tarvittava määrä liuotinta siirretään aina ruiskulla Actilyse kuiva-ainepulloon.
Actilyse injektiopullon sisältö (10 mg, 20 mg tai 50 mg) liuotetaan aseptisesti injektionesteisiin käytettävään veteen seuraavan taulukon mukaan niin, että liuoksen alteplaasipitoisuudeksi saadaan joko 1 mg/ml tai 2 mg/ml:
| Actilyse-kuiva-aine | 10 mg | 20 mg | 50 mg |
| (a) Kuiva-aineeseen lisättävän steriilin injektionesteisiin käytettävän veden määrä |
10 ml |
20 ml |
50 ml |
| Lopullinen pitoisuus: | alteplaasi 1 mg/ml | alteplaasi 1 mg/ml | alteplaasi 1 mg/ml |
| (b) Kuiva-aineeseen lisättävän steriilin injektionesteisiin käytettävän veden määrä | 5 ml | 10 ml | 25 ml |
| Lopullinen pitoisuus: | alteplaasi 2 mg/ml | alteplaasi 2 mg/ml | alteplaasi 2 mg/ml |
Käyttökuntoon saatettu Actilyse-infuusioneste annetaan laskimoon. Käyttökuntoon saatettu liuos, jonka pitoisuus on 1 mg/ml voidaan edelleen laimentaa steriilillä injektionesteisiin käytettävällä natriumkloridiliuoksella 9 mg/ml (0,9 %) siten, että pitoisuus on vähintään 0,2 mg/ml, koska käyttökuntoon saatetun liuoksen samentumista ei voida poissulkea. Käyttökuntoon saatetun liuoksen, jonka pitoisuus on 1 mg/ml edelleen laimentamista steriilillä injektionesteisiin käytettävällä vedellä tai hiilihydraattipitoisten infuusioliuosten, kuten esim. glukoosiliuoksen, käyttöä ei suositella, koska käyttökuntoon saatetun liuoksen sameus lisääntyy. Actilyse-infuusionestettä ei saa sekoittaa muiden lääkevalmisteiden kanssa samaan infuusiopulloon (ei edes hepariinin kanssa).
Säilytysolosuhteet, ks. tämän selosteen kohta Valmisteen säilyttäminen.
Käyttökuntoon saatettu liuos on tarkoitettu kertakäyttöön. Käyttämättä jäänyt liuos on hävitettävä.
Ohjeet Actilyse-valmisteen käyttökuntoon saattamiseen
| 1 | Saata käyttökuntoon juuri ennen lääkkeen antamista. |  |
| 2 | Poista muovinen repäisysuojus molemmista injektiopulloista, joista toinen sisältää liuotinta (steriiliä vettä) ja toinen Actilyse -kuiva-ainetta. Suojus poistetaan kääntämällä sitä ylöspäin peukalon avulla. | 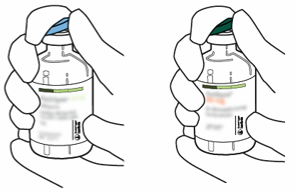 |
| 3 | Pyyhi kummankin injektiopullon kumitulpan pinta alkoholipyyhkeellä. | 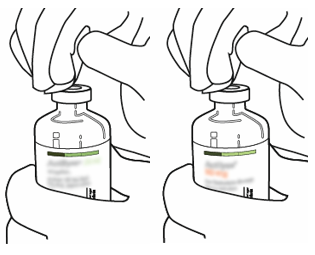 |
| 4 | Poista siirtokanyyli* pakkauksestaan. Älä desinfioi tai steriloi siirtokanyylia; se on steriili. Irrota toinen suojuksista. | 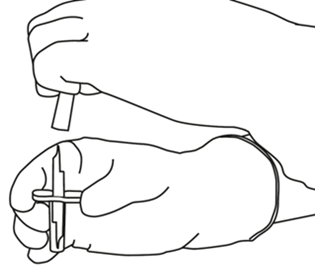 |
| 5 | Aseta liuotinta sisältävä injektiopullo pystyasennossa vakaalle alustalle. Lävistä pullon kumitulppa siirtokanyylilla suoraan ylhäältä kohtisuorassa kulmassa keskeltä tulppaa. Paina kevyesti mutta vakaasti, älä kierrä. | 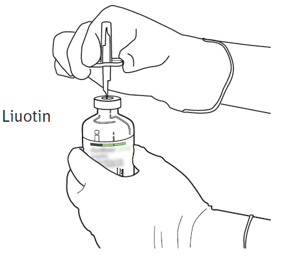 |
| 6 | Pidä liuotinta sisältävä injektiopullo ja siirtokanyyli paikoillaan yhdellä kädellä käyttäen apuna siirtokanyylin kahta siivekettä.
Irrota toinenkin siirtokanyylin päällä oleva suojus. | 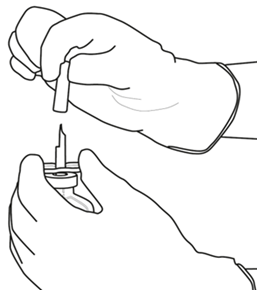 |
| 7 | Pidä liuotinta sisältävä injektiopullo ja siirtokanyyli paikoillaan yhdellä kädellä käyttäen apuna kahta siivekettä.
Pidä Actilyse-kuiva-ainetta sisältävä injektiopullo kohtisuorassa siirtokanyylin yläpuolella ja aseta siirtokanyylin kärki aivan kumitulpan keskelle.
Paina kuiva-ainetta sisältävä injektiopullo alas siirtokanyylin päälle kohtisuorassa kulmassa ylhäältä päin niin, että siirtokanyyli lävistää kumitulpan. Paina kevyesti mutta vakaasti, älä kierrä. | 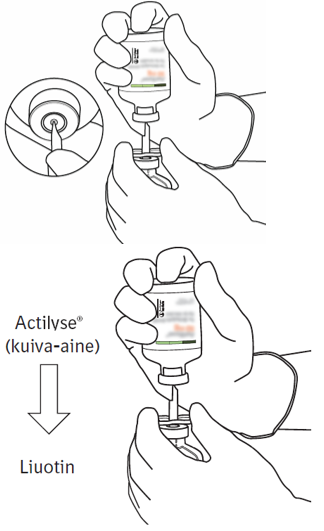 |
| 8 | Käännä injektiopullot ylösalaisin ja anna liuottimen valua kokonaan kuiva-aineen sekaan. | 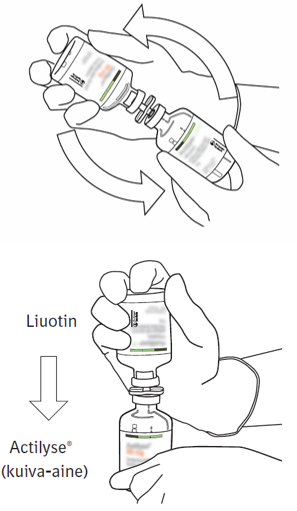 |
| 9 | Irrota tyhjä liuotinpullo yhdessä siirtokanyylin kanssa.
Ne voidaan hävittää. | 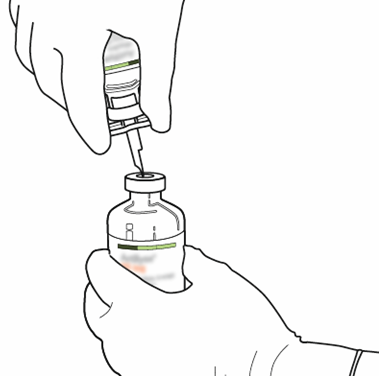 |
| 10 | Ota käyttökuntoon saatettua Actilyse-infuusionestettä sisältävä injektiopullo ja pyörittele sitä kevyesti, jotta kaikki kuiva-aine liukenee. Älä ravista, jotta liuos ei vaahtoudu.
Jos liuoksessa on kuplia, anna sen olla paikoillaan muutaman minuutin ajan, jotta kuplat katoavat. | 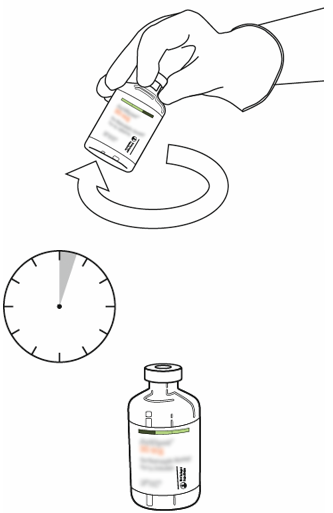 |
| 11 | Käyttökuntoon saatettu liuos sisältää 1 mg/ml alteplaasia. Liuoksen tulee olla kirkasta ja väritöntä tai vaaleankeltaista, eikä se saa sisältää minkäänlaisia partikkeleita. | |
| 12 | Ota tarvittava määrä liuosta käyttämällä vain neulaa ja ruiskua. Älä käytä siirtokanyylin tekemää lävistyskohtaa vuotamisen välttämiseksi. | 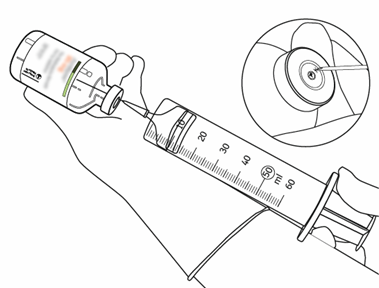 |
| 13 | Käytä välittömästi. Hävitä käyttämätön liuos. | |
(*jos siirtokanyyli kuuluu pakkaukseen. Käyttökuntoon saattamisen voi suorittaa myös neulaa ja ruiskua käyttäen.)
Annostus ja antotapa
Akuutti sydäninfarkti
Annostus
a) 90 minuutin (nopeutettu) anto potilaille, joilla on akuutti sydäninfarkti ja joiden hoito voidaan aloittaa 6 tunnin kuluessa oireiden alkamisesta.
Potilaat, joiden paino ≥ 65 kg:
| Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
| 15 mg i.v. boluksena, jonka jälkeen välittömästi | 15 ml | 7,5 ml |
| 50 mg i.v. infuusiona tasaisella nopeudella ensimmäisen 30 minuutin aikana, jonka jälkeen välittömästi | 50 ml | 25 ml |
| 35 mg i.v. infuusiona tasaisella nopeudella 60 minuutin aikana, kunnes kokonaismaksimiannos 100 mg on annettu | 35 ml | 17,5 ml |
Potilaille, joiden paino < 65 kg kokonaisannos määritetään painon mukaan seuraavan taulukon mukaisesti:
| Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
| 15 mg i.v. boluksena, jonka jälkeen välittömästi | 15 ml | 7,5 ml |
| 0,75 mg/painokilo i.v. infuusiona tasaisella nopeudella ensimmäisen 30 minuutin aikana, jonka jälkeen välittömästi | 0,75 ml/painokilo | 0,375 ml/painokilo |
| 0,5 mg/painokilo i.v. infuusiona tasaisella nopeudella 60 minuutin aikana | 0,5 ml/painokilo | 0,25 ml/painokilo |
b) 3 tunnin anto potilaille, joilla on akuutti sydäninfarkti ja joiden hoito voidaan aloittaa 6 - 12 tunnin kuluessa oireiden alkamisesta.
Potilaat, joiden paino ≥ 65 kg:
| Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
| 10 mg i.v. boluksena, jonka jälkeen välittömästi | 10 ml | 5 ml |
| 50 mg i.v. infuusiona tasaisella nopeudella ensimmäisen tunnin aikana, jonka jälkeen välittömästi | 50 ml | 25 ml |
| 40 mg i.v. infuusiona tasaisella nopeudella seuraavien 2 tunnin aikana, kunnes kokonaismaksimiannos 100 mg on annettu | 40 ml | 20 ml |
Potilaat, joiden paino < 65 kg:
| Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
| 10 mg i.v. boluksena, jonka jälkeen välittömästi | 10 ml | 5 ml |
| i.v. infuusiona tasaisella nopeudella seuraavien 3 tunnin aikana kokonaismaksimiannokseen 1,5 mg/painokilo | 1,5 ml/painokilo | 0,75 ml/painokilo |
Lisähoito: Antitromboottista lisälääkitystä suositellaan nykyisten kansainvälisten hoitosuositusten mukaisesti ST-nousuinfarktipotilaille.
Antotapa
Käyttökuntoon saatettu liuos annetaan laskimoon ja on tarkoitettu välittömästi käytettäväksi.
2 mg:n alteplaasipulloja ei ole tarkoitettu tähän käyttöaiheeseen.
Akuutti massiivinen keuhkoembolia
Annostus
Potilaat, joiden paino ≥ 65 kg:
Kokonaisannos on 100 mg alteplaasia annettuna 2 tunnin aikana. Kliinistä kokemusta on eniten seuraavasta annostuksesta:
| Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
| 10 mg i.v. boluksena 1-2 minuutin aikana, jonka jälkeen välittömästi | 10 ml | 5 ml |
| 90 mg i.v. infuusiona tasaisella nopeudella seuraavien 2 tunnin aikana, kunnes kokonaismaksimiannos 100 mg on annettu | 90 ml | 45 ml |
Potilaat, joiden paino < 65 kg:
| Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
| 10 mg i.v. boluksena 1-2 minuutin aikana, jonka jälkeen välittömästi | 10 ml | 5 ml |
| i.v. infuusiona tasaisella nopeudella seuraavien 2 tunnin aikana kokonaismaksimiannokseen 1,5 mg/painokilo | 1,5 ml/painokilo | 0,75 ml/painokilo |
Lisähoito: Alteplaasihoidon jälkeen hepariinihoito tulisi aloittaa (tai sitä tulisi jatkaa), kun APTT -arvot ovat alle kaksinkertaisia normaaliarvojen ylärajaan nähden. Infuusio tulisi säätää siten, että APTT-arvot ovat välillä 50 – 70 s (1,5 - 2,5 -kertaisia viitearvoihin nähden).
Antotapa
Käyttökuntoon saatettu liuos annetaan laskimoon ja on tarkoitettu välittömästi käytettäväksi.
2 mg:n alteplaasipulloja ei ole tarkoitettu tähän käyttöaiheeseen.
Akuutti iskeeminen aivohalvaus
Hoidon voi toteuttaa ainoastaan sellaisten lääkäreiden vastuulla ja seurannassa, joilla on koulutusta ja kokemusta neurovaskulaarisesta hoidosta (ks. valmisteyhteenvedon kohdat 4.3 Vasta-aiheet ja 4.4 Varoitukset ja käyttöön liittyvät varotoimet). Lääkärin on oltava vastuussa hoidosta ja sen seurannasta.
| Actilyse-hoito on aloitettava niin aikaisin kuin mahdollista 4,5 tunnin kuluessa oireiden alkamisesta (ks. valmisteyhteenvedon kohta 4.4). Jos Actilyse-hoito aloitetaan yli 4,5 tuntia aivohalvausoireiden alkamisen jälkeen, Actilysen antoon liittyy negatiivinen hyöty-riskisuhde, joten hoitoa ei pidä aloittaa (ks. valmisteyhteenvedon kohta Farmakodynamiikka). |
Annostus
Suositeltava kokonaisannos on 0,9 mg alteplaasia painokiloa kohti (enintään 90 mg). Hoito aloitetaan 10 % kokonaisannoksesta sisältävällä laskimonsisäisellä boluksella, jonka jälkeen välittömästi annetaan jäljellä oleva määrä kokonaisannoksesta laskimonsisäisenä infuusiona 60 minuutin aikana.
| ANNOSTELUTAULUKKO AKUUTISSA ISKEEMISESSÄ AIVOHALVAUKSESSA | |||
| Käyttämällä suositeltua standardipitoisuutta 1 mg/ml, annettava määrä millilitroina vastaa suositeltua annosta milligrammoina | |||
Paino (kg) | Kokonaisannos (mg) | Bolusannos (mg) | Infuusioannos* (mg) |
| 40 | 36,0 | 3,6 | 32,4 |
| 42 | 37,8 | 3,8 | 34,0 |
| 44 | 39,6 | 4,0 | 35,6 |
| 46 | 41,4 | 4,1 | 37,3 |
| 48 | 43,2 | 4,3 | 38,9 |
| 50 | 45,0 | 4,5 | 40,5 |
| 52 | 46,8 | 4,7 | 42,1 |
| 54 | 48,6 | 4,9 | 43,7 |
| 56 | 50,4 | 5,0 | 45,4 |
| 58 | 52,2 | 5,2 | 47,0 |
| 60 | 54,0 | 5,4 | 48,6 |
| 62 | 55,8 | 5,6 | 50,2 |
| 64 | 57,6 | 5,8 | 51,8 |
| 66 | 59,4 | 5,9 | 53,5 |
| 68 | 61,2 | 6,1 | 55,1 |
| 70 | 63,0 | 6,3 | 56,7 |
| 72 | 64,8 | 6,5 | 58,3 |
| 74 | 66,6 | 6,7 | 59,9 |
| 76 | 68,4 | 6,8 | 61,6 |
| 78 | 70,2 | 7,0 | 63,2 |
| 80 | 72,0 | 7,2 | 64,8 |
| 82 | 73,8 | 7,4 | 66,4 |
| 84 | 75,6 | 7,6 | 68,0 |
| 86 | 77,4 | 7,7 | 69,7 |
| 88 | 79,2 | 7,9 | 71,3 |
| 90 | 81,0 | 8,1 | 72,9 |
| 92 | 82,8 | 8,3 | 74,5 |
| 94 | 84,6 | 8,5 | 76,1 |
| 96 | 86,4 | 8,6 | 77,8 |
| 98 | 88,2 | 8,8 | 79,4 |
| 100+ | 90,0 | 9,0 | 81,0 |
*annettuna pitoisuudella 1 mg/ml 60 minuutin aikana tasaisen nopeuden infuusiona.
Lisähoito: Tämän hoidon turvallisuutta ja tehoa ei ole riittävästi tutkittu annettaessa hepariinia tai verihiutaleiden estäjiä, kuten asetyylisalisyylihappoa samanaikaisesti ensimmäisen 24 tunnin aikana oireiden alkamisesta. Tämän vuoksi laskimonsisäisen hepariinin tai verihiutaleiden estäjien, kuten asetyylisalisyylihapon, käyttöä pitää välttää ensimmäisen 24 tunnin aikana Actilyse-hoidon jälkeen lisääntyneen verenvuotoriskin takia. Jos hepariinia tarvitaan muiden käyttöaiheiden vuoksi (kuten syvän laskimotukoksen ehkäisyyn) annos ei saa ylittää ihon alle annettuna 10000 kansainvälistä yksikköä vuorokaudessa.
Antotapa
Käyttökuntoon saatettu liuos annetaan laskimoon ja on tarkoitettu välittömästi käytettäväksi.
2 mg:n alteplaasipulloja ei ole tarkoitettu tähän käyttöaiheeseen.
Pediatriset potilaat
Actilyse-valmisteen käytöstä lapsille ja nuorille on vain vähän tietoa. Actilyse-valmisteen käyttö on vasta-aiheista alle 16-vuotiaiden lasten ja nuorten akuutin iskeemisen aivohalvauksen hoidossa (ks. valmisteyhteenvedon kohta Vasta-aiheet). Annos 16–17-vuotiaille nuorille on sama kuin aikuisille (ks. valmisteyhteenvedon kohdasta 4.4. suositukset ennen hoitoa käytettävistä kuvantamistekniikoista).
16-vuotiaita tai sitä vanhempia nuoria hoidetaan aikuisia koskevien valmisteyhteenvedon ohjeiden mukaisesti, kun asianmukaisella kuvantamistekniikalla on suljettu pois aivohalvausta muistuttavat tilat ja neurologista puutosoiretta vastaava valtimotukos on vahvistettu.