Pakkausseloste
QDENGA pulver och vätska till injektionsvätska, lösning i förfylld spruta
Tilläggsinformation
Qdenga, pulver och vätska till injektionsvätska, lösning i förfylld spruta
tetravalent denguevaccin (levande, försvagat)
Utökad övervakning
▼ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar du eventuellt får. Information om hur du rapporterar biverkningar finns i slutet av avsnitt Eventuella biverkningar.
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du eller ditt barn vaccineras. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig eller ditt barn. Ge det inte till andra.
- Om du eller ditt barn får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Qdenga är och vad det används för
2. Vad du behöver veta innan du eller ditt barn får Qdenga
3. Hur Qdenga ges
4. Eventuella biverkningar
5. Hur Qdenga ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Qdenga är ett vaccin. Det används för att skydda dig eller ditt barn mot denguefeber. Denguefeber är en sjukdom som orsakas av denguevirus, serotyp 1, 2, 3 och 4. Qdenga innehåller virus av alla dessa fyra varianter, men de har försvagats så att de inte kan orsaka sjukdomen.
Qdenga ges till vuxna, unga och barn (från 4 års ålder).
Qdenga ska användas i enlighet med officiella rekommendationer.
Hur vaccinet fungerar
Qdenga stimulerar kroppens naturliga försvar (immunförsvaret). Detta hjälper till att skydda mot de virus som orsakar denguefeber, om kroppen utsätts för dessa i framtiden.
Vad är denguefeber
Dengue orsakas av ett virus.
- Viruset sprids genom myggor (Aedes-myggor).
- Virus från en infekterad person kan spridas till andra genom myggbett.
Dengue överförs inte direkt från person till person.
Denguefeber ger symtom som feber, huvudvärk, smärta bakom ögonen, smärta i muskler och leder, illamående, kräkningar, svullna körtlar och hudutslag. Symtomen på dengue varar vanligtvis i 2 till 7 dagar. Du kan även ha dengue utan att få några symtom.
Ibland kan dengue vara så pass allvarlig att sjukhusvård krävs, och i sällsynta fall kan sjukdomen leda till döden. Svår dengue kan ge hög feber och några av följande symtom: svår buksmärta (magont), ihållande kräkningar, snabb andning, svår blödning, blödning i magen, blödande tandkött, trötthet, rastlöshet, koma, anfall (kramper) och organsvikt.
Vad du behöver veta innan produkten används
För att försäkra dig om att Qdenga är lämpligt för dig eller ditt barn är det viktigt att du talar om för läkare, apotekspersonal eller sjuksköterska om någon av följande punkter gäller dig eller ditt barn. Tala med läkare, apotekspersonal eller sjuksköterska om det är något du inte förstår.
Använd inte Qdenga om du eller ditt barn
- vet att ni är allergiska mot de aktiva substanserna eller något annat innehållsämne i Qdenga (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- har fått en allergisk reaktion efter att ha använt Qdenga förut. Tecken på en allergisk reaktion kan inkludera kliande hudutslag, andnöd och svullnad i ansiktet och tungan.
- har ett svagt immunförsvar (kroppens naturliga försvar). Detta kan vara orsakat av ett genetisk fel eller av hivinfektion.
- använder ett läkemedel som påverkar immunförsvar (såsom högdosbehandling med kortikosteroider eller kemoterapi). Läkaren kommer inte att ge dig Qdenga förrän en tid efter att behandlingen avslutats.
- är gravid eller ammar.
Använd inte Qdenga om något av ovanstående gäller dig.
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Qdenga om du eller ditt barn:
- har en infektion med feber. Det kan bli nödvändigt att skjuta upp vaccinationen tills du eller ditt barn har tillfrisknat.
- någonsin har fått hälsoproblem i samband med en vaccination. Läkaren kommer att noggrant överväga riskerna och fördelarna med vaccination.
- någonsin har svimmat efter en injektion. Yrsel, svimning eller att ibland falla omkull, kan ske till följd av, och även inför, alla nålinjektioner (detta förekommer främst hos unga människor).
Viktig information om skyddet som ges
Som med alla vacciner kan det hända att Qdenga inte skyddar alla som får det och skyddet kan minska med tiden. Du kan fortfarande få denguefeber av myggbett, inklusive svår dengueinfektion. Du måste fortsätta skydda dig själv och ditt barn mot myggbett även efter vaccination med Qdenga.
Efter vaccination ska du vända dig till läkare om du eller ditt barn tror att ni kan ha en dengueinfektion och utvecklar något av följande symtom: hög feber, svår buksmärta, ihållande kräkningar, snabb andning, blödande tandkött, trötthet, rastlöshet eller blodiga kräkningar.
Ytterligare skyddsåtgärder
Du ska vidta försiktighetsåtgärder för att förhindra myggbett. I detta ingår att använda insektsavvisande medel, bära kläder som skyddar mot bett, och använda myggnät.
Yngre barn
Qdenga får inte ges till barn under 4 år.
Andra läkemedel och Qdenga
Qdenga kan ges samtidigt som vaccin mot hepatit A, gula febern eller humant papillomavirus på ett separat injektionsställe (på en annan del av kroppen, vanligtvis den andra armen) under samma besök.
Tala om för läkaren eller apotekspersonalen om du eller ditt barn använder, nyligen har använt eller kan komma att använda några andra vacciner eller mediciner.
Tala särskilt om för läkaren eller apotekspersonalen om du eller ditt barn använder något av följande:
- Läkemedel som påverkar kroppens naturliga försvar (immunförsvaret) såsom högdosbehandling med kortikosteroider eller kemoterapi. I det fallet kommer läkaren inte att använda Qdenga förrän en tid efter att behandlingen avslutats. Detta beror på att Qdenga kanske annars ger sämre effekt.
- Läkemedel som kallas ”immunglobuliner” eller blodprodukter som innehåller immunglobuliner, såsom blod eller plasma. I detta fall kan läkaren inte ge Qdenga förrän efter 6 veckor, och helst inte förrän 3 månader efter att behandlingen avslutats. Detta beror på att Qdenga kanske annars ger sämre effekt.
Graviditet och amning
Använd inte Qdenga om du eller din dotter är gravid eller ammar. Om du eller din dotter
- är i fertil ålder ska nödvändiga försiktighetsåtgärder tas för att undvika att bli gravid under en månad efter vaccinationen med Qdenga.
- misstänker graviditet eller planerar att bli gravid, rådfråga läkare, apotekspersonal eller sjuksköterska innan du använder detta läkemedel.
Körförmåga och användning av maskiner
Under de första dagarna efter vaccinationen, kan Qdenga ha en mindre påverkan på din förmåga att framföra fordon och använda maskiner.
Qdenga innehåller natrium och kalium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per 0,5 ml dos, d.v.s. är näst intill ”natriumfritt”.
Detta läkemedel innehåller mindre än 1 mmol (39 mg) kalium per 0,5 ml dos, d.v.s. är näst intill ”kaliumfritt”.
Hur produkten används
Qdenga ges av läkare eller sjuksköterska som en injektion under huden (subkutan injektion) i överarmen. Vaccinet får inte injiceras i ett blodkärl.
Du eller ditt barn kommer att få 2 injektioner.
Den andra injektionen ges 3 månader efter den första injektionen.
Det finns inga data tillgängliga från vuxna över 60 år. Kontakta din läkare för råd om huruvida det är bra för dig att få Qdenga.
Qdenga ska användas i enlighet med officiella rekommendationer.
Anvisningar för beredning av vaccinet för hälso- och sjukvårdspersonal finns i slutet av bipacksedeln.
Om du eller ditt barn har glömt en injektion av Qdenga
- Om du eller ditt barn har glömt en schemalagd injektion, kommer läkaren besluta om när den uteblivna injektionen ska ges. Det är viktigt att du eller ditt barn följer anvisningarna som läkaren, apotekspersonalen eller sjuksköterskan ger angående den andra injektionen.
- Om du glömmer eller inte har möjlighet att komma till den schemalagda injektionen, rådfråga läkaren, apotekspersonalen eller sjuksköterskan.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
- Allvarlig allergisk (anafylaktisk) reaktion
Om något av dessa symtom inträffar efter att du lämnat platsen där du eller ditt barn fick en injektion, kontakta läkare omedelbart:
• andningssvårigheter
• tungan eller läpparna blir blå
• utslag
• ansiktet eller halsen svullnar
• lågt blodtryck som orsakar yrsel eller svimning
• en plötslig och allvarlig sjukdoms- eller obehagskänsla med blodtrycksfall som orsakar yrsel och förlorat medvetande, snabba hjärtslag kopplat till svårighet att andas.
Dessa tecken eller symtom (anafylaktiska reaktioner) utvecklas vanligtvis strax efter att injektionen har getts och medan du eller ditt barn ännu är kvar på kliniken eller mottagningen. De kan också i mycket sällsynta fall inträffa efter att man fått vilken vaccin som helst.
Följande biverkningar förekom under studier hos barn, unga och vuxna.
Mycket vanliga (kan förekomma hos fler än 1 av 10 personer):
- smärta vid injektionsstället
- huvudvärk
- muskelsmärta
- rodnad vid injektionsstället
- allmän sjukdomskänsla
- svaghet
- infektioner i näsan och svalget
- feber.
Vanliga (kan förekomma hos upp till 1 av 10 personer):
- svullnad vid injektionsstället
- smärta eller inflammation i näsan och svalget
- blåmärken vid injektionsstället
- klåda vid injektionsstället
- inflammation i hals och tonsiller
- ledsmärta
- influensaliknande sjukdom.
Mindre vanliga (kan förekomma hos upp till 1 av 100 personer):
- diarré
- illamående
- magsmärta
- kräkningar
- blödning vid injektionsstället
- yrsel
- kliande hud
- hudutslag, inklusive flammiga eller kliande hudutslag
- nässelutslag
- trötthet
- färgförändringar i huden vid injektionsstället
- inflammation i luftvägarna
- rinnsnuva.
Sällsynta (kan förekomma hos upp till 1 av 1 000 personer):
- små röda eller lila prickar under huden (petekier).
Mycket sällsynta (kan förekomma hos upp till 1 av 10 000 personer):
- snabb svullnad under huden på områden som ansikte, hals, armar och ben.
- låga nivåer av blodplättar (trombocytopeni).
Ingen känd frekvens (kan inte beräknas från tillgängliga data):
- plötslig, allvarlig allergisk (anafylaktisk) reaktion, med svårighet att andas, svullnad, yrsel, snabba hjärtslag, svettning och förlorat medvetande
- ögonsmärta.
Ytterligare biverkningar hos barn i åldern 4 till 5 år:
Mycket vanliga (kan förekomma hos fler än 1 av 10 personer):
- minskad aptit
- trötthet
- irritabilitet.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvaras utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2ºC‑8ºC). Får ej frysas.
Förvara vaccinet i ytterkartongen.
Efter beredning (rekonstituering) med den tillhörande vätskan ska Qdenga användas omedelbart. Om Qdenga inte används omedelbart måste det användas inom 2 timmar.
Läkemedlet ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Vad Qdenga innehåller
- Efter beredning innehåller en dos (0,5 ml):
Denguevirus av serotyp 1 (levande, försvagat)*: ≥ 3,3 log10 PFU**/dos
Denguevirus av serotyp 2 (levande, försvagat)#: ≥ 2,7 log10 PFU**/dos
Denguevirus av serotyp 3 (levande, försvagat)*: ≥ 4,0 log10 PFU**/dos
Denguevirus av serotyp 4 (levande, försvagat)*: ≥ 4,5 log10 PFU**/dos
*Framställt i Vero-celler med rekombinant DNA-teknik. Gener av serotypspecifika ytproteiner införda i en typ 2-denguevirus backbone. Denna produkt innehåller genetiskt modifierade organismer (GMO).
#Framställt i Vero-celler med rekombinant DNA-teknik.
**PFU = plackbildande enheter
- Övriga innehållsämnen är: α,α-trehalosdihydrat, poloxamer 407, humant serumalbumin, kaliumdivätefosfat, dinatriumvätefosfat, kaliumklorid, natriumklorid, vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Qdenga består av pulver och vätska till injektionsvätska, lösning. Qdenga tillhandahålls som pulver i en endosflaska och vätska i en förfylld spruta med 2 separata nålar eller utan nålar.
Pulvret och vätskan måste blandas före användning.
Qdenga pulver och vätska till injektionsvätska, lösning i förfylld spruta, tillhandahålls i förpackningar om 1 eller 5 doser.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Pulvret är en vit till benvit, kompakt kaka.
Vätskan (natriumkloridlösning, 0,22 %) är en klar och färglös vätska.
Efter beredning är Qdenga en klar, färglös till svagt gul lösning, fri från främmande partiklar.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublin 2
D02 HW68
Irland
Tillverkare
Takeda GmbH
Produktionsanläggning Singen
Robert-Bosch-Str. 8
78224 Singen
Tyskland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Takeda Oy
Tel: 0800 774 051
medinfoEMEA@takeda.com
Denna bipacksedel ändrades senast månad 12/2025.
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats: http://www.ema.europa.eu.
------------------------------------------------------------------------------------------------------------------------
Direktiv för experterna inom hälsovården
- Liksom vid administrering av alla vaccininjektioner, ska tillbörlig medicinsk behandling och övervakning alltid finnas tillgängligt i händelse av en anafylaktisk reaktion efter administrering av Qdenga.
- Qdenga får inte blandas med andra vacciner eller läkemedel i samma spruta.
- Qdenga får inte under några omständigheter injiceras intravaskulärt.
- Immunisering ska utföras genom subkutan injektion, helst i överarmen i området kring deltamuskeln. Qdenga ska inte administreras genom intramuskulär injektion.
- Synkope (svimningsanfall) kan ske till följd av, eller även före, alla vaccinationer som en psykogen respons på nålinjektion. Rutiner bör finnas på plats för att förebygga skador från fall och för att hantera svimningsreaktioner.
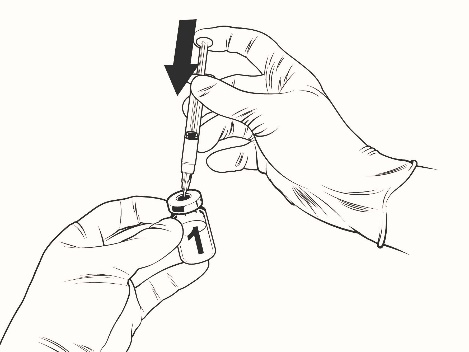
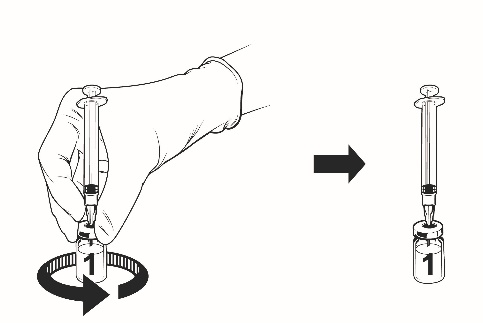
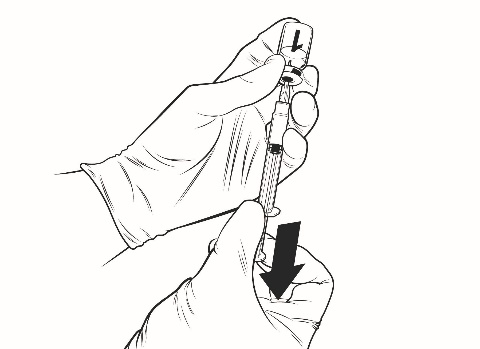
Anvisningar för beredning av vaccinet med vätska i förfylld spruta:
Qdenga är ett 2-komponentvaccin som består av en injektionsflaska med frystorkat vaccin och vätska som tillhandahålls i den förfyllda sprutan. Det frystorkade vaccinet måste beredas med vätskan före administrering.
Qdenga ska inte blandas med andra vacciner i samma spruta.
För att bereda Qdenga, använd endast vätskan (0,22-procentig natriumkloridlösning) i den förfyllda sprutan som tillhandahålls med vaccinet, eftersom den är fri från konserveringsmedel och andra antivirala substanser. Kontakt med konserveringsmedel, antiseptika, rengöringsmedel och andra antivirala substanser ska undvikas eftersom de kan inaktivera vaccinet.
Ta ut injektionsflaskan med vaccinet och den förfyllda sprutan med vätska ur kylskåpet.
Injektionsflaska med frystorkat vaccin |
|
Färdigberett vaccin |
|
Efter beredning är den färdiga lösningen en klar, färglös till svagt gul vätska, fri från främmande partiklar. Kassera vaccinet om partiklar förekommer och/eller om det är missfärgat.
Färdigberett vaccin |
|
Qdenga administreras omedelbart efter beredning. Kemisk och fysikalisk stabilitet vid användning har visats för 2 timmar i rumstemperatur (upp till 32,5 °C) från och med tidpunkten för beredning av vaccinet. Efter denna tidsperiod ska vaccinet kasseras. Lägg inte tillbaka det i kylskåpet. Ur ett mikrobiologiskt perspektiv ska Qdenga användas direkt efter öppnande. Om vaccinet inte används omedelbart ansvarar användaren för förvaringstid och förvaringsförhållanden.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.