Pakkausseloste
QDENGA injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku
Qdenga injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku
tetravalentti denguerokote (elävä, heikennetty)
Lisäseuranta
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista. Ks. kohdan Mahdolliset haittavaikutukset lopusta, miten haittavaikutuksista ilmoitetaan.
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin sinulle tai lapsellesi annetaan rokote, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle tai lapsellesi, eikä sitä pidä antaa muiden käyttöön.
- Jos saat tai lapsesi saa haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Qdenga on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat tai lapsesi saa Qdenga-valmistetta
3. Miten Qdenga-valmistetta annetaan
4. Mahdolliset haittavaikutukset
5. Qdenga-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Qdenga on rokote. Sitä käytetään suojaamaan sinua tai lastasi denguekuumeelta. Denguekuume on dengueviruksen serotyyppien 1, 2, 3 ja 4 aiheuttama sairaus. Qdenga sisältää heikennettyjä versioita näistä neljästä dengueviruksen serotyypistä, joten se ei voi aiheuttaa denguetautia.
Qdenga-valmistetta annetaan aikuisille, nuorille ja lapsille (vähintään 4-vuotiaille).
Qdenga-valmistetta on käytettävä virallisten suositusten mukaisesti.
Miten rokote toimii
Qdenga stimuloi elimistön luonnollista vastustuskykyä (immuunijärjestelmää). Tämä auttaa suojautumaan denguekuumetta aiheuttavilta viruksilta, jos elimistö altistuu näille viruksille tulevaisuudessa.
Mikä on denguekuume
Denguen aiheuttaa virus.
- Virus leviää hyttysten välityksellä (Aedes-hyttyset).
- Jos hyttynen puree denguepotilasta, se voi siirtää viruksen ihmisiin, joita se puree myöhemmin.
Dengue ei tartu suoraan ihmisestä toiseen.
Denguekuumeen merkkejä ovat kuume, päänsärky, kipu silmien takana, lihas- ja nivelkipu, huonovointisuus (pahoinvointi ja oksentelu), turvonneet imusolmukkeet tai ihottuma. Denguen merkit kestävät yleensä 2–7 päivää. Sinulla voi myös olla denguevirusinfektio ilman merkkejä sairaudesta.
Joskus dengue voi olla niin vaikea, että sinä tai lapsesi tarvitsette sairaalahoitoa, ja joissakin harvinaisissa tapauksissa se voi johtaa kuolemaan. Vaikea dengue voi aiheuttaa korkeaa kuumetta ja mitä tahansa seuraavista: voimakas vatsakipu, jatkuva pahoinvointi (oksentelu), nopea hengitys, vaikea verenvuoto, verenvuoto vatsassa, verenvuoto ikenistä, väsymyksen tunne, levottomuuden tunne, kooma, kouristuskohtaukset ja elimen vajaatoiminta.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Jotta voidaan varmistaa, että Qdenga sopii sinulle tai lapsellesi, on tärkeää, että kerrot lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos jokin alla olevista kohdista koskee sinua tai lastasi. Jos et ymmärrä jotakin kohtaa, pyydä lääkäriä, apteekkihenkilökuntaa tai sairaanhoitajaa selittämään se sinulle.
Älä käytä Qdenga-valmistetta, jos
- olet tai lapsesi on allerginen vaikuttavalle aineelle tai Qdenga-valmisteen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- olet saanut tai lapsesi on saanut allergisen reaktion aiemmin annetun Qdenga-valmisteen jälkeen. Allergisen reaktion merkkejä voivat olla kutiava ihottuma, hengenahdistus ja kasvojen ja kielen turvotus.
- sinulla tai lapsellasi on heikentynyt immuunijärjestelmä (elimistön luonnollinen vastustuskyky). Tämä voi johtua geenivirheestä tai HIV-infektiosta.
- käytät tai lapsesi käyttää immuunijärjestelmään vaikuttavaa lääkettä (kuten suuriannoksisia kortikosteroideja tai solunsalpaajahoitoa). Lääkärisi voi antaa Qdenga-valmistetta vasta jonkin ajan kuluttua tämän lääkityksen lopettamisesta.
- olet raskaana tai imetät.
Älä käytä Qdenga-valmistetta, jos mikä tahansa yllä olevista koskee sinua tai lastasi.
Varoitukset ja varotoimet
Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle ennen Qdenga-valmisteen saamista:
- jos sinulla tai lapsellasi on kuumeinen infektio. Rokotusta voi joutua lykkäämään toipumiseen asti.
- jos sinulla tai lapsellasi on joskus ilmentynyt terveysongelmia rokottamisen yhteydessä. Lääkärisi punnitsee tarkkaan rokottamisen riskit ja hyödyt.
- jos sinä olet tai lapsesi on joskus pyörtynyt injektion jälkeen. Huimausta, pyörtymistä ja joskus kaatumista voi esiintyä (useimmiten nuorilla ihmisillä) neulalla annetun injektion jälkeen tai jopa ennen injektion antamista.
Tärkeää tietoa rokotteen antamasta suojasta
Kaikkien muiden rokotteiden tavoin Qdenga ei välttämättä suojaa kaikkia sitä saavia. Lisäksi suoja saattaa heiketä ajan myötä. Voit silti saada hyttysenpuremista denguekuumeen, mukaan lukien vakavan denguetaudin. Sinun on suojeltava itseäsi tai lastasi hyttysenpuremilta myös Qdenga-rokotuksen jälkeen.
Kerro lääkärille, jos uskot sairastuneesi tai lapsesi sairastuneen dengueinfektioon rokottamisen jälkeen ja sinulle tai hänelle kehittyy jokin seuraavista oireista: korkea kuume, voimakas vatsakipu, jatkuva oksentelu, nopea hengitys, vuotavat ikenet, väsymys, levottomuus ja verta oksennuksessa.
Lisävarotoimet
Suojaa itsesi hyttysten pistoilta. Käytä hyttyskarkotteita, suojaavaa vaatetusta ja hyttysverkkoa.
Pienet lapset
Qdenga-valmistetta ei saa antaa alle 4-vuotiaille lapsille.
Muut lääkevalmisteet ja Qdenga
Qdenga-valmistetta voidaan antaa hepatiitti A -rokotteen, keltakuumerokotteen tai HPV- eli papilloomavirusrokotteen kanssa eri injektiokohtaan (toiseen kehon osaan, yleensä toiseen käsivarteen) samalla käynnillä.
Kerro lääkärille tai apteekkihenkilökunnalle, jos sinä tai lapsesi parhaillaan käyttää tai olette äskettäin käyttäneet tai saatatte käyttää muita rokotteita tai lääkkeitä.
Kerro lääkärille tai apteekkihenkilökunnalle etenkin, jos käytät tai lapsesi käyttää jotakin seuraavista:
- Lääkkeitä, jotka vaikuttavat elimistön luonnolliseen vastustuskykyyn (immuunijärjestelmään), kuten suuriannoksiset kortikosteroidit tai solunsalpaajahoito. Tässä tapauksessa lääkärisi voi antaa Qdenga-valmistetta vasta jonkin ajan kuluttua lääkityksen lopettamisesta. Tämä johtuu siitä, ettei Qdenga välttämättä tehoa yhtä hyvin.
- ”Immunoglobuliineiksi” kutsuttuja lääkkeitä tai immunoglobuliineja sisältäviä verivalmisteita, kuten verta tai plasmaa. Tässä tapauksessa lääkäri voi antaa Qdenga-valmisteen aikaisintaan 6 viikon, mieluiten vähintään 3 kuukauden kuluttua lääkityksen lopettamisesta. Tämä johtuu siitä, ettei Qdenga välttämättä tehoa yhtä hyvin.
Raskaus ja imetys
Älä ota Qdenga-valmistetta, jos olet raskaana tai imetät. Älä ota Qdenga-valmistetta tyttärellesi, jos hän on raskaana tai imettää. Jos sinä voit tai tyttäresi voi tulla raskaaksi:
- sinun tai tyttäresi täytyy käyttää tarpeellisia varotoimia raskauden estämiseksi yhden kuukauden ajan Qdenga-rokotuksen jälkeen.
- jos epäilet olevasi raskaana tai että tyttäresi on raskaana tai suunnittelette lapsen hankkimista, kysy lääkäriltä, apteekkihenkilökunnalta tai sairaanhoitajalta neuvoa ennen Qdenga-valmisteen käyttöä.
Ajaminen ja koneiden käyttö
Qdenga-valmisteella on vähäinen vaikutus ajokykyyn ja koneiden käyttökykyyn ensimmäisinä päivinä rokotuksen jälkeen.
Qdenga sisältää natriumia ja kaliumia
Qdenga-valmiste sisältää alle 1 mmol natriumia (23 mg) per 0,5 ml:n annos, eli sen voidaan sanoa olevan ”natriumiton”.
Qdenga-valmiste sisältää alle 1 mmol kaliumia (39 mg) per 0,5 ml:n annos, eli sen voidaan sanoa olevan ”kaliumiton”.
Miten valmistetta käytetään
Lääkäri tai sairaanhoitaja antaa Qdenga-valmisteen injektiona ihon alle (ihonalainen injektio) olkavarteen. Sitä ei saa antaa verisuoneen.
Sinulle tai lapsellesi annetaan kaksi injektiota.
Toinen injektio annetaan 3 kuukauden kuluttua ensimmäisen injektion antamisesta.
Ei ole olemassa tietoja käytöstä yli 60-vuotiaille aikuisille. Kysy lääkäriltä, onko Qdenga-valmisteen saamisesta sinulle hyötyä.
Qdenga-valmistetta on käytettävä virallisten suositusten mukaisesti.
Ohjeet terveydenhuollon ammattilaisille rokotteen valmistelusta löytyvät pakkausselosteen lopusta.
Jos sinulta tai lapseltasi jää väliin Qdenga-injektio
- Jos sinulta tai lapseltasi jää väliin aikataulun mukainen injektio, lääkäri päättää, milloin väliin jäänyt injektio annetaan. On tärkeää, että sinä tai lapsesi noudatatte lääkärin, apteekkihenkilökunnan tai sairaanhoitajan antamia seuraavaa rokotuskertaa koskevia ohjeita.
- Jos unohdat rokotusajan tai et pääse tulemaan vastaanotolle sovittuna aikana, kysy neuvoa lääkäriltä, apteekkihenkilökunnalta tai sairaanhoitajalta.
Jos sinulla on kysymyksiä tämän rokotteen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, Qdenga-valmistekin voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Vaikea allerginen (anafylaktinen) reaktio
Jos jokin näistä oireista ilmenee sinun tai lapsesi jo lähdettyä rokotuspaikasta, ota välittömästi yhteys lääkäriin:
• hengitysvaikeudet
• kielen tai huulten sinertyminen
• ihottuma
• kasvojen tai kurkun turvotus
• huimausta tai pyörtymisen aiheuttava matala verenpaine
• äkillinen ja vakava sairauden- tai levottomuuden tunne sekä huimausta ja tajunnanmenetyksen aiheuttava verenpaineen lasku, hengitysvaikeuksiin liittyvä nopea sydämensyke.
Nämä merkit tai oireet (anafylaktiset reaktiot) kehittyvät yleensä pian injektion antamisen jälkeen ja kun sinä tai lapsesi olette vielä klinikalla tai lääkärin vastaanotolla. Niitä voi ilmetä myös hyvin harvinaisissa tapauksissa minkä tahansa rokotteen saamisen jälkeen.
Lapsilla, nuorilla ja aikuisilla tehdyissä tutkimuksissa ilmeni seuraavia haittavaikutuksia.
Hyvin yleiset (voivat esiintyä useammalla kuin yhdellä potilaalla kymmenestä):
- injektiokohdan kipu
- päänsärky
- lihaskipu
- injektiokohdan punoitus
- yleinen huono olo
- heikotus
- nenän tai kurkun infektiot
- kuume
Yleiset (voivat esiintyä enintään yhdellä henkilöllä kymmenestä):
- injektiokohdan turvotus
- nenän tai kurkun kipu tai tulehdus
- injektiokohdan mustelma
- injektiokohdan kutina
- kurkun ja nielurisojen tulehdus
- nivelkipu
- influenssan kaltainen sairaus
Melko harvinaiset (voivat esiintyä enintään yhdellä henkilöllä sadasta)
- ripuli
- pahoinvointi
- mahakipu
- oksentelu
- injektiokohdan verenvuoto
- pyörrytyksen tunne
- ihon kutina
- ihottuma, mukaan lukien läiskäiset tai kutisevat ihoreaktiot
- nokkosihottuma
- väsymys
- ihon värimuutokset injektiokohdassa
- hengitysteiden tulehdus
- nenän vuotaminen
Harvinaiset (voivat esiintyä enintään yhdellä henkilöllä 1 000:sta):
pienet punaiset tai purppuranväriset pisteet ihon alla (petekiat)
Hyvin harvinaiset (voivat esiintyä enintään yhdellä henkilöllä 10 000:sta):
- nopeasti alkava ihonalainen turvotus esimerkiksi kasvoissa, kurkussa, käsivarsissa ja jaloissa
- verihiutalemäärän vähäisyys (trombosytopenia)
Tuntemattomat (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin):
- äkillinen, vaikea allerginen (anafylaktinen) reaktio, johon liittyy hengitysvaikeuksia, turvotusta, pyörrytystä, sydämensykkeen nopeutumista, hikoilua ja tajunnanmenetys.
- silmäkipu
Muut haittavaikutukset 4–5-vuotiailla lapsilla:
Hyvin yleiset(voivat esiintyä useammalla kuin yhdellä potilaalla kymmenestä):
- vähentynyt ruokahalu
- uneliaisuus
- ärtyneisyys
Haittavaikutusten raportointi
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Pidä Qdenga-valmiste poissa lasten ulottuvista ja näkyvistä.
Älä käytä Qdenga-valmistetta pakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 °C - 8 °C). Ei saa jäätyä.
Säilytä rokote ulkopakkauksessa.
Qdenga tulee käyttää välittömästi, kun se on saatettu käyttökuntoon mukana toimitettavalla liuottimella. Jos Qdenga-valmistetta ei käytetä välittömästi, se on käytettävä 2 tunnin kuluessa.
Lääkkeitä ei saa heittää viemäriin tai hävittää talousjätteiden mukana. Kysy lisätietoja käyttämättömien lääkkeiden hävittämisestä apteekista. Näin suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Qdenga sisältää
- Käyttökuntoon saattamisen jälkeen yksi annos (0,5 ml) sisältää:
Dengueviruksen serotyyppi 1 (elävä, heikennetty)*: ≥ 3,3 log10 PFU**/annos
Dengueviruksen serotyyppi 2 (elävä, heikennetty)#: ≥ 2,7 log10 PFU**/annos
Dengueviruksen serotyyppi 3 (elävä, heikennetty)*: ≥ 4,0 log10 PFU**/annos
Dengueviruksen serotyyppi 4 (elävä, heikennetty)*: ≥ 4,5 log10 PFU**/annos
*Tuotettu Vero-soluissa yhdistelmä-DNA-tekniikalla. Serotyyppispesifisten pintaproteiinien geenejä, jotka on valmistettu tyypin 2 denguen runkoon. Tämä tuote sisältää muuntogeenisiä organismeja (GMO).
#Tuotettu Vero-soluissa yhdistelmä-DNA-teknologian avulla.
**PFU = plakkia muodostavat yksiköt
- Muut ainesosat ovat: α,α-trehaloosidihydraatti, poloksameeri 407, ihmisen seerumialbumiini, kaliumdivetyfosfaatti, dinatriumvetyfosfaatti, kaliumkloridi, natriumkloridi, injektionesteisiin käytettävä vesi.
Qdenga-valmisteen kuvaus ja pakkauskoko
Qdenga on injektiokuiva-aine ja liuotin, liuosta varten. Qdenga-valmisteen kuiva-aine on pakattu yhden annoksen injektiopulloon ja liuotin esitäytettyyn ruiskuun, jossa on 2 erillistä neulaa tai ei neulaa.
Kuiva-aine ja liuotin on sekoitettava keskenään ennen käyttöä.
Qdenga injektiokuiva-aine ja liuotin, liuosta varten esitäytetyssä ruiskussa on saatavilla pakkauskoossa 1 tai 5.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Kuiva-aine on tiivis valkoinen tai luonnonvalkoinen kakku.
Liuotin (0,22-prosenttinen natriumkloridiliuos) on kirkas väritön neste.
Käyttökuntoon saattamisen jälkeen Qdenga on kirkas, väritön tai vaaleankeltainen liuos, jossa ei käytännössä ole vierashiukkasia.
Myyntiluvan haltija ja valmistaja
Myyntiluvan haltija
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublin 2
D02 HW68
Irlanti
Valmistaja
Takeda GmbH
Production site Singen
Robert-Bosch-Str. 8
78224 Singen
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Takeda Oy
Puh: 0800 774 051
medinfoEMEA@takeda.com
Tämä pakkausseloste on tarkistettu viimeksi 12/2025.
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu.
------------------------------------------------------------------------------------------------------------------------
Ohjeet terveydenhuollon ammattilaiselle
- Kuten kaikkien injektiona annettavien rokotteiden kohdalla, asianmukainen lääketieteellinen hoito ja valvonta on aina oltava nopeasti saatavilla Qdenga-valmisteen annon jälkeisen anafylaktisen reaktion varalta.
- Qdenga-valmistetta ei saa sekoittaa muiden lääkevalmisteiden tai rokotteiden kanssa samassa ruiskussa.
- Qdenga-valmistetta ei saa missään olosuhteissa antaa suonensisäisenä injektiona.
- Rokote annetaan ihonalaisena injektiona, mieluiten olkavarteen hartialihaksen alueelle. Qdenga-valmistetta ei saa antaa lihaksensisäisenä injektiona.
- Psykogeenisenä vasteena ilmenevä synkopee (pyörtyminen) on mahdollista minkä tahansa neulalla pistettävän rokotteen antamisen jälkeen tai jopa ennen rokottamista. Kaatumisen aiheuttamien vammojen ehkäisyyn ja pyörtymisreaktioiden hoitoon on varauduttava.
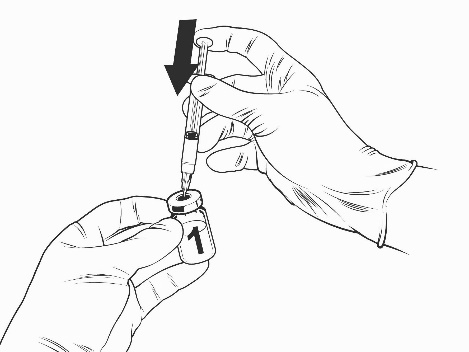
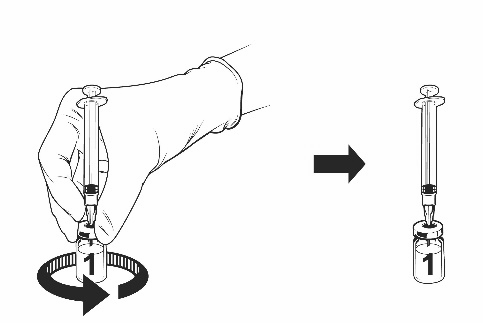
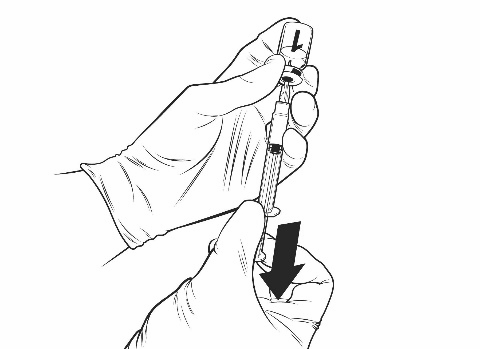
Ohjeet rokotteen käyttökuntoon saattamiseen esitäytetyssä ruiskussa olevalla liuottimella:
Qdenga on kaksiosainen rokote, joka koostuu pakastekuivattua rokotetta sisältävästä injektiopullosta ja esitäytetyssä ruiskussa olevasta liuottimesta. Pakastekuivattu rokote on saatettava käyttökuntoon liuottimella ennen antoa.
Qdenga-valmistetta ei saa sekoittaa muiden rokotteiden kanssa samassa ruiskussa.
Käytä vain rokotteen mukana toimitettua liuotinta (0,22-prosenttista natriumkloridiliuosta) esitäytetyssä ruiskussa, koska siinä ei ole säilöntäaineita tai muita viruslääkkeitä. Kosketusta säilöntäaineiden, antiseptisten aineiden, pesuaineiden ja muiden viruslääkkeiden kanssa on vältettävä, sillä ne voivat inaktivoida rokotteen.
Ota rokotteen injektiopullo ja esitäytetty ruisku liuotinta jääkaapista.
Pakastekuivatun rokotteen injektiopullo |
|
Käyttökuntoon saatettu rokote |
|
Käyttökuntoon saattamisen jälkeen tuloksena olevan liuoksen on oltava kirkasta, väritöntä tai vaaleankeltaista, eikä siinä saa olla vieraita hiukkasia. Hävitä rokote, jos siinä näkyy hiukkasia ja/tai jos siinä näkyy värimuutoksia.
Käyttökuntoon saatettu rokote |
|
Qdenga tulee antaa välittömästi käyttökuntoon saattamisen jälkeen. Kemiallisen ja fysikaalisen käytönaikaisen stabiiliuden on osoitettu olevan 2 tuntia huoneenlämpötilassa (enintään 32,5 °C) rokotepullon käyttökuntoon saattamisen jälkeen. Tämän ajan jälkeen rokote on hävitettävä. Älä laita sitä takaisin jääkaappiin. Mikrobiologiselta kannalta Qdenga-valmiste on käytettävä heti. Jos valmistetta ei käytetä heti, käytönaikaiset säilytysajat ja -olosuhteet ovat käyttäjän vastuulla.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten säädösten mukaisesti.