Pakkausseloste
IKERVIS silmätipat, emulsio, kerta-annospakkaus 1 mg/ml
IKERVIS 1 mg/ml silmätipat, emulsio
siklosporiini
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä IKERVIS on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät IKERVIS-valmistetta
- Miten IKERVIS-valmistetta käytetään
- Mahdolliset haittavaikutukset
- IKERVIS-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
IKERVIS-valmiste sisältää vaikuttavana aineena siklosporiinia, joka kuuluu immuunivastetta heikentävien lääkeaineiden ryhmään. Näitä lääkkeitä käytetään tulehduksen vähentämiseen.
IKERVIS-valmisteella hoidetaan aikuisten vaikeaa sarveiskalvon eli silmän etuosan läpinäkyvän kerroksen tulehdusta (keratiittia). Sitä käytetään potilaille, jotka kärsivät kuivasilmäisyydestä keinokyynelhoidosta huolimatta.
Käänny lääkärin puoleen, ellei olosi parane tai se huononee.
Käy lääkärin vastaanotolla vähintään 6 kuukauden välein IKERVIS-valmisteen tehon arvioimiseksi.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä IKERVIS-valmistetta
- jos olet allerginen siklosporiinille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on ollut tai on syöpä silmässä tai silmän ympärillä.
- jos sinulla on silmätulehdus.
Varoitukset ja varotoimet
Tiputa IKERVIS-valmistetta vain silmään (silmiin).
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät IKERVIS-valmistetta.
- jos sinulla on aiemmin ollut herpesviruksen aiheuttama silmätulehdus, joka on voinut vaurioittaa silmän läpinäkyvää osaa (sarveiskalvoa).
- jos käytät steroideja sisältäviä lääkkeitä.
- jos käytät glaukoomalääkkeitä.
Piilolinssit voivat vaurioittaa silmän läpinäkyvää etuosaa (sarveiskalvoa) lisää. Poista siksi piilolinssit nukkumaan mennessäsi ennen IKERVIS-valmisteen käyttöä. Voit laittaa piilolinssit takaisin paikalleen kun heräät.
Lapset ja nuoret
IKERVIS-valmistetta ei saa käyttää alle 18-vuotiaille lapsille ja nuorille.
Muut lääkevalmisteet ja IKERVIS
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Kerro lääkärille, jos käytät steroideja sisältäviä silmätippoja IKERVIS-valmisteen kanssa, sillä ne saattavat suurentaa haittavaikutusriskiä.
IKERVIS-silmätipat laitetaan vähintään 15 minuutin kuluttua muiden silmätippojen laittamisesta.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekkihenkilökunnalta neuvoa ennen tämän lääkkeen käyttöä.
Älä käytä IKERVIS-valmistetta, jos olet raskaana.
Jos voit tulla raskaaksi, sinun on käytettävä raskauden ehkäisyä tämän lääkkeen käytön aikana.
IKERVIS-valmistetta kulkeutuu todennäköisesti hyvin pieniä määriä äidinmaitoon. Jos imetät, keskustele lääkärin kanssa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
Näkösi voi sumentua heti IKERVIS-valmisteen käytön jälkeen. Jos näin käy, odota, kunnes näkösi kirkastuu, ennen kuin ajat tai käytät koneita.
IKERVIS sisältää setalkoniumkloridia
Tämä lääkevalmiste sisältää 0,05 mg setalkoniumkloridia per 1 ml. Poista piilolinssit ennen tämän lääkevalmisteen käyttöä. Voit laittaa piilolinssit takaisin paikalleen kun heräät. Setalkoniumkloridi voi aiheuttaa silmä-ärsytystä. Jos silmääsi tulee poikkeavaa tunnetta, pistelyä tai kipua tämän lääkkeen käytön jälkeen, keskustele asiasta lääkärisi kanssa.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Suositeltu annos on yksi tippa kumpaankin hoidettavaan silmään kerran päivässä nukkumaan mennessä.
Käyttöohjeet
Noudata näitä ohjeita huolellisesti ja kysy lääkäriltä tai apteekkihenkilökunnalta, jos et ymmärrä jotain.
 |
 |
 |
- Pese kädet.
- Jos käytät piilolinssejä, ota ne pois nukkumaan mennessäsi ennen silmätippojen laittamista. Voit laittaa piilolinssit takaisin paikalleen kun heräät.
- Avaa alumiinipussi, jossa on viisi kerta-annospakkausta.
- Ota yksi kerta-annospakkaus alumiinipussista.
- Ravista kerta-annospakkausta kevyesti ennen käyttöä.
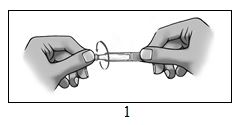
- Kierrä korkki irti (kuva 1).
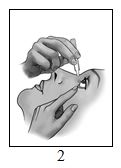
- Vedä alaluomea alaspäin (kuva 2).
- Kallista päätä taaksepäin ja katso ylös kattoon.
- Purista varovasti yksi tippa lääkettä silmään. Varmista, ettet koske kerta-annospakkauksen kärjellä silmää.
- Räpytä silmää muutaman kerran, jotta lääke leviää koko silmään.
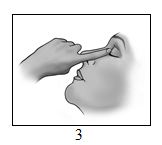
- Paina IKERVIS-valmisteen käytön jälkeen sormella silmäkulmaa nenän vierestä ja sulje silmä kevyesti 2 minuutin ajaksi (kuva 3). Tämä estää IKERVIS-valmisteen pääsyn muualle elimistöön.
- Jos käytät tippoja molempiin silmiin, toista vaiheet toiseen silmään.
- Hävitä kerta-annospakkaus heti kun olet käyttänyt sitä, vaikka siinä olisikin lääkettä jäljellä.
- Jäljellä olevat kerta-annospakkaukset pitää säilyttää alumiinipussissa.
Jos tippa ei osu silmään, yritä uudelleen.
Jos käytät enemmän IKERVIS-valmistetta kuin sinun pitäisi, huuhtele silmä vedellä. Älä laita enempää tippoja, ennen kuin on seuraavan tavanomaisen annoksen aika.
Jos unohdat käyttää IKERVIS-valmistetta, jatka seuraavalla annoksella suunnitelman mukaan. Älä käytä kaksinkertaista annosta korvataksesi unohtamasi annoksen. Älä käytä yli yhtä tippaa päivässä hoidettavaan silmään (hoidettaviin silmiin).
Jos lopetat IKERVIS-valmisteen käytön keskustelematta siitä lääkärin kanssa, sarveiskalvotulehdus (keratiitti) ei pysy hallinnassa, mikä voi johtaa näön heikkenemiseen.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Seuraavia haittavaikutuksia on havaittu:
Yleisimmät haittavaikutukset ovat silmässä ja silmän ympärillä.
Hyvin yleiset (voi esiintyä yli 1 potilaalla kymmenestä)
- silmäkipu
- silmä-ärsytys.
Yleiset (voi esiintyä enintään 1 potilaalla kymmenestä)
- silmäluomen punoitus
- vetiset silmät
- silmän punoitus
- samentunut näkö
- silmäluomen turvotus
- sidekalvon (silmän etuosan peittävän ohuen kalvon) punoitus
- silmän kutina.
Melko harvinaiset (voi esiintyä enintään 1 potilaalla sadasta)
- epämukava tunne silmässä tai silmän ympärillä, kun tippoja laitetaan silmään, rikantunne mukaan lukien
- sidekalvon (silmän etuosan peittävän ohuen kalvon) ärsytys tai turvotus
- kyynelteiden häiriö
- silmän rähmiminen
- sidekalvon (silmän etuosan peittävän ohuen kalvon) ärsytys tai tulehdus
- värikalvon (silmän värillisen osan) tai silmäluomen tulehdus
- saostumat silmässä
- sarveiskalvon ulkokerroksen hankauma
- silmäluomien punoitus tai turvotus
- silmäluomen kysta
- sarveiskalvon immuunireaktio tai arpeuma
- silmäluomen kutina
- sarveiskalvon (silmän läpinäkyvän etuosan) bakteeri-infektio tai tulehdus
- vyöruusun aiheuttama kivulias ihottuma silmän ympärillä
- päänsärky.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla):
www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa, alumiinipussissa tai kerta-annospakkauksessa mainitun viimeisen käyttöpäivämäärän(EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Ei saa jäätyä.
Säilytä alle 25°C.
Alumiinipussien avaamisen jälkeen kerta-annospakkaukset on pidettävä pusseissa valolta suojaamiseksi ja haihtumisen estämiseksi. Hävitä avattu yksittäinen kerta-annospakkaus ja mahdollinen jäljellä oleva emulsio heti käytön jälkeen.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä IKERVIS sisältää
- Vaikuttava aine on siklosporiini. Yksi millilitra IKERVIS-valmistetta sisältää 1 mg siklosporiinia.
- Muut aineet ovat keskipitkäketjuiset triglyseridit, setalkoniumkloridi, glyseroli, tyloksapoli, poloksameeri 188, natriumhydroksidi (pH:n säätöön) ja injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoot
IKERVIS on maidonvalkoinen silmätippaemulsio.
Se toimitetaan kerta-annospakkauksissa, jotka on valmistettu pientiheyspolyeteenistä (LDPE).
Yksi kerta-annospakkaus sisältää 0,3 ml silmätippaemulsiota.
Kerta-annospakkaukset on pakattu suljettuun alumiinipussiin.
Pakkauskoot: 30 ja 90 kerta-annospakkausta.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
SANTEN Oy
Niittyhaankatu 20
33720 Tampere
Suomi
Valmistaja
EXCELVISION
Rue de la Lombardière
ZI la Lombardière
F-07100 Annonay
Ranska
SANTEN Oy
Kelloportinkatu 1
33100 Tampere
Suomi
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Santen Oy
Puh: +358 (0) 974790211
Tämä pakkausseloste on tarkistettu viimeksi 01/2022.
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilla http://www.ema.europa.eu.