Pakkausseloste
TAPTIQOM ögondroppar, lösning i endosbehållare 15 mikrog/ml+5 mg/ml
Tilläggsinformation
Taptiqom 15 mikrogram/ml + 5 mg/ml
Ögondroppar, lösning i endosbehållare
tafluprost/timolol
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Taptiqom är och vad det används för
- Vad du behöver veta innan du använder Taptiqom
- Hur du använder Taptiqom
- Eventuella biverkningar
- Hur Taptiqom ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad är det för läkemedel och hur fungerar det?
Taptiqom ögondroppar innehåller tafluprost och timolol. Tafluprost tillhör en grupp läkemedel som kallas prostaglandinanaloger och timolol tillhör en grupp läkemedel som kallas betablockerare. Tafluprost och timolol verkar tillsammans och sänker trycket i ögat. Taptiqom används när trycket i ögat är för högt.
Vad är ditt läkemedel till för?
Taptiqom används för att behandla en typ av glaukom som kallas öppenvinkelglaukom och även ett tillstånd som kallas okulär hypertension hos vuxna. Båda dessa tillstånd är förknippade med förhöjt tryck i ögat och kan i slutändan påverka din syn.
Tafluprost och timolol som finns i Taptiqom kan också vara godkända för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apoteks- eller annan hälso- och sjukvårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Vad du behöver veta innan produkten används
Använd inte Taptiqom:
- om du är allergisk mot tafluprost, timolol, betablockerare eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar)
- om du har eller tidigare har haft problem med andningen som t.ex. astma, svår kronisk obstruktiv bronkit (svår lungsjukdom som kan ge väsande andning, andningssvårigheter och/eller långvarig hosta)
- om du har en långsam hjärtrytm, hjärtsvikt eller störningar i hjärtrytmen (oregelbunden hjärtrytm).
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Taptiqom.
Tala med läkare innan du använder detta läkemedel om du har eller tidigare har haft:
- sjukdom i hjärtats kranskärl (symtom kan inkludera bröstsmärta, tryck över bröstet, andnöd eller kvävningskänsla), hjärtsvikt, lågt blodtryck
- störningar i hjärtrytmen, såsom långsam hjärtrytm
- problem med andningen, astma eller kronisk obstruktiv lungsjukdom
- sjukdom med dålig blodcirkulation (som Raynauds sjukdom eller Raynauds syndrom)
- diabetes, eftersom timolol kan dölja tecken och symtom på lågt blodsocker
- överaktiv sköldkörtel, eftersom timolol kan dölja tecken och symtom på sköldkörtelsjukdom
- allergier eller anafylaktiska reaktioner
- myasthenia gravis (en sällsynt sjukdom som orsakar muskelsvaghet)
- andra ögonsjukdomar, exempelvis sjukdomar i hornhinnan (den genomskinliga hinnan som täcker den främre delen av ögat) eller en sjukdom som kräver ögonoperation.
Tala om för din läkare om du har:
- njurproblem
- leverproblem.
Observera att Taptiqom kan ha följande effekter och att vissa av dem kan vara bestående:
- Taptiqom kan öka ögonfransarnas längd, tjocklek, färg och/eller antal och kan orsaka onormal hårväxt på dina ögonlock.
- Taptiqom kan mörkfärga huden runt ögonen. Torka bort all lösning som eventuellt hamnat på huden. Detta minskar risken för att huden mörknar.
- Taptiqom kan ändra färgen på iris (den färgade delen av ditt öga). Om Taptiqom används endast i ett öga kan färgen på det behandlade ögat bli bestående annorlunda än det andra ögats färg.
- Taptiqom kan orsaka hårväxt på områden där lösningen vid upprepade tillfällen kommer i kontakt med hudytan.
Tala om för din läkare innan du genomgår en operation att du använder Taptiqom, eftersom timolol kan förändra effekterna av vissa läkemedel som används vid narkos.
Barn och ungdomar
Taptiqom rekommenderas inte till barn eller ungdomar under 18 års ålder eftersom det saknas data om säkerhet och effekt i denna åldersgrupp.
Andra läkemedel och Taptiqom
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Taptiqom kan påverka eller påverkas av andra läkemedel du använder.
Tala särskilt om för din läkare om du använder eller tänker använda:
- andra ögondroppar för behandling av glaukom
- läkemedel för att sänka blodtrycket
- hjärtläkemedel
- läkemedel för behandling av diabetes
- kinidin (används för att behandla hjärtsjukdomar och vissa typer av malaria)
- antidepressiva läkemedel som kallas fluoxetin och paroxetin.
Om du använder andra läkemedel i ögat ska du vänta minst 5 minuter efter att du har droppat i Taptiqom innan du använder det andra läkemedlet.
Kontaktlinser
Ta ut kontaktlinserna innan du använder ögondropparna och vänta minst 15 minuter innan du sätter in kontaktlinserna igen.
Graviditet, amning och fertilitet
Om du kan bli gravid måste du använda ett effektivt preventivmedel under behandlingen med Taptiqom. Använd inte Taptiqom om du är gravid. Du bör inte använda Taptiqom om du ammar. Rådfråga läkare.
Körförmåga och användning av maskiner
Taptiqom kan ge biverkningar, såsom dimsyn, vilket kan påverka din förmåga att framföra fordon och/eller använda maskiner. Vänta med att köra eller använda maskiner till dess du känner dig bra och din syn är klar.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbeten som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med läkare eller apotekspersonal om du är osäker.
Taptiqom innehåller fosfatbuffert
Detta läkemedel innehåller cirka 0,04 mg fosfat per droppe motsvarande 1,3 mg/ml. Om du har allvarligt skadad hornhinna, kan fosfat i mycket sällsynta fall orsaka grumliga fläckar på hornhinnan p.g.a. ansamling av kalcium under behandlingen.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Rekommenderad dos är 1 droppe Taptiqom i ögat eller ögonen en gång dagligen. Droppa inte i fler droppar och använd inte oftare än vad din läkare har ordinerat. Detta kan göra Taptiqom mindre effektivt.
Använd endast Taptiqom i båda ögonen om din läkare har ordinerat det. Kassera den öppnade behållaren med kvarvarande innehåll omedelbart efter användning.
Ska endast användas som ögondroppar. Får ej sväljas.
Låt inte endosbehållaren röra ögat eller området runt ögat. Det kan orsaka skada på ögat. Endosbehållaren kan också bli förorenad med bakterier som kan orsaka ögoninfektion och leda till allvarliga skador i ögat, även synförlust. För att undvika eventuell förorening av endosbehållaren ska spetsen inte vidröra någon yta.
Bruksanvisning:
När du påbörjar en ny påse:
Använd inte endosbehållarna om påsens försegling är bruten. Öppna påsen längs den streckade linjen. Skriv ner datumet du öppnade påsen på avsedd plats för datum på påsen.
Varje gång du använder Taptiqom:
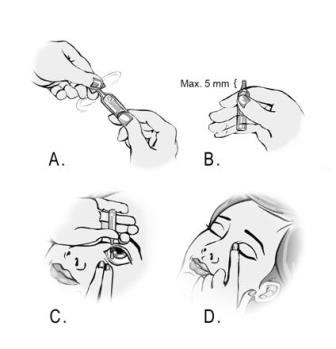
- Tvätta händerna.
- Ta ut endosbehållarna ur påsen.
- Ta loss en endosbehållare.
- Lägg tillbaka kvarvarande behållare i påsen och vik kanten för att stänga påsen.
- Öppna behållaren genom att vrida av fliken. (Bild A)
- Håll behållaren mellan tummen och pekfingret. Spetsen på behållaren får inte synas mer än 5 mm ovanför pekfingret. (Bild B)
- Luta huvudet bakåt eller ligg ner. Lägg handen på pannan. Pekfingret ska vara i linje med ögonbrynet eller vila på näsryggen. Titta uppåt. Dra det undre ögonlocket nedåt med den andra handen. Låt inte någon del av behållaren komma i kontakt med ögat eller området runt ögat. Tryck lätt på behållaren och låt en droppe falla ner i utrymmet mellan ögonlocket och ögat. (Bild C)
- Slut ögat och tryck med ett finger i den inre ögonvrån i ungefär två minuter. Detta förhindrar att ögondroppen rinner ner i tårkanalen. (Bild D)
- Torka bort all lösning som eventuellt hamnat på huden runt ögat.
Om en droppe hamnar utanför ögat, försök igen.
Om din läkare ordinerat dig att använda droppar i båda ögonen, upprepa steg 7 till 9 för det andra ögat.
Innehållet i en endosbehållare räcker till båda ögonen. Kassera den öppnade behållaren med kvarvarande innehåll omedelbart efter användning.
Om du använder andra läkemedel i ögat ska du vänta minst 5 minuter efter att du har droppat i Taptiqom innan du använder det andra läkemedlet.
Om du har tagit för stor mängd av Taptiqom, kan du känna yrsel eller få huvudvärk, hjärtsymtom eller andningsproblem.
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112 i Sverige, 0800 147 111 i Finland) för bedömning av risken samt rådgivning.
Rådfråga läkare om läkemedlet sväljs av misstag.
Om du har glömt att använda Taptiqom, droppa i en enda droppe så fort du kommer ihåg det, och återgå sedan till din vanliga rutin. Men om det nästan är dags för nästa dos kan du hoppa över den missade dosen. Ta inte dubbel dos för att kompensera för glömd dos.
Sluta inte använda Taptiqom utan att fråga din läkare. Om du slutar använda Taptiqom kommer trycket i ögat att öka igen. Detta kan orsaka bestående skada på ögat.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem. De flesta biverkningar är inte allvarliga.
Du kan vanligtvis fortsätta att använda dropparna, om inte biverkningarna är allvarliga. Om du är orolig, tala med läkare eller apotekspersonal.
Följande är kända biverkningar vid användning av Taptiqom:
Vanliga biverkningar
Följande biverkningar kan förekomma hos upp till 1 av 10 användare:
Ögon
Klåda i ögat. Irritation i ögat. Ögonsmärta. Rodnad i ögat. Förändring i längd, tjocklek och antal ögonfransar. Känsla av främmande kropp i ögat. Missfärgning av ögonfransarna. Ljuskänslighet. Dimsyn.
Mindre vanliga biverkningar
Följande biverkningar kan förekomma hos upp till 1 av 100 användare:
Centrala och perifera nervsystemet
Huvudvärk.
Ögon
Torra ögon. Rodnad av ögonlocken. Små fläckliknande inflammerade områden på ytan av ögat. Rinnande ögon. Svullna ögonlock. Trötta ögon. Inflammation av ögonlocken. Inflammation inuti ögat. Obehag i ögat. Ögonallergi. Inflammation i ögat. Onormal känsla i ögat.
Följande biverkningar har setts vid användning av de läkemedel Taptiqom består av (tafluprost och timolol) och kan därför uppstå när du använder Taptiqom:
Följande biverkningar har setts med tafluprost:
Ögon
Försämring i ögats förmåga att se detaljer. Förändring av färgen på iris (kan vara bestående). Förändring av färg på huden runt ögonen. Svullnad av ögats ytmembran. Ögonutsöndring. Pigmentering av ögats ytmembran. Folliklar i ögats ytmembran. Insjunkna ögon. Irit/uveit (inflammation i den färgade delen av ögat). Makulaödem/cystiskt makulaödem (svullnad av näthinnan i ögat vilket leder till försämrad syn).
Huden
Onormal hårväxt på ögonlocken.
Effekter på andningsvägarna
Förvärrad astma, andnöd.
Följande biverkningar har setts med timolol:
Immunsystemet
Allergiska reaktioner, inklusive svullnad under huden, nässelutslag, hudutslag. Svår plötslig livshotande allergisk reaktion. Klåda.
Metabolism och nutrition
Lågt blodsocker.
Psykiska störningar
Depression. Sömnsvårigheter. Mardrömmar. Minnesförlust. Nervositet. Hallucination.
Centrala och perifera nervsystemet
Yrsel. Svimning. Ovanliga känselförnimmelser (som stickningar och domningar). Ökningar av tecken och symtom på myasthenia gravis (muskelsjukdom). Stroke. Minskad blodtillförsel till hjärnan.
Ögon
Inflammation i hornhinnan. Nedsatt känsel i hornhinnan. Synrubbningar inklusive refraktionsförändringar (ibland på grund av utsättande av miotikabehandling). Nedhängande övre ögonlock. Dubbelseende. Dimsyn och avlossning av den blodkärlsinnehållande hinna som ligger under näthinnan efter filtrationskirurgi, vilket kan ge synstörningar. Hornhinneskada.
Öron
Tinnitus (ringningar i öronen).
Hjärtat
Långsam hjärtrytm. Bröstsmärta. Hjärtklappning. Ödem (vätskeansamling). Förändringar i puls eller hjärtrytm. Kronisk hjärtsvikt (hjärtsjukdom med andfåddhet, svullna fötter och ben på grund av vätskeansamling). En typ av hjärtrytmrubbningar. Hjärtattack. Hjärtsvikt.
Blodkärl
Lågt blodtryck. Haltande. Raynauds fenomen, kalla händer och fötter.
Andning
Kramp i luftvägarna (företrädesvis hos personer med befintlig sjukdom). Andningssvårigheter. Hosta.
Magtarmkanalen
Illamående. Matsmältningsbesvär. Diarré. Muntorrhet. Smakförändringar. Buksmärtor. Kräkningar.
Huden
Håravfall. Hudutslag med vitt till silverfärgat utseende (psoriasisliknande utslag) eller förvärrad psoriasis. Hudutslag.
Muskler och skelett
Muskelsmärta som inte orsakats av träning. Ledvärk.
Reproduktionsorgan och bröstkörtel
Peyronies sjukdom (som kan orsaka böjning av penis). Sexuell dysfunktion. Minskad libido.
Allmänna symtom
Muskelsvaghet/trötthet. Törst.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på endosbehållaren, påsen och ytterkartongen efter ”EXP”. Utgångsdatumet är den sista dagen i angiven månad.
Förvara oöppnade foliepåsar i kylskåp (2 °C–8 °C). Öppna inte påsen förrän du ska använda ögondropparna eftersom oanvända behållare i en öppen påse måste kasseras 28 dagar efter det att påsen öppnades första gången.
Efter öppnandet av foliepåsen:
- Förvara endosbehållaren i originalfoliepåsen. Ljuskänsligt.
- Förvaras vid högst 25 °C.
- Kassera oanvända endosbehållare 28 dagar efter det datum då foliepåsen först öppnades.
- Kassera öppnad endosbehållare med eventuell kvarvarande lösning omedelbart efter användning.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- De aktiva substanserna är tafluprost och timolol. 1 ml lösning innehåller 15 mikrogram tafluprost och 5 mg timolol.
- Övriga innehållsämnen är glycerol, dinatriumfosfatdodekahydrat, dinatriumedetat, polysorbat 80, saltsyra och/eller natriumhydroxid (för att justera pH) och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Taptiqom är en klar, färglös vätska (lösning) som tillhandahålls i endosbehållare av plast, var och en innehållande 0,3 ml lösning. Tio endosbehållare tillhandahålls i en påse. Taptiqom levereras i förpackningar som innehåller 30 eller 90 endosbehållare.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Santen Oy
Niittyhaankatu 20
33720 Tampere
Finland
Tillverkare
Santen Oy
Kelloportinkatu 1
33100 Tampere
Finland
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet och i Förenade kungariket (Nordirland) under namnet Taptiqom:
Österrike, Belgien, Bulgarien, Kroatien, Cypern, Tjeckien, Danmark, Estland, Finland, Frankrike, Tyskland, Grekland, Ungern, Island, Irland, Lettland, Litauen, Luxemburg, Malta, Nederländerna, Norge, Polen, Portugal, Rumänien, Slovakien, Slovenien, Spanien, Sverige, Förenade kungariket (Nordirland)
Loyada: Italien
Denna bipacksedel ändrades senast 15.7.2022